Aprakstot hroniskas nieru slimības (HNS) aktualitāti, šodien stabili tiek lietots termins „epidēmija”. Lēš, ka šī slimība skar aptuveni 10% pieaugušo populācijas pasaulē. HNS pacientu aprūpe ir tik kompleksa, ka vairumā gadījumu paliek suboptimālā līmeni. Kā klasiski šķēršļi tiek minēts dramatisks informācijas trūkums iedzīvotāju vidū (vairums nezina vispār vai kļūdaini interpretē šo terminu), novēlota diagnostika un nefrologa konsultācija, kā arī plašais iesaistīto speciālistu loks (nefrologs, ģimenes ārsts, kardiologs, endokrinologs, asinsvadu ķirurgs, transplantologs, dietologs, medicīnas māsas, farmaceiti, sociālie darbinieki) un sadarbības nepilnības starp tiem. Tomēr būtiskākais vēstījums par HNS ir – lai arī izplatīta un dzīvībai bīstama, HNS ir ārstējama (common, harmful, and treatable – World Kidney Day 2007).
Jāārstē agrīni un agresīvi
HNS var progresēt līdz terminālai nieru mazspējai, iztrūkstot simptomātiskai nieru mazspējai. ASV Nieru datu sistēmā reģistrēts titānisks populācijas ar terminālu nieru mazspēju pieaugums, kam ir tikpat titāniskas atskaņas valsts budžetā. Aprēķināts, ka 2005. gadā uz HNS pacientiem, kuri kopā sastāda aptuveni 1,2% no 31 miljona veselības aprūpes saņēmēju, attiecināmi 6,4% no visiem ASV veselības aprūpes izdevumiem.
Viens no svarīgākajiem HNS diagnozes un ārstēšanas aspektiem ir agrīna problēmas apzināšanās un agresīva pamatslimību (HNS provocējošo faktoru) ārstēšana. Kamēr pacientiem, kuriem jau tiek veikta nieru aizstājterapija, viens no kvalitatīvas aprūpes indikatoriem ir zemi hospitalizācijas rādītāji, HNS pacientiem, kuriem vēl nav nepieciešama dialīze, galvenie mērķi ir: agrīna slimības atklāšana un terapija, lai novērstu tās progresiju; HNS komplikāciju (per se) diagnosticēšana un ārstēšana; blakusslimību radīto komplikāciju atklāšana un ārstēšana; nekomplicēta pāreja uz nieru aizstājterapiju, ja līdz tās nepieciešamībai nonākts.

Tematiskais pielikums
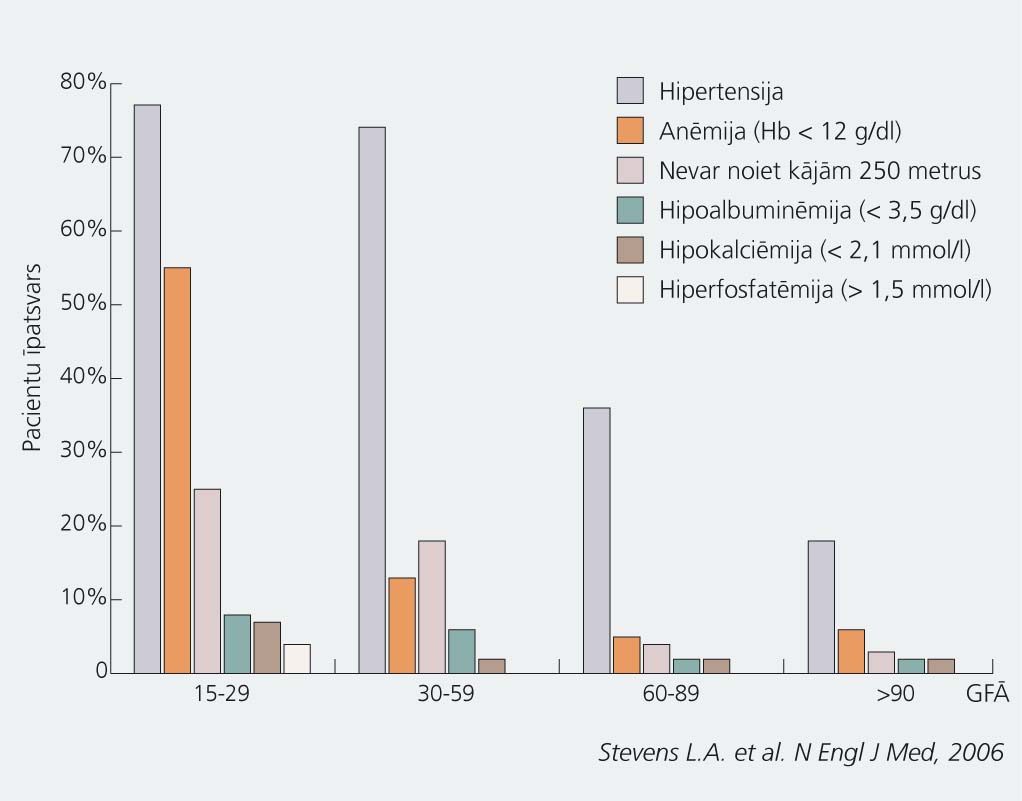
Ar hronisku nieru slimību saistītās komplikācijas vispārējā populācijā
Peter W. L. et al. Chronic kidney disease: a burgeonig health epidemic//J Manag Care Pharm, 2007; 13(9): S2-5. Rastogi et al. Adv Chronic Kidney Dis, 2008.
Komentē Asociētais profesors Harijs Čerņevskis, Rīgas Stradiņa universitātes Iekšķīgo slimību katedra
Kā jau minēts, ļoti svarīgi ir savlaicīgi diagnosticēt nieru funkciju traucējumus pacientiem, par kuriem pirmā brīdī pat nerodas iespaids, ka būtu sagaidāmas nefroloģiskas problēmas nākotnē. Diemžēl daudzas ar nieru funkciju traucējumiem saistītas problēmas slēpjas aiz kardioloģisku, endokrinoloģisku vai reimatoloģisku slimību simptomiem. Jāatceras, ka katram otrajam cukura diabēta pacientam varētu būt sagaidāmi arī nieru funkciju traucējumi. Pierādītas nieru slimības ne vienmēr beidzas tieši ar terminālu nieru mazspēju, bet letālā iznākuma iemesls var būt kardiovaskulāras vai cerebrovaskulāras komplikācijas, no kurām nieru slimības pacients aiziet bojā ātrāk, vēl nesasniedzot smagākās nieru slimības stadijas. Svarīgi ir, agrīni diagnosticējot nieru funkciju traucējumus, savlaicīgi nosūtīt pacientus nieru aizsājterapijai (NAT).
Liela apjoma datu analīze pierāda - savlaicīga nefrologa konsultācija ir vitāli nepieciešama
Autoru kolektīvs pārskatīja visus angļu valodā pieejamos literatūras datus (1980-2005), lai salīdzinātu hospitalizācijas ilgumu un mirstības rādītājus pacientiem ar HNS atkarībā no tā, vai viņus jau agrīnā slimības stadijā ir konsultējis nefrologs. Izdevās atlasīt 22 atbilstošus pētījumus ar 12 749 iesaistītiem pacientiem. Šo pētījumu analīze atklāja nozīmīgas atšķirības abos minētajos parametros.
HNS pacientu vidū, kuri bija nosūtīti pie nefrologa tikai vēlīnās slimības stadijās, bija statistiski būtiski paaugstināta kopējā mirstība (relatīvais risks - 1,99), salīdzinot ar tiem, kurus jau agrīni konsultēja speciālists. Otrkārt, vidējais hospitalizācijas dienu skaits pirms nieru aizstājterapijas uzsākšanas šiem pacientiem bija par divpadsmit dienām ilgāks.
Veiktā analīze apstiprina, ka nosūtīšanas laiks (timing) pie nefrologa ir būtisks faktors, kas ietekmē HNS slimnieku dzīves kvalitāti (hospitalizācijas dienu skaitu) un prognozi (mirstības rādītājus).
Chan M. R. et al. Outcomes in patients with chronic kidney disease referred late to nephrologists: a meta-analysis//Am J Med, 2007; 120(12): 1063-70.
Komentē asoc. prof. H. Čerņevskis
Jābūt ciešai sadarbībai starp ģimenes ārstu, internistu, endokrinologu, kardiologu vai citas specialitātes ārstu no vienas puses un nefrologu no otras puses. Ir jāapzinās tā robeža, līdz kurai varētu veikt terapiju patstāvīgi un kurā brīdī šāds pacients jānosūta tālākai terapijai pie nefrologa. Tikai nefrologs būs kompetents spriest par tālāk pielietojamām terapijas metodēm katram konkrētam pacientam. Jo savlaicīgāk tiks uzsākta nepieciešamā NAT, jo tā būs arī ekonomiski pamatotāka, jo pacientiem ar dziļi ielaistām un novēloti ārstētām nieru slimības komplikācijām arī terapijas izmaksas ir ievērojami augstākas.
Kā ļoti svarīgs faktors jāmin ārstu izglītošana un praktiskas rekomendācijas darbībai. 2002. gadā ieviestais termins hroniska nieru slimība ļauj jebkuru pacientu ar nieru patoloģiju iekļaut kādā no šīs slimības stadijām, kurai atbilstoši izriet arī praktiskas rekomendācijas - no pirmās līdz otrajai trešajai stadijai pacientu var ārstēt jebkurš speciālists, lai gan trešajā stadijā jau būtu vēlama nefrologa konsultatīva palīdzība; ceturtajā un piektajā stadijā pacientam jāatrodas stingrā nefrologa uzraudzībā (šīs stadijas viegli noteikt, zinot glomerulārās filtrācijas ātruma noteikšanas formulas, kur kā pamatelements aprēķiniem ir kreatinīna koncentrācija asins serumā). Ja ikviens ģimenes ārsts vai internists strādātu atbilstoši šīm rekomendācijām, daudzu slimnieku ārstēšanas kvalitāte būtu ievērojami augstāka. (Sīkāk par šo tēmu rakstā: Čerņevskis H. Kā jāsaprot jēdziens „hroniska nieru slimība", Doctus, 2007; 6: 9-13)
Diemžēl ne visos Latvijas rajonu centros strādā sertificēti nefrologi. Arī Rīgas lielākajās ārstniecības iestādēs joprojām ir diezgan ievērojamas rindas, lai saņemtu kvalificētu konsultatīvo palīdzību. Lai risinātu šo problēmu, iespēju robežās daudzi nefrologi cenšas sniegt konsultācijas Latvijas rajonu centros izbraukumu veidā.
Ko var secināt no skrīninga?
Astoņu gadu šķērsgriezuma pētījums efektīvai HNS gadījumu atklāšanas stratēģijai (HUNT II)
Tika pārbaudīti vairāk nekā 65 000 pacientu, no kuriem 4,7% (jeb vienam no 21 pārbaudītā) noteica HNS diagnozi atbilstoši definīcijai: aprēķinātais GFĀ (GFĀ)
Aprēķināja, ka, skrīnējot pacientus ar hipertensiju vai cukura diabētu, vai virs 55 gadu vecuma, varētu atklāt 92-94% HNS gadījumu, un ir jāskrīnē astoņi deviņi šādi pacienti, lai atklātu vienu HNS gadījumu.
Skrīnējot visus pacientus ar cukura diabētu vai hipertensiju, atklāto HNS gadījumu īpatsvars būtu 42-45%, ar sešiem pārbaudāmajiem, lai atklātu vienu gadījumu.
Pētījuma astoņu gadu laikā tikai 38 (1,2%) no 3 069 atklātajiem gadījumiem HNS progresēja līdz terminālai nieru mazspējai, ar zemu risku pacientiem bez cukura diabēta vai hipertensijas, sievietēm un personām, jaunākām par 70 gadiem, vai GFĀ 45-59 ml/min/1,73m2. Pretstatā tam, novērotā kardiovaskulārā mirstība bija augsta: 3,5 (ja GFĀ 45-59 ml/min/1,73m2), 7,4 (ja GFĀ 30-44 ml/min/1,73m2) un 10,1 (ja GFĀ
Secinājumi: visefektīvākā stratēģija būtu skrīnēt personas virs 55 gadu vecuma, personas ar hipertensiju vai cukura diabētu (bet terminālas nieru slimības risks šajās grupās nebija augsts).
Hallan S. I. et al. Screening strategies for chronic kidney disease in the general population: follow-up cross sectional health survey//BMJ, 2006; 333: 1047.
Komentē asoc. prof. H. Čerņevskis
Aktualizējama jau iepriekš minētā piebilde, ka hroniskas nieru slimības pacienta nāves iemesli ne vienmēr ir saistāmi tikai ar nieru mazspējas progresēšanu līdz terminālai stadijai, bet var būt saistīti ar kardiovaskulārām vai cerebrovaskulārām problēmām, kā arī infekcijas attīstības iespējām. Nāve šajā gadījumā var iestāties arī pacientiem, kuriem ir HNS 1.-4. stadija.
Kā zināms, riska faktors ir arī pacientu vecums un dzimums. Pēc Latvijas datiem, vīrieši, kuriem uzsāka NAT 2006. gadā, bija 104,8 pacienti uz vienu miljonu iedzīvotāju, kamēr sievietes tikai - 74. Ja vērojam atbilstoši vecuma grupām, tad 2006. gadā vecuma grupā no 20 līdz 44 gadiem NAT uzsākta 33 vīriešiem un 15 sievietēm, vecuma grupā no 45 līdz 64 gadiem - 42 vīriešiem un 34 sievietēm, savukārt virs 65 gadu vecuma - 23 vīriešiem un 42 sievietēm.
Kā izriet no aplūkojamā raksta, tad HNS skrīnēšana būtu efektīva cukura diabēta, arteriālas hipertensijas un gados vecākiem pacientiem. Tas sasaucas arī ar mūsu valsts datiem.
HNS + KVS - iznīcinošs sinerģisms
Nieres ir orgāns ar ekskretoru, biosintēzes un metabolu funkciju. Nozīmīgākās HNS sekas neaprobežojas tikai ar GFĀ samazināšanos un nieru mazspējas progresiju, bet ietver virkni citu risku, no kuriem nozīmīgākais ir augstā kardiovaskulāro slimību (KVS) komorbiditāte HNS slimnieku vidū. Jaunākie pētījumi parādījuši, ka pacientiem ar HNS ir 100 reizes paaugstināta mirstība, galvenokārt tieši KVS, nevis progresējošā nieru bojājuma rezultātā. Pēc matemātikas analoģijas HNS tiek dēvēta par KVS riska reizinātāju, un šobrīd ir atzīta par neatkarīgu kardiovaskulāro notikumu riska faktoru šiem pacientiem.
Savukārt, raugoties no patoģenētiskā loka pretējās puses, hipertensija kā tāda ir viens no galvenajiem HNS attīstības un progresa riska faktoriem - nespējot panākt hipertensijas kontroli populācijā, nozīmīga tās daļa tiek pakļauta HNS attīstībai. Tā, piemēram, ASV ik gadu 94 000 HNS slimnieku attīstās termināla nieru mazspēja un ap 65% šo gadījumu ir tieši attiecināmi uz hipertensiju un cukura diabētu. Lielos randomizētos klīniskos hipertensijas pētījumos pierādīts, ka laba asinsspiediena kontrole, salīdzinājumā ar mazāk apmierinošu, efektīvāk samazina nieru un kardiovaskulāro slimību progresēšanu - 40-70% pret 30-50% pacientiem ar suboptimālu hipertensijas kontroli.
Vairums kardiovaskulāro slimību vadlīniju rekomendē testēt pacientus ar KVS uz HNS un diferencēt ārstēšanu pacientiem ar un bez tās.
Levey A. S. et al. Chronic Kidney Disease: Common, Harmful, and Treatable - World Kidney Day 2007//J Am Soc Nephr (JASN), 2007.
Weir M. R. The role of combination antihypertensive therapy in the prevention and treatment of chronic kidney disease//Am J Hypertens, 2005 Apr; 18(4 Pt 2): 100S-105S.
Komentē asoc. prof. H. Čerņevskis
Lielākās problēmas patiesi rada nevis primāras nieru slimības (glomerulonefrīts, pielonefrīts u. c.), bet gan sekundāri nieru bojājumi citu slimību gadījumos. ASV cukura diabēts ar diabētisko nefropātiju apmēram 40% gadījumu izraisa nieru mazspējas attīstību līdz pat terminālai stadijai. Otra biežākā patoloģija parasti ir hipertensīva nefropātija (līdz 20% gadījumu). Zināma loma ir arī asinsvadu patoloģijām, it sevišķi aterosklerotiskām pārmaiņām. Latvijā šie dati ir nedaudz atšķirīgi. Ja raugāmies uz galvenajiem iemesliem, kas noved pie HNS terminālas stadijas, tad 2006. gadā diabētiska nefropātija bija 18,4% no kopējā NAT slimnieku skaita Latvijā, hipertensīva nefropātija - 5,5%, hronisks glomerulonefrīts - 17,4%, bet summāri pirmajā vietā Latvijā ir hronisks pielonefrīts - 24,4%.
Pie nekoriģējamiem HNS riska faktoriem būtu jāpieskaita četri galvenie: glomeruloskleroze, vīriešu dzimums, lielāks pacientu vecums un tumšās rases pārstāvji. Pārējie riska faktori ir vairāk vai mazāk koriģējami: neadekvāta pamatslimības terapija, arteriāla hipertensija, proteinūrija, pārlieku liels uzņemto olbaltumvielu daudzums, dislipidēmija, anēmija, elektrolītu disbalanss, neadekvāta fiziska slodze un neveselīgs uzturs. Šo riska faktoru savlaicīga korekcija, var mazināt HNS un KVS progresēšanas ātrumu.
Kā redzams no uzskaitījuma, arteriālās hipertensijas kontrolei ir ārkārtīgi liela nozīme. ASV nefrologs G. Bakris (2000) savos darbos norāda, ka nekoriģēta arteriāla hipertensija noved pie GFĀ samazināšanās ar ātrumu 12 ml/min/gadā, kamēr normālos apstākļos pēc 45 gadu vecuma GFĀ fizioloģiski samazinās, bet samazināšanās ātrums nepārsniedz 1 ml/min/gadā. Piemērs apstiprina, ka arteriāla hipertensija pasliktina nieru funkcionālo stāvokli vismaz desmit reizes.
Dakterīt, cik daudz man jādzer?
Vispārējās prakses ārsti pacientiem ar HNS parasti rekomendē augstu šķidruma patēriņu, taču nav īsti skaidrs iemesls, kāpēc tā tiek darīts, jo zinātniska pamatojuma šai rekomendācijai nav. Vēl trakāk - šķiet, pastāv korelācija starp seruma kreatinīna līmeni un rekomendēto šķidruma daudzumu, proti, jo augstāka kreatinīna koncentrācija pacientam, jo lielāks šķidruma daudzums viņam tiek rekomendēts, sasniedzot pat četrus litrus dienā. Raksta autori norāda uz vairākām nesenām autoritatīvām publikācijām, kur HNS rīcības plāna ietvaros rekomendēts paaugstināts šķidruma daudzums, un min, ka cēlonis šādai dīvainai rīcībai varētu būt vienīgi vēsturiskas izcelsmes. Autori atspoguļo un atspēko dažus izplatītus, labi iesakņojušos mītus.
(1) Paaugstināts plazmas tilpums pastiprina nieru perfūziju un urīna produkciju, tā stimulējot kreatinīna un urīnvielas ekskrēciju. Šis pieņēmums ir spēkā tikai prerenālas nieru mazspējas izraisītas dehidrācijas gadījumos (piemēram, diareja, diurētisko līdzekļu pārdozēšana). Savukārt eivolēmiskiem pacientiem paaugstināta šķidruma uzņemšana vai izraisīt abnormālu cirkulējošā šķidruma tilpuma pieaugumu un arteriālu hipertensiju (sevišķi, runājot par NaCl saturošiem dzērieniem).
(2) Lai nieres labi strādātu, tām nepieciešama mitra vide, un vairāk urīna norāda uz labāku to funkciju. Patiesībā nierēm vajadzīgs pārsteidzoši mazs šķidruma apjoms, lai saglabātu pilnvērtīgu funkciju - veselām nierēm nepieciešams izdalīt 670 ml šķidruma, lai izvadītu 800 mOsmol/kg (vidējā norma) vielmaiņas produktu. Ja nieru koncentrēšanas spēja ir samazināta par 50% - tie būs 1 340 ml, turklāt, ņemot vērā, ka ne viss šķidrums tiek uzņemts dzerot (arī ēdiens, metabolisms), nepieciešami aptuveni 1 140 ml šķidruma dienā.
(3) Visiem pacientiem ar nierakmeņiem šķidrums ir labvēlīgs. Pacientiem ar recidivējošu nefrolitiāzi paaugstināta šķidruma plūsma un samazināta urīna koncentrācija patiešām ir vēlama. Bet mīts slēpjas citā apstāklī - proti, tautā nierakmeņu slimība un HNS visbiežāk tiek uztverti kā sinonīmi. Šis varētu būt skaidrojums, kāpēc populācijā pieņemts uzskatīt, ka visiem nieru slimniekiem daudz jādzer.
Minētais vēl nenozīmē, ka HNS pacientam būtu labvēlīgs efekts no šķidruma ierobežošanas vai ka lielāks šķidruma daudzums būtu kaitīgs nierēm (lai gan ir pētījumi, kur novērots, ka pacientiem, kas uzņem vairāk šķidruma, ātrāk samazinās nieru funkcija). Raksta autori atgādina, ka slāpes ir viena no vissmalkāk regulētajām organisma signālfunckijām un HNS pacientam nav nekāda pamata dzert tad, kad neslāpst.
Ulrich O. W. et al. My doctor said I should drink a lot! Recommendation for fluid intake in patients with chronic kidney disease//Clin J Am Soc nephrol, 2006; 1: 344-6.
Komentē asoc. prof. H. Čerņevskis
Varētu pilnībā piekrist visam šajā rakstā minētajam. Neliels komentārs attiecībā uz mūsu valstī pieņemtām šķidruma lietošanas tradīcijām: varētu tomēr uzskatīt, ka kopumā Latvijā nav paraduma lietot šķidrumu pietiekošā daudzumā, par ko, iespējams, liecina arī nierakmeņu slimības statistika, jo, kā jau rakstā pieminēts, nierakmeņu profilaksei šķidruma patēriņam vajadzētu būt optimālam (vismaz divi litri dienā, ja nav kontrindikāciju).
Par šķidruma lietošanu HNS pacientu ārstēšanā: manuprāt, vēl gados vecāku kolēģu praksē ir saglabājusies tā dēvētā dezintoksikācijas metode, kad HNS pacientus ārstē ar fizioloģiskā šķīduma vai glikozes šķīdumu parenterālu ievadi. Kā izriet no iepriekšminētā, tas praktiski nedod ievērojamus paliekošus pozitīvus rezultātus, un tā vietā, lai pacientu lēnām sāktu kaut vai psiholoģiski sagatavot nākotnē nepieciešamai NAT, mēs varam radīt ilūziju, ka var palīdzēt organisma skalošana ar infūzijas šķīdumiem. Lielākā kļūda infūziju veikšanas procesā ir tā, ka piemirstas sekot līdzi pacienta izdalītajam urīna daudzumam, un tad nereti gaidītā atindējošā efekta vietā varam izraisīt hiperhidrāciju, pat ar plaušu vai smadzeņu tūskas veidošanos.
Kā ārstēt gados vecus HNS pacientus?
Jā vai nē nieru aizstājterapijai
Pēdējās desmitgades laikā vairāk nekā divkāršojies gados vecu cilvēku ar terminālu nieru mazspēju (HNS 5. stadija) skaits. Fundamentālais jautājums šo cilvēku aprūpē ir - vai un kad uzsākt nieru aizstājterapiju? Viens no faktoriem, kas kompromitē šo lēmumu, - šiem pacientiem parasti ir virkne blakusslimību, kuru gadījumā dialīze var arī neuzlabot dzīvildzi. Patiesībā, ja neskatās tikai no ekonomiskā, bet no pacienta viedokļa, lēmums uzsākt dialīzi šādā situācijā - gados vecam slimniekam ar multipliem veselības traucējumiem - saistīts ar papildu stresu, ko rada dialīzes radītās ikdienas dzīves izmaiņas. Turklāt dialīzes pacientu vidū visaugstākos hospitalizācijas un komplikāciju rādītājus novēro tieši gados vecāko cilvēku vidū. Nesen publicēti divi pētījumi, kas labi papildina trūcīgo faktu bāzi par šo problēmu.
Pirmais pētījums parādīja, ka, neskatoties uz to, ka pacientiem virs 75 gadu vecuma dialīze kopumā asociējas ar pozitīvu dzīvildzes rādītāju dinamiku, apakšgrupās ar multiplām blakusslimībām (sevišķi išēmisko sirds slimību), dialīze neuzlabo dzīvildzi, salīdzinot ar konservatīvo terapiju.
Otrā pētījumā (randomizēts klīnisks pētījums) salīdzināja zemu proteīnu diētu ar dialīzi 112 HNS pacientiem bez cukura diabēta (> 70 gadi). Novēroja, ka dzīvildzes rādītāji starp abām grupām neatšķīrās, bet kopējais hospitalizācijas dienu skaits bija būtiski zemāks diētas grupā.
Brunori G. et al. How to manage elderly patients with chronic renal failure: conservative management versus dialysis//Blood Purif, 2008; 26(1): 36-40.
Komentē asoc. prof. H. Čerņevskis
Uzsākt vai neuzsākt NAT gados vecam pacientam ir jautājums, kas risināms individuāli katrā gadījumā, un to nosaka gan medicīniska rakstura jautājumi (pacienta mentālais stāvoklis, pārvietošanās iespējas, blakusslimību raksturs, izvērtējums, cik efektīva varētu būt NAT pacienta dzīves kvalitātes uzlabošanā u. c.), gan arī sociālas problēmas (piederīgo un sociālā darbinieka loma, attālums no NAT centra, mājas apstākļi u. c.). Mūsdienās Latvijā jau ir piemirsts laiks, kad (1974.-1976. gadā) NAT pielietojums ar Veselības ministrijas izdotām vadlīnijām tika ierobežots ar 45 gadu vecumu. Gados vecāku pacientu terapijas iespējas palielinājās pēdējās desmitgadēs, uzlabojoties ārstēšanas tehnoloģijām (modernāki mākslīgās nieres aparāti) un ieviešot klīniskajā praksē jaunas NAT metodes (hemodiafiltrācija, peritoneālā dialīze, kas atļauj veikt procedūru mājas apstākļos). Mūsu valstī gados vecu pacientu skaits ar NAT nav nemaz tik zems. 2006. gadā 72 pacientiem, kuri ārstējās ar hemodialīzi, peritoneālo dialīzi vai kuriem ir funkcionējošs nieres transplantāts, vecums pārsniedza 75 gadus.
Nefrologam bieži gadās situācijas, kad jāizšķiras, vai gados vecam pacientam NAT pielietošana dos labāku dzīves kvalitāti, vai arī turpināma konservatīvā terapija. Domāju, ka jābūt reālistam un jāsaprot, ka konservatīva terapija var nebūt sevišķi efektīva ilgākam laika periodam. Ja, piemēram, pacientam rekomendē ļoti zemu olbaltumu saturu uzturā ar domu samazināt katabolismu un tādējādi paglābt pacientu no NAT uzsākšanas, tad ar laiku šādam malnutrīcijā novestam pacientam labs NAT rezultāts būs ļoti apšaubāms.
D vitamīna deficīts
D vitamīna deficīta, kas manifestējas vēlākās HNS stadijās, attīstība sākas jau agrīnās slimības stadijās. Kalcija metabolisma regulācija nav vienīgā D vitamīna funkcija, un noskaidrots, ka D vitamīna deficīts ir saistīts ar paaugstinātu mirstību atsevišķās HNS pacientu grupās (sevišķi kardiovaskulāro slimību). Kā tieši šis faktors ietekmē pacientu ar 3. un 4. stadijas HNS mirstības rādītājus?
Laikā no 1995. līdz 2006. gadam tika noteikts seruma 25(OH)D līmenis 226 pacientiem (67 vīrieši, 159 sievietes, vidējais vecums 67 gadi) ar HNS 3. un 4. stadijā, salīdzinot kopējo un kardiovaskulāro mirstību starp tiem, kam 25(OH)D bija virs 20 pg/ml (142 pacienti) un zem tā (84 pacienti). Novērojuma periodā nomira 43 no šiem pacientiem, un kardiovaskulārās slimības bija vadošais iemesls tūlīt pēc infekcijas slimībām. Kopējā mirstība bija ievērojami augstāka tiem, kam 25(OH)D līmenis bija
Inaguma D. et al. Relationship between serum 1,25-dihydroxyvitamin D and mortality in patients with pre-dialysis chronic kidney disease//Clin Exp Nephrol, 2008.
Komentē asoc. prof. H. Čerņevskis
Gribētos vēlreiz atgādināt par D vitamīna terapijas nepieciešamību attiecīgā HNS stadijā. D vitamīna deficīts ir būtiska HNS izpausme, no kuras esamības ir atkarīgas multiplas metabolas pārmaiņas elektrolītu vielmaiņā. Iztrūkstot D vitamīnam, seko pazemināta kalcija absorbcija no gremošanas trakta ar sekojošu hipokalciēmijas attīstību. Hipokalciēmija stimulē epitēlijķermenīšu funkciju, un to izdalītais parathormons (PTH) mobilizē kalciju no kauliem, kā rezultātā nieru pacientam attīstās patoloģiskas kaulu pārmaiņas (sāpes kaulos, osteoporoze, patoloģiski lūzumi). Ilgstoši izdaloties PTH, kalcija līmenis asinīs sāk pārsniegt normu un uz hiperkalciēmijas fona draud parādīties nākamā iespējamā komplikācija - kalcinoze, kas veidojas, savienojoties kalcija un fosfora sāļiem (kuru koncentrācija asinīs HNS gadījumā sāk palielināties). Kalcinoze ir ģeneralizēta, tā lokalizējas asinsvados, mīkstajos audos, paraartikulāri, radzenē, sirds vārstulēs u. c.
Kā redzams, visas pārmaiņas sākumā iniciē pazeminātais aktīvā D vitamīna līmenis asinīs. Normālos apstākļos D vitamīns aktivējas, piesaistot hidroksilgrupas pie previtamīna D holesterīna gredzena aknās un nierēs. Nieru bojājumu gadījumos previtamīna D hidroksilācija nenotiek un pacientam ir jāievada D vitamīna preparāts, kurš jau ir aktivēts - 1,25(OH)2D3.
Minētās pārmaiņas sākas ļoti agrīni - HNS 3. stadijā. Sākumā klīniskajā ainā nekādu simptomu nav - pārmaiņas konstatē tikai laboratoriskā izmeklēšanā (hipokalciēmija, hiperfosfatēmija). Tādēļ ģimenes ārsta un internista praksē būtu svarīgi noteikt šos laboratoriskos kritērijus un uzsākt savlaicīgu terapiju ar aktīvo D vitamīnu, pat vēl pirms pacienta nosūtīšanas pie nefrologa.
Hemoglobīna mērķi
Anēmijas korekcija HNS slimniekiem, izmantojot eritropoetīnu, ir fundamentāls terapijas aspekts. Tomēr pašreizējās vadlīnijās nav minēts hemoglobīna mērķa līmeņa augstākais punkts.
12 randomizētu kontrolētu pētījumu (minimums 100 pacienti, minimums 12 nedēļas; pavisam 5 143 pacienti) metaanalīze uzrādīja paaugstinātu visu iemeslu mirstības risku (1,17) un arterio-venozas trombozes risku (1,34) grupā ar augstāku hemoglobīna līmeņa mērķi, turklāt starp pētījumiem nebija būtiskas heterogenitātes. Šajā grupā novēroja arī paaugstinātu slikti kontrolētas arteriālās hipertensijas risku (1,27), kaut gan ne visos aprēķinu modeļos. Miokarda infarkta risks bija līdzvērtīgs augstāka un zemāka hemoglobīna mērķa grupās.
Tādējādi pētījuma autori vērš uzmanību uz to, ka pārāk augsts hemoglobīna līmeņa mērķis, ārstējot HNS pacientus ar cilvēka rekombinēto eritropoetīnu, var ierindot šos pacientus paaugstinātas mirstības riska grupā. Tāpēc vadlīnijās nākotnē būtu jādefinē augšējā rekomendējamā hemoglobīna robeža.
Phrommintikul A. et al. Mortality and target haemoglobin concentrations in anaemic patients with chronic kidney disease treated with erythropoietin: a meta-analysis//The Lancet, 2007; 369: 381-8.
Komentē asoc. prof. H. Čerņevskis
Gribētos akcentēt anēmijas ārstēšanas aktualitāti agrīnās HNS stadijās. Kā klīnisks simptoms anēmija sāk izpausties HNS 3. stadijā, kuras gadījumā ģimenes ārsts vai internists vēl pacientu pat nesūta pie nefrologa. Taču, ja pacientam parādās anēmijas simptomātika, tālākā ārstēšanā būs jāiesaista nefrologs. Kāpēc? Anēmijas attīstības pamatā ir samazināta eritropoetīna sintēze nierēs. Mūsdienās ir pieejami moderni eritropoetīna preparāti, taču, ņemot vērā to augstās izmaksas, šos preparātus ar 100% valsts finansējumu var izrakstīt tikai sertificēti ārsti-nefrologi saskaņā ar Kompensējamo zāļu sarakstu (2008. gada janvāris, 177. lpp.). Un arī tikai tad, ja pacientam HNS 3. stadijā ir: 1) izslēgti citi anēmijas cēloņi; 2) hemoglobīna līmenis 100 ng/ml.
Ja pacientam jau ir uzsākta hemodialīze, tad preparātu var izrakstīt nefrologs vai ārsts, kurš veic hemodialīzi sertificēta nefrologa uzraudzībā.
Ņemot vērā minēto, ģimenes ārstam vai internistam nebūs īpaši jāuztraucas par hemoglobīna līmeņa pārmaiņām terapijas gaitā, jo tām sekos arī nefrologs, kas atbild par terapiju ar šo preparātu.
Olbaltumvielu deficīts un iekaisums
Proteīnu zudums un hronisks iekaisums ir būtiski prognostiski nelabvēlīgi faktori pacientiem ar HNS progresīvās stadijās. Neatkarīgi no specifiskajiem etioloģiskajiem mehānismiem, pašreiz pieejamie dati norāda, ka visi metabolie traucējumi HNS gadījumā patoģenētiski ir saistīti ar pārmērīgu proteīnu degradāciju neproporcionāli to sintēzei. Vairākos pētījumos secināts, ka hronisks iekaisums var predisponēt HNS pacientu katabolam stāvoklim olbaltumvielu enerģētiskā pienesuma samazināšanās dēļ. Tādējādi tiek atbalstīta ilgstoša pārtikas piedevu (parenterāli un perorāli) administrēšana, ar ko iespējams uzlabot barojumu pat pacientiem ar hemodialīzi.
Tā kā vairāki pilotpētījumi parādījuši, ka arī pretiekaisuma terapija var uzlabot metabolos parametrus, raksta autori vēlas pateikt, ka papildu barošana un pretiekaisuma terapija ir potenciāla ārstēšanas iespēja, kā uzlabot pacientu ar HNS stāvokli un samazināt mirstību šajā grupā.
Ikizler T. A. Nutrition, inflammation and chronic kidney disease//Curr Opin nephrol Hypertens, 2008; 17(2): 162-7.
Komentē asoc. prof. H. Čerņevskis
Ja pirmsdialīzes etapā (HNS 1.-4. stadijas) akcentējam pazemināta olbaltumvielu (0,8 mg/kg/d) satura nozīmi pacienta nefroprotektivitātē, tad, uzsākot NAT, nostādne kardināli mainās. NAT pacientiem nevajadzētu ierobežot olbaltumvielu daudzumu uzturā, jo nieru funkcijas tas vairs īpaši nespēs ietekmēt (pacientam jau ir NAT). Mūsu galvenais mērķis šajā gadījumā ir saglabāt normālu barojumu un neļaut attīstīties malnutrīcijai. Runājot par dažāda veida uztura bagātinātājiem, jebkurā gadījumā to lietošanu vajadzētu ļoti rūpīgi apsvērt, sekojot konkrētā preparāta lietošanas indikācijām, kontrindikācijām un sagaidāmajām blaknēm.
Slimības progress
HNS progresiju līdz terminālai nieru mazspējai var attālināt, tikai atpazīstot un ārstējot HNS jau agrīnās stadijās. Galvenie koriģējamie HNS attīstības un progresijas riska faktori ir cukura diabēts un arteriālā hipertensija.
Kā pirmās rindas medikamenti HNS progresijas prevencijai tiek minēti AKE inhibitori un angiotensīna receptoru blokatori, sevišķi HNS pacientiem ar proteinūriju (ar proteinūriju norit cukura diabēts, primāras glomerulu slimības, vairums hipertensīvas nefropātijas gadījumu), kas nodrošina renīna-angiotensīna-aldosterona sistēmas (RAAS) blokādi. Kā citi faktori, bez RAAS blokādes un asinsspiediena kontroles, kuri palēnina HNS progresēšanu, minēta intensīva hiperglikēmijas kontrole, smēķēšanas atmešana, agrīna anēmijas kontrole, kā arī statīnu terapija. Novērots, ka, piemēram, pacientiem ar diabētisko nefropātiju HNS adekvātas terapijas uzsākšana var samazināt nieru funkcijas redukcijas tempu no 10 ml/min/1,73m3/gadā līdz 2-4 ml, tā pārliecinoši samazinot mirstības rādītājus šiem pacientiem.
Wriner D. E. Causes and consequences of chronic kidney disease: implications for managed health care//JMPC, 2007; 13(3): S1-S9.
Komentē asoc. prof. H. Čerņevskis
Protams, nevar būt runa par adekvātu terapiju, ja pacienti ar HNS netiek atpazīti un pareizi ārstēti jau slimības agrīnās stadijās. Ja salīdzinām pacientu skaitu, kuriem uzsāk NAT mūsu valstī un ASV, tad starpība ir apmēram četras reizes mums par sliktu. Iespējamie iemesli ir nepietiekami agrīna HNS diagnostika un līdz ar to arī neadekvāta terapija. Manuprāt, par vienu no būtiskākajiem faktoriem šī stāvokļa korekcijai būtu jāuzskata izglītība par aktuāliem nefroloģijas jautājumiem - gan pacientiem un iedzīvotājiem kopumā, gan ģimenes ārstiem un internistiem.
Kā izriet no KDOQI (Kidney Disease Outcomes Quality Initiative) vadlīnijām, arteriālās hipertensijas korekcijai jāizvēlas preparāti ar iespējami nefroprotektīvu darbību, kuri vienlaicīgi koriģētu gan arteriālo hipertensiju, gan izmainītu hiperfiltrēto glomeruļu patoloģisko vaskularizāciju. Pirmkārt, ir jāpieskaita AKEI (angiotensīnkonvertējošā enzīma inhibitori) un AIIRB (angiotensīna II receptoru blokatori), kas var mazināt ne tikai arteriālo asinsspiedienu, bet samazināt proteinūrijas lielumu (mūsdienās proteinūriju nevērtē vienīgi kā nieru slimības marķieri, bet arī kā nieru bojājošo faktoru). Proteinūriju pazeminošs efekts ir novērots arī citiem hipotensīviem preparātiem. Var minēt nedihidropiridīnu grupas kalcija kanālu blokatorus (verapamils, diltiazems), dihidropiridīna grupas preparātu lerkanidipīnu, antialdosterona grupas preparātus (verošpironu, eplerenonu), diurētiskos līdzekļus (hidrohlortiazīdu, indapamīdu, cilpas diurētiskos līdzekļus). Interesanti ir dati par statīnu pleijotropisko efektu proteinūrijas samazināšanā.
Saskaņā ar KDOQI vadlīnijām, arteriālās terapijas korekcijā ir jāievēro vismaz astoņas galvenās rekomendācijas (kas kopumā ir diezgan līdzīgas kardiologu vadlīnijām): 1) nemedikamentozās terapijas ieteikumi (diēta, alkohola, vārāmās sāls ierobežošana, fiziska slodze utt.); 2) sekot līdzi citu nieru bojājošo faktoru iedarbībai (hiperlipidēmija, cukura diabēts); 3) AKEI un AIIRB terapija, it sevišķi mikroalbuminūrijas/proteinūrijas gadījumā; 4) monitorēt kālija līmeni terapijas laikā; 5) diurētisko līdzekļu nozīmēšana; 6) arteriālās hipertensijas (sistoliskās) mērķa spiediens zem 130 mm Hg; 7) proteinūrijas samazināšana; 8) terapijas laikā monitorēt GFĀ.