Intraokulārā spiediena izmaiņas pēc kataraktas ārstēšanas
Saīsinājumi
- AC — priekšējā kamera
- ACA — priekšējās kameras kakts
- ACD — priekšējās kameras dziļums
- ACG — slēgta kakta glaukoma
- ACV — priekšējās kameras tilpums
- APAC — akūta primāra kakta slēgšanās
- CACG — hroniska slēgta kakta glaukoma
- IOP — acs iekšējais spiediens
- OAG — atvērta kakta glaukoma
- PACG — primāra slēgta kakta glaukoma
- PEG — pseidoeksfoliatīvā glaukoma
- POAG — primāra atvērta kakta glaukoma
- TM — trabekulārais tīkls
Jau 1971. gadā pētnieki Bigers un Bekers nāca klajā ar slēdzienu, ka kataraktas operācija pazemina acs iekšējo spiedienu (IOP). 1990. gadu vidū Matsumura konstatēja, ka kataraktas operācija IOP pazemina vidēji par 1,5 mmHg un ka šis pazeminājums saglabājas vismaz trīs gadus. Kopš tā laika veikti daudzi retrospektīvi un perspektīvi pētījumi par kataraktas operācijas izraisītām IOP izmaiņām dažādu populāciju pacientiem. Daudzos gadījumos katarakta nav vienīgā acu slimība, to var pavadīt citas slimības, no kurām nozīmīgākā ir glaukoma. Tomēr tikai 2002. gadā publicēts sistemātisks apskats par ķirurģisko stratēģiju līdztekus kataraktas un glaukomas gadījumā. Pašlaik, pateicoties jaunu ķirurģisko metožu izstrādei un metožu pilnveidei, arvien lielāku interesi izraisa kataraktas operācijas IOP pazemināšanas iespēja tieši līdztekus glaukomas gadījumā.
Katarakta un glaukoma — izplatītākās acu slimības
Katarakta
Katarakta ir acu slimība, kad dzidrā un caurspīdīgā acs lēca kļūst necaurspīdīga, tāpēc tai cauri netiek gaismas stari un slimniekam rodas sūdzības par redzes pasliktināšanos, kā arī iespējamo attēla dubultošanos, skatoties ar vienu aci. Kad lēca apduļķojas pilnībā, slimnieks atšķir gaismu no tumsas, bet nevar saskatīt priekšmetus. Visbiežākais kataraktas cēlonis ir novecošanās, bet var būt iesaistīti arī tādi faktori kā trauma, toksīni, sistēmiskās slimības (piemēram, cukura diabēts), smēķēšana un iedzimtība.
Patoģenēze
Kataraktas patoģenēze nav pilnībā skaidra, tomēr zināms, ka kataraktas lēcai raksturīgi proteīnu agregāti, kas izkliedē gaismas starus un samazina lēcas caurspīdīgumu. Patoloģiskas izmaiņas olbaltumvielu struktūrā rezultējas ar dzeltenām vai brūnām krāsas izmaiņām. Raksturīgi arī pūslīši starp lēcas šķiedrām vai epiteliālo šūnu migrācija un patoloģiska palielināšanās. Patoģenētiskie mehānismi, kas veicina kataraktas veidošanos: brīvo radikāļu reakciju radīts oksidatīvs bojājums, ultravioleto staru izraisīts bojājums un nepilnvērtīgs uzturs (aizsargājoši iedarbojas karotinoīdi).
Glaukoma
Glaukoma ir optiska neiropātija, ko raksturo tīklenes ganglionāro šūnu un to aksonu progresējošs zudums. Tas rada neatgriezeniskas izmaiņas redzes nerva diskā un attiecīgi arī izmaiņas redzes laukā. Ir daudz hipotēžu par RGC bojāejas iemesliem. Vairāki faktori (ģenētiskie, acs asinsrite, neirodeģenerācija) ir nozīmīgi RGC bojāejas iemesli, bet pēdējā laikā par glaukomas iespējamo iemeslu min lēni noritošu iekaisumu, kā arī glaukomu kā autoimūnu slimību.
Iepriekš glaukomu skaidroja kā slimību, ko izraisa paaugstināts IOP (> 21 mmHg). Šobrīd skaidrs, ka paaugstināts IOP ir vērā ņemams glaukomas riska faktors, bet tas neizskaidro slimības būtību. Turklāt tikai pēc paaugstināta IOP diagnosticēt glaukomu var nepamatoti, jo ir liela starpība starp mazliet paaugstinātu IOP un klīniski nozīmīgām redzes diska vai redzes lauka izmaiņām. Ja IOP izmanto kā vienīgo glaukomas diagnostikas kritēriju, jāņem vērā, ka izoperēto acu biezā radzene rada potenciālu mērījumu kļūdu.
Patoģenēze
1. Atvērta kakta glaukoma (OAG)
POAG tradicionāli uzskata par ziemeļu platuma grādu slimību, tomēr jaunākie pētījumi liecina, ka tā bieži sastopama arī Āfrikas reģionos. Primāro atvērta kakta glaukomu grupā ir četras nozoloģiskās formas:
- primārā atvērta kakta glaukoma (POAG);
- pseidoeksfoliatīvā glaukoma (PEG);
- pigmenta glaukoma;
- normāla spiediena glaukoma.
OAG gadījumā par galveno ūdeņainā šķidruma drenāžas rezistences iemeslu uzskata mikroskopisku bloku trabekulārajā tīklā (TM), jo īpaši jukstakanalikulārajā TM reģionā. Ir piedāvāti vairāki OAG veidošanās mehānismi, piemēram, glikozoaminoglikānu depozīti TM ātrākas šķidruma plūsmas dēļ; iekaisuma ierosinātas morfoloģiskas pārmaiņas TM; sekundāras trabekulārā endotēlija izmaiņas un asins—ūdeņainā šķidruma barjeras izmaiņa.
2. Slēgta kakta glaukoma (ACG)
Lēš, ka ar ACG slimo 3,9 miljoni iedzīvotāju pasaulē (īpaši Āzijā) un ka tā izraisa apmēram ½ no visiem ar glaukomu saistītiem redzes zuduma gadījumiem, t.i., tikpat daudz, cik OAG gadījumā, lai gan ar to slimo trīsreiz vairāk cilvēku. ACG patoģenētiskās formas:
- ACG ar zīlītes bloku;
- ACG ar plakanu varavīksneni;
- “lienošā” ACG glaukoma;
- ACG ar stiklveida ķermeņa bloku.
Primāru kakta slēgšanos definē kā varavīksnenes—trabekulārā kontakta klātbūtni, kas kavē ūdeņainā šķidruma atteci caur difūzi nosprostoto TM, un parasti tā rodas seklas priekšējās kameras (AC) un priekšējās kameras kakta (ACA) sašaurināšanās dēļ. Slēgta kakta veidošanās iespēja ir proporcionāla attālumam starp varavīksneni un TM, tādējādi, ja kakta atvērums ir ≤ 20°, varavīksnenes—trabekulārā kontakta risks palielinās.
Glaukomas un kataraktas koeksistēšana vienā acī
Kataraktu un glaukomu vienā un tajā pašā acī bieži konstatē vienlaikus, īpaši gados vecākiem cilvēkiem. Nesenā Medicare datubāzes pārskatā atklāts, ka 19,1 % pacientu ar kataraktas diagnozi līdztekus ir arī glaukoma. Izplatītākais kataraktas un glaukomas koeksistēšanas veids ir primārā, ar vecumu saistītā katarakta un primārā atvērta kakta glaukoma. Zināms, ka vienas patoloģijas dēļ var attīstīties otra, piemēram, fakomorfiskā vai fakolītiskā glaukoma var izraisīt kataraktu, bet kataraktas operācija var veicināt glaukomas progresēšanu. Abas slimības var būt arī vienā un tajā pašā acu vai sistēmiskajā patoloģijā, piemēram:
- pseidoeksfoliatīvais sindroms;
- sindromi, kas saistīti ar ectopia lentis un glaukomu (homocistīnūrija, Weill—Marchesani sindroms);
- iedzimtas anomālijas (varavīksnenes—radzenes disģenēzes sindroms);
- ilgstoša lokālu vai sistēmisku kortikosteroīdu lietošana;
- komplikācijas pēc acu traumām vai iekaisumiem.
Kataraktas un glaukomas koeksistēšana var radīt vairākas problēmas, piemēram, anatomiskas izmaiņas ACG gadījumā (sekla AC, īsāks aksiālais garums), kas apgrūtina kataraktas ekstrakciju, IOP kontroli POAG pacientu kataraktas ārstēšanas procesā; kataraktas progresēšanas riska pieaugumu pēc glaukomas ķirurģiskas ārstēšanas.
Kataraktas operācijas ietekme uz acs IOP
No literatūras datiem zināms, ka kataraktas operācija pazemina acs IOP. Šo efektu novēro gan acīs ar kataraktu, gan acīs ar okulāro hipertensiju vai glaukomu (POAG, PACG un PEG). IOP pazemināšanās konstatēta acīs arī pēc dzidrās lēcas implantācijas.
Kataraktas acis
Pēc kataraktas operācijas jebkura tipa acīs vērojamas anatomiskas izmaiņas priekšējā kamerā, tādas kā priekšējās kameras dziļuma (ACD), kakta atvēršanās lieluma un AC tilpuma (ACV) pieaugums. IOP pazeminājums ir stabils un svārstās robežās no 1,4 līdz 3,8 mmHg.
Kataraktas acis ar okulāro hipertensiju
Novecojošā kristāliskā lēca var būt galvenais acu hipertensijas cēlonis. Daudzos pētījumos apstiprināts, ka dzidrās radzenes fakoemulsifikācija pazemina IOP pacientiem ar līdztekus kataraktu un hipertensiju un ka šī pazemināšanās parasti ir proporcionāla pirmsoperācijas IOP. Tādējādi, pazeminot IOP, var aizkavēt glaukomas attīstību acīs ar hipertensiju.
Pēc kataraktas operācijas okulārās hipertensijas acīs IOP pazeminās par 4,1 mmHg, kas ir 17 % pazeminājums no pirmsoperācijas IOP. Pazeminātais IOP saglabājās tādā pašā līmenī vismaz gadu pēc operācijas, bet pakāpeniski paaugstinās turpmākajos divos gados.
Kataraktas acis ar primāru atvērta kakta glaukomu (POAG)
Pacienti ar vidējas pakāpes POAG un IOP normas robežās ir ideāli kandidāti kataraktas operācijai. Šajā gadījumā novērotais IOP vidējais pazeminājums ir 1,1—4,7 mmHg. Turklāt nekontrolētas POAG acīs ir novērota lielāka IOP pazemināšanās nekā kontrolētas POAG gadījumā (attiecīgi 5,5 mmHg un 2,5 mmHg). Parasti IOP pazeminājums saglabājas apmēram gadu pēc kataraktas operācijas, lai gan ir arī pētījumi, kas norāda, ka pazeminājums saglabājas trīs un pat piecu gadus, bet ar laiku tam ir tendence atgriezties sākotnējā līmenī. Lai gan fakoemulsifikācija var pazemināt IOP, tai nav būtiskas ietekmes uz IOP svārstībām, tāpēc tikai kataraktas operācija POAG pacientiem var nenodrošināt sekmīgu IOP kontroli, lai glaukoma vairs neprogresētu. Dati par kataraktas operācijas ietekmi uz OAG ir šādi:
- vidējais IOP pazeminājums ilgtermiņā 1,5—2 mmHg. Piemēram, 150 pacientiem ar medicīniski kontrolētu glaukomu gadu pēc kataraktas operācijas konstatēts IOP pazeminājums 1,8 ± 3,1 mmHg. Tas nozīmīgi ir statistiski, bet ne no klīniskā viedokļa;
- nebūtiskas izmaiņas lietoto pretglaukomas medikamentu skaitā;
- IOP kontroles zudums gadu pēc operācijas apmēram 40 % gadījumu vai arī IOP paaugstināšanās;
- strauja IOP paaugstināšanās (> 30 mmHg) pirmajās trīs dienās pēc kataraktas operācijas.
Tātad pašlaik nav pārliecinošu pierādījumu, ka fakoemulsifikācija būtu efektīva IOP pazemināšanas metode kataraktas/OAG gadījumā.
Kataraktas acis ar primāru slēgta kakta glaukomu (PACG)
Lēca ir būtiska PACG patoģenēzē, ko nosaka tās anatomiskās īpatnības — pieaugošais sabiezējums un relatīvi priekšējais novietojums, kas izraisa kakta sašaurināšanos. Pēdējā laikā lēcas izņemšana popularizēta kā primārā ACG ārstēšanas metode. Parādās arvien vairāk datu, kas apstiprina, ka pēc sekmīgas kataraktas operācijas AC padziļinās, varavīksnenes—radzenes kakts paplašinās, IOP pazeminās un redze atjaunojas, turklāt tiek likvidēts šaurais kakts acīs ar primāru kakta slēgšanos un PACG. Šīs izmaiņas ir lielākas pacientiem, kam pirms operācijas bijis augstāks IOP un seklāka AC.
Tomēr lēcas ekstrakciju neiesaka kā rutīnas metodi akūtas PAC (APAC) gadījumā, jo operācija ir tehniski sarežģīta un saistīta ar ievērojamu komplikāciju risku. Nav īsti skaidrs, kad ir labākais laiks lēcas ekstrakcijai pēc APAC lēkmes. Teorētiski — jo agrāk, jo labāk (mazāka iespēja attīstīties perifēri priekšējām sinehijām un progresēt slimībai), taču lēcas ekstrakcija saistās ar komplikāciju risku. Varētu pieņemt, ka optimālais fakoemulsifikācijas laiks ir viens mēnesis pēc APAC, bet šī pieeja vēl adekvāti jāizvērtē.
Mūsdienās asām diskusijām pakļauta arī kataraktas ekstrakcija kā vienīgā ārstēšanas metode līdztekus kataraktas un slēgta kakta glaukomas (CACG) gadījumā. Dažos pētījumos apstiprināta šķietama IOP pazemināšanās pēc fakoemulsifikācijas CACG acīs. Tomēr alternatīvos literatūras apskatos pierādīts, kā lēcas ekstrakcijai nav reālas ietekmes uz CACG ārstēšanu, un, kaut arī lēcas ekstrakcija it kā rada labvēlīgu ietekmi PACG acīs, tās nozīme nav pilnībā pierādīta.
Lai gan dati par lēcas ekstrakcijas efektivitāti APAC un CACG gadījumā ir pretrunīgi, tomēr, apkopojot dažādu literatūras avotu datus, redzams, ka lēcas ekstrakcijas gadījumā IOP pazemināšanas efekts CACG/PACG acīs svārstās no 1,8 līdz 12,7 mmHg, turklāt šī pazemināšanās ir izteiktāka acīs ar APAC (padziļina AC un paplašina kaktu), sasniedzot pat 38 mmHg.
Rezumējot varētu secināt, ka kataraktas operāciju vienmēr vajadzētu apsvērt kā primāro ār-stēšanas metodi PACG gadījumā. Turpretī acīs ar POAG kataraktas operācijai attiecībā uz IOP pazemināšanu var būt ierobežots klīniskais efekts.
Kataraktas acis ar pseidoeksfoliatīvo glaukomu (PEG)
Apkopojot piecu pētījumu rezultātus par pacientiem ar pseidoeksfoliatīvo glaukomu (PEG), kuru vidējais apsekošanas laiks bija 34,2 mēneši, konstatēts, ka vidējais pirmsoperācijas acs iekšējais spiediens 20,7 mmHg pēc fakoemulsifikācijas pazeminājās līdz 16,6 mmHg, bet lietoto pretglaukomas medikamentu skaits no 1,7 samazinājās līdz 1. Rezultātā IOP pazeminājums bija 20 %, bet medikamentu skaita samazinājums — 35 % no sākotnējā.
Kombinētā ķirurģija
Jau iepriekš minēts par kataraktas un glaukomas koeksistenci vienā un tajā pašā acī. Vairāku pētījumu analīzē secināts, ka tikai kataraktas ekstrakcija IOP šajās acīs pazemina par 2—4 mmHg, bet kataraktas un glaukomas operāciju kombinācija — par 6—8 mmHg, tāpēc kombinētā pieeja varētu būt labvēlīgāka IOP ilglaicīgai stabilizēšanai. Kataraktu un glaukomu kombinēti ārstē arvien biežāk, jo:
- viena pati kataraktas operācija var nenodrošināt pietiekamu IOP pazemināšanos;
- glaukomas operācija pacientiem ar medikamentozi nekontrolējamu glaukomu var inducēt agrīnas kataraktas attīstību.
Faktori, kas ietekmē IOP pazemināšanos pēc operācijas
Lai prognozētu IOP izmaiņas pēc kataraktas operācijas, svarīgi izprast šo procesu ietekmējošos faktorus. Kataraktas operācijas rezultātu galvenokārt ietekmē pirmsoperācijas IOP, kas ir apgriezti proporcionāls pēc operācijas sasniegtajam IOP.
IOP pazemināšanos pēc kataraktas operācijas ietekmē arī vairāki citi faktori, piemēram, ACD, ACV un ACA lielumi. Novērots ievērojams ACD, ACV un ACA pieaugums (attiecīgi 1,08 mm, 54,4 mm3 un 13,11°) un vidējā IOP pazemināšanās (nekoriģētais: 2,47 mmHg; koriģētais: 3,18 mmHg) pēc standarta kataraktas operācijas.
Vēl svarīgs faktors, kas ietekmē kataraktas operācijas izraisīto IOP pazemināšanās lielumu, ir pirmsoperācijas nekoriģētā IOP un pirmsoperācijas ACD attiecība.
Spriežot pēc literatūras datiem, citi faktori — vecums, dzimums, lēcas biezums un aksiālais garums — nekādu iespaidu uz pēcoperācijas IOP neatstāj. Tāpat šo procesu neietekmē intervāls starp trabekulektomiju un kataraktas operāciju.
IOP pazemināšanās mehānismi
No literatūras datiem zināms, ka pēc kataraktas operācijas iespējama IOP pazemināšanās. Lai labāk prognozētu iespējamās pēcoperācijas IOP izmaiņas, svarīgi saprast, kādus acs iekšējos procesus ietekmē fakoemulsifikācija. Kataraktas ekstrakcijas ietekmes mehānisms uz IOP līdz galam nav skaidrs. Uzskata, ka IOP pazemināšanās kataraktas acīs pēc fakoemulsifikācijas varētu būt saistīta ar:
- palielinātu trabekulāro izplūdi (lēcas izņemšana izraisa AC un ACA padziļināšanos un ciliārā ķermeņa atpakaļrotāciju, tādējādi atbrīvojot TM un Šlemma kanālu);
- palielinātu uveo–sklerālo plūsmu, kas veidojas tālab, ka pēc operācijas atbrīvojas prostaglandīns F2;
- ūdeņainā šķidruma hiposekrēciju, ko izraisa ciliārā ķermeņa saraušanās, kas saistīta ar fibrozi un kontrakcijām, kuras raksturīgas lēcas mugurējai kapsulai pēc kataraktas operācijas;
- palielinātu ACV — tā pamatā ir 5 mm biezās kristāliskās lēcas aizvietošana ar 1 mm biezu mākslīgo lēcu. Rezultātā palielinās ACV, kas jāpiepilda ar ūdeņaino šķidrumu.
Kataraktas operācijas iespējamā negatīvā ietekme uz IOP
Lai gan parasti uzsvērta kataraktas operācijas pozitīvā ietekme uz acīm ar paaugstinātu IOP, literatūras dati liecina, ka tas ne vienmēr tā ir. Veicot kataraktas operāciju, jāparedz arī tās iespējamā negatīvā ietekme uz pēcoperācijas IOP.
Strauja pēcoperācijas IOP paaugstināšanās
Svarīgākā fakoemulsifikācijas komplikācija ir strauja IOP paaugstināšanās pēcoperācijas periodā, kas dažādos literatūras avotos dēvēta par spikes (angļu val. — smaile, asums). Agrīna IOP paaugstināšanās pēc kataraktas operācijas tradicionāli uzskatīta par nevēlamu glaukomas pacientiem, jo palielina glaukomas progresēšanas risku. Tāpēc acu ārstu galvenais uzdevums ir paredzēt šo fenomenu un censties to novērst, laikus domājot par profilaksi.
Krasas IOP paaugstināšanās novēršanā svarīga ir gan medikamentozā terapija, gan ķirurģiskās metodes izvēle.
IOP kontroles zudums
IOP kontroles zudumu definē kā IOP < 6 mmHg vai IOP ≥ 21 mmHg divās secīgās pārbaudēs, nepieciešamību lietot pretglaukomas medikamentus, lai IOP uzturētu < 21 mmHg, vai nepieciešamība veikt vēl vienu IOP pazeminošu operāciju.
Kataraktas operācija pēc trabekulektomijas var rezultēties gan ar IOP pazemināšanos, gan paaugstināšanos. Iespējamais IOP pazemināšanās mehānisms saistīts ar kataraktas operācijas pastiprināto hipotonijas efektu, bet IOP paaugstinās tālab, ka pēc fakoemulsifikācijas pasliktinās pūslīša (bleb) funkcija.
IOP izmaiņu neesība
Pierādīts, ka fakoemulsifikācija ne tikai izraisa pēcoperācijas spiediena pazemināšanos vai paaugstināšanos, bet tai var nebūt arī nekādas ietekmes uz pēcoperācijas IOP. Ir pētījumi, kas apstrīd lēcas ekstrakcijas noderīgumu OAG ārstēšanā.
Glaukomas progresēšana
CACG pacientiem ar zemu redzes lauka indeksu un augstāku pēcoperācijas IOP slimība var progresēt pat pēc vienkāršas kataraktas operācijas. Retrospektīvā pētījumā par 45 CACG pacientu 56 acīm pierādīts, ka pēc 24—84 mēnešus ilga apsekošanas perioda 14 acīs (25 %) glaukoma progresēja, bet 42 acu (75 %) stāvoklis nemainījās.
Svarīgi saprast, ka glaukoma un katarakta ir atšķirīgas slimības, tāpēc nav pareizi glaukomu ārstēt no kataraktas speciālista viedokļa. Lēcas ekstrakcija glaukomas ārstēšanai apsverama individuāli un jāpamato ar ticamiem klīniskiem rezultātiem, nevis hipotēzēm.
Glaukomas medikamentoza ārstēšana
Glaukomas medikamentoza ārstēšana ir pirmās rindas izvēles metode, tās taktika atkarīga no vairākiem faktoriem:
- slimības attīstības stadija diagnosticēšanas brīdī un progresēšanas ātrums;
- pacienta vecums un vispārējais veselības stāvoklis;
- medikamentu pieejamība un to izmaksas;
- pacienta līdzestība;
- iespēja regulāri sekot pacienta stāvoklim.
Līdz šim par galveno glaukomas medikamentozas ārstēšanas mērķi uzskatīta IOP pazemināšana (< 18 mmHg katrā apmeklējuma reizē vai vidējais IOP ~ 12,3 mmHg), pieņemot, ka šāds IOP apturēs glaukomas progresēšanu. Ja tas nenotiek, mērķa IOP pazemina vēl vairāk. Glaukoma turpina progresēt, ir svarīgi samazināt tās attīstības ātrumu, bet to prognozēt ir grūti. Pieņēmums, ka ≤ 21 mmHg ir vēlamais IOP visiem, ir vienkāršots. Tas būtu jānosaka ik pacientam individuāli.
Ārstēšanas procesā nav akli jāseko vispārējām vadlīnijām, bet jāizvērtē ieguvumu/riska attiecība katrā ārstēšanas stadijā, jo primārais glaukomas ārstēšanas mērķis ir nevis noteikta IOP sasniegšana, bet gan redzes saglabāšana. No redzes saglabāšanas viedokļa nav nozīmes, vai glaukomas sākotnējai ārstēšanai izvēlas ķirurģiskas vai medikamentozas metodes. Taču, tā kā medikamentozajai metodei ir daudz mazāk paredzamu blakņu, tai dodama priekšroka, sevišķi atvērta kakta glaukomas gadījumā.
Medikamenti
Pretglaukomas medikamentu klāsts mūsdienās ir plašs. Pēdējos 20 gados glaukomas ārstēšanai apstiprināts vairāk medikamentu nekā iepriekšējos 100 gados. Biežāk lietotās medikamentu grupas, to darbības mehānisms, efektivitāte un kontrindikācijas apkopotas 1. tabulā, uzskaitītie medikamenti lietojami arī kombinācijās. Ja tradicionāli pretglaukomas zāļu kombinācijas veidoja prostaglandīni, β blokatori, pilokarpīns un epinefrīns, pašlaik to sastāvs var būt daudzveidīgāks. Daudzas no medikamentu kombinācijām, piemēram, prostaglandīni/karbonanhidrāzes inhibitori, palīdz sasniegt labāku ārstēšanas rezultātu. Taču var atšķirties pacientu reakcija uz zāļu kombinācijām, tāpēc pirms kombināciju izrakstīšanas būtu jāpārbauda pacienta reakcija uz katru no medikamentiem atsevišķi. 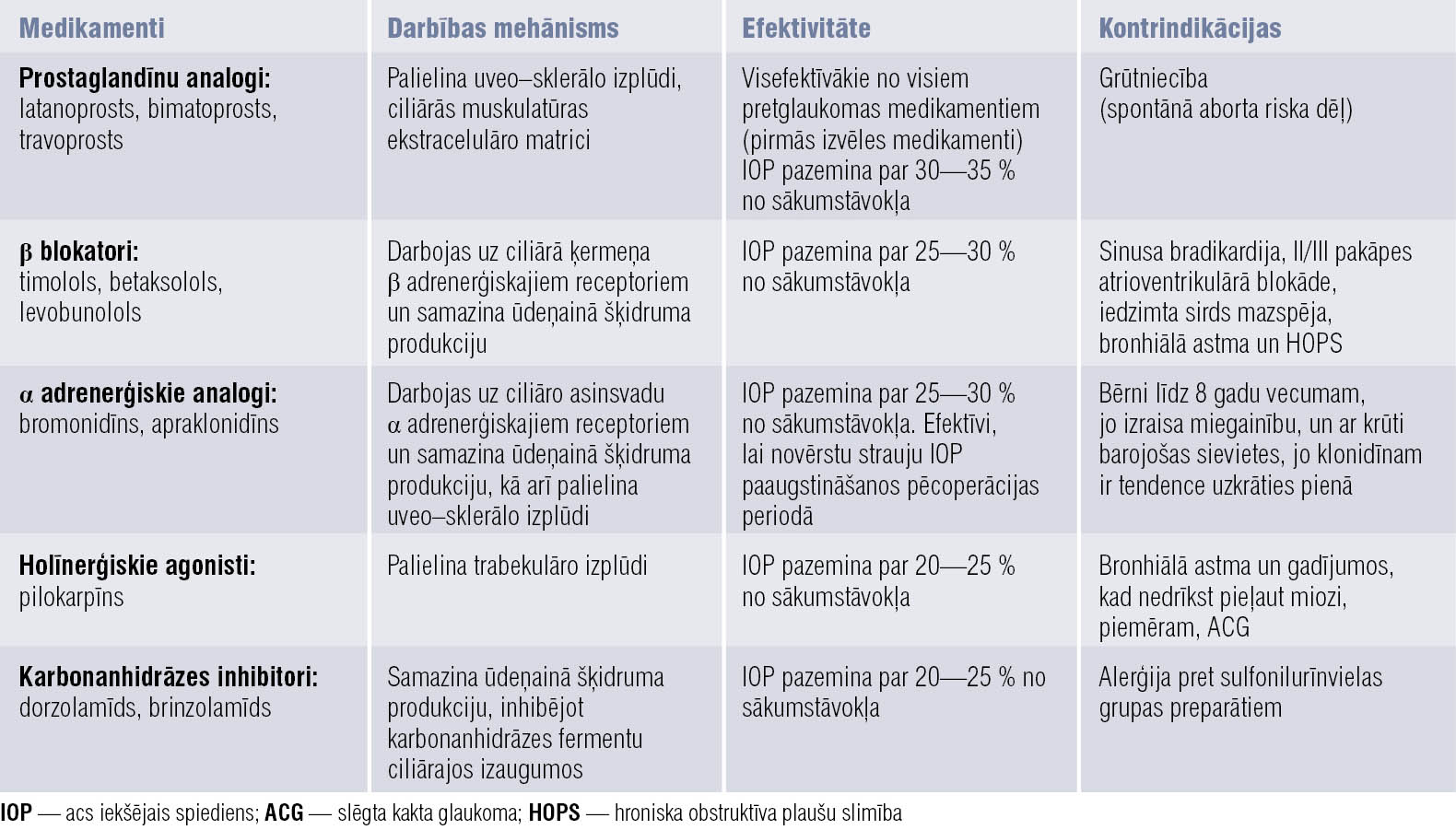

Ievades forma
Visizplatītākā pretglaukomas medikamentu ievades forma ir lokāli lietojami acu pilieni. Lai gan tie ir populāri un lietojami samērā vienkārši, šai zāļu formai ir arī savi trūkumi:
- lokāli lietojamie medikamenti var ātri noskaloties no radzenes virsmas ar asaru plūsmu, tāpēc, iespējams, vajadzēs lielākas devas;
- medikamentu absorbciju var samazināt radzenes sliktā caurlaidība, bet tas var izraisīt blaknes, kas saistītas ar zāļu sistēmisko absorbciju (2. tabula);

 2. tabulaPretglaukomas medikamentu grupu lokāla un sistēmiska iedarbība
2. tabulaPretglaukomas medikamentu grupu lokāla un sistēmiska iedarbība - pilienu iedarbības efektu var ietekmēt arī pacienta prasme tos pareizi lietot.
Pētījumos pierādīts, ka pat 59 % glaukomas pacientu neievēro pilienu ievades regularitāti, devas un metodi. Situāciju diez ko neuzlabo arī pilienu aizvietošana ar ziedēm un geliem, jo tie var izraisīt redzes miglošanos un diskomforta sajūtu acīs. Šo iemeslu pēc liela uzmanība veltīta jaunu pretglaukomas zāļu formu izstrādei un ieviešanai praksē. Viena no šādām formām ir subkonjunktivālas injekcijas (SI), kas jāievada vienreiz trīs mēnešos.
Šī jaunā zāļu forma ir laba izvēle pacientiem, kam vairāku veidu pilieni jālieto vairākas reizes dienā. Tomēr jāatzīst, ka reāla injekciju izmantošana ikdienas acu pilienu vietā regulārajā praksē vēl nav ieviesta, lai gan SI oftalmoloģijā izmanto arvien biežāk.
Aizvien vairāk diskutē par medikamentu depo formām, uznesot tos uz polimēru hidrogela kontaktlēcām. Analītiskie dati apstiprina, ka pretglaukomas medikamentus var pasīvi pārnest uz hidrogela kontaktlēcām un tad tie pasīvi izdalās no polimēra, tādējādi, lai lēcas piesātinātu ar medikamentu, tās ievieto medikamenta šķīdumā. Šīs metodes priekšrocība — lēca jāievieto tikai 30 minūtes dienā, tā īpaši piemērota pacientiem ar paaugstinātu IOP vai glaukomu, kuri nēsā arī kontaktlēcas. Publikāciju skaits ir neliels, pētījumi šajā virzienā joprojām turpinās.
KOPSAVILKUMS
- Daudzos gadījumos katarakta nav vienīgā acu slimība, to var pavadīt citas slimības, no kurām nozīmīgākā ir glaukoma.
- Katarakta ir acu slimība, kad dzidrā un caurspīdīgā acs lēca kļūst necaurspīdīga, tāpēc tai cauri netiek gaismas stari un slimniekam rodas sūdzības par redzes pasliktināšanos, kā arī iespējamo attēla dubultošanos, skatoties ar vienu aci.
- Glaukoma ir optiska neiropātija, ko raksturo tīklenes ganglionāro šūnu un to aksonu progresējošs zudums. Tas rada neatgriezeniskas izmaiņas redzes nerva diskā un attiecīgi arī izmaiņas redzes laukā. Paaugstināts acs iekšējais spiediens ir vērā ņemams glaukomas riska faktors, bet tas neizskaidro slimības būtību.
- Kataraktu un glaukomu vienā un tajā pašā acī bieži konstatē vienlaikus, īpaši gados vecākiem cilvēkiem. 19,1 % pacientu ar kataraktas diagnozi līdztekus ir arī glaukoma.
- Kataraktas operācija pazemina acs IOP. Šis efekts novērots ne tikai acīs ar kataraktu, bet arī acīs ar okulāro hipertensiju vai glaukomu.
- Pēc kataraktas operācijas jebkura tipa acīs vērojamas anatomiskas izmaiņas priekšējā kamerā, piemēram, priekšējās kameras dziļuma, kakta atvēršanās attāluma un AC tilpuma pieaugums. IOP pazeminājums ir stabils un svārstās robežās no 1,4 līdz 3,8 mmHg.
- Tradicionāli pretglaukomas zāļu kombinācijas veidoja prostaglandīni, β blokatori, pilokarpīns un epinefrīns; lietojot medikamentu kombinācijas, piemēram, prostaglandīnus/karbonanhidrāzes inhibitorus, iespējams labāks ārstēšanas rezultāts.
Literatūra
- Laganovska G. Īsumā par kataraktu. Latvijas Ārsts, 2010/10: 19–20.
- Volksone L. Glaukoma. Latvijas Ārsts, 2007/10: 21–23.
- Volksone L. Glaukoma un tās terapija mūsdienīgā izpratnē. Doctus, 2014/3(156): 29–30.
- Augustinus CJ, Zeyen T. The Chenffect of phacoemulsification and combined phaco/glaucoma procedures on the intraocular pressure in open-angle glaucoma. A review of the literature. Bull Soc Belge Ophthamol, 2012; 320: 51–66.
- Baig N, Kam K, et al. Lens extraction: where does it stand in the primary angle closure glaucoma management algorithm? Expert Rev Ophthalmol, 2014; 9(1): 1–5.
- Bergmanson JPG. Neural Control of Intraocular Pressure. Am J of Optometry & Physiological Optics, 1982; 59(1): 94–98.
- Brown RH, Zhong L, Lynch MG. Lens-based glaucoma surgery: Using cataract surgery to reduce intraocular pressure. J Cataract Refract Surg, 2014; 40(8): 1255–1262.
- Brown RH, Zhong L, Whitman AL, Lynch MG, Kilgo PD, Hovis KL. Reduced intraocular pressure after cataract surgery in patients with narrow angles and chronic angle-closure glaucoma. J Cataract Refract Surg, 2014; 40(10): 1610–1614.
- Budenz DL, Gedde SJ. New opinions for combined cataract and glaucoma surgery. Current Opinion in Ophthalmology, 2014; 25(2): 141–147.
- Chadrima P, Subhrangshu S, Ajoy P. Complications of phacoemulsification vs phacotrabeculectomy in the treatment of chronic angle closure glaucoma with concomitant cataract. Journal of Innovative Research & Development, 2013, 2(9): 56–66.
- Chen PP, Lin SC, Junk AK, Radhakrishnan S, Singh K, Chen TC. The effect of phacoemulsification on intraocular pressure in glaucoma patients OTA. Ophthalmology, 2015; 122: 1294–1307.
- Dada T, Rathi A, Angmo D, Agarwal T, Vanathi M, Khokhar SK, Vajpayee RB. Clinical outcomes of clear lens extraction in eyes with primary angle closure. J Cataract Refract. Surg, 2015; 41(7): 1470–1477.
- Dooley I, Charalampidou S, Malik A, Loughman J, Molleoy L, Beatty S. Changes in intraocular pressure and anterior segment morphometry after uneventful phacoemulsificaton on cataract surgery. Eye, 2010, 24: 519–527.
- Drolsum L, Ringvald A, Nicolaissen B. Cataract and glaucoma surgery in pseudoexfoliation syndrome: a review. Acta Ophthalmol Scand, 2007; 85: 810–821.
- Huang G, Gonzales E, Lee R, Chen YC, He M, Lin SC. Association of biometric factors with anterior chamber angle widening and intraocular pressure reduction after uneventful phacoemulsification for cataract. J Cataract Refract Surg, 2012; 38(1): 108–116.
- Irak-Dersu I, Nilson C, Zabriskie N, Durcan J, Spencer HJ, Crandall A. Intraocular pressure change after temporal clear corneal phacoemulsification in normal eyes. Acta Ophthalmol, 2010; 88: 131–134.
- Issa SA, Pacheco J, Mahmood U, Nolan J, Beatty S. A novel index for predicting intraocular pressure reduction following cataract surgery. Br J Ophthalmol, 2005; 89: 543–546.
- Klein BEK, Klein R, Knudtson MD. Intraocular pressure and systemic blood pressure: longitudinal perspective: The Beaver Dam Eye Study. Br J Ophthalmol, 2005; 89(3): 284–287.
- Kristianslund O, Østern AE, Råen M, Sandvik GF, Drolsum L. Does cataract surgery reduce the long-term risk of glaucoma in eyes with pseudoexfoliation syndrome? Acta Ophthalmol, 2016.
- Kung JS, Choi DY, Cheema AS, Singh K. Cataract surgery in the glaucoma patient. Middle East Afr. J Ophthalmol, 2015; 22(1): 10–17.
- Lambert SR, Purohit A, Superak HM, Lynn MJ, Beck AD. Long-term risk of glaucoma after congenital cataract surgery. Am J Ophthalmol, 2013; 156(2): 355–361.
- Lee CK, Lee NE, Hong S, Kang E, Rho SS, Seong GJ, Hong YJ, Kim CY. Risk factors of disease progression after cataract surgery in chronic angle-closure glaucoma patients. J Glaucoma, 2015.
- Lee YH, Yun YM, Kim SH, Lee EK, Lee JE, Kim CS. Factors that influence intraocular pressure after cataract surgery in primary glaucoma. Canadian Journal of Ophthalmology, 2009; 44(6): 705–710.
- Levkovitch-Verbin H, Habot-Wilner Z, Burla N, Melamed S, Goldenfeld M, Bar-Sela SM, Sachs D. Intraocular pressure elevation within the first 24 hours after cataract surgery in patients with glaucoma or exfoliation syndrome. Ophthalmology, 2008; 115(1): 104–108.
- Longo A, Uva MG, Reibaldi A, Avitabile T, Reibaldi M. Long-term effect of phacoemulsification on trabeculectomy function. Eye (London), 2015; 29(10): 1347–1352.
- Mansberger SL, Gordon MO, Jampel H, Bhorade A, Brandt JD, Wilson B, Kass MA. Reduction in intraocular pressure after cataract extraction: The ocular hypertension treatment study. Ophthalmology, 2012; 119(9): 1826–1831.
- Matlach J, Freiberg FJ, Leippi S, Grehn F, Klink T. Comparison of phacotrabeculectomy versus phacocanaloplasty in the treatment of patients with concomitant cataract and glaucoma. BCM Ophthalmology, 2013; 13: 1–12.
- Mayer C, Bergin C, Passarin O, Sharkawi E. Predictive factors for intraocular pressure reduction after phacoemulsification in Swiss patients. Klin Monbl Augenheilkd, 2015; 232(4): 409–413.
- Melancia D, Pinto LA, Marques-Neves C. Cataract surgery and intraocular pressure. Ophthalmic Res, 2015; 53: 141–148.
- Moghimi S, Latifi G, Amini H, Mohammadi M, Fakhraie G, Eslami Y, Nassiri N, Caprioli J. Cataract surgery in eyes with filtered primary angle closure glaucoma. J Ophthalmic Vis Res, 2013; 8(1): 32–38.
- Neuhann TH. Trabecular micro-bypass stent implantation during small-incision cataract surgery for open-angle glaucoma or ocular hypertension: Long-term results. J Cataract Refract Surg, 2015; 41(12): 2664–2671.
- Nonaka A, Kondo T, Kikuchi M, Yamashiro K, Fujihara M, Iwawaki T, Yamamoto, K, Kurimoto Y. Angle widening and alteration of ciliary process configuration after cataract surgery for primary angle closure. Ophthalmology, 2006; 113: 437–441.
- Poley BJ, Lindstrom RL, Samuelson TW, Schulze R. Intraocular pressure reduction after phacoemulsification with intraocular lens implantation in glaucomatous and nonglaucomatous eyes: evaluation of a causal relationship between the natural lens and open-angle glaucoma. J Cataract Refract Surg, 2009, 35(11): 1946–1955.
- Prata TS, Ushida M, Dorairaj S. Cataract surgery alone cannot be considered an IOP-lowering procedure for open-angle glaucoma patients: an evidence-based perspective. Arq Bras Oftalmol, 2015; 78(5).
- Rainer G, Stifter E, Luksch A, Menapace R. Comparison of the effect of Viscoat and DuoVisc on postoperative intraocular pressure after small-incision cataract surgery. J Cataract Refract Surg, 2008; 34(2): 253–257.
- Riordan-Eva P, Whitcher JP. Vaughan & Asbury’s General Ophthalmology, ed. 17. Mc-Graw Hill, 2008, 170–177.
- Sabihuddin A, Ayeza S. Role of cataract surgery in lowering intraocular pressure. Pak Armed Forces Med J, 2015; 65(3): 402–404. www.pafmj.org
- Senthil S, Chinta S, Rao HL, Choudhari NS, Pathak-Ray V, Mandal AK, Garudadri CS. Comparison of cataract surgery alone versus cataract surgery combined with trabeculectomy in the management of phacomorphic glaucoma. J Glaucoma, 2015.
- Shingleton BJ, Pasternack JJ, Hung JW, O’Donoghue MW. Three and five year changes in intraocular pressures after clear corneal phacoemulsification in open angle glaucoma patients, glaucoma suspects, and normal patients. Journal of Glaucoma, 2006; 15(6): 494–498.
- Shrivastava A, Singh K. The impact of cataract surgery on glaucoma care. Current Opinion in Ophthalmology, 2014; 25(1): 19–25.
- Tarek ME. Primary lens extraction for glaucoma management: A review article. Saudi Journal of Ophthalmology, 2011; 25: 337–345.
- Tetz M, Koerber N, Shingleton B, von Wolff K, Bull H, Samuelson T, Lewis R. Phacoemulsification and intraocular lens implantation before, during or after canaloplasty in eyes with open-angle glaucoma: 3-year results. J Glaucoma, 2013.
- Tham CCY, Kwong YYY, Leung DYL, Lam SW, Li FCH, Chiu TYH, Chan CHY, Poon ASY, Yick DWF, Chi CC, Lam DSC, Lai JSM. Phacoemulsification Versus Combined Phacotrabeculectomy Medically Controlled Chronic Angle Closure Glaucoma with Cataract. Ophthalmology, 2008; 115(12): 2167–2173.
- Tham CC, Leung DY, Kwong YY, Liang Y, Peng AY, Li FC, Lai JS, Lam DS. Factors correlating with failure to control intraocular pressure in primary angle-closure glaucoma eyes with coexisting cataract treated by phacoemulsification or combined phacotrabeculectomy. Asia Pac J Ophthalmol (Phila), 2015; 4(1): 56–59.
- Tojo N, Otsuka M, Miyakoshi A, Fujita K, Hayashi A. Improvement of fluctuations of intraocular pressure after cataract surgery in primary angle closure glaucoma patients. Graefes Arch Clin Exp Ophthalmol, 2014; 252: 1463–1468.
- Toteberg-Harms M, et al. Cataract surgery combined with excimer laser trabeculectomy to lower intraocular pressure: effectiveness dependent on preoperative IOP. BCM Ophthalmology, 2013, 13: 24–32.
- Vizzeri G, Weinreb RN. Cataract surgery and glaucoma. Current Opinion in Ophthalmology, 2010; 21: 20–24.
- Walland MJ, Thomas R. Lens surgery to treat open-angle glaucoma: Triumph of hope over (evidence-based) experience. J Cataract Refract Surg, 2014; 41(1): 247–248.
- Weiner Y, Severson ML, Weiner A. Intraocular pressure 3 to 4 hours and 20 hours after cataract surgery with and without ab interno trabeculectomy. J Cataract Refract Surg, 2015; 41(10): 2081–2091.
- Weinreb RN, Aung T, Madeiros FA. The Pathophysiology and Treatment of Glaucoma: A review article. JAMA, 2014; 311(18): 1901–1911.
- Zetterstrom C, Behndig A, Kugelberg M, Montan P, Lundstrom M. Changes in intraocular pressure after cataract surgery: Analysis of the Swedish National Cataract Register data. J Cataract Refract Surg, 2015; 41(8): 1725–1729.
- Zhang ML, Hirunyachote P, Jampel H. Combined surgery versus cataract surgery alone for eyes with cataract and glaucoma. Cohrane Database Syst Rev, 2015; 7: CD008671.
- Zhang ZM, Niu Q, Nie Y, Zhang J. Reduction of intraocular pressure and improvement of vision after cataract surgeries in angle closure glaucoma with concomitant cataract patients. Int J Clin Exp Med, 2015; 8(9): 16557–63.
- Zhou AW, Giroux J, Mao AJ, Hutnik CML. Can preoperative anterior chamber angle width predict magnitude of intraocular pressure change after cataract surgery? Canadian Journal of Ophthalmology, 2010; 45(2): 149–153.
- Егоров АЕ. Глаукома. Национальное руководство. Москва: ГЭОТАР-Медиа, 2013; 33–40, 217–226.
- Volksone L. Glaukoma un tās terapija mūsdienīgā izpratnē. Doctus 2014/3(156): 29–30.
- Chong RS, Su DH, Tsai A, Jiang Y, Htoon HM, Lamoureux EL, Aung T, Wong TT. Patient acceptance and attitude toward an alternative method of subconjunctival injection for the medical treatment of glaucoma. J Glaucoma, 2013; 22(3): 190–194.
- Dada T, Dave V, Mithal N. Medical Management of Glaucoma. Journal of Current Glaucoma Practice, 2009; 3(3): 13–17.
- Dietlein TS, Hermann MM, Jordan JF. The Medical and Surgical Treatment of Glaucoma. Dtsch Arztebl Int, 2009; 106(37): 597–606.
- Schultz CL, Poling TR, Mint JO. A medical device/drug delivery system for treatment of glaucoma. Clin Exp Optom, 2009; 92(4): 343–348.
- Singh K, Shrivastava A. Medical management of glaucoma: Principles and practice. Indian J Ophthalmol, 2011; 59(7): 88–92.
- Weinreb RN, Aung T, Madeiros FA. The Pathophysiology and Treatment of Glaucoma: A review article. JAMA, 2014; 311(18): 1901–1911.