Pēc European lung foundation sniegtajiem datiem gandrīz katrā eiropiešu ģimenē ir plaušu slimnieks – bieži vien nesmēķētājs. Aprēķināts, ka 2020. gadā pasaulē mirs ap 68 miljoniem cilvēku, no kuriem 11,9 miljonus nogalinās plaušu slimības (4,7 hroniska obstruktīva plaušu slimība, 2,5 pneimonija, 2,4 tuberkuloze un 2,3 miljonus – plaušu vēzis). Kā redzams, elpošanas orgānu slimības ir viens no galvenajiem nāves cēloņiem visā pasaulē, mirstības, incidences, prevalences un izmaksu ziņā ieņemot otro vietu aiz sirds-asinsvadu saslimšanām. Tālākais materiāls atlasīts no specializētas pulmonoloģijas un respiratorās medicīnas periodikas šā gada publikācijām un atspoguļo intensīvāk diskutētas tēmas.
Netuberkulozes mikobaktērijas
Pēdējos gados pieaug netuberkulozes mikobaktēriju (NTM, īpaši Mycobacterium avium kompleksa) klīniskā aktualitāte. NTM arvien biežāk tiek izdalītas no pacientiem ar plaušu slimībām: šī tendence tiek novērota visā pasaulē un ir viena no nedaudzajām šāda veida tendencēm, kas nav pamatojama tikai ar labākām diagnostikas metodēm vai saistīta ar HIV infekciju.
Lai gan vairākumam inficēto nekad nerodas NTM infekcija, daļai imūnkompetentu personu tas tomēr notiek. Tad slimība var attīstīties trīs formās: kā tuberkulozei līdzīgs - fibrokavitārs - process (biežāk gados vecākiem smēķētājiem ar HOPS), kā nodulāras bronhektāzes (klasiski - vidēja vecuma nekad nesmēķējušām sievietēm ar sūdzībām par klepu) vai kā hiperesensitīvs pneimonīts. M. avium komplekss aprakstīts saistībā ar visām trim formām, bet vienu, otru vai trešo slimības variantu var izraisīt daudzas NTM.
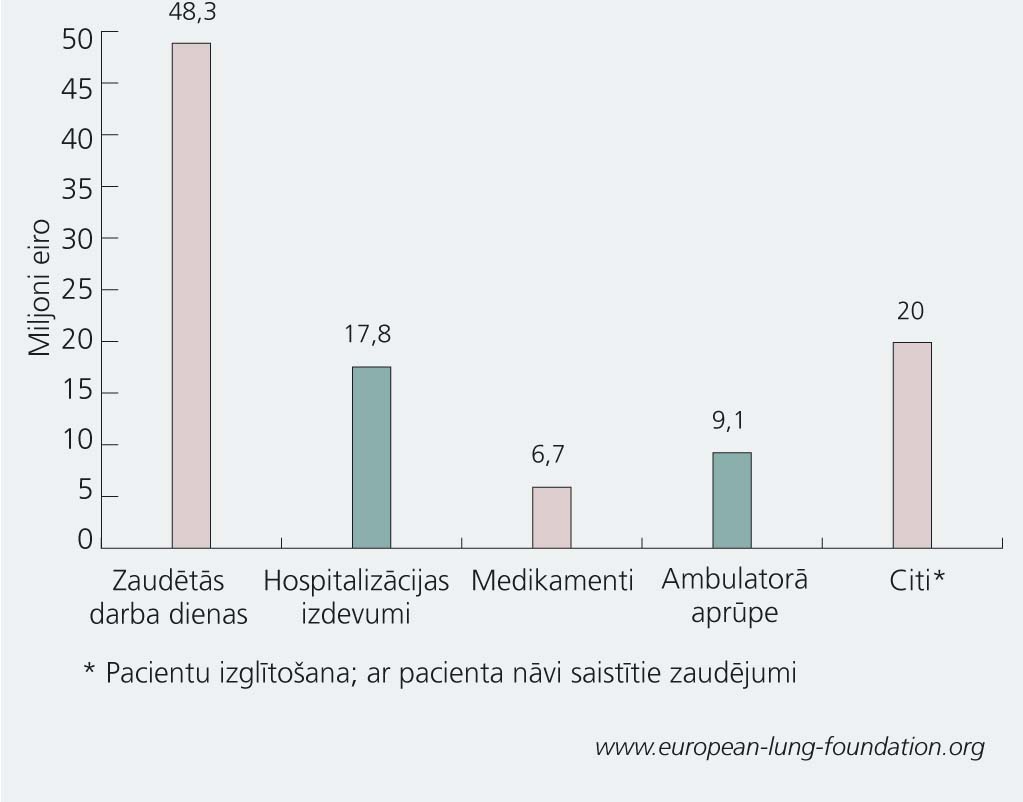

1. tematiskais pielikums
Respiratoro slimību radītais ekonomiskais slogs Eiropā (2000)
Summējot literatūras datus par NTM un plaušu slimībām, secināts, ka galvenā riska grupa ir pacienti ar preeksistējošām strukturālām izmaiņām plaušās. Otra augsti uzņēmīga grupa iezīmējas kopš 1980. gadiem - tie ir vidēja vecuma nesmēķētāji bez iepriekšējām plaušu slimībām, kā arī personas ar atsevišķiem ģenētiski noteiktiem šūnu imunitātes traucējumiem (IL-12/gamma interferona ass izmaiņas, D vitamīna receptoru izmaiņas u. c.).
Glassroth J. Pulmonary disease due to nontuberculous mycobacteria//Chest 2008; 133 (1): 243-51.
Sexton P., Harrison A. C. Susceptibility to nontuberculous mycobacterial lung disease//Eur Respir J 2008; 31 (6): 1322-33.
Komentē Dr. med. Māris Bukovskis, P. Stradiņa KUS, Pulmonoloģijas centrs
NTM ir ubikvitāri (dabā plaši sastopami) mikroorganismi, kas cilvēkiem var izsaukt plaušu (M. avium komplekss, M. cansasii), limfmezglu (M. avium komplekss, M. scrofulaceum, M. malmoense), ādas un mīksto audu (M. marinum, M. ulcerans), kā arī smaga imūndeficīta gadījumā - ģeneralizētas slimības (M. abscessus, M. fortuitum, M. chelonae). Ne vienmēr NTM infekciju novēro pacientiem ar imūndeficītu, bet parasti tā attīstās pacientiem ar jau esošu plaušu slimību: HOPS, bronhektāzēm, pneimokoniozi, cistisko fibrozi vai iepriekš pārslimotu tuberkulozi. Riska grupu un raksturīgāko simptomu identifikācija šajā gadījumā ir ļoti svarīga, lai klīniskā praksē nepieļautu kļūdas plaušu iekaisuma slimības diagnostikā.
NTM infekcijām raksturīga klīnisko formu daudzveidība, tāpēc diagnostika var būt sarežģīta. Tā kā ne klīniskie, ne radiolģiskie kritēriji nav specifiski, tad ir nepieciešams diagnozes mikrobioloģisks apstiprinājums.
Bordetella pertussis - pieaugušajiem ar ilgstošu klepu
Literatūrā nonāk arvien vairāk datu par B. pertussis infekciju pieaugušo populācijā. Piemēram, kohortas pētījumā Grieķijā 554 pacientiem, kas griezušies pie ārsta ar sūdzībām par jaunparādījušos klepu (2005-2007), kurš ildzis vairāk par trim nedēļām, retrospektīvi noteiktas antivielas pret B. pertussis. 397 no šīm personām jeb 71,5% gadījumu seroloģiskie antivielu testi (IgM/IgG) uzrādīja pozitīvu rezultātu.
Šis ir viens no pētījumiem, kas parāda, ka minētā infekcijas slimība nebūt nav reta klepus diferenciāldiagnoze pieaugušo vidū.
Kapaskelis A. M. et al. High prevalence of antibody titers against Bordetella pertussis in an adult population with prolonged cough//Respir Med 2008; Aug 4.
Komentē Dr. med. M. Bukovskis
Pacientiem, kam pēc akūtas elpceļu infekcijas klepus turpinās ilgāk par trim nedēļām, tiek diagnosticēts pēcinfekcijas klepus sindroms. Pēcinfekcijas klepus parasti neturpinās ilgāk par astoņām nedēļām, un viens no tā cēloņiem (par ko liecina seroloģiskie antivielu testi) ir B. pertussis infekcija. Interesanti, ka pēdējo piecdesmit gadu laikā saslimstība ar šo infekciju pusaudžu un pieaugušo vidū pieaugusi aptuveni 10-20 reižu. Problēmas risinājums varētu būt pusaudžu un pieaugušo atkārtota vakcinācija.
Bērnu mirstība no astmas Zviedrijā
Pēdējās desmitgadēs, pieaugot astmas saslimstībai, aktualizējies arī jautājums par mirstību, kas ar to saistīta. Analizēti riska faktori bērniem un jauniem pieaugušajiem (1-34 gadi) Zviedrijā desmit gadu periodā. Tika identificēti 37 letāli gadījumi, kas apstiprināti ar atbilstīgu SSK kodu un autopsijas datiem. Vidējais nāves iestāšanās vecums bija 27 gadi, bet grupā zem 15 gadu vecuma - seši gadi. Kopējā incidence samazinājās no 1,54 gadījumiem uz vienu miljonu 1994. gadā līdz 0,53 gadījumiem 2003. gadā. Kā biežākie riska faktori tika izdalīti: nepietiekama ārstēšana (23 no 37 gadījumiem), zema līdzestība nozīmētajai terapijai (17 no 37) un nelabvēlīga psihosociālā situācija (19 no 37). Satraucošs ir novērojums, ka letālais iznākums 11 no šiem 37 gadījumiem, iespējams, bijis saistīts ar alerģiju pret pārtiku un astoņos gadījumos - ar kontaktu ar mājdzīvniekiem.
Secināts, ka alerģija pret pārtikas vielām un neadekvāta terapija ir galvenie riska faktori ar astmu saistītai mirstībai.
Bergström S. E. et al. Asthma mortality among Swedish children and young adults, a 10-year study//Respir Med 2008; Jul 15.
Komentē Dr. med. M. Bukovskis
Aptuvenas aplēses liecina, ka gada laikā visā pasaulē no astmas mirst ap 250 000 cilvēku. Kopš astoņdesmito gadu vidus ārstēšana ar inhalējamiem glikokortikoīdiem, neskatoties uz slimības izplatības un atsevišķās valstīs arī smaguma palielināšanos, ir būtiski uzlabojusi astmas kontroli un samazinājusi mirstību Eiropā. Nāves varbūtība astmas uzliesmojuma laikā samazinās apgriezti proporcionāli izlietoto inhalējamo glikokortikoīdu inhalatoru skaitam gada laikā (Suissa S. et al. NEJM 2000; 343(5): 332-6).
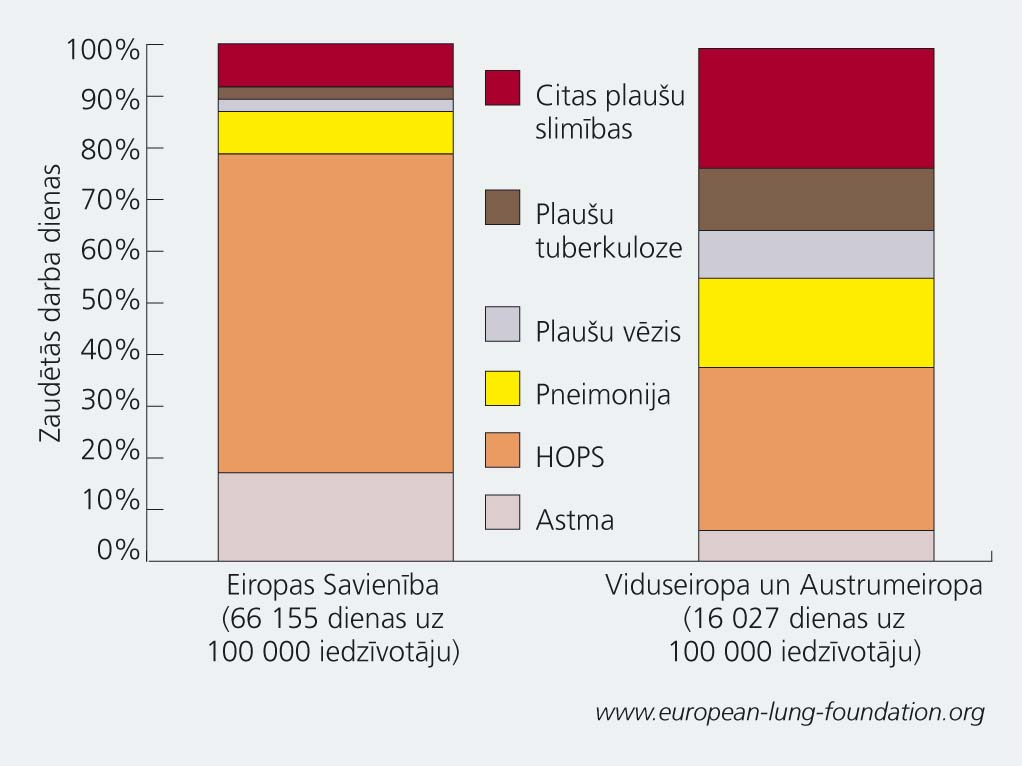

2. tematiskais pielikums
Ikgadējais zaudēto darba dienu īpatsvars dažādu plaušu slimību dēļ
Minētajā publikācijā atspoguļojas pārtikas alerģijas un nepietiekamas ārstēšanas nozīme fatālas astmas gadījumā. 20-66% pacientu ar pēkšņiem, smagiem, dzīvībai bīstamiem astmas uzliesmojumiem diagnosticē pārtikas alerģiju. Visbīstamākie no pārtikas alergēniem ir zemesrieksti - kā liecina epidemioloģisko pētījumu rezultāti, vismaz 50% fatālu alerģisku reakciju saistīti ar zemesriekstiem un 92% no visām ar pārtiku saistītām anafilaktiskām reakcijām izraisa dažādas riekstu sugas. Būtiski atcerēties, ka lielākajai daļai pacientu, kas mirst anafilaktiskas reakcijas dēļ, tiešais nāves cēlonis ir nevis šoks vai angioneirotiskā tūska, bet smaga astmas lēkme (Ayres J. G. et al. Thorax 1998; 53(4): 315-21; Bock S. A. et al. J Allergy Clin Immunol 2001; 107(1): 191-93).
Pareizas ārstēšanas nozīmi apstiprina fakts, ka pie fatālās astmas riska faktoriem jāpieskaita tādi faktori kā nesen pārtraukta glikokortikoīdu terapija, zems ienākumu līmenis, psihiskas slimības, psihosociālas problēmas vai neadekvāta elpceļu obstrukcijas uztvere, kas neļauj pacientam objektīvi novērtēt savu stāvokli un pielāgot ārstēšanu (Papiris S. et al. Crit Care 2002; 6(1): 30-44).
HOPS un atvilnis
Ir labi zināmas tādas gastroezofageālā atviļņa (GEAS) izpausmes respiratorajā sistēmā kā astma, laringīts un hronisks klepus, bet par HOPS jautājums nav tik skaidrs. Veikts pētījums ar mērķi noskaidrot GEAS ietekmi uz HOPS norisi, iesaistot 82 pacientus ar HOPS un 40 atbilstīgas kontrolpersonas. HOPS pacienti sešus mēnešus aizpildīja speciālu GEAS simptomu dienasgrāmatu, paralēli tika noteikts izelpas kondensāta pH līmenis abās grupās un veikta krēpu indukcija HOPS grupā.
Rezultāti: pozitīvus GEAS simptomus bija atzīmējuši 26,8% personu ar HOPS un 12,5% kontrolpersonu. HOPS uzliesmojumu biežums ticami korelēja ar GEAS simptomu biežu mu (vidējais relatīvais risks 6,55 (1,86-23,11)). Izelpas kondensāta pH līmenis savukārt apgriezti korelēja ar GEAS rādītājiem abās grupās - paaugstinoties pH līmenim (samazinoties skābumam), samazinājās GEAS simptomu biežums.
Secināts, ka GEAS ir būtisks faktors, kurš saistās ar HOPS uzliesmojumiem.
Terada K., Muro S. et al. Impact of gastro-oesophageal reflux disease symptoms on chronic obstructive pulmonary disease exacerbation//Thorax 2008; Jun 5.
Komentē Dr. med. M. Bukovskis
Pacientiem ar HOPS, tāpat kā astmas slimniekiem, GEAS novēro biežāk nekā veseliem indivīdiem, un pēdējo gadu pētījumi pierāda, ka GEAS patiešām palielina HOPS uzliesmojumu varbūtību. Novērojumi liecina, ka pacientiem ar HOPS un GEAS ir vismaz divas reizes augstāks risks nonākt slimnīcā slimības paasinājuma dēļ (Rascon-Aguilar I. E. et al. Chest 2006; 130:1096-101). Iespējamie patoģenētiskie mehānismi, kas veicina HOPS uzliesmojumu, ir kuņģa satura mikroaspirācija un/vai n. vagus kairinājums.
Par spīti pārliecinošiem pierādījumiem, joprojām ir atklāts jautājums par to, vai ārstēšana ar skābes aktivitāti samazinošiem medikamentiem var samazināt HOPS uzliesmojumu biežumu.
Prognostiskie kritēriji pacientiem ar pneimoniju pēc izrakstīšanas no stacionāra
Kādas klīniskās variācijas korelē ar prognozi pneimonijas slimniekiem pēc izrakstīšanas no stacionāra? Apkopojot datus par 870 pacientiem (vitālie rādītāti + oksigenācijas dati), identificēja četrus parametrus, kas ticami prognozē atkārtotas hospitalizācijas un mirstības risku 30 dienu laikā pēc izrakstīšanas no stacionāra: vienu lielo kritēriju (ķermeņa temperatūra > 37,5o) un trīs mazos kritērijus (sistoliskais asinsspiediens 24 x min.; skābekļa saturācija (viens lielais vai divi mazie) vai vairākiem kritērijiem aprēķinātais mirstības risks bija gandrīz sešas reizes augstāks (5,8).
Novērojuma autori norāda: šie ir klīnicistam vienkārši pieejami dati, kas norāda uz to, ka pacienta stāvoklis nav stabils.
Capelasteugi A. et al. Pneumonia: criteria for patient instability on discharge//Chest 2008; May 19.
Komentē Dr. med. M. Bukovskis
Pētījumi liecina, ka nestabilu pacientu izrakstīšana no slimnīcas var palielināt nāves risku par 50-60%, salīdzinot ar stabiliem pacientiem. Tāpēc ļoti svarīgi ir atklāt un definēt kritērijus, uz kuriem balstoties, būtu iespējams pneimonijas pacientus izrakstīt no slimnīcas pēc iespējas ātrāk, nebaidoties par iespējamām komplikācijām. Pie nestabilitātes rādītājiem patiešām pieskaitāmi augstākminētie; arī attiecībā uz mirstību dažādos pētījumos iegūti līdzīgi rezultāti, ka nāves risks piecas sešas reizes palielinās, izrakstot pacientus, kam ir spēkā divi vai vairāki nestabilitātes kritēriji (Halm E. A. et al. Arch Intern Med 2002; 162: 1278-84).
Granzīms K - jauns akūta iekaisums mediators?
Granzīmi ir serīna proteāžu, kuras iesaistītas daudzu iekaisīgu slimību patoģenēzē, apakšgrupa. Līdz šim bija zināma A un B grupas granzīmu loma plaušu slimību patoģenēzē cilvēkam, bet ne granzīma K (GrK) loma. Tāpēc veikts pētījums par GrK produkciju un ekspresiju pacientiem ar alerģisku astmu, HOPS un bronhopneimoniju. GrK līmenis tika kvantificēts šo pacientu un veselu kontrolpersonu bronhoalveolārās lavāžas (BAL) šķīdumā. Paralēli analizēja GrK molekulāro formu un celullāro ekspresiju.
Par izejas (normālo) līmeni pieņemot veselo kontrolpersonu rādītājus, GrK līmenis BAL nebija izmainīts pacientiem ar HOPS un pacientiem ar alerģisku astmu pirms alergēnu provokācijas. Turpretī nozīmīgi paaugstināts GrK līmenis tika konstatēts pacientiem ar akūtu bronhopneimoniju. GrK līmenis BAL, kā arī GrK ekspresējošo CD8+ šūnu līmenis BAL astmas pacientiem būtiski pieauga vienu līdz trīs diennaktis pēc alergēnu provokācijas.
Šie ir pirmie dati, kas parāda GrK regulācijas traucējumu saikni ar akūtu (gan infekciozas, gan neinfekciozas etioloģijas) elpceļu iekaisumu.
Bratke K., Klug A. Granzyme K: a novel mediator in acute airway inflammation//Thorax 2008, Jun 17.
Komentē Dr. med. M. Bukovskis
Granzīmi ir iesaistīti daudzu iekaisuma slimību patoģenēzē. IL-3 stimulē serīna proteāzes granzīma B sintēzi bazofilos leikocītos, kas alergēna ekzpozīcijas gadījumā veicina jaunu granulu veidošanos šajās šūnās (Tschopp C. M. et al. Blood 2006; 108 (7): 2290-9). Tuklās šūnas un bazofilos leikocītus var uzskatīt par vienu no galvenajām šūnām alerģiskās reakcijas patoģenēzē.
Granzīma K koncentrācijas paaugstināšanās pacientiem ar akūtu pneimoniju un pacientiem ar astmu pēc provokācijas ar alergēnu liecina par vēl viena jauna iekaisuma regulācijas mehānisma atklāšanu.
Hroniska klepus empīriska ārstēšana
Hronisks klepus ir bieži sastopams: tas ir mokošs simptoms pacientam un sarežģīts uzdevums ārstam. Par spīti izstrādātām pedantiskām hroniska klepus diagnostikas vadlīnijām, līdz pat 42% pacientu netiek konstatēti tā iemesli.
Žurnālā Respirology publicēts prospektīvs pētījums par trīspakāpju empīriskās terapijas efektivitāti 102 pacientiem (vecums 49 +/- 16 gadi) ar hronisku klepu, kas ilgst no diviem mēnešiem līdz pat desmit gadiem, normālu plaušu rentgenu un funkcionālajiem testiem. Kā pirmais solis pacientiem tika ordinēti antihistamīnus saturoši dekongestanti un bronhodilatatori, otrais - kortikosteroīdi, trešais - protonu pumpja inhibitori kombinācijā ar prokinētiķiem. Klepus simptomus dokumentēja pirms un pēc katra soļa.
Pēc pirmā soļa klepus izzuda 67,7% pacientu, pēc otrā 12,7%, pēc trešā - 7,8% (kopumā 88,2%). Nelielai pacientu daļai (trim pacientiem) klepus mazinājās pēc pirmā soļa terapijas, bet pilnībā izzuda, pievienojot trešā soļa medikamentus. Kopumā aprakstītā trīssoļu terapija nebija pietiekami efektīva tikai 18,8% pacientu. Terapija bija vienu līdz divpadsmit gadu ilga, lielākajai daļai pacientu (79,4%) klepus kontroli sasniedzot nepilnu četru nedēļu laikā. Au to ri se ci na, ka šāda empīriskās terapijas shēma ir lietderīga praktiskai lietošanai un efektīva vairākumam pacientu ar hronisku klepu.
Yu L. et al. Clinical benefit of sequential three-step empirical therapy in the management of chronic cough//Respirology 2008; 13 (3): 353-8.
Komentē Dr. med. M. Bukovskis
Par hroniska klepus sindromu uzskata gadījumus, kad pacientiem klepus turpinās ilgāk par astoņām nedēļām, bez acīm redzama, viegli identificējama iemesla. Klīniskajā praksē ļoti bieži ir jāsastopas ar šādiem pacientiem. Hroniska klepus sindroma galvenie cēloņi ir bronhiālā astma (paveids, kas bieži izpaužas tikai ar sausu klepu), eozinofilais bronhīts, augšējo elpceļu un deguna blakusdobumu iekaisums, gastroezofāgais atvilnis un/vai balsenes un rīkles pārmērīgs jutīgums pacientiem ar fizioloģisku atvilni (bieži pacientiem nav sūdzību par dedzināšanu vai sāpēm pakrūtē), angiotenzīnkonvertāzes inhibitoru lietošana. Turklāt vienmēr jāņem vērā kombinētas hroniska klepus patoģenēzes iespēja, jo lielākoties cēloņi ir vairāki - divi vai trīs - un attiecīgi nepieciešama arī atbilstīga ārstēšana.
Empīriska terapija varētu būt viens no veidiem, kā ārstēt pacientus ar hroniska klepus sindromu. Tomēr, manuprāt, racionālāk pacientam vispirms veikt dažus vienkāršus un neinvazīvus izmeklējumus (piemēram, FeNO noteikšanu izelpas gaisā, bronhoprovokācijas testu), lai izslēgtu vismaz kādu no klepus iespējamiem cēloņiem.
Izelpas analīze plaušu slimību diagnostikā
Izelpas gaisa sastāva analizēšana kā mazinvazīvs diagnostisks tests pulmonoloģijā piesaista arvien lielāku interesi. Tā pielietošanu apraksta plaušu vēža, astmas, HOPS un citu plaušu (arī citu sistēmu) slimību gadījumā. Izelpas analīze pamatā vērsta uz slāpekļa oksīda (NO) un pH līmeņa noteikšanu izelpojamā gaisā un biomarķieru noteikšanu izelpas kondensātā. Bez diferenciāldiagnozes šie dati ļauj atklāt arī smalkākas patoloģiskā procesa nianses.
Tā, piemēram, van Veen un līdzautoru veiktajā pētījumā NO kā elpceļu iekaisuma marķieris ļāva ticami prognozēt plaušu funkcijas samazināšanos pacientiem ar grūti kontrolējamu astmu. Pacientiem ar augstu NO saturu izelpas gaisā (>/= 20 ppb) FEV1 samazinājums bija par 40,3 ml/gadā lielāks, salīdzinot ar pacientiem, kam šis rādītājs bija 20 ppb vai mazāk.
Citā pētījumā (Sato et al.) aprakstīta frakcionētā NO noteikšana izelpā kā efektīvs tests ilgstoša klepus diferenciāldiagnozē, īpaši, lai diferencētu astmu no eozinofila bronhīta. Izmeklējot 71 pacientu ar sūdzībām par ilgstošu klepu, ar standarta testiem noteica diagnozes - bronhiālā astma, klepus varianta astma, eozinofils bronhīts vai cita respiratora slimība. Tālāk, nosakot NO saturu izelpas gaisā, novēroja drošu korelāciju starp IgE līmeņiem, FEV/FVC, eozinofiliju u. c. FeNO līmenis bija būtiski augstāks pacientiem ar astmu nekā pacientiem ar eozinofilu bronhītu, kā arī citām respiratorām slimībām. FeNO līmeņa optimālā atšķirība bija 38,8 ppb ar metodes jutību 79,2% un specifiskumu 91,3% attiecībā uz astmas diferenciāldiagnozi no citām slimībām, kas norit ar klepu.
HOPS gadījumā NO dati izmantojami mazāk, kamēr izelpas kondensāta iekaisuma marķieru analīze var sniegt būtisku informāciju. Respiration publicētā darbā demonstrēts, ka 8-izoprostāna daudzums izelpas kondensātā ticami parāda emfizēmas apjomu pacientiem ar HOPS, korelējot ar krūškurvja datortomogrāfijas datiem. Turklāt 8-izoprostāna līmenis pacientiem ar HOPS bija paaugstināts neatkarīgi no plaušu funkcijas: 18,1 pret 5,6 pg/ml kontrolgrupā. Šis, tāpat kā daudzi citi rādītāji, prasa padziļinātu izpēti, taču ar izelpas analīzi tiek saistītas lielas cerības HOPS patoģenēzes, diagnostikas un terapijas jomā.
Savukārt gaistošo organisko savienojumu noteikšana izelpā daudzos pētījumos tiek pielīdzināta datortomogrāfijas efektivitātei plaušu vēža agrīnā diagnostikā.
Šādi un līdzīgi pētījumi un publikācijas šodien atrodami lielā daudzumā (aut).
van Veen I. H. et al. Eur Respir J 2008; 32 (2): 344-49. Sato et al. Respir Med 2008; Jul 17. Makris D. et al. Respiration 2008; 75 (2): 138-44.
Komentē Dr. med. M. Bukovskis
Izelpas gaisa analīze, visticamāk, ir viens no nākotnes medicīnas attīstības virzieniem. Viens no virzieniem, kas jau ieņēmis savu vietu klīniskā praksē, ir FeNO noteikšana izelpas gaisā. Normāla FeNO koncentrācija izelpas gaisā svārstās no 5-20 ppb jeb NO molekulām uz miljardu izelpas gaisā esošu citu molekulu. Nosakot NO izelpas gaisā, iespējams diag no sticēt bronhiālo astmu un eozinofilo bronhītu (precīzāk - pret glikokortikoīdu terapiju jutīgu slimību). Šāda pieeja, kā jau minēts iepriekš, ir efektīva, atklājot un ārstējot pacientus ar subakūta vai hroniska klepus sindromu. Izmantojot NO kontroli izelpas gaisā, pacientiem ar eozinofilo astmas iekaisuma fenotipu iespējams paredzēt astmas uzliesmojumus, precīzi dozēt inhalējamos glikokortikoīdus un noteikt to minimālo efektīvo devu, kas ļauj mazināt potenciālās glikokortikoīdu izraisītās blaknes un ārstēšanas izdevumus.
Viens no perspektīvākajiem virzieniem ir plaušu vēža agrīna diagnostika, veicot izelpas gaisa analīzi. Interesanti, ka audzēja atklāšanai netraucē tā stadija un histoloģiskā tipa atšķirības, kas nodrošina agrīnas vēža diagnostikas iespējas un padara šo metodi potenciāli ļoti pievilcīgu (Machado R. F. et al. Am J Respir Crit Care Med 2005; 171:1286-91).