Pirms 20 gadiem 1990. gada 4. aprīlī Andrejs Ērglis un Andis Dombrovskis Paula Stradiņa Klīniskajā universitātes slimnīcā veica pirmo angioplastiju Latvijā pacientei ar stabilu stenokardiju un hemodinamiski nozīmīgu stenozi labajā koronārajā artērijā. Šobrīd, kad mūsu valstī veikts jau vairāk nekā 30 000 angioplastiju (skat. 1. attēlu), ne tikai kardiologiem, bet arī ģimenes ārstiem un citiem speciālistiem praksē arvien biežāk jāsastopas ar pacientiem pēc invazīvām ārstnieciskām procedūrām. Šā raksta mērķis ir iepazīstināt ne tikai ar zinātniskiem pierādījumiem, bet arī ar ikdienas praksē gūto pieredzi pacientu aprūpē pēc angioplastijām.
Perkutāna koronāra intervence
Pirmo perkutāno transluminālo koronāro angioplastiju (PTCA) pasaulē 1977. gadā veica vācu kardiologs Andreas Grüntzig Cīrihē, Šveicē. [1; 2] Gadu gaitā invazīvā ārstēšanas metode piedzīvojusi ievērojamu evolūciju, tāpēc mūsdienās to sauc par perkutānu koronāru intervenci (PCI). Dažādas tehnoloģijas (radioaktīvais starojums, rotablatori, griezošie baloni, stenti, ar zālēm pildīti stenti u.c.) ir ieviestas, lai uzlabotu tūlītējos un vēlīnos ārstēšanas rezultātus. Pateicoties šīm novitātēm, ir paplašinājies PCI klīnisko indikāciju loks, kā arī ārstēto koronāro bojājumu sarežģītības pakāpe.

Attēls
Invazīvās kardioloģijas pamatlicēji Latvijā – Andrejs Ērglis (no kreisās puses) un Andis Dombrovskis
Pēc pirmajām 1970. gados veiktajām angioplastijām 10 gadu dzīvildze bija laba (98,5%), tomēr gandrīz trešdaļai pacientu pusgadu pēc angioplastijas konstatēja restenozi jeb atkārtotu koronārās artērijas sašaurināšanos ārstētā bojājuma vietā. [3] Koronārie stenti ir būtiskākais PCI līdzeklis cīņā ar restenozi. Pirmo reizi stenta protēzes cilvēka koronārajās artērijās implantēja Jacqu es Puel Francijā un Ulrich Sigwart Šveicē 1986. gadā. [4; 5] Klīniskajā praksē tie ienāca tikai 1990. gadu vidū, kad BENESTENT I un STRESS pētījumos 6 mēnešus pēc stenta implantācijas novēroja par 10% mazāku restenozes biežumu nekā pēc balonangioplastijas. [6; 7] Latvijā pirmo stentu implantēja 1996. gadā, un šobrīd stentu implantāciju īpatsvars ir virs 90% no kopējā PCI skaita.
Vislielākais ieguvums no invazīvas ārstēšanas ir pacientiem ar miokarda infarktu ar ST elevāciju. 23 randomizētu pētījumu meta-analīze pierādīja, ka primāra PTCA ir labāka nekā trombolītiskā terapija, statistiski ticami mazinot gan mirstību, gan nefatālu reinfarktu un insultu biežumu jau 4-6 nedēļu laikā pēc notikuma. [8] Savukārt COURAGE pētījumā 2287 pacientiem ar stabilu stenokardiju PCI salīdzinājumā ar medikamentozo terapiju nemazināja nāves, miokarda infarkta vai insulta risku, tomēr samazināja nepieciešamību pēc turpmākām revaskularizācijām un būtiski uzlaboja dzīves kvalitāti. [9; 10]
Taču par spīti klīniskajai efektivitātei PCI ir arī savi būtiski trūkumi - restenoze un stenta tromboze (skat. 2. attēlu). [11]
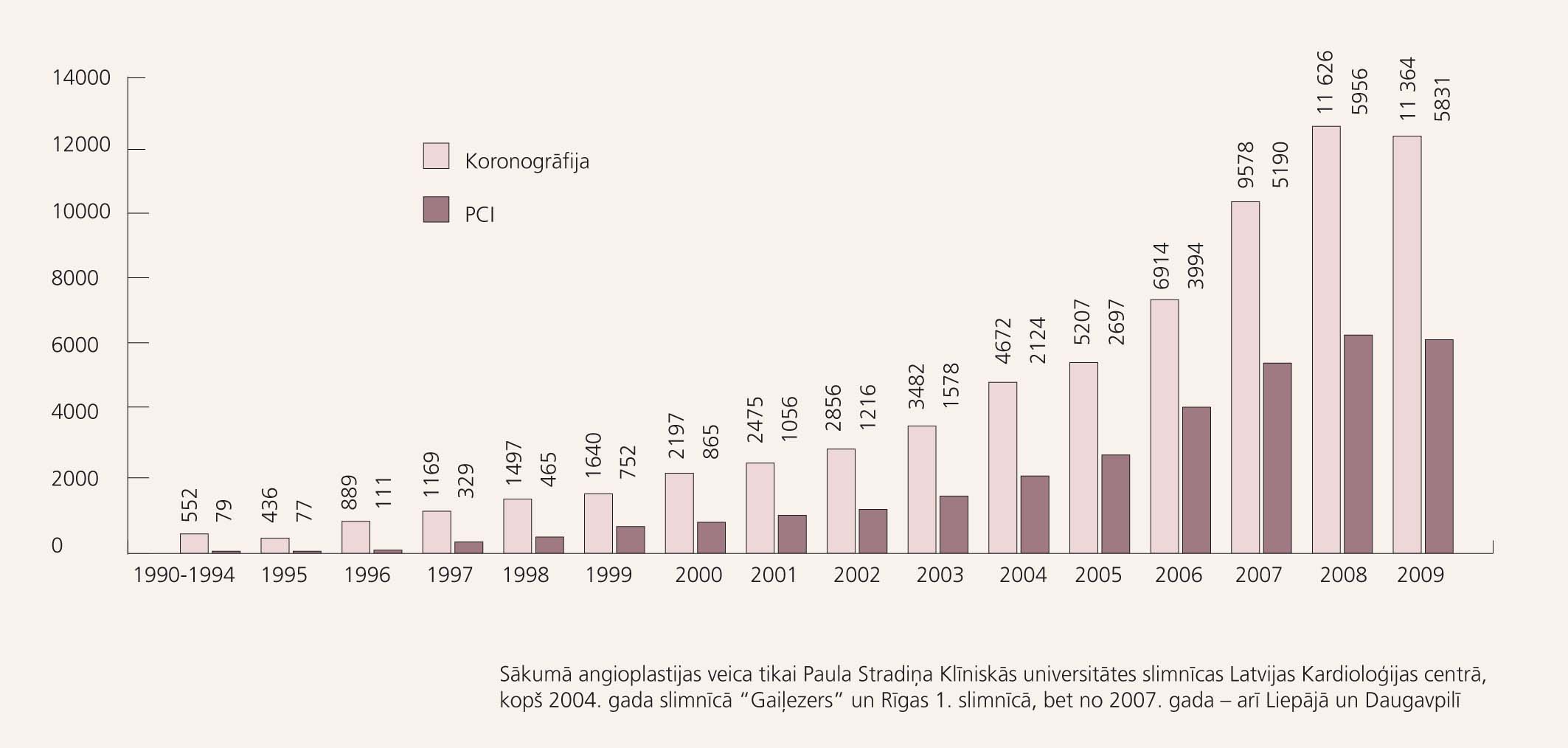

1. attēls
Koronāro angiogrāfiju un perkutānu koronāru intervenču (PCI) skaits Latvijā
Restenoze
Angioplastijas laikā ar balonu iestiepj koronārās artērijas sieniņu. Rezultātā rodas plīsumi aterosklerotiskajā plāksnē un artērijas sieniņas struktūrās (intīma, media, adventīcija). Tam uzreiz seko dzīšanas process. Ja atbilde ir pārspīlēta, veidojas restenoze. [12]
Stenta implantācija novērš vairākus restenozes patofizioloģiskos mehānismus, tomēr sekmē citus, piemēram, neointīmas ieaugšanu (skat. 3. attēlu). [13; 14] Pēc sekmīgas balonangioplastijas restenozes biežums ir 12-48%. [15] Pēc parasta metāla stenta implantācijas restenozi sastop 15-20% gadījumu, tomēr sarežģītākos bojājumos šis skaitlis svārstās no 30 līdz 50%. [16] Kopš praksē tiek izmantoti stenti, kas pildīti ar citostatiskām vielām (ar zālēm pildīti stenti, DES - angliski: drug eluting stents), restenozes biežums ir zem 10-15%, taču nav pilnībā novērsts, jo tiek ārstēti arvien sarežģītāki bojājumi. [17; 18]
Stenta tromboze
Jau pirmajos klīniskajos pētījumos novēroja augstu subakūtu stenta oklūziju biežumu, lai gan tika izvēlēts agresīvs antikoagulācijas režīms ar mazas molekulmasas dekstrāniem vai varfarīnu, kas ne tikai pagarināja hospitalizācijas laiku, bet paaugstināja arī asiņošanas risku. [19] Stenta tromboze joprojām saistīta ar augstu miokarda infarkta (60-70%) un mirstības (20-25%) risku. [20] Tās pamatā ir artērijas sieniņas (īpaši endotēlija) bojājums intervences laikā, trombogēno subintimālo slāņu atkailināšanās un trombocītu aktivācija (skat. 3. attēlu). Duālās antitrombotiskās terapijas ieviešana ir dramatiski mazinājusi stenta trombozes incidenci, kas mūsdienās ir apmēram 1% no PCI, tomēr augsta riska pacientiem sarežģītu bojājumu gadījumā tās novēro biežāk.
Stenta trombozes var attīstīties ne tikai akūtajā un subakūtajā periodā (attiecīgi līdz 24 stundām un 30 dienām), bet arī vēlīni un ļoti vēlīni (attiecīgi līdz 1 gadam un vēlāk). Īpaši aktuāli tas ir tad, ja lieto ar zālēm pildītu stentus. Citotoksiskās vielas (sirolimus, paklitaksels, everolimus, zotarolimus, biolimus u.c.) šo stentu sastāvā mazina neointīmas veidošanos, inhibējot gludo muskuļšūnu migrāciju un proliferāciju, kas ir būtiski restenozes mazināšanai. Taču šīs zāles kavē arī stenta endotelizāciju, endotēlija priekšteču šūnu proliferāciju un veicina audu faktora ekspresiju, kā rezultātā aktivējas koagulācijas sistēma (skat. 4. attēlu). [21] Lai gan pirms dažiem gadiem pastāvēja zināmas bažas par tādu stentu drošību, kas pildīti ar zālēm, jaunākie zinātniskie pierādījumi liecina, ka jauno stentu lietošana nav saistīta ar kopējā stentu trombožu biežuma pieaugumu. [22; 23]
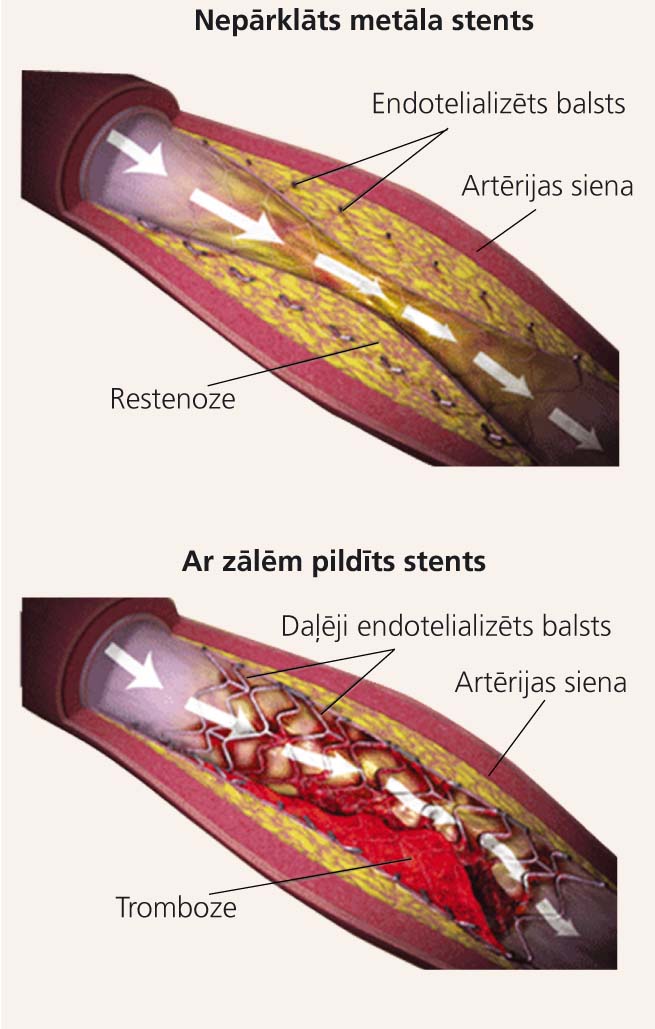

2. attēls
PCI “Ahilleja papēži” – restenoze un stenta tromboze
Pacientu aprūpe pēc PCI
Pacients pēc PCI vispirms jāuzlūko kā slimnieks ar koronāro sirds slimību. Tāpēc aprūpē jāievēro nemedikamentozās un medikamentozās terapijas principi, kas iegūti klīniskos pētījumos un apkopoti vadlīnijās. Latvijas Kardiologu biedrība ir izstrādājusi akūtu koronāru sindromu, stabilas stenokardijas un kardiovaskulāro slimību profilakses vadlīnijas. Šiem pasākumiem jāsamazina turpmākā saslimstība un mirstība no aterosklerotiskā procesa radītām komplikācijām, kā arī jāuzlabo dzīves kvalitāte. Būtiska ir šo pacientu regulāra apsekošana. Latvijas Kardioloģijas centrā pacienti ierodas uz apsekošanas vizītēm un kontroles veloergometrijām 3, 6 un 12 mēnešus pēc PCI. Tomēr, protams, ir arī īpatnības pacientu aprūpē pēc PCI. Īpaši jāuzsver duālās antitrombotiskās terapijas, kā arī aterosklerozes progresiju ierobežojošu medikamentu nozīme.
Duālā antitrombotiskā terapija
Ar duālās antitrombotiskās terapijas jēdzienu šobrīd mēs saprotam aspirīna un tienopiridīnu (tiklopidīns, klopidogrels, prasugrels) kombināciju. Nākotnē tienopiridīnu vietu varētu ieņemt tiešie P2Y12 receptoru antagonisti (kangrelors, tikagrelors, elinogrels). Duālās antitrombotiskās terapijas mērķis ir kavēt kardiovaskulāru notikumu (īpaši stenta trombozes) attīstības risku pirms un pēc PCI, t.sk. ilgtermiņā.
Aspirīns trombocītos bloķē tromboksāna A2 sintāzi (ciklooksigenāzi), kavējot trombocītu agregāciju. Tienopiridīni ir antagonisti ADP (adenozīna 5'-difosfāta) P2Y12 receptoriem, kas nodrošina trombocītu agregāciju (skat. 5. attēlu). [24] Atšķirībā no tienopiridīniem jaunos tiešos P2Y12 receptoru antagonistus nav jāmetabolizē CYP450 enzīmiem, līdz ar to trombocītu inhibīcija iestājas daudz ātrāk un spēcīgāk. [25]
1990. gadu beigās veiktos pētījumos tienopiridīni kombinācijā ar as pi rī nu bija pārāki par aspirīna monoterapiju vai aspirīnu kombinācijā ar orāliem an ti koa gu lan tiem, samazinot nozīmīgu kardiovaskulāru notikumu, t.sk. akūtu un subakūtu, stenta trombožu biežumu pēc parasta metāla stenta implantācijas. [26] Salīdzinot pirmās un otrās paaudzes tienopiridīnus (CLASSICS pētījums), tiklopidīna un klopidogrela klīniskā efektivitāte bija līdzīga, tomēr pēdējam bija labāka panesamība, īpaši - retākas neitropēnijas. [30] Šā iemesla dēļ klopidogrels šobrīd ir visplašāk lietotais tienopiridīns.
Klopidogrels
Vislielākie pierādījumi klopidogrela lietošanai pēc PCI ir iegūti PCI-CURE un CREDO pētījumos.
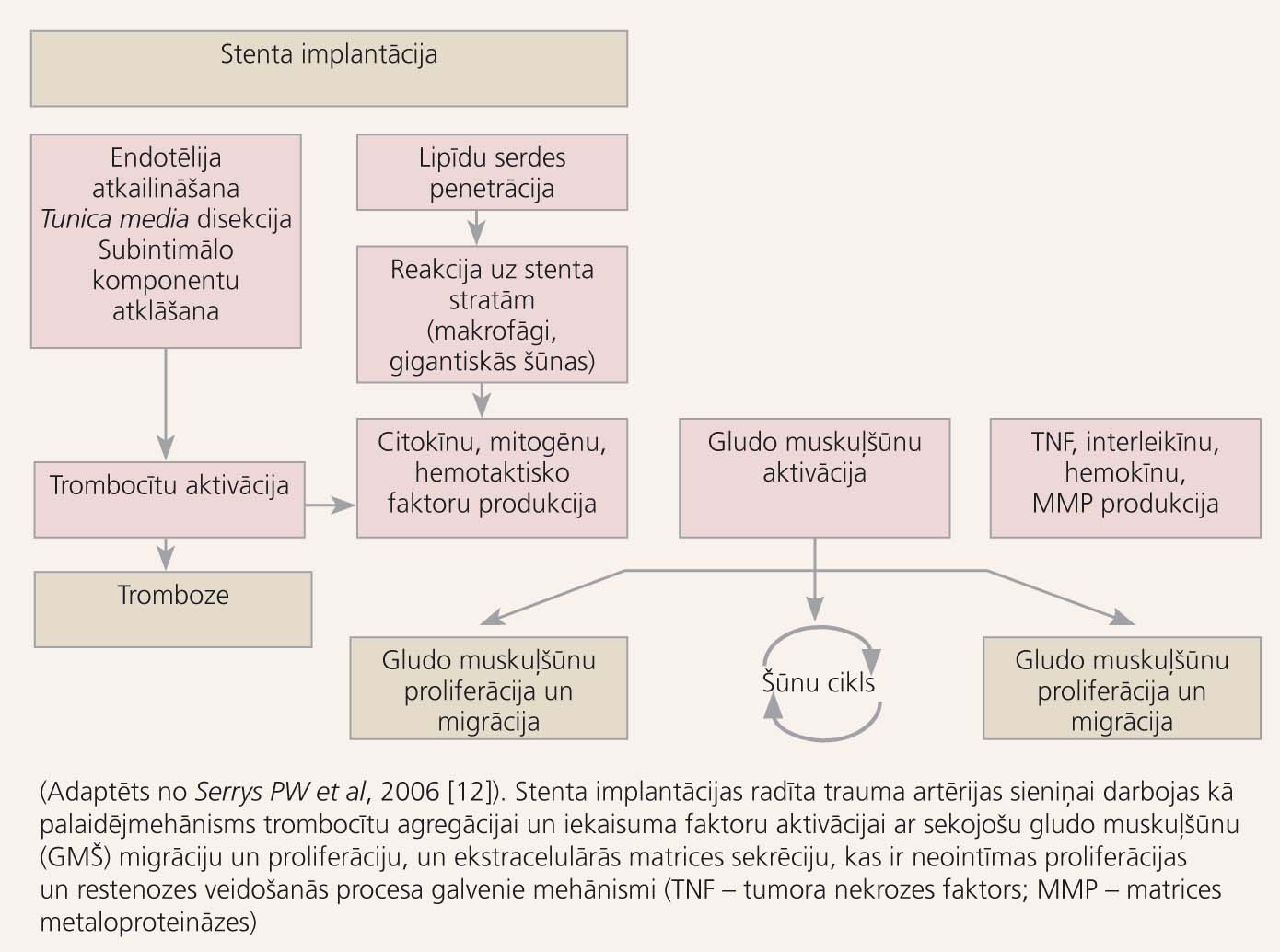

3. attēls
Stenta trombozes un restenozes mehānismi pēc stenta implantācijas
- PCI-CURE pētījumā pacientiem (n=2658) ar akūtu koronāru sindromu nozīmēja 75mg klopidogrela vai placebo kombinācijā ar aspirīnu pirms un pēc PCI (vidēji 8mēnešus). Pirmās 4nedēļas pēc intervences atklāto klopidogrelu saņēma arī placebo plus aspirīna grupa. Klopidogrela lietošana 30dienu pirms PCI kardiovaskulārās nāves, miokarda infarkta un neatliekamas mērķa asinsvada revaskularizācijas relatīvo risku mazināja par 30% (p=0,03). Savukārt ilgtermiņa klopidogrela lietošana 12mēnešus kardiovaskulārās nāves vai miokarda infarkta relatīvo risku mazināja par 31% (p=0,002).[31]
- CREDO pētījumā iekļāva pacientus (n=2116) ar simptomātisku koronāru sirds slimību un pierādītu išēmiju. Viena pacientu grupa saņēma klopidogrelu 300mg 3-24stundas pirms PCI un 75mg dienā 12mēnešus pēc intervences, bet otra grupa pirmās 28dienas pēc PCI saņēma klopidogrelu, toties pirms intervences un ilgtermiņā saņēma placebo. Klopidogrela pirmsterapijai bija tendence mazināt 28dienu kardiovaskulāros notikumus tikai pacientiem, kas piesātinošo devu saņēma vismaz 6stundas pirms PCI (p=0,051). Klopidogrela ilgstoša lietošana bija saistīta ar 12mēnešu nāves, miokarda infarkta vai insulta relatīvā riska redukciju par 26,9% (95% CI 3,9%-44,4%, p=0,02).[32]
Galvenie trūkumi klopidogrela lietošanā ir nedaudz paaugstinātais asiņošanas komplikāciju risks, kā arī pēdējos gados daļai pacientu novērotā samazinātā trombocītu reaktivitāte uz klopidogrelu, kas saistīta ar paaugstinātu stenta trombožu un citu notikumu attīstības risku. [33] Tāpēc šobrīd noris intensīva pētniecība jaunu antitrombotisko aģentu meklējumos.
Prasugrels
Tas ir trešās paaudzes tienopiridīns, kas drīzumā būs pieejams arī Latvijā. Triton-TIMI 38 pētījumā [34] 13 608 pacienti ar mērena un augsta riska akūtu koronāru sindromu, kam plānota PCI, 6 līdz 15 mē nešus saņēma prasugrelu (60 mg piesātinošā deva un 10 mg uzturošā deva) vai klopidogrelu (300 mg piesātinošā deva un 75 mg uzturošā deva). Kardiovaskulārās nāves, nefatāla miokarda infarkta vai nefatāla insulta biežums bija 9,9% prasugrela un 12,1% klopidogrela grupā (p
Tikagrelors
Tas ir viens no perspektīvākajiem jaunajiem antitrombotiskajiem līdzekļiem, kas tieši un atgriezeniski inhibē ADP P2Y12 receptorus. PLATO pētījumā [25] tikagrelors (180 mg piesātinošā deva, uzturošā deva 90 mg 2 reizes dienā) salīdzinājumā ar klopidogrelu (300-600 mg bolus un turpmāk 75 mg dienā) 18 624 pacientiem ar akūtu koronāru sindromu statistiski ticami mazināja 12 mēnešu kardiovaskulārās nāves, miokarda infarkta vai insulta risku (p
Duālās antitrombotiskās terapijas lietošanas ilgums
Šis parametrs dažādās rekomendācijās nav viennozīmīgi definēts. Sākotnēji pēc stentu implantācijām šo terapiju lietoja 1 mēnesi, lai gan jau senākos klīniskos pētījumos ar parastiem metāla stentiem augstāka efektivitāte bija ilgtermiņa terapijai. Ar zā lēm pildītos stentos ir kavēts endotelizācijas process, tāpēc duālai antitrombotiskai terapija ir jābūt ilgstošākai, jo viens no vēlīnas (līdz 1 gadam pēc PCI) stenta trombozes riska faktoriem ir priekšlaicīga antitrombotiskās terapijas pārtraukšana (p
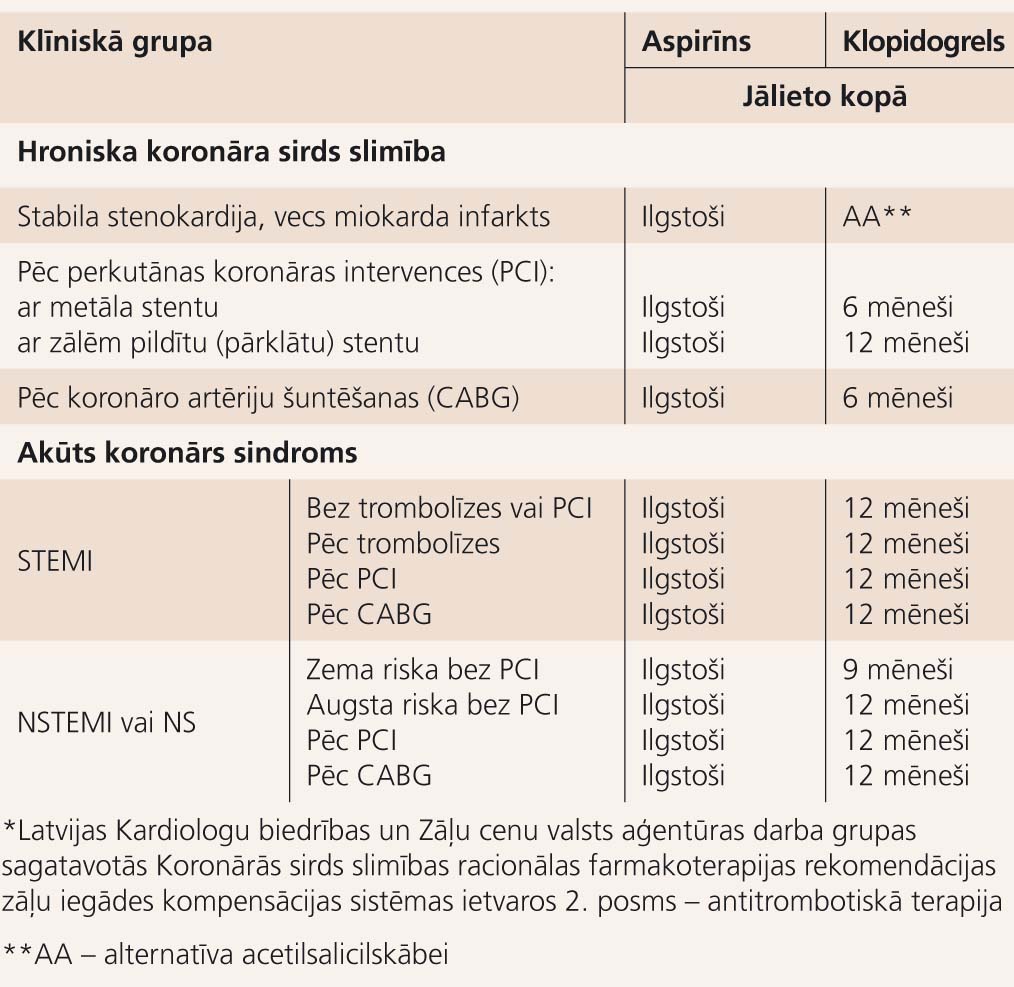
Pēc Latvijas Kardiologu biedrības rekomendācijām klopidogrels uzturošā devā 75 mg dienā pēc parasta metāla stenta implantācijas jālieto vismaz 6 mēnešus, bet pēc ar zālēm pildīta stenta implantācijas - 12 mēnešus, savukārt pacientiem ar akūtu koronāru sindromu 9-12 mēnešus (skat. tabulu). Taču, ņemot vērā klopidogrela izmaksas, stenta trombozes profilakses nolūkā klopidogrels obligāti būtu jālieto vismaz divus mēnešus pēc parasta stenta un vismaz 6 mēnešus pēc ar zālēm pildīta stenta implantācijas, ja vien invazīvais kardiologs nav ieteicis citus terapijas noteikumus. Augsta riska pacientiem (akūts koronārs sindroms, cukura diabēts, sarežģīti bojājumi, garu stentu implantācija utt.) nereti klopidogrels jālieto 12-24 mēnešus un ilgāk, kā arī pirmā mēneša laikā deva jādubulto (150 mg).
Pārējā kardiovaskulārā terapija
Līdzīgi visiem koronārās sirds slimības slimniekiem, arī pēc PCI indicēta medikamentoza terapija, kas mazina kardiovaskulāru notikumu un nāves risku un koriģē riska faktorus.
Līdz šim veiktajos farmakoloģiskajos pētījumos nav pierādīta antitrombotisku vielu, kalcija kanālu blokatoru, steroīdu, ACE in hi bi to ru, statīnu spēja mazināt restenozes risku. [38] Turpretī daži preparāti kavē aterosklerozes progresiju vai pat veicina tās regresiju.
Statīni
Plaši pierādīta ir statīnu spēja mazināt holesterīna līmeni serumā, kā arī kardiovaskulāro notikumu un nāves risku pacientiem ar koronāru sirds slimību, līdzīgs efekts ir novērots arī atsevišķos pētījumos, lietojot statīnus pēc PCI. [39; 40]
Intravaskulārās ultraskaņas pētījumos pierādīts, ka statīni aizkavē arī aterosklerozes progresiju. REVERSAL [41] pētījumā, 18 mēnešus lietojot atorvastatīnu 80 mg, ar intravaskulāro ultraskaņu mērītais procentuālais ateromas tilpums nemainījās (p=0,98), kamēr pravatstatīna (40 mg) grupā tas pieauga (p=0,001). ASTEROID pētījumā [42] 40 mg rosuvastatīna lietošana bija saistīta ar nelielu, bet statistiski ticamu aterosklerozes regresiju.
Kalcija kanālu blokatori
Šīs grupas medikamenti ir maz pētīti PCI populācijā. CAPARES pētījums pierādīja, ka amlodipīna terapija 2 nedēļas pirms PCI un 4 mēnešus pēc tās mazina kardiovaskulāro notikumu risku, bet neietekmē restenozi. [43] CAMELOT apakšpētījumā Normalise [44] 274 pacienti 24 mēnešus saņēma 10 mg amlodipīna, 20 mg enalaprila vai placebo.

Tabula
Antiagregantu duālā farmakoterapija*
Pēc intravaskulārās ultraskaņas parametriem ateroskleroze bija progresējusi placebo (p
ACE inhibitori un beta blokatori
Arī šo grupu medikamentu spēja ietekmēt klīniskos notikumus pacientiem pēc PCI nav daudz pētīta. Lai gan dažos nelielos pētījumos, kā arī lielu pētījumu apakšgrupu analīzēs ramiprils un perindoprils ir mazinājis koronāru notikumu biežumu pēc PCI [45; 46], šo preparātu lietošanas indikācijām būtu jābalstās koronārās sirds slimības formā, komplikācijās un riska faktoros.
Noslēgumā jāatzīmē, ka sekmīgas perkutānas koronāras intervences pamatā ir ne tikai pašas procedūras kvalitatīvs izpildījums sirds kateterizācijas laboratorijā, bet arī medikamentozo un nemedikamentozo pasākumu komplekss mūža garumā. Šī metode būtiski uzlabo pacientu ar koronāru sirds slimību dzīves prognozi un kvalitāti, taču šis efekts nav panākams bez modernas farmakoterapijas.
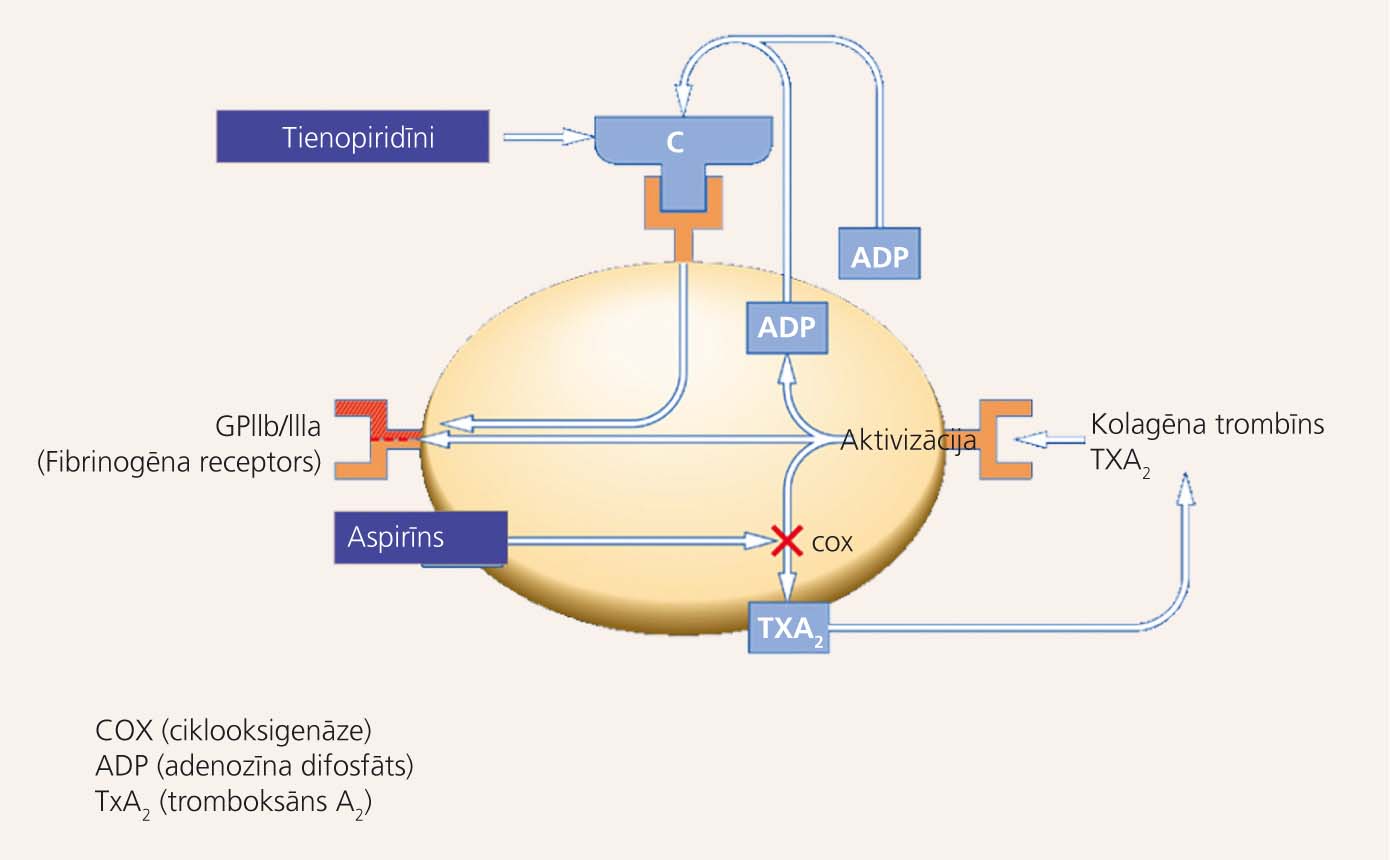

5. attēls
Aspirīna un tienopiridīnu darbības mehānisms