Sirds ritma traucējumi ir visai bieža parādība. Turklāt par tiem konsultē gan ģimenes ārsti un kardiologi, gan citu specialitāšu ārsti. Pēdējos gados aritmoloģija strauji attīstījusies un praksē ienākušās iedarbīgas aritmiju ārstēšanas metodes, piemēram, ablācijas procedūra ar katetru un sarežģītas implantējamas sistēmas.
Raksta mērķis ir atgādināt par aritmiju veidošanās pamatiem, proti, par sirds vadīšanas sistēmas īpašībām, tahiaritmiju mehānismiem, kā arī par dažādu ārstēšanas metožu būtību.
Sirds vadīšanas sistēmas anatomija
Sirds vadīšanas sistēma ir specializētu kardiomiocītu tīkls, kas nodrošina normālu impulsa parādīšanos un izplatīšanos miokardā, tādējādi nosakot adekvātu sirdsdarbības frekvenci, kā arī pareizu šā impulsa izplatīšanās secību. Vadīšanas sistēmā ietilpst sinoaurikulārais jeb sinusa mezgls, atrioventrikulārais savienojums un Hisa-Purkinjē šķiedras.
Jāpiebilst, ka elektrisku impulsu pārvada ne tikai specializētas vadīšanas sistēmas šūnas, bet arī pārējie darba kardiomiocīti priekškambaru un kambaru miokardā.
Sinusa mezgls
Sinusa mezgls atrodas labajā priekškambarī pie augšējās dobās vēnas (v. cava superior) ieplūšanas vietas. Sinusa mezgls ir lokalizēts epikardiāli, t.i., nevis dobumā, bet it kā no ārpuses.
Sinusa mezglā veidotais impulss izplatās pa visām priekškambaru miokarda šķiedrām. Priekškambaros nav specializētas vadīšanas sistēmas. Impulss no labā priekškambara uz kreiso arī izplatās pa darba kardiomiocītiem.
Standarta elektrokardiogrammā (EKG) impulsa pārvadei pa priekškambariem atbilst P vilnis, paša sinusa mezgla darbību tiešā veidā EKG redzēt nevar.
Atrioventrikulārais savienojums
Labajā priekškambarī atrodas arī nākamais vadīšanas sistēmas elements - atrioventrikulārais savienojums. Šīs struktūras galvenā funkcija ir nodrošināt impulsa pārvadi no priekškambariem uz kambariem. Normā tā ir vienīgā pārvades vieta, jo citur starp priekškambaru un kambaru miokarda šķiedrām ir atrioventrikulāro vārstuļu (trikuspidālā un mitrālā) fibrotiskie gredzeni, caur kuriem elektriskais impulss nevar iziet cauri. Atrioventrikulārais savienojums lokalizēts trikuspidālā vārstuļa augšēji septālajā daļā. Atrioventrikulārajā savienojumā impulss izplatās salīdzinoši lēni, t.i., notiek impulsa aizture. Tā nepieciešama, lai priekškambaru sistole būtu pilnvērtīgāka un iespējami lielāks asins daudzums caur atvērtām atrioventrikulārajām atverēm tiktu pārvirzīts uz kambariem.
Standarta EKG impulsa pārvades aizture atspoguļojas kā PR (PQ) intervāls.
Izejot cauri atrioventrikulārajam savienojumam, kambaros impulss izplatās pa specializētu Hisa-Purkinjē šķiedru tīklu. Kambaru masa ir lielāka nekā priekškambariem, tāpēc nepieciešama speciāla impulsa pārvades sistēma. Tās galvenais uzdevums ir nodrošināt ātru un vienlaicīgu impulsa izplatīšanos caur kambaru miokarda šķiedrām. Hisa-Purkinjē sistēmā izdala labo un kreiso kājiņu. Labā kājiņa impulsu pārved pārsvarā uz labo kambari, kreisā - uz kreiso. Kreisā kājiņa gandrīz uzreiz sadalās pa kreiso priekšējo un kreiso mugurējo zaru. Kreisais priekšējais zars iet gar kambaru starpsienu un uz priekšu. Līdzīgi kā labā kājiņa tas ir tievs un ar nelielu zaru daudzumu. Savukārt kreisais mugurējais zars kā vēdeklis izplatās kreisā kambara mugurējā daļā. Tas izskaidro to, kāpēc labās kājiņas un kreisā priekšējā zara blokādes ir relatīvi biežas pat pacientiem bez sirds slimībām.
Impulss no Hisa-Purkinjē sistēmas šķiedrām tiek pārvadīts uz darba miocītiem, kas nodrošina tālāku pārvadi savā starpā.
Kambaru miokarda masa ir liela, tāpēc elektriskie notikumi tajā ir sarežģītāki - depolarizāciju atspoguļo QRS komplekss, bet repolarizāciju - ST-T (U) intervāls.
Normālos apstākļos impulsa izplatīšanās secība ir tāda, kā aprakstīts iepriekš, proti, kad P vilnim seko QRS komplekss. Dažos gadījumos secība ir citāda, piemēram, pēc kambaru ekstrtasistoles QRS kompleksa var redzēt retrogrādi pārvadītu P vilni.
Tātad sirds vadīšanas sistēma nodrošina fizioloģisko impulsu veidošanos un izplatīšanos un tā ir būtiska normālā sirds un arī visa organisma darbībā.
Jēdziens par darbības potenciālu
Visām šūnām uz membrānas iekšējās un ārējās virsmas ir lādiņš. Starpība starp lādiņiem abās membrānas virsmās jeb transmembrānas potenciāls rodas tāpēc, ka šūnu iekšpusē tiek akumulēti negatīvi lādēti joni. Kardiomiocīti ir uzbudināmas šūnas un pēc attiecīgas stimulācijas tās atver vai aizver jonu kanālus, mainot transmembrānas potenciālu. Atspoguļojot potenciāla izmaiņas laikā, veidojas darbības potenciāla līkne (skat. 1. attēlu).
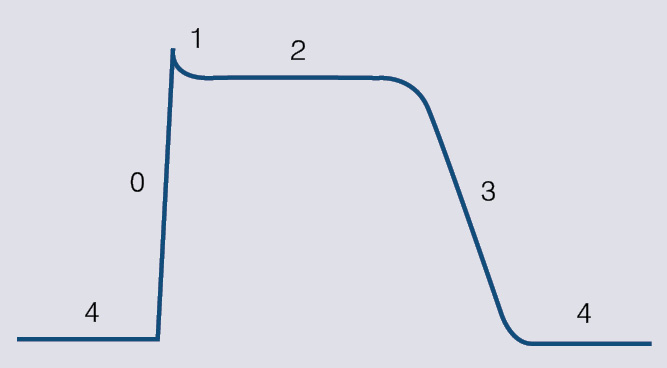

1. attēls
Darba kardiomiocītu darbības potenciāla līkne. Ar cipariem atzīmētas dažādas darbības potenciāla fāzes
Darbības potenciāla līknē izdala divas daļas: depolarizāciju un repolarizāciju. Starp viena darbības potenciāla repolarizāciju un nākamā darbības potenciāla depolarizāciju kardiomiocītos iestājas miera potenciāls jeb atpūtas fāze.
Depolarizācija
Depolarizācija jeb 0. fāze. Šīs fāzes laikā potenciāls strauji mainās no miera potenciāla līdz maksimumam. Depolarizācijas pamatā ir ātro nātrija jonu kanālu atvēršana, tāpēc daudz pozitīvi uzlādētu nātrija jonu ātri ieplūst šūnā un DP līknē parādās depolarizācijas pīķis.
Vienas šūnas depolarizācija izsauc līdzīgu reakciju blakus šūnās un sākas depolarizācijas vilnis visā sirdī.
Depolarizācijas ātrums (darbības potenciāla 0. fāzes leņķis) nosaka to, cik ātri depolarizēsies nākamā šūna, līdz ar to arī impulsa izplatīšanās ātrumu visā sirdī.
Repolarizācija
Repolarizācija ir potenciāla atgriešanās izejas stāvoklī. Tā atbilst darbības potenciāla līknes 1.-3. fāzei. Repolarizācijas laikā kardiomiocīts nevar atkal depolarizēties, tātad no 0. līdz 3. fāzei kardiomiocīts ir neuzbudināms, proti, iestājas refrektārais periods.
Repolarizācija ir sarežģīts process, kurā piedalās vairāku jonu kanāli, bet galvenais tās uzdevums ir nodrošināt darbības potenciāla atgriešanos miera stāvoklī. Attēlā var redzēt, ka repolarizācija ir ievērojami garāka par depolarizāciju. Būtiskākais iemesls ir darbības potenciāla līknes 2. jeb "plato" fāze, kas ir tikai kardiomiocītiem, un tieši tā nosaka darbības potenciāla ilgumu. "Plato" fāzes ilgumu galvenokārt nosaka kalcija jonu kanāli. Repolarizācijas lejupslīdi (3. fāze) lielākoties nosaka kālija un vēlīnie nātrija jonu kanāli.
Darbības potenciāla līknes dažādām šūnām atšķiras. Darba kardiomiocītiem un Purkinjē sistēmas šūnām tā ir līdzīga 1. attēlā parādītajai, bet sinusa mezgla un atrioventrikulārā savienojuma kardiomiocītu līknes ievērojami atšķiras (skat. 2. attēlu).
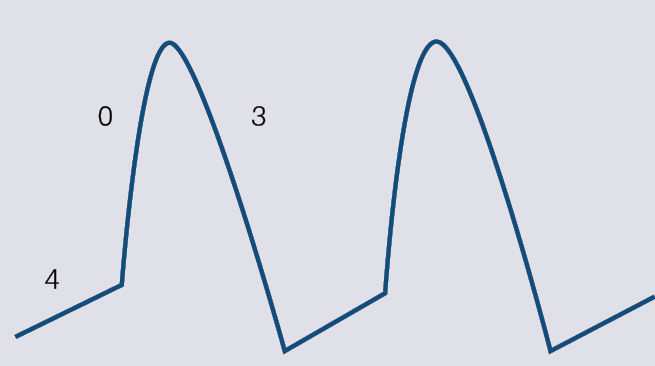

2. attēls
Ritma avotu darbības potenciāls. Ievērojiet faktiskās 1. un 2. fāzes neesību, kā arī 4. fāzes līknes īpatnības, t.i., nav miera potenciāla
Atpūtas fāze
Lielākajai kardiomiocītu daļai atpūtas (4.) fāzē jonu plūsma ir niecīga un darbības potenciāls ir bez būtiskām izmaiņām. Bet ne visiem. Dažām šūnām jonu plūsma parādās uzreiz pēc repolarizācijas beigām, līdz ar to miera potenciāls pakāpeniski pieaug. Sasniedzot noteiktu līmeni (slieksni), sākas depolarizācija, kas var sākt visas sirds depolarizāciju. Šīs šūnas dēvē par ritma avotiem. 4. fāzes aktivitāti ar spēju sasniegt depolarizācijas slieksni sauc par automātismu.
Automātisms ir mehānisms, kā normāli sirdī veidojas ritms. Sinusa mezgla kardiomiocītiem 4. fāzes ātrums ir vislielākais, tāpēc tā darbība ir visātrākā. Sinusa mezgla darbības frekvence parasti ir ap 50-80 reizēm minūtē, normālos apstākļos tas ir primārais ritma avots. Gadījumos, kad sinusa mezgla darbības ātrums ir samazināts, par ritma avotu kļūst atrioventrikulārais savienojums (sekundārais ritma avots), tā darbības frekvence ir ap 40-50 reizēm minūtē.
Ritma avotu noteicējšūnām depolarizāciju nosaka kalcija jonu plūsma, bet repolarizāciju - kālija jonu plūsma, un 2. attēlā var redzēt, ka šiem kardiomiocītiem ir lēns depolarizācijas ātrums (0. fāze), līdz ar to arī impulsa pārvade ir lēnāka. Tieši tāpēc atrioventrikulārā savienojumā notiek impulsa pārvades aizture.
Būtiska kardiomiocītu darbībā ir autonomās nervu sistēmas darbība. Spēcīgāks simpatiskais tonuss palielina automātismu (ritma noteicēji darbojas aktīvāk, ātrāk), palielina impulsa pārvades ātrumu un saīsina darbības potenciāla ilgumu, līdz ar to saīsina refrektāro periodu. Parasimpatiskais tonuss darbojas pretēji - nomāc automātismu, palēnina impulsa pārvades ātrumu un pagarina refrektāros periodus.
Gan simpatiskās, gan parasimpatiskās nervu šķiedras bagātīgi inervē sinusa mezglu un atrioventrikulāro savienojumu. Pārējās sirds vadīšanas sistēmas daļās simpatiskā inervācija ir diezgan plaša, bet parasimpatiskā relatīvi nabadzīga. Tāpēc izmaiņas parasimpatiskajā tonusā vairāk iedarbojas uz sinusa mezgla un atrioventrikulārā savienojuma audiem nekā citur.
Aritmiju mehānismi
No frekvences izriet aritmiju sadalījums bradi-aritmijās un tahiaritmijās (par tām šajā rakstā). Biežākie tahiaritmiju mehānismi: ektopisks perēklis un re-entry. Pirmajā gadījumā aritmijas avots lokalizēts nelielā miokarda daļā. Faktiski runa ir par atsevišķu šūnu sakopojumu.
Re-entry gadījumā aritmijas pamatā ir impulsa virzīšanās apkārt kādai anatomiskai vai funkcionālai struktūrai. Šajā gadījumā nav noteikta aritmijas avota, bet gan šķiedru kopums, kas piedalās cilpas veidošanā (skat. 3. attēlu).
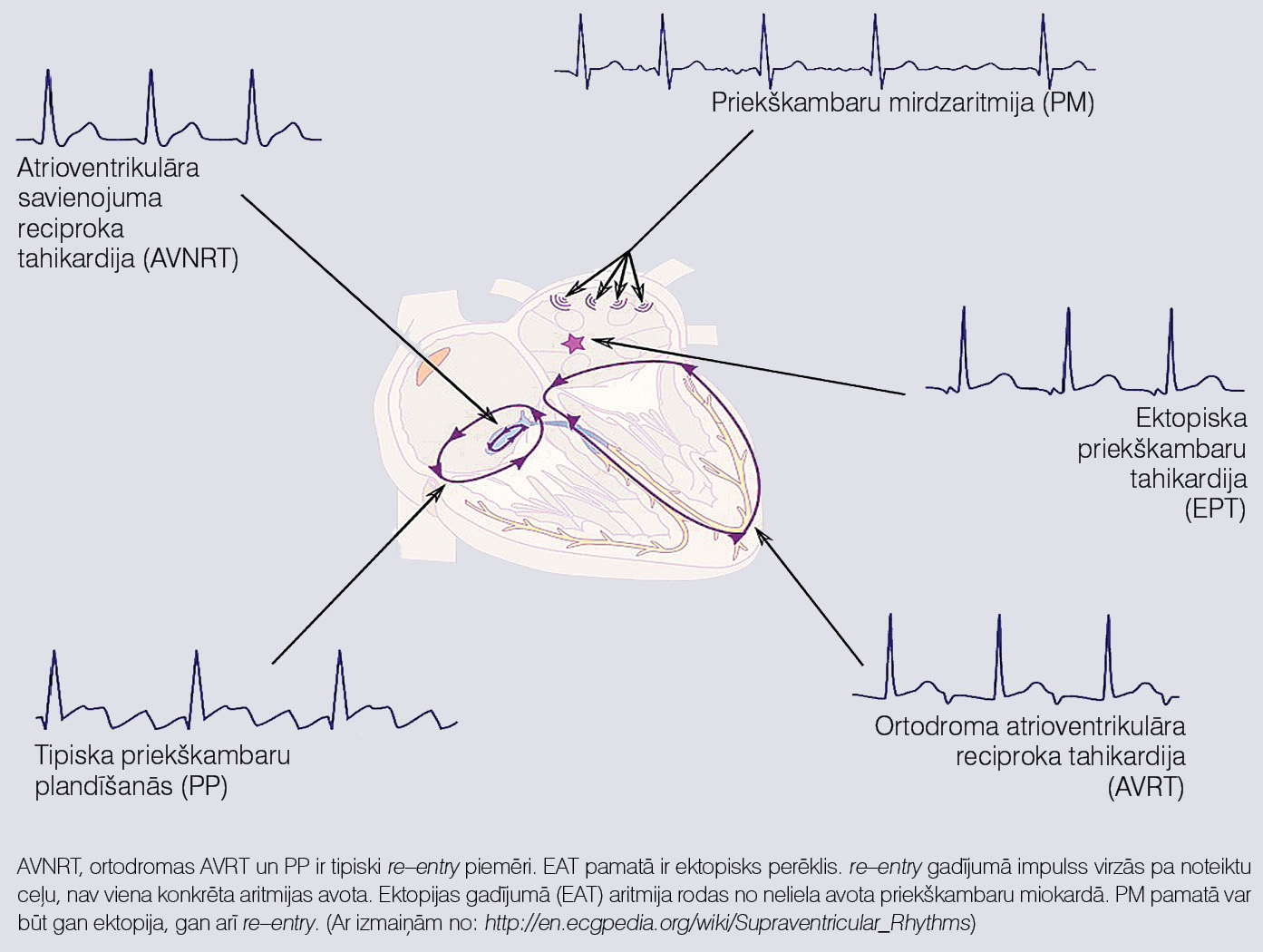

3. attēls
Ektopiska un re–entry mehānismu salīdzinājums uz šauru QRS kompleksu tahikardiju piemēra
Ektopija
Ektopiskie perēkļi var būt divu veidu: paātrināts automātisms vai palaista (triggered) aktivitāte.
Automātisms ir normāla ritma devēja funkcija. Gadījumā, kad darbības potenciāla līknes 4. fāze saīsinās un šīs aktivitātes ātrums apsteidz sinusa mezgla frekvenci, parādās automātisks perēklis. Biežākā šā mehānisma izpausme ir sinusa tahikardija pastiprināta simpatiskā tonusa gadījumā.
Aritmijām pēc paātrināta automātisma mehānisma raksturīga "iesilšana" un "atdzišana", t.i., aritmijas frekvence pieaug un samazinās pakāpeniski. Biežākie iemesli ir miokarda išēmija, elektrolītu līdzsvara traucējumi (piemēram, hipokaliēmija), spēcīgs simpatiskais tonuss, kā arī simpatomimētisku līdzekļu lietošana. Aritmijas pēc šā mehānisma diezgan bieži parādās intensīvās terapijas palātu un reanimācijas pacientiem. Kopumā šis ir retākais no mehānismiem.
Palaista (triggered) aktivitāte: mehānismu pamatā ir papildu depolarizācija (pēcdepolarizācija, no angļu after-depolarisation). Pēcdepolarizācija parādās darbības potenciāla līknes repolarizācijas beigās - 3. fāzes beigās vai 4. fāzes sākumā. Ja pēcdepolarizācija sasniedz depolarizācijas slieksni, sākas nākamais darbības potenciāls un sirds impulss. Atšķirībā no automātisma pēcdepolarizācija parasti nav spontāna, bet saistīta ar ekstrasistolēm vai ar ritma palēnināšanu, vai pauzēm.
Būtiskāka atšķirība starp automātismu un palaistu aktivitāti ir pēcdepolarizāciju atkarība no kalcija jonu kanāliem, tās var reaģēt uz ārstēšanu ar kalcija kanālu blokatoriem.
Re-entry
Re-entry ir visbiežākais un visbūtiskākais tahi-aritmiju mehānisms. Mēģināsim saprast, kas notiek (skat. 4. attēlu). Pirmkārt, lai izveidotos re-entry cilpa, nepieciešami divi impulsa pārvades ceļi, kas savā starpā savienoti, izveidojot elektrisku loku. Pa vidu abiem ceļiem jābūt elektriski neitrālai struktūrai. Otrkārt, ceļiem jābūt ar noteiktām īpašībām: vienam jābūt ar garu refrektāro periodu un ātrāku impulsa pārvades ātrumu, otram ar īsu refrektāro periodu un lēnāku impulsa pārvades ātrumu. Tā kā vienam no ceļiem jābūt ar garu refrektaritāti un ātrāku impulsa pārvadi, sauksim to par "ceļš GĀ" (ar Garu refrektaritāti un ir Ātrs), bet otro ceļu ar īso refrektāro periodu un lēnāko impulsa pārvadi, par "ceļu ĪL" (ar Īsu refrektaritāti un ir Lēnāks). (Sic! Refrektaritāte ir periods, kad miokards nespēj depolarizēties.)
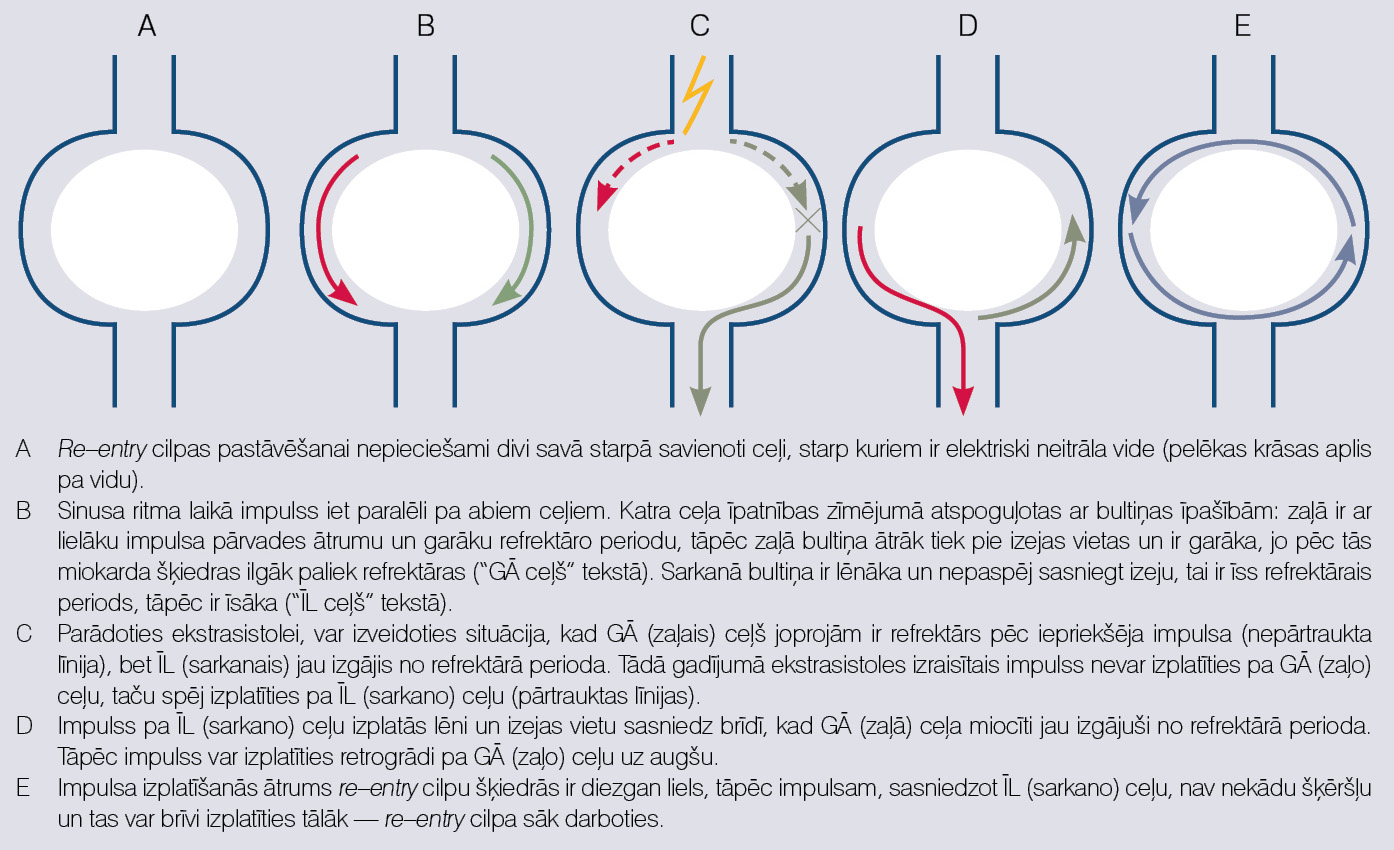

4. attēls
Re–entry mehānisms
Sinusa ritma laikā abi ceļi izvada impulsu antegrādi un aritmija nesākas. Pastāvot abiem šiem ceļiem, ekstrasistole var inducēt virzīšanu pa šo loku (C daļa 4. attēlā). Ekstrasistolei jātrāpa tādā laikā, kad ceļš GĀ joprojām ir refrektārs no iepriekšējās depolarizācijas, bet ceļš ĪL jau izgājis no refrektārā perioda. Kamēr ceļš ĪL lēni izvada ekstrasistoles impulsu, ceļam GĀ ir iespēja iziet no refrektārā perioda un būt gatavam pārvadīt impulsu uz augšu. Retrogrādi pārvadītam impulsam atgriežoties pie ceļa ĪL, tas var atkal izplatīties uz leju antegrādi (tas ir pat ļoti ticams, jo ĪL ceļam ir īss refrektārais periods), un sākas impulsu izplatīšanās pa nodibinātu re-entry loku. Pārējās miokarda daļas noteiktās vietās ir savienotas ar šo loku un tiek depolarizētas ar re-entry loka noteiktu frekvenci.
Re-entry loku inducē ekstrasistole, līdzīgi to var arī pārtraukt. Savlaicīga ekstrasistole var ieiet cilpā un satikties ar impulsu, tādējādi pārtraucot aritmiju.
Re-entry loka izveidošanā var piedalīties gan vadīšanas sistēmas, gan darba miocītu šķiedras. Daži no re-entry lokam nepieciešamajiem ceļiem cilvēkam ir kopš dzimšanas (piemēram, papildu atrioventrikulārās vadīšanas ceļš pacientiem ar WPW sindromu vai divi atrioventrikulārā savienojuma "ceļi" pacientiem ar atrioventrikulārā savienojuma reciproku tahikardiju), bet daži izveidojas dzīves laikā (piemēram, rēta pēc miokarda infarkta pacientiem ar kambaru tahikardijām). Taču tas nenozīmē, ka, pastāvot vien diviem ceļiem (GĀ un ĪL), uzreiz sāksies tahikardija, ir nepieciešams arī palaidējs - ekstrasistole.
Šie ir universāli mehānismi un var būt jebkurā sirds daļā. Piemēram, pēc re-entry mehānisma priekškambaros ir priekškambaru plandīšanās, atrioventrikulārajā savienojumā - atrioventrikulārā savienojuma atgriezeniska tahikardija (skat. 3. attēlu), bet kambaros - kambaru tahikardija pacientiem pēc pārciesta miokarda infarkta. Dažreiz aritmijas uzturēšanai pēc re-entry mehānisma nepieciešams sarežģītāks substrāts. Piemēram, pacientiem ar WPW sindromu aritmijas pastāvēšanai nepieciešamas četras sastāvdaļas: priekškambaru miokards, atrioventrikulārais savienojums, kambaru miokards un papildu vadīšanas ceļš.
Ektopijas mehānisms priekškambaros var izpausties, piemēram, kā ektopiska priekškambaru tahikardija, bet kambaros kā idiopātiska kambaru tahikardija.
Daudzi kolēģi jautā, kāpēc ir tik būtiski atšķirt vienu mehānismu no otrā. Atbilde ir visai vienkārša: mehānisma dēļ mainās arī ārstēšana.
Tahiartimiju ārstēšanas principi
Tahiaritmijas var ārstēt ar dažādām metodēm. Dažas no tām izmantojamas aritmijas paroksizma kupēšanai, bet dažas pasargāšanai no recidīviem. Šajā rakstā vairāk par antiaritmiskajiem līdzekļiem, transezofageālu stimulāciju un ablāciju ar radiofrekvences katetru.
Antiaritmisko līdzekļu darbība
Vienkāršoti antiaritmiskos līdzekļus jeb antiaritmiķus dala pēc to darbības mehānisma. Tādējādi ir četras antiaritmiķu klases:
- nātrija jonu kanālu blokatori (I klase);
- bēta adrenoblokatori (II klase);
- kālija jonu kanālu blokatori (III klase);
- nedihidropiridīna tipa kalcija kanālu blokatori (IV klase).
Taču daži līdzekļi iedarbojas uz vairākiem kanāliem (piemēram, sotalols ir gan III, gan II klases antiaritmiķis. Pēdējā grupā (V klasē) ir vairāki antiaritmiķi, kas darbojas dažādi.
I un III klases antiaritmiskie līdzekļi darbojas uz darbības potenciālu līkni. Daži no tiem (I A un III klase) pagarina darbības potenciāla ilgumu, daži (I C klase) palēnina depolarizāciju (darbības potenciāla līknes 0. fāzi) bez īpašas ietekmes uz darbības potenciāla ilgumu, bet daži saīsina darbības potenciālu (I B klase). Kādā veidā tas var ietekmēt aritmijas?
Kā iepriekš teikts, biežākais tahiaritmiju mehānisms ir re-entry. I A un III klases antiaritmiskie līdzekļi pagarina darbības potenciāla ilgumu un vēl vairāk pagarina GĀ ceļa refrektaritāti, un neļauj impulsam izplatīties tam cauri retrogrādi. IB klases līdzekļi saīsina GĀ ceļa refrektāro periodu un padara abu ceļu refrektaritātes vienādas, un tas neļauj impulsam retrogrādi ieiet GĀ ceļā. I C klases antiaritmiskie līdzekļi palēnina depolarizāciju un samazina impulsa pārvades ātrumu GĀ un ĪL ceļā (skat. 5. attēlu).
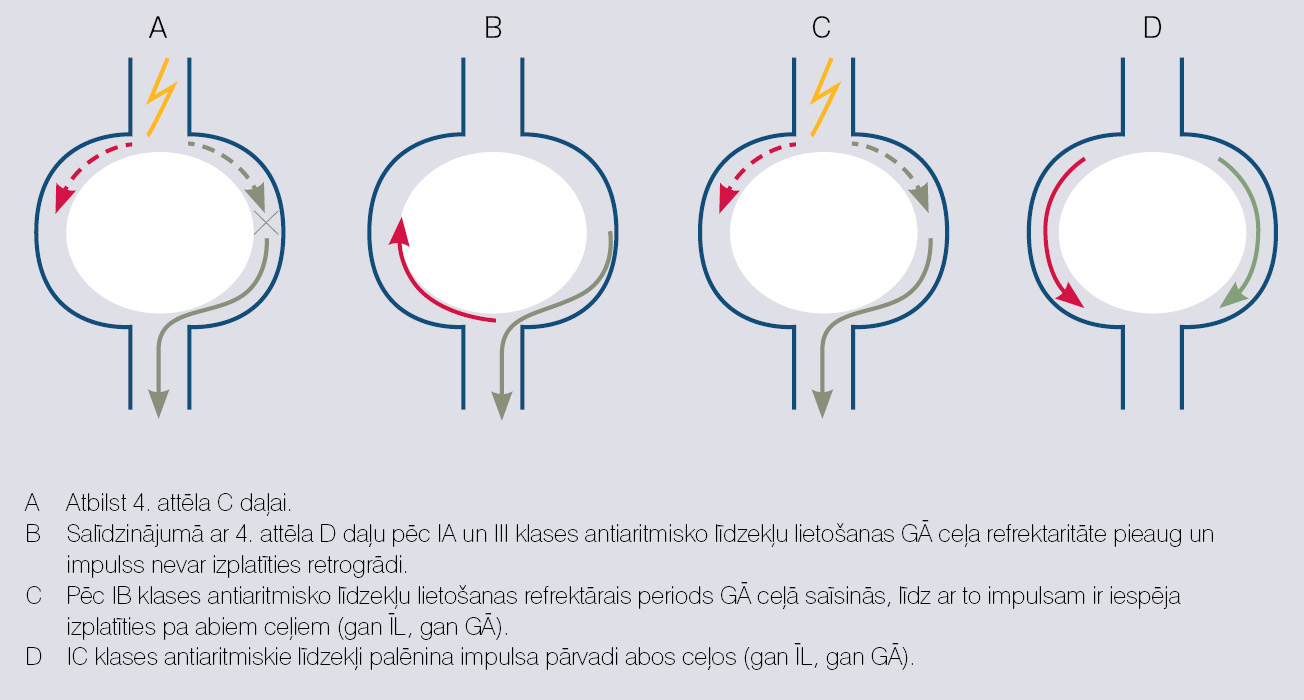

5. attēls
Antiaritmisko līdzekļu darbība
II un IV klases antiaritmiskajiem līdzekļiem ir diezgan neliels efekts uz kardiomiocītu darbības potenciālu, to galvenais darbības mehānisms ir simpatiskā tonusa vājināšana, līdz ar to tie iedarbojas pārsvarā uz sinusa mezglu un atrioventrikulāro savienojumu.
II un IV klases antiaritmiskie līdzekļi ir nozīmīgi ektopisku tahiaritmiju ārstēšanā. Automātiskie perēkļi labāk reaģē uz bēta adrenoblokatoriem, bet palaistie (triggered) - uz nedihidropiridīnu grupas kalcija kanālu blokatoriem.
Starp neklasificētiem antiaritmiskajiem līdzekļiem jāmin digoksīns, adenozīns un ivabradīns.
Digoksīns pastarpināti pastiprina parasimpatisko tonusu, tādējādi samazina sinusa mezgla darbības frekvenci un ievērojami izteiktāk palēnina impulsa pārvadi caur atrioventrikulāro savienojumu.
Adenozīna iedarbība atgādina digoksīna efektu uz atrioventrikulāro savienojumu.
Ivabradīna mērķis ir sinusa mezgla šūnās, tas ir viens no jonu kanāliem, kas nosaka ritma devēja 4. fāzes spontānas plūsmas ātrumu. Bloķējot šo kanālu, panāk sinusa ritma palēnināšanos.
Antiaritmiķi izmantojami gan aritmijas paroksizma kupēšanai, gan recidīvu profilaksei. Jāuzsver, ka to efektivitāte lielā mērā atkarīga no devas, jo klīnisks efekts iespējams tikai ar noteiktu preparāta koncentrāciju. Dažreiz šīs devas ir diezgan lielas.
Visiem antiaritmiskajiem līdzekļiem ir arī blaknes. Par tām nedrīkst aizmirst, izrakstot šos preparātus. Nozīmīgākās blaknes:
- pro-aritmija. Ārstējot vienu aritmiju, antiaritmiskie līdzekļi var izsaukt citu aritmiju. Biežākās pro-aritmijas ir "piruetes" jeb "torsades de pointes" tipa polimorfas kambaru tahikardijas pēc I A, I C un III klases antiaritmiķu lietošanas. Toties I C klases līdzekļu lietošana var provocēt ātriju plandīšanos. Arī digoksīna pārdozēšanas gadījumā var būt kambaru tahikardijas;
- bradisistolija. Īpaši pēc II, IV klases antiaritmisko līdzekļu un digoksīna lietošanas. Pacientiem ar intraventrikulāriem vadīšanas traucējumiem I A, I C un III klases antiaritmiķi var izraisīt pārvades blokādi;
- hipotensija. Bez II un IV klases antiaritmiskajiem līdzekļiem asinsspiediena pazemināšanos var izraisīt arī citu līdzekļu intravenoza ievade, īpaši, ja infūzija ir pārāk ātra;
- toksiska iedarbība uz citiem orgāniem. Šeit obligāti jāmin amiodarons: šis III klases antiaritmiskais līdzeklis ir diezgan efektīvs vairāku aritmiju ārstēšanā, bet ar ļoti sliktu blakņu profilu. Amiodarona toksiskie efekti var izpausties vairogdziedzera, aknu, plaušu u.c. orgānu darbībā. IV klases antiaritmiskie līdzekļi var izraisīt aizcietējumus. Ivabradīns var izraisīt redzes traucējumus. Mēdz būt arī citas retākas blaknes.
Transezofageāla stimulācija
Transezofageālas stimulācijas izmantošanas pamatā, pirmkārt, ir anatomisks aspekts. Proti, barības vads ir lokalizēts tieši aiz kreisā priekškambara, dažu milimetru attālumā (skat. 6. attēlu). Otrkārt, šīs metodes izmantošanu nosaka aritmijas mehānismi. Ar transezofageālu stimulāciju var pārtraukt tikai ar priekškambariem saistītas tahiaritmijas pēc re-entry tipa. Aritmijas apstāšanos var panākt, stimulējot miokarda daļu netālu no re-entry loka ar frekvenci, kas ir ātrāka nekā tahikardijai (veic "pārstimulāciju"). Visbiežāk transezofageālu stimulāciju izmanto priekškambaru plandīšanās pārtraukšanai. Šī metode nav izmantojama kambaru tahikardiju paroksizmu kupēšanai.
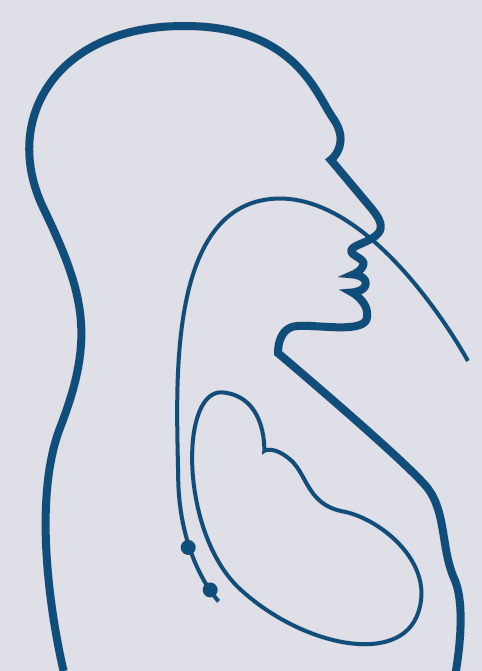

6. attēls
Barības vada elektroda un sirds attiecības
Jāatzīmē, ka transezofageālu stimulāciju var izmantot arī tam, lai inducētu kādu no tahikardijām. To sīkāk apspriedīsim rakstā par supraventrikulārām tahikardijām.
Transezofageāla stimulācija izmantojama arī citiem mērķiem, piemēram, pacientiem ar aizdomām par sinusa mezgla vājuma sindromu diagnozes precizēšanai. Tādos gadījumos izmanto pavisam citus stimulācijas režīmus.
Ablācija ar radiofrekvences katetru
Ablācijas metode ar katetru klīniskajā praksē aritmiju ārstēšanai ievesta pirms aptuveni 25 gadiem un tiek izmantota arvien biežāk. Mūsdienās ablācija ar radiofrekvences katetru izmantojama ļoti daudzu aritmiju ārstēšanai, pat dzīvībai bīstamu, piemēram, kambaru tahikardiju aritmijas ārstēšanai pacientiem pēc pārciesta miokarda infarkta. Metodes plašās izmantošanas pamatā ir uzlabotās zināšanas par tahiaritmiju mehānismiem, kas atklāti arī pašas ablācijas procedūras izmantošanas gaitā.
Procedūras veikšanai nepieciešams speciāls instruments (katetrs), uz kura izvietoti vairāki elektrodi intrakardiālu elektrisku potenciālu reģistrēšanai un kuru ievada pacienta sirdī. Procedūra veicama stacionārā, sterilos apstākļos. Katetrs var būt viens vai vairāki. Pieejai visbiežāk izvēlas labo cirkšņa vēnu (v. femoralis dx.), retāk labo cirkšņa artēriju (a. femoralis dx.). Gadījumos, kad nepieciešama manipulācija kreisajā priekškambarī vai kambarī, izmanto transseptālas punkcijas pieeju. Instrumentu lokalizēšana sirdī notiek rentgena staru kontrolē.
Pirms procedūras veic izmeklēšanu, lai precīzi noteiktu aritmijas mehānismu un atbildīgo substrātu. Precizējot diagnozi, lemj par ablācijas nepieciešamību. Ablāciju veic ar tiem pašiem instrumentiem, ko izmantoja izmeklēšanā. Ablācijas mērķis ik aritmijai atšķiras, detalizēti tie aprakstīti konkrētām diagnozēm.
Pēc procedūras visus instrumentus no pacienta sirds evakuē un punkcijas vietā nodrošina hemostāzi.
Kādas priekšrocības ir ablācijai ar radiofrekvences katetru, salīdzinot ar citām tahiaritmiju ārstēšanas metodēm?
Būtiskākā atšķirība ir radiofrekvences katetra spēja precīzi noteikt aritmijas mehānismu un atbildīgos patoloģiskos substrātus un šos substrātus pilnībā likvidēt. Proti, ar radiofrekvences katetru iespējams iedarboties uz aritmiju etioloģisko vai patoģenētisko mehānismu. Veiksmīgas ablācijas gadījumā mērķa aritmija vairs neatkārtojas.
Indikācijas ablācijas veikšanai ar radiofrekvences katetru:
- supraventrikulāra tahikardija jeb atrioventrikulārā savienojuma reciproka tahikardija;
- WPW sindroms;
- priekškambaru plandīšanās;
- idiopātiska kambaru tahikardija;
- atrioventrikulārā savienojuma destrukcija pacientiem ar pastāvīgu priekškambaru mirdz-aritmiju, ja nav iespējama pietiekama bradikardizācija.
Pacientiem ar šīm diagnozēm mūsdienās ablācija ar radiofrekvences katetru ir pirmās izvēles ārstēšanas metode.
Papildu indikācijas:
- paroksizmāla priekškambaru mirdzaritmija;
- atipiskas priekškambaru plandīšanās un ektopiskas priekškambaru tahikardijas;
- kambaru tahikardijas pacientiem ar strukturālām sirds slimībām, arī pēc pārciesta miokarda infarkta.
Šajos gadījumos ablācijas nepieciešamība ar radiofrekvences katetru jāvērtē individuāli.
Par ablācijas izmantošanu katrā noteiktā situācijā runāsim nākamajos rakstos.
Protams, arī ablācijai ar radiofrekvences katetru ir komplikācijas. Vērā ņemami sarežģījumi ir reti (ap 2-3%), bet daži no tiem ir ļoti būtiski un pat dzīvībai bīstami (0,2-0,5%). Dažas no komplikācijām:
- ar punkcijas vietu saistītās: zemādas hematoma, retroperitoneāla hematoma, atriovenoza fistula u.c.;
- ar ritma traucējumiem saistītās: pēc pakāpes dažādas atrioventrikulārās blokādes, atipiskas priekškambaru plandīšanās u.c.;
- ar sirds bojājumiem saistītās: miokarda ruptūra ar tamponādi, plaušu vēnu stenozes u.c.;
- ar koagulācijas sistēmu saistītās: trombu veidošanās, kam seko embolizācija - išēmisks insults, vai citos baseinos;
- blakus orgānu bojājumi: atrioezofageāla fistula, n. phrenicus bojājums u.c.