Iepriekšējā Doctus numurā publicējām rakstu par mikrovaskulāru stenokardiju, šajā turpinām stāstu par mazāk tipiskiem stenokardijas variantiem, šoreiz uzmanības centrā — vazospastiska un Princmetāla jeb variablā stenokardija.
Vazospastiska stenokardija pirmoreiz minēta The American Journal of Medicine 1959. gadā, kad Dr. Myron Prinzmetal to nosaucis par angina pectoris variablo formu, jo “tā neatbilst diviem galvenajiem klasiskas stenokardijas kritērijiem (I — sāpes krūtīs, ko izsauc palielināta sirds slodze un atvieglo nitroglicerīns; II — EKG sāpju laikā uzrāda ST segmenta depresiju standartnovadījumos I, II, III un V4 bez reciprokām elevācijām)”. Viņš izcēla atšķirības, ka sāpes tipiski parādās miera vai ikdienišķu fizisku nodarbju laikā jebkurā diennakts laikā, tātad to neizsauc slodze, turklāt lēkmes laikā reģistrētā EKG vērojamas pārejošas, bieži vien ļoti izteiktas ST segmentu elevācijas ar reciprokām ST segmentu depresijām. Lēkme tipiski beidzas spontāni, bet, ja ieilgst, iznākums var būt letāls. Princmetāls ierosināja, ka sāpju iemesls varētu būt primārs asins plūsmas samazinājums stenotiskās koronārajās artērijās to paaugstinātā tonusa dēļ. [1]
Definīcijas
Jēdzienus “variablā (jeb Princmetāla) stenokardija” un “vazospastiska stenokardija” bieži lieto kā sinonīmus, bet COVADIS (Coronary Vasomotion Disorders International Study Group) autori uzsvēruši, ka Princmetāla stenokardija ir vazospastiskas stenokardijas specifiska forma (EKG reģistrē ST elevācijas, spazma okludē asinsvadu; skatīt 1. attēlu), šīs atšķirības var izrādīties nozīmīgas, salīdzinot informāciju pētījumos, kas veikti atšķirīgā laikā. [2]
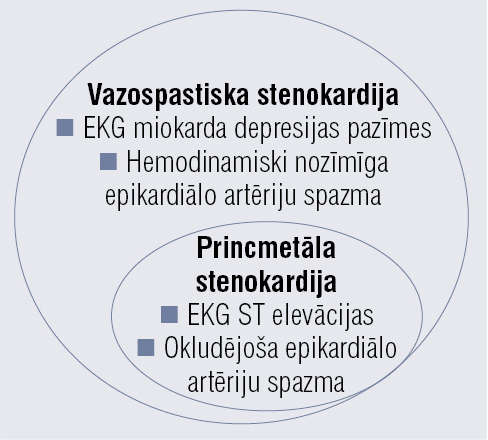

1. attēls
Vazospastiska stenokardija
Vazospastiska stenokardija (VSS) ir stenokardijas forma, ko izsauc pēkšņa, totāla vai subtotāla spazma epikardiālās artērijas segmentā, tāpēc nozīmīgi samazinās koronārā asins plūsma. [3; 4]
Patoģenēze
Vazospazma var veidoties gan normālās, gan atero-sklerotiskās artērijās, vienā lokalizācijā vai multifokāli, īsā fragmentā vai difūzi. Ja spazma ir difūza, tad raksturīga pozitīva korelācija starp spazmas izteiktību un attālumu no asinsvada sākuma. Galvenais lēkmes cēlonis ir vazokonstrikciju izsaucošu stimulu ietekme uz hiperjutīgām asinsvadu muskulārā slāņa šūnām, lai gan arī endotēlija disfunkcijai var būt nozīme, tātad abi šie patoģenēzes mehānismi VSS varētu būt kopīgi ar mikrovaskulāru stenokardiju. Asinsvadu gludās muskulatūras šūnu hiperreaktivitātes cēloņi ir neskaidri, bet ir vairākas teorijas, piemēram, paaugstināta ro–kināzes aktivitāte. Pētot koronāro artēriju spazmu cūku koronārajās artērijās, Kandabashi ar kolēģiem 2000. gadā pierādīja, ka ro–kināze varētu būt viens no būtiskākajiem intracelulārajiem gludās muskulatūras šūnu hiperreaktivitātes izsaucējiem. [5] Šis enzīms veicina gludās muskulatūras kontrakciju, padarot miozīna vieglās ķēdes jutīgākas pret Ca2+. [6] Pētītajām cūkām gludo muskuļšūnu ro–kināzes līmenis bija paaugstināts un ro–kināzes inhibitors hidroksifazudils veiksmīgi novērsa vairāku vazokonstriktoru izsauktu koronāro artēriju spazmu.
Ro–kināzes nozīme vazospastiskas stenokardijas patoģenēzē tika apstiprināta, kad noskaidrojās, ka fazudila (ro–kināzes inhibitora) profilaktiska lietošana pacientiem novērš acetilholīna izsauktu koronāro vazospazmu. [5]
Iemesli varētu būt arī patoloģija ATF jutīgajos K+ kanālos un/vai membrānas Na+/H+ antiportā. Citi cēloņi varētu būt izmaiņas autonomajā nervu sistēmā, palielināta vazokonstriktoru (piemēram, endotelīna) koncentrācija, hormonālas izmaiņas pēc ovarektomijas. [4]
Klīniskā aina
Raksturīgas neizteiksmīgas spiedošas sāpes, žņaudzoša sajūta krūškurvja priekšējā daļā, īpaši substernāli, retāk — vēdera augšdaļā.
Simptomi parasti parādās miera stāvoklī un ilgst apmēram 15 minūtes. Sāpēm bieži vien raksturīga izstarošana uz kaklu, žokli, kreiso plecu un citur, kā arī nejutīgums un vājums kreisajā plecā un augšdelmā. VSS lēkmes tipiski notiek naktī uz rīta pusi miera stāvoklī.
Pacientiem slodzes panesība diennakts gaitā mainās: agros rītos arī pavisam neliela fiziska slodze var izsaukt stenokardijas lēkmi, toties vēlāk problēmas nesagādā arī liela fiziska slodze.
Spazmas izraisītas stenokardijas lēkmes mēdz būt ilgākas nekā organisku asinsvadu bojājumu izsauktā stenokardija, dažkārt tās pavada auksti sviedri. Lēkmi bieži vien pavada aritmijas; ja kā komplikācija pievienojas pilna atrioventrikulāra blokāde, kambaru tahikardija vai fibrilācija, tad var novērot samaņas traucējumus, arī sinkopi.
Lēkmju biežums ir ļoti mainīgs gan dažādiem pacientiem, gan vienam un tam pašam cilvēkam — var būt vairākas reizes dienā un tad var neatkārtoties vairākus mēnešus vai pat gadus. [8]
Kādā pētījumā 1997. gadā, pacientu kontrolējot ar EKG, novērots, ka ⅔ jeb 67 % no visām miokarda išēmijas epizodēm bija asimptomātiskas, bet jāņem vērā, ka darbs veikts Japānā, kur vazospazmas pacientiem novērotas biežāk nekā kaukāziešu populācijā, turklāt pētījumā iekļauti tikai Princmetāla stenokardijas pacienti, tātad vazospastiskas stenokardijas pacientu vidū asimptomātiskas išēmijas epizodes varētu būt krietni vien izplatītākas. [9]
Sāpes var provocēt hiperventilācija, alkohols, stress, smēķēšana. VSS attīstībā nozīme ir arī ģenētiskiem faktoriem, rasei. Cukura diabēts, arteriāla hipertensija un paaugstināts holesterīna līmenis asinīs nepalielina risku, bet interesanti, ka efekts darbojas pretējā virzienā — vazospazmas veicina holesterīna līmeņa paaugstināšanos.
Diagnostika
Vazospastiska stenokardija nav bieža, populāra diagnoze, ko apsver pacientiem ar sāpēm krūtīs, un pētījumi rāda, ka tas atspoguļojas arī laikā līdz diagnozes precizēšanai. Piemēram, Lanza ar kolēģiem noskaidrojuši, ka vidējais laiks no pirmās vizītes līdz diagnozei Kardioloģijas institūtā Romā bijuši divi mēneši. [10] Kavēšanās palielina pacientu risku nozīmīgiem kardiovaskulāriem notikumiem ne tikai laikus nesāktas pareizas terapijas dēļ, bet arī uzsāktas nepiemērotas terapijas dēļ. Dati par nozīmīgu kardiovaskulāru notikumu sastopamību ļoti atšķiras: no nepilna 1 % līdz 37 %, bet, iespējams, zīmīgākais pētījumu novērojums ir tas, ka nozīmīgiem kardiovaskulāriem notikumiem ir tendence notikt trīs mēnešos pēc simptomu sākuma, tātad brīdī, kad diagnoze vēl arvien nav skaidra. [2]
Kritēriji
COVADIS 2015. gadā izveidoja kritērijus VS diagnostikai:
- spontāna, ar nitrātiem kupējama stenokardijas lēkme, kam turklāt raksturīgs viens no šiem faktoriem: stenokardija miera stāvoklī, īpaši naktī vai rīta stundās, izteikti mainīga slodzes panesība dienas gaitā — no rītiem samazināta, hiperventilācija provocē lēkmi, kalcija kanālu blokatori (nevis bēta blokatori) nomāc epizožu atkārtošanos;
- pārejošas izmaiņas EKG pierakstā spontānas epizodes laikā, kas raksturīgas miokarda išēmijai ar šīm pazīmēm vismaz divos blakus novadījumos: ST segmenta elevācija > 0,1 mV, ST segmenta depresija > 0,1 mV, jauni, negatīvi U zobi;
- koronāro asinsvadu spazma, kas definēta kā pārejoša totāla vai subtotāla (avotos kritēriji atšķiras: COVADIS definīcijā runāts par > 90 % sašaurinājumu, Eiropas Kardioloģijas biedrības stabilas stenokardijas vadlīnijās (2007. gadā) 75—99 %, pētījumos nereti > 70 %) koronāro artēriju spazma ar sāpēm krūtīs un išēmijai raksturīgām izmaiņām EKG pierakstā, kas radusies spontāni vai kā reakcija uz provocējošu stimulu (tipiski acetilholīns, ergotamīns vai hiperventilācija).
Diagnoze ir pārliecinoša, ja ar nitrātiem kupējamu spontānu sāpju krūtīs laikā fiksēts pozitīvs EKG izmaiņu vai koronāro artēriju spazmu kritērijs, bet iespējama, ja ar nitrātiem kupējamas lēkmes laikā EKG reģistrētās izmaiņas ir nepārliecinošas vai izmeklējums nav bijis iespējams un koronāro artēriju spazmas kritēriji ir nepārliecinoši. [4]
Indikācijas neinvazīvai diagnostikai
COVADIS ziņojumā rūpīgāk veidotas arī rekomendācijas diagnozes noteikšanai; neinvazīvai diagnostikai ir divi I klases ieteikumi:
- EKG pieraksts lēkmes laikā un pēc nitrātu lietošanas (vai tieši pēc simptomu beigšanās) gadījumā, ja pēc pacienta subjektīvajām sūdzībām ir pamatotas aizdomas par VSS,
- 24—48 h kontrole ar Holtera monitoru, ja pēc subjektīvām sūdzībām ir pamatotas aizdomas par VSS un bijusi sinkope vai palpitācijas bez zināma iemesla.
II A klases rekomendācija: 24—48 h kontrole ar Holtera monitoru, ja EKG pieraksts lēkmes laikā ir problemātisks.
II B klases indikācija EKG vai kontrolei ar Holtera monitoru: ja pacientiem VSS iespējamība ir niecīga, ņemot vērā vecumu, sūdzības un apstākļus, kā arī EKG pieraksta plānošana laikā, kad lēkmes ir biežākas (gadījumos, ja hiperventilācijas un slodzes testus dažādu iemeslu dēļ nevar veikt).
Slodzes testiem pacientiem ar aizdomām par VSS ir II A klases rekomendācija: testa veikšana agri no rīta un dienā, ja atšķiras diennakts slodzes panesība; II B klases indikācija, ja atšķirību diennakts slodzes panesībā nav. Slodzes testu nedrīkst veikt pacientiem, kam ir aizdomas par akūtu koronāru sindromu (AKS).
Hiperventilācijas tests ar II A klases pierādījumu līmeni ieteikts pacientiem ar aizdomām par VSS un retām lēkmēm.
Spontānas lēkmes laikā veiksmīgi reģistrēta EKG vai vizualizēta spazma ir drošs veids, kā pierādīt vazospastisku stenokardiju, tomēr izmeklējuma laikā spazmas var nebūt, tāpēc izstrādātas gan invazīvas, gan neinvazīvas metodes to mākslīgai provokācijai un vizualizācijai. Neinvazīvi — veic stresa ehokardiogrāfiju, ievadot ergometrīnu [11], invazīvi — katetrizējot koronārās artērijas un tajās ievadot acetilholīnu vai ergonovīnu. Tā kā pašlaik Latvijā šos izmeklējumus ikdienas praksē neveic, tie apspriežami tīri teorētiskā līmenī. Procedūrām ir savi riski, tāpēc katra pacienta stāvoklis pirms nosūtīšanas uz izmeklējumu rūpīgi jāizvērtē. Indikācijas un kontrindikācijas apkopotas 1. un 2. tabulā.
![Indikācijas invazīvam vazospazmas provokācijas testam [2]](https://cdn.doctus.lv/media/2016/10/2/original/06a444a9083e.jpg)
![Indikācijas invazīvam vazospazmas provokācijas testam [2]](https://cdn.doctus.lv/media/2016/10/2/original/06a444a9083e.jpg)
1. tabula
Indikācijas invazīvam vazospazmas provokācijas testam [2]


2. tabula
Kontrindikācijas invazīvam vazospazmas provokācijas testam
Pilnu raksta versiju lasiet DOCTUS 2016. gada novembra numurā!