Diemžēl pat tad, ja pigmenta plankumus atpazīstam un ārstējam laikus, tie var saglabāties gadiem ilgi, kas nenoliedzami rada kā estētiska rakstura problēmas, tā izteiktu psiholoģisko diskomfortu. [2] Tāpēc svarīgi apzināties pēciekaisuma pigmentācijas cēloņus un zināt veidus, kā labāk pasargāt savu ādu.
Pēciekaisuma hiperpigmentācija sastopama visās vecumgrupās, vienādi bieži sievietēm un vīriešiem, biežāk mongoloīdās un ekvatoriālās rases pārstāvjiem.
Lielāks risks attīstīties PIH ir cilvēkiem ar tumšāku ādas fototipu (III—VI pēc Ficpatrika). [1; 3]
Melanīna nozīme PIH veidošanā
Melanoģenēze jeb melanīna sintēze ir viens no organisma aizsardzības mehānismiem, ko īsteno ādas pigmenta šūnas jeb melanocīti, kas atrodas ādas bazālajā slānī. Melanocītu ķermeņu sastāvā ir īpašas augsti organizētas struktūras — melanosomas, kurās ar enzīma tirozināzes palīdzību izstrādājas pigments melanīns. Vēlāk tas tiek transportēts pa melanocīta izaugumiem uz blakus šūnām — keratinocītiem un strādā kā optiskais filtrs, kas absorbē kaitīgo UV starojumu, tādējādi kavējot staru nokļūšanu dziļāk organismā. [4; 5]
Ķīmiskie faktori jeb mediatori, kas piedalās iekaisuma procesā, var veicināt melanoģenēzi ar vairāku mehānismu starpniecību, piemēram, atbildot uz iekaisumu, keratinocīti sintezē tādus mediatorus kā prostaglandīni (PGE2 un PGF2α), tie saistās ar melanocīta virsmas receptoru, kas šūnas iekšienē izraisa cikliskā adenozīna monofosfāta (cAMP) produkciju, kurš tieši stimulē enzīma tirozināzes aktivāciju. Šie mediatori veicina arī jaunu melanocīta izaugumu veidošanos, kas izraisa palielinātu melanīna depozīciju epidermā.
Cita mehānisma pamatā iesaistīts iekaisuma mediators interleikīns 1 alfa (IL–1α), kas stimulē saistaudu šūnas fibroblastus, pastiprināti veidojot keratinocītu augšanas faktoru (KGF), kas veicina pastiprinātu melanosomu uzņemšanu keratinocītos. Šis augšanas faktors iesaistīts arī tirozināzes aktivācijā. [2]
Pastiprināta melanīna depozīcija var notikt ne tikai epidermā, bet arī dermā. Tas kļūst iespējams, kad iekaisuma šūnas sagrauj epidermas bazālo slāni, kas ļauj melanīnam no epidermas nokļūt dermas slānī (pigmenta nesaturēšana), kur to fagocitē makrofāgi jeb melanofāgi. Ir arī alternatīvs patoģenēzes variants: makrofāgi migrē uz epidermu, fagocitē epidermas melanosomas un atgriežas dermas slānī, kur pigments var saglabāties gadiem. [1]
Pēciekaisuma hiperpigmentācijas raksturojums
Cēloņi
Iekaisuma procesus ādā var izsaukt gan ārvides iedarbība, gan dažādi iekšējie procesi organismā. Pie tiem pieder iekaisīgās ādas slimības, piemēram, lichen planus (1. attēls), acne vulgaris, psoriāze, atopiskais dermatīts vai kontaktdermatīts, kā arī dažādas ādas infekcijas — bakteriālās, virālās, sēnīšu izraisītās.
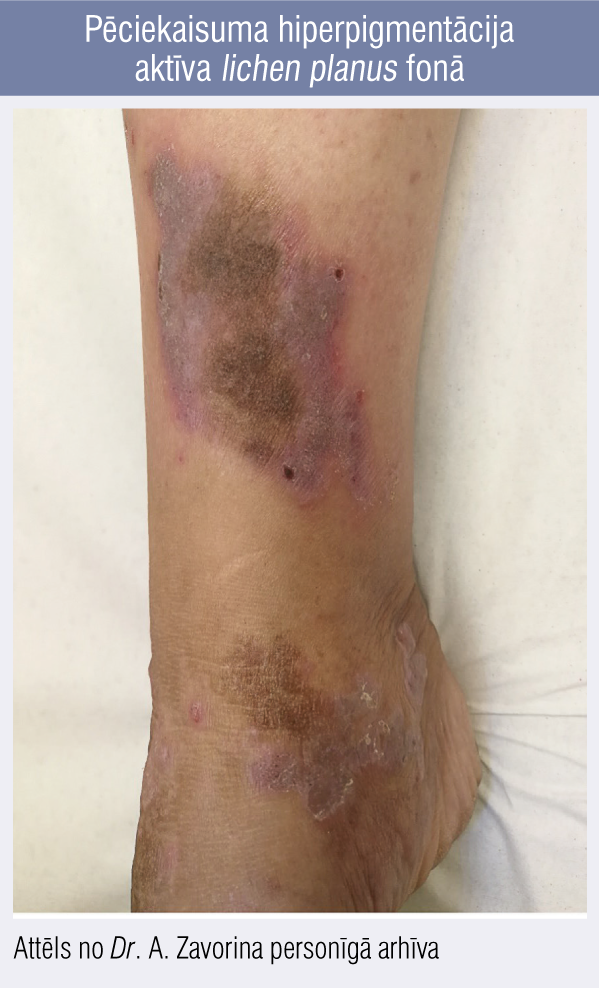

1. attēls
Pēciekaisuma hiperpigmentācija aktīva lichen planus fonā
Ārējie faktori ir ādas trauma vai apdegums, fototoksiski medikamenti. Ādas lāzerprocedūras, krioterapija un ķīmiskie pīlingi, kas estētiskajā dermatoloģijā kļūst arvien populārāki, arī pieder iekaisumu vecinošiem ārējiem faktoriem. [2; 6]
Tas, ka PIH riska faktors ir tumšāks ādas tips, iespējams, saistīts ar ģenētiski noteiktu lielāku melanīna daudzumu epidermas melanosomās un aktīvākiem melanoģenēzes enzīmiem. To varētu izskaidrot arī teorijas par atšķirīgu keratinocītu spēju uzņemt melanosomas dažādiem ādas tipiem — jo tumšāka āda, jo lielāka KGF receptoru ekspresija. [2] Tas nozīmē, ka, veicot šīs procedūras cilvēkiem ar tumšāku ādu, jāuzmanās īpaši. Pašiem pacientiem laikus jāvēršas pie speciālistiem, lai ārstētu ādas slimības un mazinātu PIH attīstību, piemēram, aknes gadījumā.
Klīniskā aina un diagnostika
PIH izpaužas kā hiperpigmentētas makulas un plankumi vietās, kur āda tikusi pakļauta iekaisuma procesam. Krāsa variē no gaiši brūnas līdz tumši brūnai, ja pigments lokalizējas epidermā (epidermālā melanoze).
Dermālās melanozes gadījumā makulas/plankuma krāsa var būt pelēka vai pelēcīgi zila, pat melna. Ādas hiperpigmentācijas plankuma lokalizāciju un izmēru nosaka sākotnējā iekaisuma perēkļa lokalizācija un plašums, plankums var būt gan labi norobežots, gan difūzs. [1; 3]
Parasti pēciekaisuma hiperpigmentācija ir klīniska diagnoze, ko nosaka pēc klīniskās ainas un pacienta anamnēzes: vai iepriekš ir bijusi iekaisīga dermatoze, ādas infekcija, trauma, nesena lāzerprocedūra. [1; 3]
Diagnostikā noder arī dermatoskopija, lai atšķirtu epidermālo un dermālo melanozi, kas ir svarīgi terapijas izvēlei. Epidermālais komponents dermatoskopiski izskatās brūngans, bet dermālais — kā pelēcīgi punkti un/vai plankumi. [7; 8] Agrāk tika uzskatīts, ka atšķirt epidermālu melanīnu no dermāla var ar Vuda lampu, tomēr mūsdienās viedokļi par šā izmeklējuma efektivitāti ir pretrunīgi. Svarīgi pieminēt, ka izmeklējums ar Vuda lampu nav informatīvs un efektīvs pacientiem ar tumšu ādas fototipu (V—VI pēc Ficpatrika). [1]
Ādas biopsija kā diagnostiska metode visbiežāk nav nepieciešama. To var apsvērt gadījumos, kad ir ļoti ticams kāds cits pigmentācijas cēlonis vai ja nepieciešams iekaisīgas dermatozes kā pamata diagnozes apstiprinājums. [1]
Piesardzības pasākumi
Aktīva iekaisīgās ādas dermatozes ārstēšana ir viens no galvenajiem veidiem, kā ādu pasargāt no pēciekaisuma hiperpigmentācijas. [9] Viens no piemēriem ir acne vulgaris, ko mūsdienās ārstē ar lokāliem līdzekļiem (benzilperoksīdu, retinoīdu, antibakteriālu līdzekli), sistēmiskiem medikamentiem (antibakteriālu līdzekli, kombinēto orālo kontracepciju, spironolaktonu, izotretinoīnu) vai kombinēti. Terapijas izvēli nosaka slimības smaguma pakāpe.
Diemžēl cilvēkiem PIH var attīstīties arī vieglas slimības gadījumā, kad ādā nav izteiktas iekaisuma reakcijas. [2] Tāpēc ir svarīgi uz konsultāciju pie dermatologa doties laicīgi, lai ārstēšanu sāktu iespējami ātrāk. Augsta riska indivīdiem ar ādas III—VI fototipu profilaktiski kombinācijā ar aknes terapiju var nozīmēt lokāli lietojamo hipopigmentējošo līdzekli hidrohinonu, kas var samazināt iespēju attīstīties PIH. [2]
Nākamais svarīgais solis — ja iespējams, nelietot zāles, kas var izraisīt pastiprinātu ādas pigmentāciju vai stāvokli pasliktināt. Ir vairāki medikamenti, kas izraisa šādu blakusparādību, daži piemēri minēti tabulā.
![Medikamenti un hiperpigmentācija [6; 15]](https://cdn.doctus.lv/media/2022/03/2/original/3775fdb42bc8.jpg)
![Medikamenti un hiperpigmentācija [6; 15]](https://cdn.doctus.lv/media/2022/03/2/original/3775fdb42bc8.jpg)
Tabula
Medikamenti un hiperpigmentācija [6; 15]
Ja pacientam ir pigmentācijas problēmas un jālieto kādi no šiem medikamentiem, novērošanai jābūt sevišķi rūpīgai, jāseko līdzi ādas stāvoklim, bet, pamanot izmaiņas, jāapmeklē dermatologs. [2; 9]
Ja jāveic lāzerprocedūra (piemēram, lāzerepilācija, asinsvadu lāzerkoagulācija, tetovējumu likvidēšana u.c.), jāņem vērā daži padomi, kas var samazināt risku PIH attīstītībai.
- Aizsardzība no saules četras nedēļas pirms procedūras.
- Izvairīties no uzturēšanās tiešos saules staros, kad to aktivitāte ir palielināta (plkst. 11.00—15.00). Obligāti jāņem vērā arī UV indekss konkrētajā dienā. PVO rekomendācijās teikts, ka papildu aizsardzība pret sauli iesakāma no UV indeksa 3. Svarīgi atcerēties: UV indekss 7 vai 8 nozīmē, ka saule ir pārāk agresīva un tiešos tās staros uzturēties nevajadzētu. Ja citādi nav iespējams, obligāti jālieto aizsargkrēms un galvā jāliek cepure. Ja saulē jāuzturas ilgstoši, labs risinājums ir speciāls apģērbs ar UV aizsardzību (nopērkams sporta veikalos).
- Ikdienā lietot plaša spektra (UVB un UVA) saules aizsarglīdzekli ar SPF 30—50.
- Uzreiz pēc procedūras atdzesēt ādu (pievadīt aukstu gaisu vai uz brīdi pielikt ledus gabaliņu). Tas palīdz minimizēt ādas traumēšanu.
- Pēc procedūras var nozīmēt īsu lokāli lietojamo glikokortikoīdu kursu (divas nedēļas) kombinācijā ar saules aizsarglīdzekļiem (SPF 50+, četras nedēļas). Glikokortikoīdiem ir izteikta pretiekaisuma darbība, tāpēc tie var būt lietderīgi cīņā pret PIH attīstību.
- Pacientiem ar noslieci uz pēciekaisuma hiperpigmentāciju profilaktiski pirms un pēc procedūras var nozīmēt līdzekļus (piemēram, hidrohinonu, retinoīdus, traneksāmskābi, tiamidolu), kas kavē melanīna sintēzi un/vai transportu uz keratinocītiem. [10]
Izpildot šos piesardzības pasākumus un laikus ārstējot iekaisīgās ādas slimības, katrs no mums var samazināt hiperpigmentācijas attīstības risku. [2]
Ārstēšana
Pēciekaisuma hiperpigmentācijas ārstēšanas process ir sarežģīts, kombinēts, nereti arī ilgstošs (6—12 mēnešus). [3] Tie ir dažādi pasākumi PIH pastāvības un uzliesmojumu biežuma samazināšanai, iekļaujot arī ārstēšanas metodes ādas melanīna izkliedei vai iznīcināšanai. Terapijas stūrakmens nenoliedzami ir ārīgi uzklājamie līdzekļi. [1]
Mūsdienās nav vienotu vadlīniju PIH ārstēšanai, terapijas taktika atkarīga no vairākiem faktoriem: vai ādā ir aktīvs iekaisums, kāds ir tā iemesls, vai tā ir epidermālā, dermālā vai jauktā melanoze. [9; 11] Iespējamais terapijas algoritms apkopots 2. attēlā.
![Terapijas algoritms PIH gadījumā [11—13]](https://cdn.doctus.lv/media/2022/03/2/original/0cac5096aa81.jpg)
![Terapijas algoritms PIH gadījumā [11—13]](https://cdn.doctus.lv/media/2022/03/2/original/0cac5096aa81.jpg)
2. attēls
Terapijas algoritms PIH gadījumā [11—13]
Lai kāda būtu izraudzītā ārstēšanas stratēģija, ikvienam pacientam ar PIH nepieciešama stingra fotoprotekcija, lai samazinātu risku papildus attīstīties ultravioletā starojuma izraisītai pigmentācijai. [1] Fotoprotekcija nozīmē izvairīties no tiešas saules gaismas dienas aktīvajās stundās, nēsāt gaišu apģērbu vai apģērbu ar SPF filtru, kā arī regulāri lietot plaša spektra saules aizsarglīdzekļus ar vismaz SPF 30 (ieteicams ar fizikālu bloķējošu aģentu, piemēram, dzelzs oksīdu) un atbilstošu UVA aizsardzību. Tāpat svarīgi izglītot pacientus par provocējošiem faktoriem: skartās ādas skrāpēšanu, berzēšanu vai traumēšanu. [1; 9]
Pirmās līnijas terapija
Viens no visbiežāk lietotajiem hipopigmentējošiem līdzekļiem, ar kuru sāk PIH ārstēšanu, ir lokāli lietojams hidrohinons.
Tā darbības mehānisma pamatā ir tirozināzes inhibēšana, kas rezultējas ar traucētu dihidrofenilalanīna konversiju melanīnā, kā arī samazinātu melanosomu veidošanos un melanizāciju.
Tomēr svarīgi atzīmēt, ka šis medikaments ir mazāk efektīvs dermālā pigmenta uzkrāšanās gadījumā, jo melanofāgiem ir minimāla tirozināzes aktivitāte. Visbiežāk hidrohinonu lieto 4 % koncentrācijā. Atbildreakcija uz terapiju būtu jānovērtē pēc 12 nedēļām — ja dinamika pozitīva, bet rezultāts nav sasniegts, ārīgi uzklājamo līdzekli var lietot vēl 12 nedēļas, bet, ja efekta nav, tā lietošanu pārtrauc. [11]
Arvien biežāk literatūrā minēts, ka vislabākais ārstēšanas rezultāts ir tad, ja izmanto kombinēto terapiju ar hidrohinonu—retinoīdu—glikokortikoīdu jeb trīskāršo kombināciju (4 % hidrohinons, 0,05 % tretinoīns, 0,01 % fluocinolona acetonīds). Pētījumi liecina, ka kombinēta terapija ir efektīvāka par atsevišķo līdzekļu lietošanu monoterapijā. Retinoīds novērš hidrohinona oksidēšanos, izšķīdina melanīnu, uzirdina ādas raga slāni, tādējādi sekmējot hidrohinona uzsūkšanos, kā arī papildus inhibē melanosomu transportu. Glikokortikoīds palīdz mazināt ādas kairinājuma reakciju, kas ir bieža hidrohinona blakusparādība, sevišķi koncentrācijā virs 4 %. [12] Izmantojot trīskāršo terapiju, novērošanas vizīte ir pēc 8—12 nedēļām, terapija ilgst ne vairāk par 24 nedēļām. Ārīgi uzklājamos retinoīdus var lietot arī monoterapijā, to darbības pamatā ir epidermas atjaunošanas paātrināšana, kas veicina melanīna dispersiju un sekmē tā izzušanu. [1; 3; 9]
Eritēma, hipertrihoze un aknei līdzīgi izsitumi ir visbiežāk aprakstītās blakusparādības pēc hidrohinona ārīgas uzklāšanas. Ļoti retos gadījumos indivīdiem ar tumšāku ādas fototipu aprakstīts stāvoklis, kas pazīstams kā eksogēna ohronoze. Klīniski tam raksturīga simetriska zili melna vai pelēcīgi zila hiperpigmentācija vaigu, deniņu un kakla ādā. Jāatzīmē, ka šajos gadījumos pacienti lielākoties ilgstoši lietojuši hidrohinonu bez ārsta uzraudzības. Tas ir viens no apsvērumiem, kāpēc hidrohinons Eiropas Savienībā ir recepšu medikaments. Tas sekmēja alternatīvu, plašāk pieejamu līdzekļu parādīšanos tirgū. [12]
Pie alternatīvām izvēlēm pieskaitāmi vairāki līdzekļi: azelaīnskābe, kojskābe, sojas līdzekļi, niacīnamīds u.c. Azelaīnskābe tiešā un netiešā veidā inhibē tirozināzi, tai raksturīgs selektīvs citotoksisks un antiproliferatīvs efekts, bet niacīn-
amīds bloķē melanosomu transportu uz keratinocītiem. [9]
Viens no pēdējā laikā plaši pētītiem kosmētiskiem līdzekļiem, ko lieto melasmas un PIH terapijā, ir tiamidols (isobutylamido‐thiazolyl‐resorcinol). Tas ir potents cilvēka tirozināzes inhibitors.
Kontrolētā 12 nedēļas ilgušā pētījumā, kurā piedalījās indivīdi ar aknes inducētu PIH un tumšu ādas fototipu (V un VI pēc Ficpatrika), novērots, ka 39 dalībnieku grupā, kas regulāri lietoja kosmētisku līdzekli ar tiamidolu, PIH mazinājās statistiski ticami izteiktāk nekā kontroles grupā ar 38 dalībniekiem. Būtiski, ka līdzeklis bija labi panesams, netika atzīmēts apsārtums, kairinājums, nieze, dedzināšana. [13]
Otrās līnijas terapija
Pie šīs grupas pieder ķīmiskie pīlingi: glikolskābes pīlings (koncentrācijā 50 % un vairāk), ko atkārto ik pēc trīs nedēļām, vai 20—30 % salicilskābes pīlings ik pēc divām nedēļām. Procedūru veic pieredzējis skaistumkopšanas speciālists vai dermatologs.
Ķīmiskie pīlingi veicina depigmentējošo līdzekļu penetrāciju, tāpēc vienmērīgi nolobās keratinocīti, kas pildīti ar melanosomām, mazinās epidermālā melanīna daudzums. Vairāk rekomendējami tieši virspusēji ādas pīlingi, jo tie izraisa mazāku ādas kairinājumu nekā dziļāki pīlingi, kuri ietekmē dermas kārpiņu un tīklaino slāni. [1; 9]
Lāzerterapija
Pētījumi par dažādu veidu lāzeriem un to efektivitāti PIH ārstēšanā joprojām turpinās. Jāatceras, ka PIH ir potenciāla lāzerterapijas komplikācija, tāpēc jāuzmanās pacientiem ar tumšāku ādas tipu.
Šo risku var reducēt, izmantojot garo viļņu lāzerus, tādus kā 1064 nm Q switched Nd:YAG (neodīmija). QS lāzeri izstaro īpaši augstas enerģijas lāzerimpulsus ar impulsa ilgumu nanosekunžu diapazonā. Kad šādā veidā izstaroto gaismu absorbē melanīns, melanosomās veidojas akustiski triecienviļņi, kas izraisa melanocītu un melanosomu bojāeju. [9]