Prostatas audzējs ir viens no biežākajiem nāves cēloņiem Latvijā. 2017. gadā Latvijā tika reģistrētas 74 ar prostatas audzēju saistītas nāves uz 100 000 iedzīvotāju, kas bija augstākais rādītājs Eiropas Savienībā.
[1] Prostatas audzēju, kuru atklāj sākuma stadijā, var izārstēt radikāli ar ķirurģisku terapiju (radikālu prostatektomiju). Pēc radikālas terapijas sagaidāmā audzējam specifiskā desmit gadu dzīvildze ir 84,3 %.
[2] Tomēr recidīvi pēc radikālas operācijas ir 20—40 %.
[3] Arī šai pacientu grupai vēl var lietot staru terapiju kombinācijā ar hormonālo terapiju un daļu no šiem pacientiem izārstēt.
Lielā mirstība no prostatas audzēja Latvijā un pasaulē saistāma ar primāri (de novo) diagnosticētiem metastātiskiem audzējiem un pacientiem ar metastāzēm, kas attīstās kā recidīvi pēc radikālas terapijas. Lielāko daļu nāves gadījumu izraisa novēloti diagnosticēts prostatas vēzis.
Metastātiska prostatas audzēja sastopamība dažādos reģionos ievērojami atšķiras, piemēram, de novo vēlīni diagnosticētie gadījumi ASV ir < 5 % [4] no visiem diagnosticētajiem prostatas audzējiem, bet Indijā 85 %. [5]
Eiropā primāru metastātisku prostatas audzēju sastopamības rādītājs ir 5—30 %. Diemžēl Latvijā vēlīni diagnosticētie audzēji ir ap 30 % no visiem prostatas vēžiem.
Diagnostika
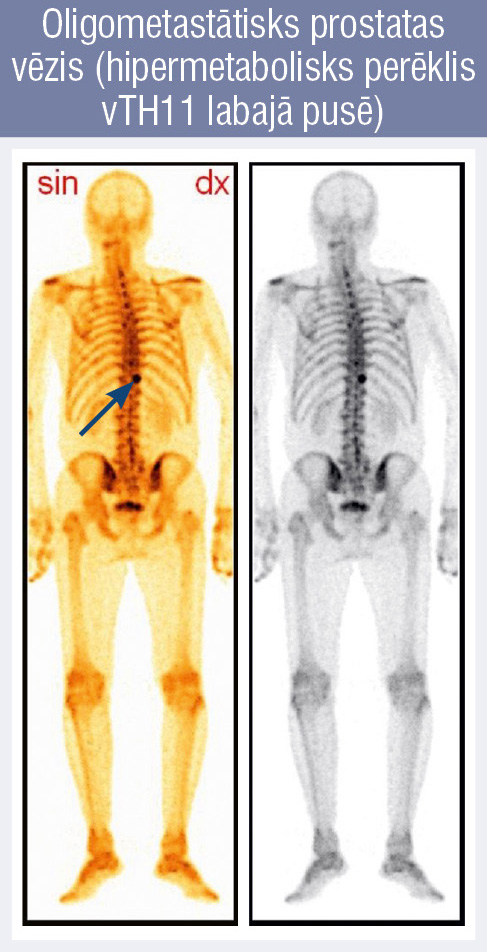

1. attēls
Oligometastātisks prostatas
vēzis (hipermetabolisks perēklis vTH11 labajā pusē)
Pacientiem, kam biopsijā tiek konstatēts prostatas audzējs, lai noteiktu stadiju un izplatību, veic magnētisko rezonansi mazajam iegurnim un skeleta scintigrāfiju, un datortomogrāfiju vēdera dobumam un krūškurvim. Pacientam ar metastātisku prostatas audzēju var veikt arī PSMA—PET/CT, kas ļauj precīzāk izvērtēt metastāžu esību un lokalizāciju. Jāatzīmē, ka pašreizējās ārstēšanas rekomendācijas un vadlīnijas izstrādātas pēc datortomogrāfijas un skeleta scintigrāfijas datiem.
Mūsdienās primārus metastātiskus prostatas audzējus uzskata par heterogēnu grupu un atbilstoši metastāžu skaitam ārstē atšķirīgi. Pateicoties diviem lieliem pētījumiem Chaarted un Lattitude, de novo metastātisko prostatas audzēju pacientus iedala divās grupās pēc metastāžu skaita. Ir oligometastātiski (zema riska, maza tilpuma, 1. attēls) un multimetastātiski (augsta riska, liela tilpuma, 2. attēls) audzēji (tabula).
Terapijas iespējas
Pamata terapija metastātiska prostatas vēža ārstēšanā ir androgēnu deprivācijas terapija (ADT). Androgēnu deprivācijas terapijas pamatā ir medikamentoza vai ķirurģiska kastrācija. Par adekvātu kastrācijas līmeni tiek uzskatīts testosterona līmenis asinīs zem 50 ng/ml. Vissvarīgākais priekšnoteikums ADT efektivitātei ir stabila un pastāvīgi zema testosterona koncentrācija serumā.
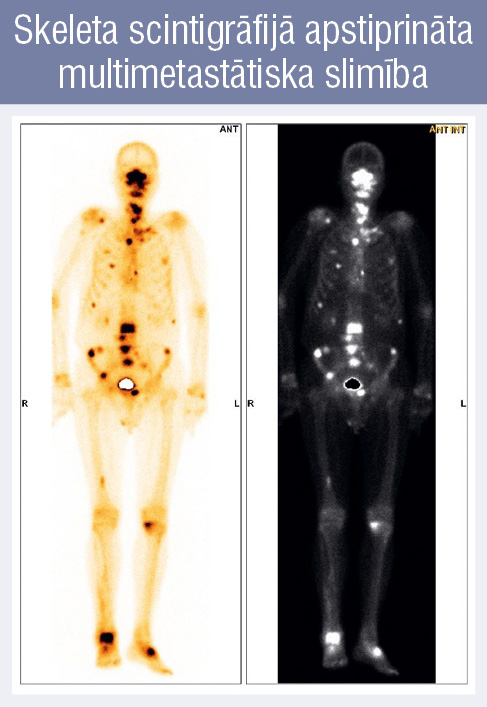

2. attēls
Skeleta scintigrāfijā apstiprināta multimetastātiska slimība
Metastātiska prostatas audzēja terapijā testosterona izslēgšana organismā ir vitāli nepieciešama, bet tā var negatīvi ietekmēt kardiovaskulāro sistēmu, kaulu blīvumu un metaboliskās izmaiņas. Pirms terapijas un tās laikā jāveic atbilstošas pārbaudes un profilaktiski pasākumi. Nozīmīgu kardiovaskulāru blakusslimību gadījumā pirms terapijas sākšanas jāveic kardioloģiski izmeklējumi.
Riska grupām pirms terapijas un tās laikā būtu jāveic kaulu blīvuma mērījums. Osteopēnijas gadījumā nepieciešama D vitamīna un kalcija substitūcija, kas praktiski ir vajadzīga visiem pacientiem. Izteiktas osteoporozes gadījumā indicēta papildu terapija ar denozumabu vai zoledronskābi. ADT var izraisīt metabolisma izmaiņas, attīstoties cukura diabētam un/vai paaugstinoties lipīdu līmenim asinīs. Pirms terapijas sākšanas un terapijas laikā jāmēra un jāpārbauda attiecīgie laboratoriskie rādītāji (glikoze, HbA1c, triglicerīdi, holesterīns). Terapijas laikā vēlams Vidusjūras diētu apvienot ar fiziskām aktivitātēm.
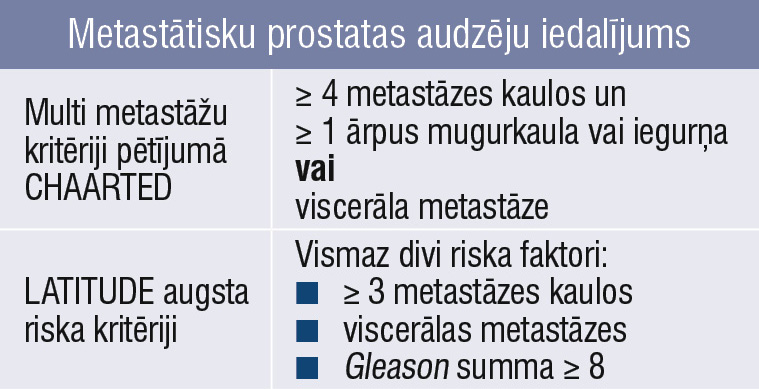

Tabula
Metastātisku prostatas audzēju iedalījums
ADT + staru terapija
Oligometastātiskiem pacientiem, kuri atbilst zema riska vai maza tilpuma kritērijiem jāpiedāvā ADT kombinācijā ar staru terapiju prostatai, jo Stampede pētījumā šai pacientu grupai statistiski ticami pagarinājās vispārējā dzīvildze, salīdzinot ar pacientiem, kurus ārstēja tikai ar ADT. [6]
Pievienojot staru terapiju multimetastātiskiem pacientiem, vispārējā dzīvildze nemainījās. Paliatīva prostatas staru terapija jāveic līdz 72 Gy, izmantojot hipofrakcionētas vai normofrakcionētas shēmas, ņemot vērā pacienta individuālās īpašības.
Kombinēta medikamentoza terapija
Pēdējos desmit gados stipri pilnveidotas terapijas iespējas metastātiskiem prostatas audzējiem un monoterapija ar ADT modernajā medicīnā vairs netiek izmantota. Ir vairākas kombinētās terapijas iespējas.
Piemērotāko terapijas veidu izlemj multidisciplināra konsilija ietvaros, jo metastātisku prostatas audzēju pacientu grupa ir ļoti heterogēna, ārstēšana atkarīga no šādiem faktoriem:
- metastāžu lokalizācija — viscerāli vai kaulos,
- metastāžu izplatība kaulu sistēmā (metastāžu skaits un lokalizācija — mugurkaulā vai ārpus mugurkaula),
- simptomu esība,
- primārā audzēja histoloģiskais tips,
- pacienta vispārējais stāvoklis un blakusslimības.
ADT + ķīmijterapija
Pirmā kombinētā terapija, kurai pierādīts pārākums pār ADT monoterapiju, bija ADT + 6–docetaksela terapijas cikli. Kombinētā terapija Charteed un Stampede pētījumos samazināja mirstības risku vidēji par 20 %. [7; 8] Labāki rezultāti tika sasniegti pacientiem ar multiplām metastāzēm, bet oligmetastātiskiem pacientiem rezultāti nebija tik izteikti.
Pirmajos trīs mēnešos sliktāka dzīves kvalitāte bija ADT un docetaksela grupā nekā ADT grupā, bet pēc 12 mēnešiem dzīves kvalitāte abās grupās statistiski ticami neatšķīrās. Nozīmīgākās docetaksela blakusparādības ir kuņģa—zarnu trakta problēmas, nogurums, izsīkums, izmaiņas asins analīzēs, nervu bojājumi. [9]
ADT + abiraterons
Abiraterons (abiraterona acetāts) ir medikaments no steroīdu grupas. Ja ADT veicina testosterona sintēzes apstādināšanu sēkliniekos, tad abiraterons, bloķējot CYP17A enzīma darbību, izslēdz testosterona sintēzi prostatas audzēja šūnās un virsnierēs.
Abiraterona darbības mehānisms, kavējot pregnenolona vai progesterona pārvēršanu par testosterona prekursoriem, izslēdz testosterona sintēzi, taču papildus var paaugstināt minerālkortikoīdu līmeni, savukārt tas veicina hipokaliēmiju, tūskas un hipertensiju. Tāpēc regulāri jānosaka elektrolītu līmenis, aknu funkcionālie rādītāji asins analīzēs. Lai samazinātu blakusparādību risku, terapijā jāpievieno kortikosteroīdi, piemēram, prednizolons.
Latitude pētījumā secināts, ka, pievienojot abirateronu/prednizolonu, vidējā dzīvildze pagarinās par 16,8 mēnešiem. [10] Novēroja arī nozīmīgus ieguvumus dzīves kvalitātē — pagarinājās laiks līdz sāpju progresēšanai. Līdzīgus datus novēroja Stampede pētījumā. Uzlabojums tika novērots arī abiraterona kombinācijai ar ADT zema riska pacientu grupā.
Abiraterona un ADT kombinācija vispārējo dzīvildzi uzlabo vidēji par 37 %. [11]
Jaunie selektīvie nesteroīdie antiandrogēni + ADT
Ir izstrādāti jauni selektīvi nesteroīdie antiandrogēni: apalutamīds, darolutamīds, enzalutamīds. To mehānisms ietver androgēnreceptoru bloķēšanu celulārā un intranukleārā līmenī, kas stipri uzlabo šīs zāļu grupas darbību. Jaunie selektīvie nesteroīdie antiandrogēni saistās ar androgēnu receptoru ligandu saistošo domēnu, bloķē androgēnu receptoru kodola translokāciju, inhibē DNS saistīšanos un kavē androgēnu receptoru mediētu transkripciju.
Selektīvos nesteroīdos antiandrogēnus lietojot kombinācijā ar ADT, mirstības risks samazinās par 33 %, [12] salīdzinot ar ADT grupu. Šīs grupas medikamentiem blakusparādības nav izteiktas un, salīdzinot ar ADT grupu, tās bija līdzvērtīgas, tas nozīmē, ka blakusparādības asociējamas tikai ar ADT, nevis ar selektīvajiem nesteroīdajiem antiandrogēniem.
Kombinētā trīskāršā terapija: ADT + docetaksels + abiraterons vai darolutamīds
Arasens un PEACE–1 pētījumi pierādīja, ka ADT + docetaksels + abiraterons vai darolutamīds statistiski ticami uzlabo dzīvildzi, salīdzinot ar ADT un docetaksela kombināciju.
Arasens pierādīja, ka darolutamīds + ADT + docetaksels mirstības risku samazina par 32,5 %, salīdzinot ar ADT + docetaksels. [13; 14] Ir nepieciešami tālāki pētījumi, kurām pacientu grupām labākus rezultātus dotu trīskārša terapija un kurām pacientu grupām pietiktu ar ADT + jaunajiem selektīvajiem nesteroīdajiem antiandrogēniem, lai izvairītos no docetaksela radītajām blaknēm.
Secinājumi
- Mūsdienās de novo metastātiski audzēji jāārstē ar kombinētu terapiju, jo rezultāti ir ievērojami labāki un tiek pagarināta pacienta dzīvildze.
- Primāri metastātisks prostatas audzējs ir heterogēns, jāizvēlas pacientam piemērots ārstēšanas veids, ko izlemj multidisciplinārā konsilijā.
- Oligometastātiskiem pacientiem, kuri atbilst zema riska vai maza tilpuma kritērijiem, jāpiedāvā ADT kombinācijā ar staru terapiju prostatai.
- Ņemot vērā pētījuma rezultātus par mirstības riska samazināšanos, selektīvie nesteroīdie antiandrogēni un abiraterons kombinācijā ar ADT ir efektīvāki nekā ADT un docetaksela kombinācija.
- Latvijā šai pacientu grupai pašlaik tiek kompensēta ADT, docetaksels un apalutamīds.