Klīniskā gadījuma aprakstā paciente ar neiroendokrīnu audzēju — insulinomu. Gadījuma aprakstā detalizēti skaidroti izmeklējumi un ārstu izvēlētās ārstēšanas metodes katrā slimības progresēšanas posmā.


par mērvienību lietojumu rakstā
Klīniskais gadījums
Paciente, dzimusi 1957. gadā, 2012. gada augustā zaudēja samaņu un stacionēta rajona slimnīcā, kur viņai konstatēja hipoglikēmiju 1,9 mmol/l (N 4—6 mmol/l), HbA1c 5,5 % (N 4—5,6). Pacientei veica vēdera dobuma datortomogrāfiju (DT), konstatēja veidojumu aizkuņģa dziedzerī ar metastāzēm aknās. Tālākai izmeklēšanai un ārstēšanai paciente nosūtīta uz Upsālas Universitātes slimnīcas Onkoloģiskās endokrinoloģijas klīniku.
Stāvoklis iestājoties
Subjektīvās sūdzības
Vismaz 2—3 gadus pastiprināts nogurums, epizodes ar hipoglikēmijai tipiskiem simptomiem (lēkmjveida svīšana, sirdsklauves, trīce, panikas epizodes un bada sajūta). Simptomi izteiktāki naktī un agrās rīta stundās. Paciente pati šos simptomus saistījusi ar menopauzi un pie ārsta nav devusies. Citu sūdzību nav. Laba apetīte, stabils svars, normāla vēdera izeja.
Slimību anamnēze
14 gadu vecumā operēta kreisās olnīcas mucinoza cistadenoma (2,3 kg). Nedaudz paaugstināts asinsspiediens no 24 gadu vecuma, lieto losartānu 50 mg 1 × dienā. Vairākus gadus nedaudz paaugstināti aknu transamināžu rādītāji, plašāk nav izmeklēti.
Ģimenes un sociālā anamnēze
Paciente strādā birojā, smēķē no 12 gadu vecuma, 15—20 cigaretes dienā. Pacientei ir četras meitas, veselas. Pacientes mātei bijusi sarkoma, vecmāmiņai — aizkuņģa dziedzera audzējs (plašākas informācijas nav), brālim un māsasdēlam — leikēmija.
Objektīvais stāvoklis
Bez patoloģijas. Asinsspiediens 120/80 mmHg. Ķermeņa masas indekss (ĶMI) 24 kg/m2.
Laboratoriskās izmeklēšanas rezultāti
Norādīti tikai izmainītie rādītāji: sārmainā fosfatāze 165 V/l (N 40—150); AlAT 210 V/l (N 0—50); AsAT 86 V/l (N 0—45); insulīns 54 μU/ml (N 6—27); C peptīds 6,65 ng/ml (N 0,9—4); glikagons 197 pmol/l (N < 140); gastrīns 22,33 pg/ml (N 0—100); kalcitonīns 109,59 pg/ml (N 3—26); proinsulīns 500 pmol/l (N < 16); hromogranīns A (CgA) 270 V/. (N 2—18). Glikozes līmenis asinīs stacionārā svārstās no 1,9 līdz 8 mmol/l, nakts stundās paciente saņem pastāvīgu infūziju ar 10 % glikozi.
Biopsija no veidojuma aknās
Histopatoloģiskajā izmeklēšanā neiroendokrīna audzēja histoloģiskā aina, kur vērojams pozitīvs krāsojums uz pankeratīnu, sinaptofizīnu, hromogranīnu A. 10—20 % šūnu populācijas pozitīvs krāsojums uz insulīnu. Negatīvs krāsojums uz glikagonu, PP, somatostatīnu, gastrīnu un kalcitonīnu. Ki67 18 % (Ki67 — šūnu proliferācijas marķieris).
Radioloģiskās izmeklēšanas rezultāti
Somatostatīna receptoru (SSR) scintigrāfija (Octreoscan) uzrāda SSR pozitīvu veidojumu aizkuņģa dziedzera galviņas/ķermeņa daļā, multiplas aknu un limfmezglu metastāzes vēdera dobumā, kā arī rada aizdomas par metastāzēm skeletā. Uzkrāšanās intensitāte atbilst 3.—4./4. pakāpei pēc Krenninga skalas (Krenninga skala atspoguļo preparāta uzkrāšanos — somatostatīna receptoru daudzumu neiroendokrīnos audzējos, salīdzinot ar uzkrāšanos veselos aknu audos), tātad paciente var būt laba radionukleīdās terapijas kandidāte (PRRT — radionukleīdā terapija). Veic arī krūškurvja/vēdera dobuma DT, kur redzams 32 × 41 mm liels hipervaskulārs veidojums aizkuņģa dziedzerī, multiplas, hipervaskulāras aknu metastāzes (lielākā 61 × 46 mm), kā arī palielināti, pat 40 mm lieli limfmezgli paraaortāli.
Diagnoze
Neiroendokrīns aizkuņģa dziedzera audzējs (P–NET), G2 pēc PVO, insulinoma, ar metastāzēm aknās, limfmezglos un skeletā.
Slimības gaita un terapija
Sāk ārstēšanu ar streptozotocīnu/5–FU
2012. gada oktobrī pacientei sāk ķīmijterapiju ar streptozotocīnu/5–FU (fluorouracilu), kas ir pirmās līnijas terapija P–NET pacientiem Upsālas klīnikā. Jau drīz pēc pirmā terapijas cikla glikozes līmenis uzlabojas un paciente var iztikt bez i/v glikozes infūzijas. Kontrole ar DT 2012. gada decembrī (paciente saņēmusi trīs ķīmijterapijas ciklus) parāda labu terapijas efektu, piemēram, lielākā aknu metastāze no 61 × 46 mm mazinājusies uz 56 × 42 mm, kāda cita no 50 mm uz 33 mm. Regress vērojams arī limfmezglu metastāžu izmēros, pazeminājies proinsulīna līmenis (insulīna, C peptīda un hromogranīna A līmeņa izmaiņas slimības gaitā parādītas 1. attēlā, proinsulīna līmeņa izmaiņas 2. attēlā). Paciente turpina līdzšinējo terapiju ik trešo nedēļu. Arī nākamās kontroles 2013. gada februārī un aprīlī parāda gan bioķīmiski, gan radioloģiski stabilu slimības gaitu (aknu metastāzes turpina samazināties izmēros), hipoglikēmijas nav bijušas, nav nepieciešama i/v glikoze un ir stabils glikozes līmenis ar trim ēdienreizēm dienā. Pacientei kopā bijuši 12 ķīmijterapijas cikli ar streptozotocīnu/5–FU (cikls ik trešo nedēļu).
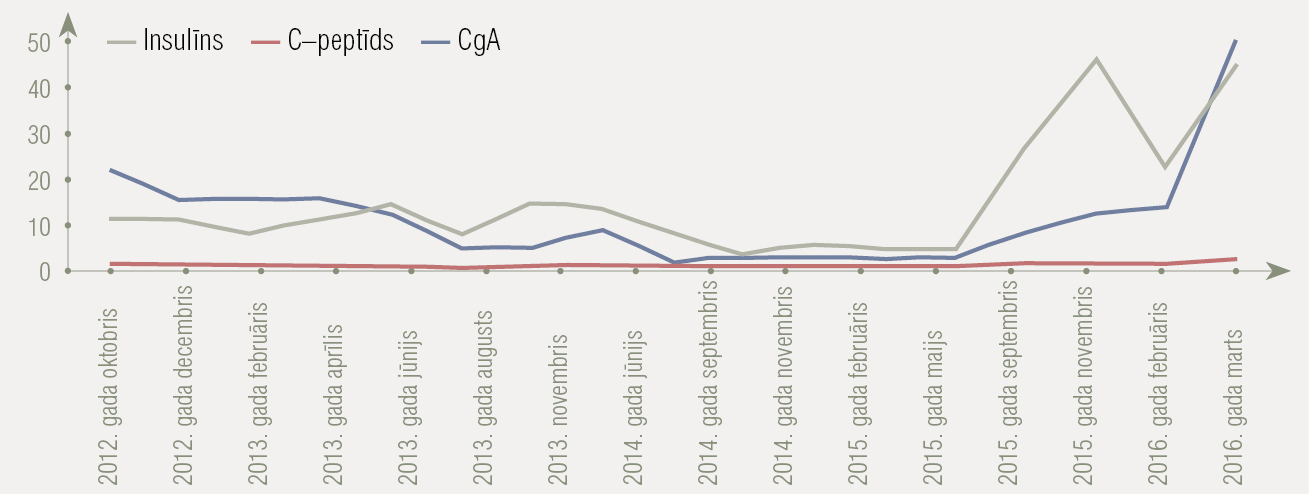

1. attēls
Insulīna, C peptīda un hromogranīna A (CgA) izmaiņas slimības gaitā. Laboratoriskie rādītāji
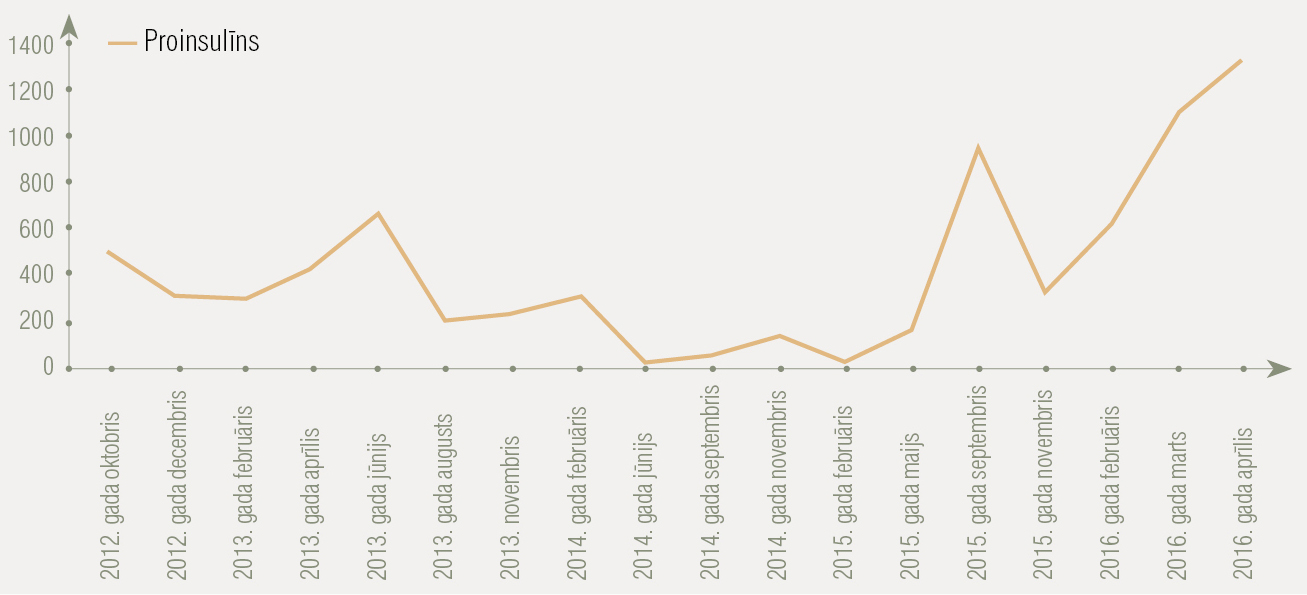

2. attēls
Proinsulīna līmeņa izmaiņas slimības gaitā
Terapijas maiņa uz everolimus
No 2013. gada maija pamazām atgriežas hipoglikēmijas, nakts stundās atkal nepieciešama 10 % glikozes infūzija, biežākas ēdienreizes dienā. Jūnijā veic DT, kas apstiprina slimības progresu aknās, salīdzinot ar izmeklējumu aprīlī. Pieaudzis arī proinsulīna līmenis. Līdzšinējā terapija tiek pārtraukta un tiek ordinēts everolimus (Afinitor) 10 mg × 1. Glikozes līmenis ievērojami stabilizējas, tomēr medikamenta blakusparādību dēļ (klepus, izsitumi un nieze, čūlas mutes gļotādā, nogurums un garšas izmaiņas) paciente nejūtas labi. 2013. gada augustā atkārtoti veic Octreoscan: salīdzinot ar iepriekšējo izmeklējumu 2012. gada oktobrī, izteikta metastāžu regresija aknās, atsevišķām metastāzēm pieaugusi preparāta uzkrāšanās intensitāte. DT stabila slimības aina, salīdzinot ar izmeklējumu jūnijā. Proinsulīna līmenis no 643 (jūnijā) pazeminājies uz 212 pmol/l, i/v glikoze nav nepieciešama.
Radionukleīdās terapijas (PRRT) sākšana
2013. gada ziemā atgriežas hipoglikēmijas nakts stundās (min. 2,9 mmol/l), DT atkal vērojama slimības progresija, piemēram, viena no aknu metastāzēm no 33 × 40 mm (2012. gada oktobrī — 61 × 46 mm) pieaugusi uz 40 × 48 mm, otra lielākā no 23 × 24 mm augustā uz 27 × 28 mm (2012. gada oktobrī 56 × 42 mm). Lai gan terapija ar everolimus nav izrādījusi nozīmīgu pret-audzēja aktivitāti, pēc tā lietošanas stabilizējies glikozes līmenis, tāpēc paciente turpina lietot šo medikamentu (līdz 2016. gada martam). Agrāk veiktais Octreoscan uzrādījis pietiekami augstu preparāta uzkrāšanos audzēja audos (3.—4. pakāpe pēc Krenninga skalas), tāpēc pacientei apstiprina PRRT ar 177Lu–DOTA/Octreotate četriem terapijas cikliem ik pēc astoņām nedēļām. Pirmais terapijas cikls 2014. gada februārī.
Stāvoklis pēc pirmās PRRT
Asinsaina pēcterapijas periodā uzrāda trombocitopēniju, tāpēc otro terapijas ciklu atliek līdz brīdim, kad analīzes normalizējas. Tomēr arī pēc pirmās PRRT ir ievērojams uzlabojums: pacientes pašsajūta labāka nekā jebkad agrāk, glikozes līmenis stabils, pat nedaudz paaugstināts (everolimus efekts), i/v glikoze nav nepieciešama. DT 2014. gada jūnijā un septembrī uzrāda metastāžu samazināšanos par apmēram 50 %. Otra PRRT2014. gada novembrī, efekts joprojām labs: metastāzes turpina mazināties izmēros, hipoglikēmiju nav. 3. attēlā uzskatāmi parādīti Octreosan un PRRT pēcterapijas scintigrāfijas izmeklējumi.
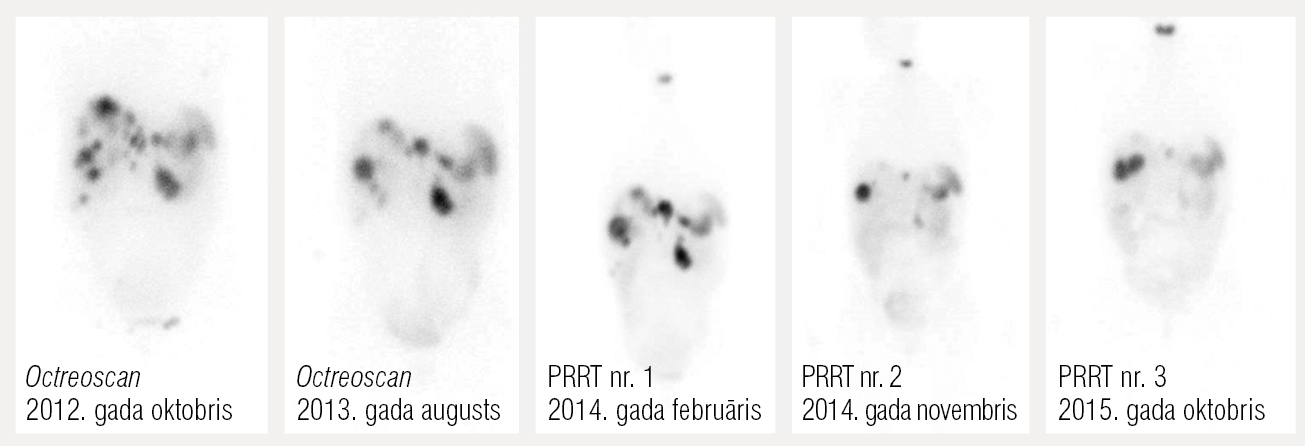

3. attēls
Octreoscan un PRRT scintigrāfiskie uzņēmumi pēc terapijas
Slimības attīstība
2015. gada vasarā DT izmeklējumā konstatē cistisku veidojumu labajā olnīcā, ko vēlāk arī operē. Histopatoloģiskā izmeklēšana apstiprina neiroendokrīna audzēja metastāzi olnīcā ar Ki67 50—60 %, to traktē kā slimības progresiju (jauna metastāze) un audzēja de–diferencēšanos (Ki67 pieaugums no 18 % uz 60 %). Pacientei veic atkārtotu aknu biopsiju: Ki67 50—70 %. Tā kā aizvien pieaug everolimus blaknes, slimība progresē (atgriežas hipoglikēmijas), tad 2015. gada augustā everolimus devu samazina uz 5 mg × 1 un trombocitopēnijas dēļ terapijā pievieno temozolomīdu samazinātā devā.
Diagnoze
Neiroendokrīns aizkuņģa dziedzera audzējs (P–NEC), G3 pēc PVO, insulinoma, ar metastāzēm aknās, limfmezglos un skeletā. Metastāze labajā olnīcā.
Citas ārstēšanas metodes
2015. gada oktobrī paciente stacionēta smagu hipoglikēmiju dēļ. DT progresijas aina (pēc diviem cikliem ar temozolomīdu), tāpēc šī terapija tiek atcelta. Pacientei nepieciešama pastāvīga 10 % glikozes infūzija, pēdējā mēneša laikā ir izteikts svara pieaugums (ĶMI 30), jo paciente spiesta ēst ik otro stundu. Stacionārā vairākas dienas mēģināta terapija ar īsas darbības somatostatīna analogu, kas glikozes līmeni diemžēl neuzlabo un tiek pārtraukta. Arī diazoksīds ir neefektīvs, turklāt izraisa izteiktu šķidruma aizturi ar tūsku. Veic Gallium–DOTATOC PET/DT, kas uzrāda slimības progresēšanas ainu, salīdzinot ar PRRT pēcterapijas scintifgrāfiju 2015. gada februārī. Pacientei joprojām nozīmīga somatostatīna receptoru (SSR) ekspresija, lai gan notiek audzēja de–diferenciācija. PRRT veic trešo reizi.Tomēr Gallium–DOTATOC PET (4. attēlā) redzams arī ļoti daudz metastāžu, kuras zaudējušas SSR ekspresiju, kas ir tipiska aina, pieaugot audzēja proliferācijai.
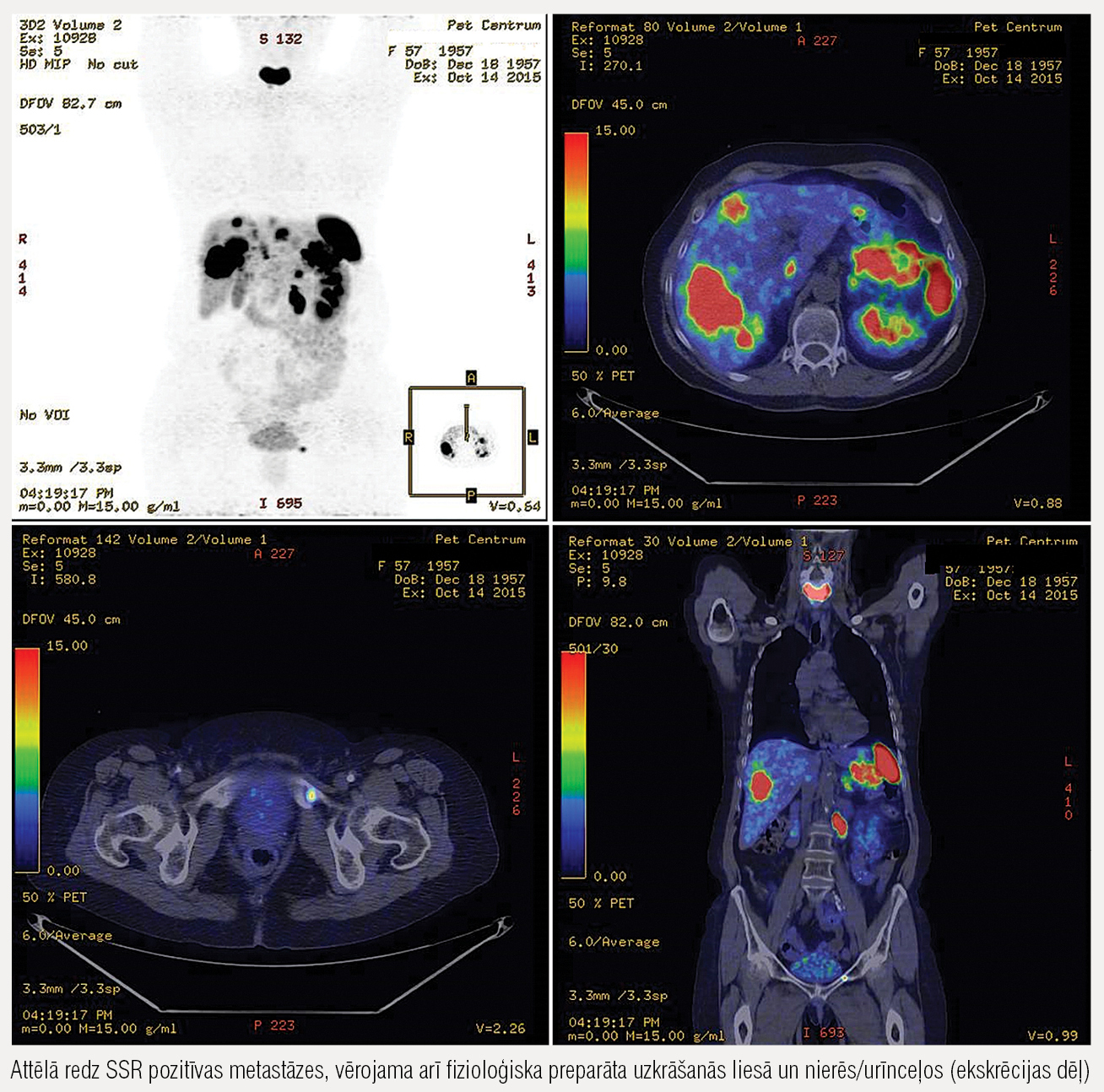

4. attēls
Gallium–DOTATOC PET/DT 2015. gada oktobrī
Līdz pat 2016. gada februārim pacientes veselības stāvoklis stabils, glikoze normas robežās bez i/v infūzijas un ar trim ēdienreizēm dienā.
Iznākums
2016. gada martā DT uzrāda izteiktu slimības progresiju. CgA 3078 V/l, proinsulīns 1308 pmol/l. AsAT 365 V/l (N 0—50). Glikozes līmenis no 1,7 līdz 4 mmol/l, lai gan ir pastāvīga 10—30 % glikozes infūzija 24 stundas diennaktī un biežas ēdienreizes. Pacientes vispārējā stāvokļa un paaugstinātā aknu transamināžu līmeņa dēļ turpmāka pretaudzēja terapija nav iespējama. 5. attēlā redzama 2016. gada aprīlī veikta DT aknām bez i/v kontrastvielas.
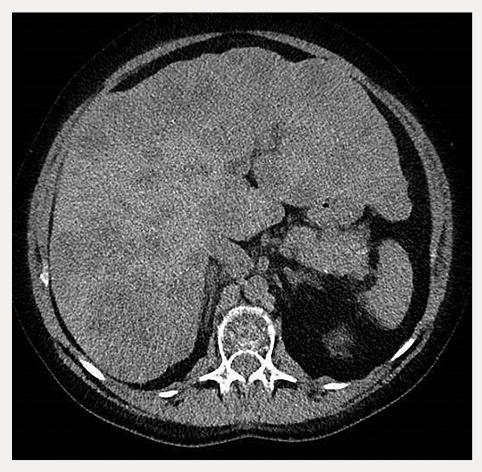

5. attēls
Aknu DT bez i/v kontrastvielas 2016. gada aprīlī
2016. gada maijā exitus letalis.
Demonstrācijas mērķis un secinājumi
- Parādīt hormonāli aktīva P–NET/NEC klīniskās gaitas variantu, ārstēšanas iespējas un izaicinājumus.
- Arī vecākās paaudzes pretvēža terapija labi izmantojama P–NET ārstēšanā (streptozotocīns/5–FU; Latvijā nav).
-
Everolimus ir īpaši piemērots malignas insulinomas ārstēšanā — ne tikai pretvēža efekta dēļ, bet arī hiperglikēmiskās darbības dēļ.
- PRRT (Latvijā nav) ir labs efekts somatostatīna receptoru pozitīvu NET audzēju terapijā (gan audzēja masas, gan hormonālās hipersekrēcijas mazināšanā).
Patoloģija — pārskats
Neiroendokrīnie audzēji veido 1—2 % no visiem aizkuņģa dziedzera audzējiem. Zināšanas par šo audzēju izcelsmi joprojām ir nepilnīgas, tomēr zināms, ka daļa ģenētisko patoloģiju, piemēram, MEN1 sindroms un von Hippel Lindau slimība, palielina risku šo neoplazmu attīstībai. Lai gan agrāk šie audzēji uzskatīti par retiem, pēdējos gados, uzlabojoties zināšanām un radioloģiskās/histoloģiskās izmeklēšanas metodēm, to sastopamība arvien pieaug. Neiroendokrīnus aizkuņģa dziedzera audzējus (P–NET) konstatē pacientiem visās vecumgrupās (vidējais vecums 53 gadi), vienlīdz bieži sievietēm un vīriešiem.
Pēc hormonālās sekrēcijas potenciāla P–NET iedalāmi funkcionālos (35 % no visiem P–NET, piemēram, insulinoma 50 %, gastrinoma 40 %, glikagonoma, VIPoma, somatostatinoma) un nefunkcionālos — 65 % P–NET (nav simptomus izraisošas hormonālās hiperprodukcijas).
Bieži vien funkcionālie ļaundabīgie P–NET izraisa vairāku hormonu hipersekrēciju reizē, piemēram, insulinoma/gastrinoma vai pat insulinoma/glikagonoma. Parasti šādos gadījumos novērojama arī agresīvāka slimības gaita. Nereti laika gaitā audzējs var mainīt hormonālās sekrēcijas profilu, tāpēc hormonālās analīzes svarīgi veikt ne tikai diagnostikas brīdī, bet arī vēlāk.
Nedrīkst aizmirst, ka P–NET var izraisīt arī citus hormonālos sindromus:
- ektopisku Kušinga sindromu (ACTH),
- akromegāliju (GHRH),
- karcinoīdo sindromu (5–hidroksi–indoletiķskābe),
- hiperkalcēmiju (PTHrP).
PVO klasifikācija (attiecināma uz visiem NET):
- Ki67 ≤ 2 % — 1. pakāpes NET (neuroendocrine tumor),
- Ki67 3—20 % — 2. pakāpes NET,
- Ki67 > 20 % — 3. pakāpes NEC (neuroendocrine cancer).
Insulinomas 90—95 % gadījumu ir labdabīgas, pārējie P–NET > 60 % gadījumu ir ļaundabīgi un jau diagnozes brīdī metastazējuši uz limfmezgliem un/vai aknām. Visbiežāk P–NET ir ļoti diferencēti un progresē salīdzinoši lēni (pēc PVO G1—G2), tomēr jāatceras, ka jebkurā brīdī slimības gaitā metastāzes var de–diferencēties uz G3 pakāpes audzēju.
Aptuveni 80—90 % P–NET labi ekspresē somatostatīna receptorus (SSR), kas izmantojams gan diagnostikā, gan ārstēšanā.
P–NET diagnostikas un kontroles iespējas
- Hromogranīns A
- Samērīgi simptomiem: insulīns, C peptīds, proinsulīns, gastrīns, glikagons, VIP, kalcitonīns, PP, somatostatīns (ACTH, STH, PTHrP, 5–HIAA)
- Gados jauniem pacientiem ar P–NET — arī PTH un prolaktīns (MEN1 sindroms ?)
- Stimulācijas testi
- Histopatoloģiskā diagnostika (!!!)
- Ultrasonogrāfija (US), DT, MR, endoskopiska US, intraoperatīva US
- Somatostatīna receptoru scintigrāfija, Gallium–DOTATOC DT/PET
- 18F–FDG–PET, ja Ki67 > 20 %
Ārstēšanas iespējas
- Ķirurģiska iejaukšanās, ja iespējama radikāla ārstēšana (un/vai simptomu atvieglošanas nolūkā).
- Aknu metastāžu terapija dažu indikāciju gadījumā (radiofrekvences ablācija, embolizācija, SIRTEX radioembolizācija).
- Simptomātiska terapija (piemēram, protonsūkņu inhibitori — gastrinoma; diazoksīds, somatostatīna receptoru analogi, everolims — insulinoma).
- Sistēmiska terapija, metastazējošas slimības gadījumā — kā 6. attēlā.
![P–NET ārstēšanas shēma [1]](https://cdn.doctus.lv/media/2016/10/2/original/842b0ad2927d.jpg)
![P–NET ārstēšanas shēma [1]](https://cdn.doctus.lv/media/2016/10/2/original/842b0ad2927d.jpg)
6. attēls
P–NET ārstēšanas shēma [1]