Autori izsaka pateicību Dr. med. Kristīnei Baumanei un Dr. Elīzai Briedei par iesaistīšanos un palīdzību sadaļas “Diabētiska retinopātija” tapšanā!
Šajā numurā lasiet par diabētisku retinopātiju un nefropātiju, kādā no nākamajiem — par tādām cukura diabēta komplikācijām kā centrāla, perifēra un autonoma neiropātija.
Diabētiska retinopātija
Diabētiska retinopātija līdzīgi citām vēlīnām diabēta mikrovaskulārajām komplikācijām sastopama bieži un ir viens no galvenajiem redzes zuduma iemesliem pieaugušajiem darbspējīgā vecumā. [1] Starptautiskās Diabēta federācijas [2] šā brīža aprēķini liecina, ka 56,3 miljoniem cukura diabēta pacientu jeb ~12 % ir pasliktināta redze, kas var attīstīties līdz aklumam, ja netiek veikti tūlītēji un atbilstoši pasākumi. Tiek lēsts, ka 2030. gadā 191 miljonam diabēta pacientu var attīstīties diabētiska retinopātija, respektīvi, katram trešajam. Tāpēc neatņemama sastāvdaļa darbā ar cukura diabēta pacientiem ir endokrinologa un oftalmologa cieša sadarbība, lai tiktu nodrošināta kvalitatīva, savlaicīga un inovatīva ārstēšana.
Klasifikācija
Diabētiskas retinopātijas klasifikācija veidota pēc vizualizējamām pārmaiņām tīklenē, piemēram, jaunu patoloģisku asinsvadu esība/neesība fundus oculi apskates laikā pēc acu zīlīšu dilatācijas. Izšķir neproliferatīvu un proliferatīvu diabētisku retinopātiju, kas tālāk tiek iedalīta vairākās smaguma pakāpēs. [4]
Neproliferatīvu diabētisku retinopātiju raksturo nervšķiedru slāņu infarkti (“vates veida eksudāti”), intraretinālas hemorāģijas, cietie eksudāti un mikrovaskulāras patoloģijas, piemēram, mikroaneirismas, nosprostoti vai dilatēti asinsvadi, galvenokārt makulas un tīklenes aizmugurējā apvidū (1. attēls).
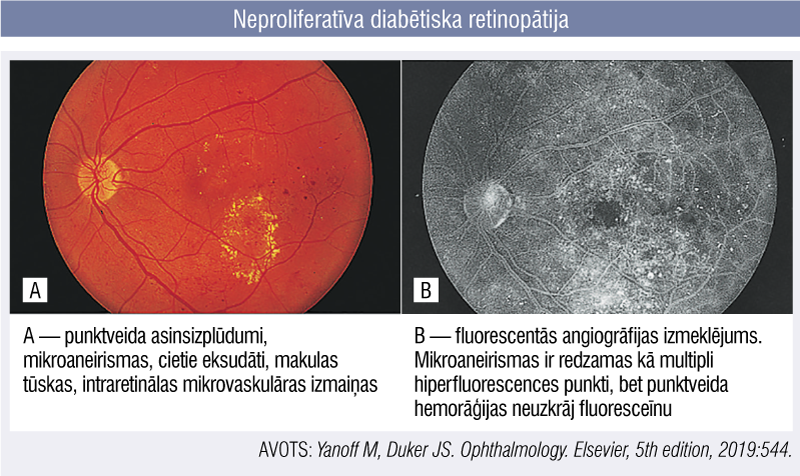

1. attēls
Neproliferatīva diabētiska retinopātijav
Lai atbilstoši izvēlētos savlaicīgu ārstēšanu un kontroles vizīšu skaitu, neproliferatīvu diabētisku retinopātiju iedala vieglā, vidēji smagā, smagā un ļoti smagā pakāpē, no kurām pēdējā būtiski ietekmē proliferatīvas retinopātijas attīstības risku. [4]
Turpretī proliferatīvu diabētisku retinopātiju raksturo neovaskularizācija (2. attēls), kas rodas, proliferējot redzes nerva diska un/vai tīklenes asinsvadiem, preretināla vai stiklveida ķermeņa hemorāģija (hemoftalms) ar sekojošu fibrozi un iespējamu trakcijas tīklenes atslāņošanās attīstību. To iedala agrīnā, augsta riska un smagas pakāpes retinopātijā. [4]
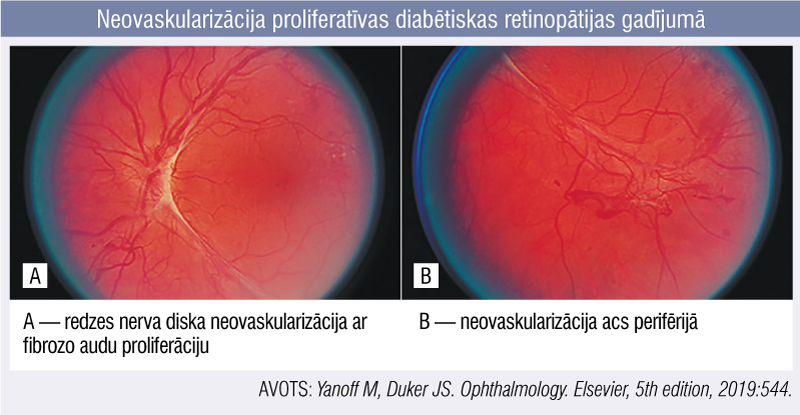

2. attēls
Neovaskularizācija proliferatīvas diabētiskas retinopātijas gadījumā
Savukārt makulas tūska var attīsties jebkurā diabētiskas retinopātijas stadijā, un to var diagnosticēt ar optiskās koherences tomogrāfiju (OCT) (3. attēls). Ja tiek diagnosticēta tīklenes tūska (≤ 500 mikronu attālumā no makulas centra) ar vai bez cietiem eksudātiem vai tīklenes tūska vismaz viena diska laukuma robežās, tā tiek definēta kā klīniski nozīmīga makulas tūska. [4]
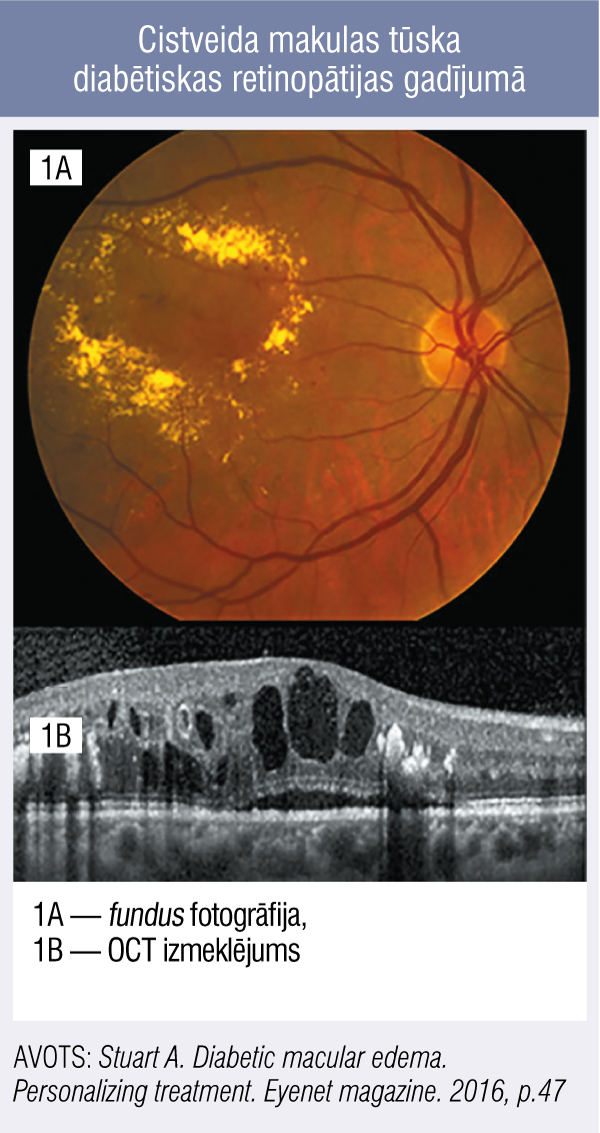

3. attēls
Cistveida makulas tūska diabētiskas retinopātijas gadījumā
Riska faktori
Noteicošais riska faktors diabētiskas retinopātijas attīstībā ir diabēta stāžs. Viskonsīnas Universitātes veiktā epidemioloģiskā pētījumā [5] secināts, ka retinopātijas izplatība grupā ar nepilnu divu gadu stāžu no 23 % pieaug divkārt (57,5 %), ja stāžs ir vairāk par 15 gadiem un terapijā lietoti perorālie pretdiabēta medikamenti.
Savukārt insulīnterapijas lietotājiem ar līdzīgu slimības ilgumu acu komplikācijas no 30 % pieauga līdz 84,5 %. Taču ir arī modificējamie riska faktori:
- hiperglikēmija, [6]
- arteriāla hipertensija, [7]
- dislipidēmija. [8]
Pēc Eiropas Kardioloģijas biedrības (European Society of Cardiology) un Eiropas Diabēta Izpētes asociācijas (European Association for the Study of Diabetes) kopīgi izstrādātām 2019. gada vadlīnijām glikētā hemoglobīna (HbA1c%) mērķis ir zemāks par 7 %, taču jāizvērtē katram individuāli, ņemot vēra diabēta ilgumu, blakusslimības un pacienta vecumu. Arteriālais asinsspiediens pacientiem ar augstāku kardiovaskulāro risku rekomendēts 120––130/70––80 mmHg, taču cilvēkiem, kas vecāki par 65 gadiem, sistoliskais asinsspiediens var būt robežās no 130 līdz 139 mmHg. Lipīdu mērķis: triglicerīdi < 1,7 mmol/l, bet zema blīvuma lipoproteīnu holesterīna (ZBLH) mērķi ir izvērtējami, vadoties pēc kardiovaskulārā (KV) riska pakāpes, respektīvi:
- mērens KV risks –– < 2,6 mmol/l,
- augsts KV risks –– < 1,8 mmol/l un tā samazinājums vismaz par 50 % hipolipidemizējošās terapijas fonā,
- ļoti augsts KV risks –– < 1,4 mmol/l un tā samazinājums vismaz par 50 % hipolipidemizējošās terapijas fonā.
Vizīte pie oftalmologa
Amerikas Oftalmologu akadēmijas [10] rekomendācijās teikts, ka 1. tipa cukura diabēta pacientiem pirmreizējā vizīte pie oftalmologa jāplāno ne ātrāk kā piecus gadus pēc diagnozes atklāšanas, toties 2. tipa cukura diabēta pacientiem uzreiz pēc slimības diagnosticēšanas.
Grūtniecēm (1. un 2. tipa cukura diabēta gadījumā) diabētiska retinopātija var izpausties tieši grūtniecības laikā, un tas tiek skaidrots ar placentas negatīvo hormonālo aktivitāti saistībā ar tīklenes asinsvadiem, ko izraisa paaugstinātais estrogēna, progesterona un cilvēka placentārā laktogēna līmenis. [11] Cilvēka placentārajam laktogēnam jeb cilvēka horioniskajam somatomammotrofīnam ir nozīmīga potenciāla angiogēna loma ne tikai augļa asinsvadu attīstībā, bet arī neovaskularizācijas procesā. Tieši šā iemesla dēļ grūtniecības laikā ir nepieciešama stingra sistemātiska kontrole pie oftalmologa, respektīvi, tūlīt pēc grūtniecības iestāšanās un agrīni pirmā trimestra laikā ar tālāku kontroli ik pēc 3—12 mēnešiem.
Svarīgi uzsvērt, ka viss iepriekš minētais attiecas uz gadījumu, ja pirms grūtniecības fundus oculi nekonstatē izmaiņas. Turpretī, ja grūtniecības laikā sākotnēji tiek diagnosticēta smagas pakāpes neproliferatīva diabētiska retinopātija, tad līdz dzemdībām vizīte pie oftalmologa jāplāno ik pēc 1—3 mēnešiem. Sievietēm, kam diagnosticēts gestācijas diabēts, nav nepieciešama oftalmologa konsultācija, jo risks diabētiskas retinopātijas attīstībai grūtniecības laikā nav palielināts.
Terapija
Amerikas Oftalmologu akadēmijas [10] rekomendētās ārstēšanas metodes šobrīd ir lāzerterapija, anti–VEGF medikamenti intravitreālu injekciju veidā, kortikosteroīdi gan intravitreālu injekciju, gan intravitreālu implantu veidā vai ķirurģiska terapija — vitrektomija, kas apsverama gadījumos, kad ir vitreomakulāra trakcija, persistējošs hemoftalms vai trakcijas tīklenes atslāņošanās.
Lāzerfotokoagulācija (LFK) ir ieteicamā ārstēšanas metode ne–centrālas makulas tūskas gadījumā. Centrālas makulas tūskas gadījumā tūskas izplatība jāizvērtē ar fluorescentās angiogrāfijas palīdzību un atbilstīgi atradei jāizvēlas piemērota ārstēšana, pamatā izmantojot LFK vai anti–VEGF medikamentu intravitreālu ievadi. Augsta riska proliferatīvas diabētiskas retinopātijas gadījumā panretināla fotokoagulācija ir primārā ārstēšanas metode, ja nav sākta terapija ar anti–VEGF. Detalizētas rekomendācijas neproliferatīvas retinopātijas gadījumiem apkopotas tabulā.
![Amerikas Oftalmologu akadēmijas [10] rekomendācijas diabēta pacientiem](https://cdn.doctus.lv/media/2020/07/2/original/2293e18f8cb6.jpg)
![Amerikas Oftalmologu akadēmijas [10] rekomendācijas diabēta pacientiem](https://cdn.doctus.lv/media/2020/07/2/original/2293e18f8cb6.jpg)
Tabula
Amerikas Oftalmologu akadēmijas [10] rekomendācijas diabēta pacientiem
Anti–VEGF medikamenti jeb anti–neovaskularizācijas preparāti
Amerikas Oftalmologu akadēmijas [10] rekomendācijās minēti trīs anti–VEGF preparāti intravitreālu injekciju veikšanai: afliberceptum, ranibizumabum un bevacizumabum. Pēc Latvijas Zāļu reģistra (www.zva.gov.lv) datiem, aflibercepta maksimālā cena Latvijas tirgū ir 1107,43 €, ranibizumaba — 1271,41 €, bet bevacizumaba cenu diapazons svārstās no 340,39 € līdz 1261,93 € (pēc flakona tilpuma). Bevacizumabs, kas nav apstiprināts intravitreālai ievadei, tiek dalīts vairākās devās, un vienas devas cena intravitreālai ievadīšanai Latvijā ir no 120 € līdz 180 €.
ASV Pārtikas un zāļu pārvaldē apstiprināti pirmie divi medikamenti intravitreālu injekciju izmantošanai pretēji bevacizumabam, kas nav apstiprināts, bet tiek izmantots klīniskā praksē visā pasaulē, arī oftalmoloģijas klīnikās Latvijā.
Intravitreālie implanti
ASV Pārtikas un zāļu pārvaldē apstiprināti divi intravitreālie implanti — dexamethasonum (Ozurdex 0,7 mg, Latvijas aptieku tīklos šobrīd nav), kuru darbība ir līdz 6 mēnešiem, un fluocinoloni acetonidum (Iluvien 0,19 mg, Latvijas zāļu tirgū nav) — darbība līdz 36 mēnešiem.
Taču izteikto komplikāciju dēļ (kataraktas progresēšana, paaugstināts intraokulārais spiediens) tie tiek izmantoti kā otrās līnijas medikamenti.
Diabētiska nefropātija
Kā novērst vai aizkavēt diabētiskas nefropātijas attīstību CD pacientam?
Diabētiska nefropātija attīstās 25—40 % pacientu ar cukura diabētu un ir galvenais cēlonis hroniskas nieru slimības attīstībai, kas var būt iemesls nepieciešamībai sākt nieru aizstājterapiju; [3] šādai progresējošai slimības gaitai diemžēl ir vispārzināma slikta prognoze, jo tiek novērots kardiovaskulāro notikumu pieaugums. Tāpēc īpaši svarīgi novērst diabētiskas nefropātijas attīstību. [1; 2]
Agrīni diagnosticējot pacientus ar cukura diabētu, apzināt augsta riska grupas pacientus diabētiskas nefropātijas attīstībai ir vitāli nepieciešams, lai būtu iespējams mazināt diabētiskas nefropātijas radītās komplikācijas un labākajā gadījumā pat novērst tās attīstību. [3]
Lai spētu nodrošināt adekvātu homeostāzi, DN agrīnajā fāzē novēro glomerulāro hiperfiltrāciju. Nieres sekretē intrarenālus vazoaktīvus hormonus, kā prostaglandīnu E2, kas pārsvarā dilatē aferentās arteriolas, un citus hormonus, kā angiotensīnu un kateholamīnus, kuri sašaurina eferentās arteriolas. Šis process pakāpeniski izraisa turpmāku glomerulu zudumu, proteīnūriju, glomerulu un interstīcija sklerozi, kas rezultējas ar hronisku nieru mazspēju. [3]
DN komplikācijas var attīstīties pakāpeniski mēnešu vai gadu laikā, un tās var būt:
- šķidruma aizture, kas var izraisīt
- perifēru tūsku, arteriālu hipertensiju,
- vai plaušu tūsku,
- hiperkaliēmija,
- kardiovaskulāra slimība ar iespējamu
- insultu,
- progresējoša diabētiska retinopātija,
- anēmija,
- pēdu čūlas, erektila disfunkcija, caureja un citas ar nervu un asinsvadu bojājumu saistītas problēmas,
- grūtniecības komplikācijas ar riskiem mātei un auglim,
- neatgriezeniskas izmaiņas nierēs (termināla nieru mazspēja) ar dialīzes vai nieres transplantācijas nepieciešamību.
Diabētiskas nefropātijas attīstības novēršanas pamatā ir zināmo riska faktoru — arteriālas hipertensijas, hiperglikēmijas, aktivētas nieru renīna—angiotensīna sistēmas (RAS), smēķēšanas un dislipidēmijas — sekmīga ārstēšana. [3; 4]
Asinsspiediena un glikēmijas normalizēšanā svarīgs ir veselīgs dzīvesveids un smēķēšanas atmešana, holesterīna līmeni pazeminoša terapija ar statīnu grupas medikamentiem, jo lielākajai daļai pacientu ar diabētisku nefropātiju ir palielināts risks kardiovaskulāro slimību attīstībai. [5]
Interesanti, ka jau embrioģenēzes periodā hiperglikēmijas dēļ samazinās nefronu skaits, tāpēc sekmīga glikēmijas kontrole grūtniecības laikā var novērst nieru bojājumu nākotnē. [3]
Mikroalbuminūrija
Viens no pirmajiem marķieriem diabētiskas nefropātijas attīstībā ir mikroalbuminūrija, kas liecina par nieru un ģeneralizētu endotēlija bojājumu, kurš var rezultēties progresējošā diabētiskā nefropātijā un iespējamā kardiovaskulārā slimībā. [3; 4]
Lai novērstu mikroalbuminūrijas attīstību, nepieciešama sekmīga glikēmijas kontrole, kas ietver HbA1c < 7 % (glikēmijas mērķus piemērojot pacientam individuāli), kā arī arteriālā asinsspiediena pazemināšana, izmantojot RAS blokādi ar angiotensīnu konvertējošo enzīmu inhibitoriem (AKEi) vai ar angiotensīna receptoru II blokatoriem (ARB) līdz < 125—130/80 mmHg. [3; 4; 6; 7]
Iepriekš bija zināms, ka tiazolidīndionu grupas preparāti, ko lieto 2. tipa cukura diabēta ārstēšanā, kā peroksisomas proliferatoru aktivēto receptoru agonisti (PPARs) līdztekus glikēmijas kontrolei nodrošina aizsardzību pret diabētiskas nefropātijas attīstību. [8]
Šobrīd liela nozīme diabētiskas nefropātijas attīstības bremzēšanā ir SGLT2 inhibitoriem, kas ievērojami ietekmē gan kardiovaskulāru slimību, gan hroniskas nieru slimības attīstību, īpaši pacientiem jau ar pieaugošu albuminūriju.
Pacientiem ar samazinātu nieru funkciju kā alternatīva ieteikta to GLP1 receptoru agonistu pievienošana terapijā, kam ir pierādīts izteikts ieguvums nieru un kardiovaskulāro slimību iznākumā. [11]