Aptaukošanās ir aktuāla mūsdienu veselības problēmu ar tendenci vērsties plašumā. Būtībā diētu var kontrolēt, regulāri trenēties – it kā jā; bet ir taču daudz vienkāršāk – tablete/divas tabletes dienā, tālāk vairs nav jādomā un jāpūlas! Tomēr viss nav tik vienkārši. Un efektivitātes ziņā nepavisam ne. Apetīti mazinošās zāles ir medikamenti, kas jālieto ārsta vai farmaceita uzraudzībā (vismaz ārzemēs farmaceiti to dara). Vēsture ir bagāta ar piemēriem, kas notiek, kad cilvēks to dara vieglprātīgi un nekontrolēti. Šajā rakstā īsumā par to, kā cilvēkam veidojas izsalkuma un sāta sajūta, kas par to atbild un kādi ir apetīti mazinošie medikamenti.
Indikācijas
Ķermeņa masu regulējošo medikamentu grupas galvenā indikācija ir ķermeņa svara samazināšana. Pasaulē un īpaši Rietumos aptaukošanās problēma sasniegusi gandrīz epidēmijas līmeni: ASV tādu cilvēku ir 33%, Meksikā 24%, Lielbritānijā 24%, Austrālijā 24,5% (Latvijā skaitļi pagaidām nav tik šausminoši - ap 13%). Taču šiem procentiem ir tendence ik gadu pieaugt. Pēc svara samazināšanas ārstēšanas algoritmiem terapija ar medikamentiem iesakāma, ja ķermeņa masas indekss (ĶMI) ir virs 30 kg/m2. Tos iesaka arī tad, ja ĶMI ir virs 27kg/m2 un kad ir ar aptaukošanos saistītas papildu slimības. Protams, ja nav līdzējušas pārējās metodes (mazkalorāžas diēta, vairāk fizisko aktivitāšu, psiholoģiska apmācība), var mēģināt terapiju ar medikamentiem. Apetītes nomācējus reti kad izmanto atsevišķi, tie vairāk uzskatāmi par papildu terapiju. ĶMI uzturēšana normas robežās svarīga ir tāpēc, ka palīdz izvairīties no daudzām slimībām (gremošanas, kardiovaskulārām slimībām, cukura diabēta un dažādiem vēža veidiem). [1; 2]
Ieskats vēsturē
Vēlme mazināt ķermeņa svaru un farmakoloģisku savienojumu lietošanas sākums iestiepjas XIX gs. beigās, kad šādā nolūkā izmantoja vairogdziedzera ekstraktu. Lai iegūtu vēlamo efektu, ekstrakts bija jālieto lielās devās, tāpēc bieži radās hipertireoze ar kataboliskām sekām uz kauliem, muskuļiem un sirdi. 1933. gadā parādījās dinitrofenols, bet drīz vien, kad vairākiem dinitrofenolu lietojušiem pacientiem attīstījās neiropātijas un katarakta, tā lietošana tika pārtraukta. 1887. gadā Vācijā no efedras krūma tika sintezēts amfetamīns, bet sākumā par tā iedarbību uz cilvēka "ēšanas īpatnībām" nezināja. 1937. gadā amfetamīna kā apetītes nomācēja ieviešanu ASV pavadīja daudzsološi pozitīvie rezultāti. Un tiešām - apetīti amfetamīns kavēja lieliski, taču pēc kāda laika pacientam nekas cits, izņemot amfetamīnu, vairs arī nebija vajadzīgs. Izrādījās, ka tā ir spēcīga atkarību izraisoša viela, kas sagandēja dzīvi tūkstošiem lietotāju. Farmakoloģiski amfetamīns ir spēcīgs psihostimulators, kas darbojas uz smadzeņu atalgojuma sistēmu. Tiek izjaukta kateholamīnu, īpaši noradrenalīna un dopamīna, endogēna cirkulācija, tāpēc palielinās to daudzums. Aktivējas simpatiskā nervu sistēma, kas, aktivēdama β adrenoreceptorus, samazina apetīti un palielina enerģijas patēriņu. Turklāt amfetamīns kavē oreksigēna neiropeptīda Y darbību. Aktivēta atalgojuma sistēma dod ātrāku baudu, tāpēc ātrāk veidojas sāta sajūta. Apetītes mazināšanas labad izmantoja arī citus amfetamīnus, bet sekas bija vairāk vai mazāk līdzīgas.
1967. gadā uzvirmoja skandāli ar digitalis preparātu, diurētiķu izraisītiem nāves gadījumiem. 1971. gadā pēc vairākiem pulmonālās hipertensijas gadījumiem no tirgus izņēma aminorex preparātu. Pozitīvais iznākums lietai ar amfetamīnu - tas deva sākumu jaunai medikamentu grupai, proti, apetītes nomācējiem, kas darbojas līdzīgi amfetamīnam, bet tiem ir mazāk blakusparādību un ievērojami mazāks atkarības risks. Taču neilgā lietošanas pieredze un fakts, ka cits pēc cita tie tiek izņemti no tirgus, liek domāt, ka tomēr tie nav tik labi, kā šķita sākumā. [3; 4]
Ilglaicīga un īslaicīga apetītes regulācija
Cik, kad un kas jāēd, mums pasaka sāts un izsalkums. To regulē centri smadzenēs. Izšķir barošanas centru (laterālā hipotalāma areāla kodoli, LHA), sāta centru (ventromediālie hipotalāma kodoli, VMH), kā arī paraventrikulāros, dorsomediālos un nucleus arcuatus kodolus, kas arī ir svarīgi izsalkuma/sāta regulācijā. Hipotalāms saņem milzīgi daudz informācijas no nervus vagus, no kuņģa-zarnu trakta ķīmiskajiem mediatoriem, hormoniem, informāciju par barības vielu sastāvu asinīs (glikozi, aminoskābēm un taukskābēm) un no sensorās sistēmas - ožas, garšas, redzes signālus. Tas viss jāapkopo, un noteiktā laika posmā mums veidojas barības uzņemšanas īpatnības, ieradumi. Ir vairāku veidu substances (hormoni, neiromediatori, peptīdi), kas darbojas vai nu anoreksigēni (samazina ēstgribu), vai oreksigēni (palielina apetīti). Anoreksigēna iedarbība ir somatostatīnam, leptīnam, adiponektīnam insulīnam, amilīnam, holecistokinīnam, bombezīnam, serotonīnam, bet oreksigēna - steroīdiem megestrolam, medroksiprogesteronam, grelīnam, galanīnam, oreksīnam, neiropeptīdam Y; vēl citu vielu īpašības tiek pētītas. [3; 5]
Enerģijas uzkrāšana
Tauki ir galvenais enerģijas uzkrājumu veids mūsu ķermenī - 75 kg smagam pieaugušajam tauki veido vidēji 15% no viņa masas, kas ir ap 5,5 × 105 kJ. Daudz mazāka enerģijas resursu daļa ir ogļhidrāti (glikogēns), kas atrodas aknās un skeleta muskuļos. Turklāt tie ir uzreiz pieejamie resursi un tos izmanto pirmos, bet taukus izmanto vēlāk. Taukaudu (ķermeņa enerģijas rezerves) masas regulācija ir ļoti precīzs un ilgstošs process, jo bioloģiskos apstākļos ķermeņa taukaudu masu mēnešiem un gadiem tas spēj uzturēt < 1% robežās. Ir divas neironu grupas hipotalāma nucleus arcuatus, kuru darbība ir cieši saistīta, bet ar pretēju efektu:
- proopiomelanokortīna (POMC) neironi un kokaīnu un amfetamīnu regulējamā transkripta (CART) peptīds. Šo neironu aktivēšana izraisa oreksigēno, bet kavēšana - anoreksigēno efektu. Viena no vielām, kas darbojas uz šiem neironiem, ir leptīns (gr. leptos - plāns), ko producē ķermeņa tauku šūnas. Leptīns atbild par ilglaicīgo ķermeņa tauku masas regulāciju, jo, pieaugot tauku masai, palielinās arī leptīna daudzums, kas caur hormonu α-MSH (caur MCR-3/MCR-4 receptoriem) aktivē POMC/CART neironus:
o veidojas anoreksigēnais efekts - samazinās barības uzņemšana;
o caur paracentrikulāriem kodoliem tiek aktivēts NTS (nucleus tractus solitarius), kas palielina simpatiskās nervu sistēmās aktivitāti (noradrenalīns), palielinās enerģijas patēriņš un termoģenēze;
o pašos paraventrikulārajos kodolos ir hormoni oksitocīns, CRH (kortikotropīna atbrīvotājhormons), TSH (tireotropīna atbrīvotajhormons), kuri stimulē ķermeņa metabolismu, proti, veicina katabolismu un kavē anabolismu;
- otra neironu grupa ir NPY (neironpeptīdsY) un AgRP (Agouti radniecīgs peptīds): tos aktivējot, novērojams oreksigēnais efekts. Mehānisms nav īsti skaidrs, bet domājams, ka caur Y1-Y5 receptoriem NPY/AgRP neironi aktivē LHA neironus, kas izdala peptīdus oreksīnu un MCH (melanīnu koncentrējošo hormonu). Iedarbība ir pretēja POMC/CART neironu sistēmas efektam. [6; 7]
Lai gan taukaudu masas regulācija ir saistīta ar barības uzņemšanas regulāciju, starp tām ir atšķirības. Ilglaicīga regulācija vajadzīga, lai uzturētu pastāvīgu ķermeņa masu un enerģijas rezerves, bet īslaicīga - lai pasargātu no pārēšanās. Šie mehānismi ir interesanti (kā gan cilvēkam top skaidrs, ka ēšana jāpārtrauc, kad jāatsāk un cik daudz vispār jāēd?), bet nav precīzi, jo mēs uzreiz nepamanām, kā mainās ķermenis un cik īsti enerģijas nepieciešams.
Kas veicina liekās ķermeņa masas veidošanos?
Ja organisms barības uzņemšanas regulācijā ir tik gudrs, tad kāpēc apkārt ir tik daudz adipozu cilvēku? Kas veicina liekas tauku masas veidošanos? Zinātnieki jau sen noskaidrojuši un pierādījuši, ka lieka ķermeņa masa rada kaitējumu veselībai, tad kāpēc pats ķermenis no tās nevairās? Jautājums ir ne tikai par mūsdienu ar kalorijām bagāto uzturu un skrejošo dzīves ritmu, bet arī par psiholoģisko uzvedību ēdiena uzņemšanā, uztura kultūru, uztura vieglo pieejamību un daudziem citiem aspektiem. Visi sensorie stimuli (informācija no maņu orgāniem, mehāniskie un ķīmiskie kuņģa-zarnu trakta kairinājumi) tiek analizēti viscerāli sensorajā garozā (insula un infralimbiskajā garozā). Tātad viscerālajā garozā formulējas galīgā atbilde, kas un cik jāēd. Tomēr arī šajā situācijā (līdzīgi kā ar narkotikām) mums par spīti kalpo smadzeņu atalgojuma sistēma, ko veido mezolimbiskais trakts, nucelus accumbens, prefrontālā garoza, VTA (ventral tegmental area). Galvenais mediators šeit ir dopamīns, kas darbojas caur D1 un D2 receptoriem. Un atalgojuma sistēma var ignorēt ķermeņa tauku masas un barības uzņemšanas homeostāzi un, darbojoties uz viscerālo garozu, mainīt izsalkuma/sāta sajūtu. Tas īstenojas caur nucleus accumbens, kas ir reciproki saistīts ar LHA. Mezolimbiskā sistēma aktivē ucleus accumbens un, kavējot GABA erģiskos neironus/aktivējot MSH neironus, aktivē LHA neironus, stimulējot barības uzņemšanu un anabolismu. Tādi pastiprinoši signāli kā garšīga smarža, labs izskats un garša var pārspēt smadzeņu regulējamos homeostatiskos procesus. Mums pietiek iztēloties/atcerēties kādu garšīgu ēdienu, un dopamīnerģiskā atalgojuma sistēma sāks darboties. Nav tā, ka viena sistēma vienkārši pārspēj otru vai pretēji, jo abas sistēmas - homeostatiskā un ne-homeostatiskā (atalgojuma) - ir noteiktā līdzsvarā, bet, tam izjūkot, attīstās ēšanas traucējumi, kas veicina arī aptaukošanos. Vēl ir t.s. nosacītā (kondicionālā) uztura uzņemšana. Mēs dzīvojam sociālā vidē, ēdam ne vien mājās, bet arī restorānos, tāpēc ir arī sociālie stimuli: noteikts maltītes laiks, vides faktori (trauku šķindoņa, barības daudzums). Iespējams, ka šiem faktoriem ikdienā ir lielāka nozīme nekā fizioloģiskajiem. [6; 7]
Medikamenti, kas var ietekmēt svaru
Galvas smadzenēs neironi savstarpēji sazinās ar neiromediatoru palīdzību. Tos farmakoloģiski inhibējot vai stimulējot, tiek iegūti dažādi fizioloģiskie efekti, arī apetītes stimulācija/nomākums. Galvenie monoamīnu neiromediatori, kas piedalās apetītes regulēšanā, ir noradrenalīns, serotonīns un dopamīns.
Vielas, kas iedarbojas uz noradrenalīna metabolismu
Noradrenalīns ir selektīvs pret α1 un α2, mazāk selektīvs pret β3 un vēl mazāk pret β1 un β2 receptoriem. Neiromediatora iedarbība uz α1 receptoriem PVH (PVN nucleus parventricularis) samazina apetīti; to apstiprina dati, ka adrenerģiski receptoru agonisti, kā fenilpropanolamīns un metaraminols, samazina apetīti. Šo efektu var bloķēt, ievadot α1 antagonistus terazosīnu/doksazosīnu. Noradrenalīnu injicējot hipotalāmā, panākama apetītes stimulācija. α2 receptoru stimulācija izraisa apetītes palielināšanos, to pierādījuši eksperimentu rezultāti ar dzīvniekiem, ar α2 agonistu klonidīnu. Klonidīna efektu var bloķēt ar α2 antagonistiem - johimbīnu un idazoksānu, lai gan ne klonidīnam, ne johimbīnam pētījumos ar cilvēkiem apetītes regulācijai lielas nozīmes nebija. β2 receptoru stimulācija prefornikālajā zonā samazina barības uzņemšanu, tāds efekts ir β receptoru agonistiem salbutamolam un klenbuterolam. Līdzīgi ir arī ar β3 receptoriem. Tātad var secināt, ka vai nu noradrenalīnam atsevišķi nav pietiekami izteiktas iedarbības uz apetītes regulāciju, vai tas ir ļoti atkarīgs no tā, uz kuru vietu CNS tas iedarbojas. Noradreneģiski medikamenti: fentermīns, dietilpropions, fendimetrazīns, benzfetamīns, fenilpropanolamīns, mazindols. Fentermīns, kas strukturāli līdzīgs amfetamīnam, ir viens no pirmajiem apetīti samazinošajiem medikamentiem, kas stimulē arī serotonīna un dopamīna izdali. Bija agrāk populāra preparāta Fen-Phen (kopā ar fenfluramīnu) sastāvā. 1997. gadā ASV preparāts skandalozi tika atsaukts no tirgus, kad apstiprinājās, ka Fen-Phen izraisa mitrālā/aortālā vārstuļu defektus un pulmonālo hipertensiju. Ražotājiem prāvas izmaksas pārsniedza 14 miljardu dolāru. Šīs grupas medikamenti tieši stimulē noradrenalīna un citu neiromediatoru izdalīšanos no nervu galotnēm LHA hipotalāmā (barošanas centrā), kas mākslīgi rada sāta sajūtu. Otrais mehānisms - kavē noradrenalīna atpakaļsaisti. No visiem šīs grupas medikamentiem tikai dažiem efektivitātes un drošuma klīniskie pētījumi ilguši 6 mēnešus vai mazliet ilgāk, tāpēc tie paredzēti terapijas kursam, kas ilgt ne vairāk par 12 nedēļām. Ir novērotas vairākas blaknes: bezmiegs, eiforija, sirds palpitācijas, aizcietējumi, hipertensija. Kontrindicēti pacientiem ar arteriālo hipertensiju, kardiovaskulārām slimībām, hipertireoīdismu, glaukomu. Lai gan klīniskie dati liecina par labu rezultātu, grūti iedomāties adipozu pacientu bez paaugstināta asinsspiediena vai bez kādas no sirds-asinsvadu sistēmas slimībām. Pirms terapijas kursa rūpīgi būtu jāizvērtē ieguvumu/riska attiecība un jāpadomā par alternatīvām. [3; 4]
Vielas, kas iedarbojas uz serotonīna metabolismu
Serotonīna receptoru saime ir plaša, izšķir 5-HT1-5HT7 apakštipu. Serotonīna agonisti (kvipazīns, metahlorofenilpiperazīns (mcPP) un d-norfenfluramīns) samazina barības uzņemšanu, tos injicējot uz PVN. 5-HT1A receptora, kas atrodas nucleus raphe dorsalis, stimulācija nozīmīgi palielina apetīti. Ievadot flesinoksānu, 5-HT1A agonistu, žurkām palielinās apetīte un palielinās NPY daudzums PVN un nucleus arcuatus kodolos. Taču ilgstoša šo receptoru stimulācija apetīti vairs neietekmē. Lielāka nozīme ir postsinaptiskiem 5-HT1B receptoriem; eksperimentos tika panākta samazināta barības uzņemšana un NPY daudzums PVN, ievadot 5-HT1B/2C agonistu metahlorofenilpiperazīnu 7 dienas 10 mg/kg. Arī 5-HT2C receptori regulē barības uzņemšanu. Serotonīnerģiski medikamenti, kas inhibē serotonīna atpakaļsaisti un pastiprina to izdali, ir fenfluramīns un deksfenfluramīns. Pēc jau minētā skandāla 1997. gadā abi tika atsaukti no tirgus.
Pie selektīviem serotonīna atpakaļsaistes inhibitoriem pieder arī slavenais fluoksetīns. Pētījumā (ar 60 mg devu) pierādīts, ka pirmajos sešos mēnešos pacientiem svars samazinās vairāk nekā placebo lietotājiem, bet nākamajos sešos mēnešos atkal pieaug. Arī pētījumā par sertralīnu kā papildu terapijas veidu mazkaloriju diētai tika iegūti līdzīgi rezultāti, kas norāda uz ilglaicīgas efektivitātes trūkumu.
Metergolīns, plaša spektra 5-HT receptoru inhibitors, fluoksetīna un sertralīna efektu uz apetīti nemazināja, kas liek domāt, ka apetītes regulēšanā šie SSRI darbojas citādi. Visjaunākais apstiprinātais apetītes nomācējs ir lorkaserīns. Uz serotonīn-erģisko sistēmu tas iedarbojas arī kā selektīvs 5-HT2c agonists; tālākais darbības mehānisms, iespējams, saistīts ar POMC sistēmas aktivāciju, kas nomāc apetīti/paildzina sāta sajūtu. Lorkaserīns indicējams pacientiem ar ĶMI > 30 kg/m2 vai pacientiem ar ĶMI > 27 kg/m2, kuriem ir vēl vismaz viena ar virssvaru saistīta veselības problēma (arteriālā hipertensija, cukura diabēts u.c.). [3; 4; 8; 9]
Noradrenalīnerģiski serotonīnerģiski medikamenti
Sibutramīns
Pretēji fenfluramīnam un deksfenfluramīnam sibutramīns ir serotonīna un nor-adrenalīna atpakaļsaistes inhibitors, bet serotonīna izdali neveicina. Sešus mēnešus ilgā pētījumā pacientiem (mazkaloriju diēta kopā ar sibutramīnu) svara samazinājums bija 5-8% (placebo grupā tikai 1-4%). Vēl sibutramīna grupā novērots, ka svara samazinājums saglabājas ilgāk par gadu. Sibutr-amīna blakusefekti saistīti ar simpatiskās nervu sistēmas stimulāciju: asinsspiediena paaugstināšanās, sirdsdarbības frekvences palielināšanās, sausa mute, galvassāpes, bezmiegs. Bez svaru mazinošās iedarbības tas uzlaboja arī citus metaboliskos riska faktorus: hiperlipidēmiju, hiperurikēmiju, glikozi un plazmas insulīnu. Tomēr 2010. gadā FDA paziņoja, ka sibutramīns no tirgus tiek atsaukts, jo dati liecinot par augstāku insulta un miokarda infarkta riska līmeni - sibutramīns šo risku palielina par 16%. [3; 10]
Dopamīns
Ir zināmi vismaz 5 D receptoru apakštipi: D1-D5: D1 ir līdzīgs D5, bet D2 ir līdzīgs D3 un D4. Medikamenti, kas iedarbojas uz dopamīna receptoriem, vairāk saistīti ar garastāvokļa izmaiņām. Agonistu iedarbība uz dažādiem receptoriem ir mazliet atšķirīga. D1/D5 agonisti samazina barības uzņemšanu, laika posmus starp ēdienreizēm padarot garākus (apomorfīns). D2 grupas agonisti samazina ēšanas ātrumu. Sulpirīds, D1 receptoru antagonists, palielina barības uzņemšanu. Pētījumos ar bromokriptīnu, selektīvu D2 agonistu, tika iegūti rezultāti, ka bromokriptīns samazina zemādas tauku slāni un kopējo ķermeņa masu, salīdzinot ar placebo. Kā apetīti mazinošu līdzekli to nelieto.
Histamīns
CNS histamīna receptori arī modulē apetītes sajūtu; H3 ir autoreceptori un hist-amīns pats kavē histamīna izdalīšanos no nervu galiem. H3 antagonists bloķē šos autoreceptorus, izdalās vairāk histamīna, tāpēc palielinās barības uzņemšana. H1 receptoru antagonists hlorfeniramīns izraisa pretēju efektu; turklāt H1 antagonista ievade uz PVN/VMH samazina apetīti. Divos pētījumos ar H2 antagonistu cimetidīnu tika iegūti pretēji rezultāti, līdz ar to H2 receptoru nozīme apetītes regulēšanā vēl nav zināma. [3] Psihiatrijā viena no biežākajām neiroleptiķu blaknēm ir svara pieaugums. No atipiskiem antipsihotiskajiem līdzekļiem vislielāko svara pieaugumu rada klozapīns un olanzapīns, bet no tipiskiem - hlorpromazīns, tioridazīns un mezoridazīns, lai gan lielākā vai mazākā mērā visi šīs grupas medikamenti izraisa pieaugumu. Šīs blakusparādības mehānisms nav noskaidrots; hipotēzes to mēģina skaidrot ar serotonīnerģisku, adrenerģisku, histamīnerģisku, glutamāterģisku, antiholīnerģisku receptoru stimulāciju, estrogēna testosterona disbalansu, insulīna, leptīna efektu. Algoritmos svara pieauguma ārstēšanai, ko radījuši neiroleptiķi, bez nosauktajiem apetītes nomācējiem vēl izmanto topiramātu, amantadīnu, H2 blokatorus nizatidīnu, famotidīnu un cimetidīnu, metformīnu, reboksetīnu, naltreksonu, bet par šo medikamentu lietošanu drošu datu nav. [11]
Pirmā tipa kanabinoīdu receptoru aktivācija stimulē apetīti, tāpēc tiem, kas smēķē marihuānu, pēc tam tik ļoti gribas ēst. Rimonabants ir selektīvs CB1 receptoru bloķētājs. Taču vispār rimonabants tika izgudrots ar domu, lai palīdzētu atmest smēķēšanu, bet pierādījumu trūkuma dēļ EMA un FDA noraidīja tā apstiprināšanu. Pēc tam medikaments tika apstiprināts Eiropā kā svaru mazinošs līdzeklis, tiesa, uz neilgu laiku. Paaugstināta pašnāvības, depresijas un citu psihiatrisku problēmu riska līmeņa dēļ 2009. gada sākumā rimonabants tika izņemts no apgrozības. [12]
Medikamenti, kas maina metabolismu
Barības vielas mūsu organismā var uzsūkties tikai iepriekš sašķeltā stāvoklī. Šo procesu nodrošina "ķīmijas laboratorija" gremošanas traktā, kur attiecīgos apstākļos (temperatūra un pH) lielmolekulārie veidojumi tiek šķelti līdz glikozei, aminoskābēm un taukskābēm. To veic enzīmi, bet enzīmu iedarbību var bloķēt.
Orlistats
Orlistats ir baktērijas Streptococcus toxytricini hidrogenizēts lipstatīna derivāts. Tā ir izteikti lipofila substance, kas var spēcīgi kavēt zīdītāju fermentu lipāzi. Gremošanas laikā lipāze divpadsmitpirkstu zarnā žults skābju klātbūtnē saistās pie lipīdu triglicerīdiem. Saistīšanās momentā atveras lipāzes aktīvais centrs, pievienojas orlistats un neatgriezeniski inhibē šo centru. Šis medikaments ir selektīvs, jo neinhibē pārējos gremošanas enzīmus, piemēram, hidrolāzi, aizkuņģa dziedzera fosfolipāzi A2, acetilholīnesterāzi, nespecifisko aknu karboksiesterāzi un citus. Orlistats par 30% samazina tauku absorbciju, līdz ar to mazinās uzņemto kaloriju daudzums. Klīniskie pētījumi apstiprina medikamenta efektivitāti un diezgan labu panesību. Deviņu klīnisko pētījumu dati (1993.-1999. gadā) liecina, ka orlistatu lietojušie pacienti, salīdzinot ar placebo, zaudējuši par 0,63-5,8 kg vairāk svara. Orlistatam ir labi rādītāji arī svara atgūšanas ziņā ("jo-jo efekts"), ko parasti pieredz pēc striktākas diētas vai apetītes nomācēju lietošanas. Pētījuma otrajā gadā placebo grupā svaru atguva 62,4%, bet orlistata grupā 35,2% pacientu (starpību 2,5 kg). Turklāt ilgtermiņa pētījumi rāda, ka pacientiem stabilizējās diastoliskais asinsspiediens, samazinājās kopējais un ZBL holesterīns, insulīna daudzums tukšā dūšā. Pozitīvi rezultāti slimniekiem ar 2. tipa cukura diabētu: uzlabojas glikolizētā hemoglobīna rādītāji, samazinās nepieciešamība pēc sulfanil-urīnvielas grupas medikamentiem. Orlistata blakusiedarbība saistīta ar aizkuņģa dziedzera lipāzes inhibīciju - zarnu borborigmi, meteorisms (24%), vēdergraizes, steatoreja, pusšķidras fēces (13%), taukainas fēces (31%), palielināta defekācijas tieksme (22%), fēču nesaturēšana (8%). [13] Medikaments, kavēdams tauku rezorbciju, kavē arī taukos šķīstošo vitamīnu (īpaši D vitamīna) un pamata taukskābju rezorbciju; šā deficīta novēršanas labad 2 stundas pēc orlistata lietošanas iesaka lietot multivitamīnu preparātus. Medikaments mijiedarbojas ar imunitātes nomācēju ciklosporīnu. [3; 4; 13]
Amilāzes inhibitori
Amilāze ir enzīms, kas šķeļ ogļhidrātus, tātad amilāzes inhibitori traucēs ogļhidrātu rezorbciju. 1980. gadu sākumā bija šādi līdzekļi, bet vēlāk noskaidrojās, ka nekādas iedarbības uz ogļhidrātu šķelšanu/uzsūkšanos tiem nav. Tomēr ieinteresētība ogļhidrātu metabolismā nemazinājās; zinātnieki pētīja akarbozi (1979. gadā) 2. tipa cukura diabēta ārstēšanai, bet ieguva vien nenozīmīgu ķermeņa masas samazināšanos. Tad izdomāja ķīmiski modificēt saharozi - acetilēt to ar taukskābēm; šādu savienojumu aizkuņģa dziedzera lipāze sašķelt nevar. Doma sākumā šķita brīnišķīga, olestru varēja atrast daudzu uzkodu sastāvā. Bet tauku rezorbcijas mazināšanās dēļ cilvēki maltītes beigās jutās mazāk apmierināti un nākamajā dienā kompensēja to ar lielāku uztura patēriņu. Lai gan pētījuma rezultāti rāda, ka svara samazinājums trīs mēnešos ir 5 kg, olestrai vēl nav bijuši ilgtermiņa pētījumi efektivitātes un drošuma ziņā. [3]
Metformīns
Vismaz sešu pētījumu rezultāti apstiprināja metformīna pārākumu pār citiem per-orālajiem glikozes līmeni regulējošiem medikamentiem (galvenokārt sulfanilurīnvielu) 2. tipa cukura diabēta pacientiem ķermeņa masas samazināšanas ziņā. Metformīns, ja nav individuālas nepanesības, ir pirmās izvēles preparāts 2. tipa cukura diabēta medikamentozai terapijai. Grūti pateikt, vai tāpēc, ka bieži vien ar metformīna terapiju nepietiek, vai tāpēc, ka pacientiem ir attīstījušies metabolisma traucējumi, vairākumam 2. tipa cukura diabēta pacientu svars turpina palielināties. Vēl pētīti citi savienojumi: glikozes metabolīts piruvāts, hroma pikolināts, cilvēka hCG, androgēni dehidroepiandrosterons, testosterons. [3; 4; 12]
Tauku slānis mums kalpo ne vien kā barības vielu rezerve, bet ir svarīgs termoģenēzes procesā. Un šeit nozīme ir vairogdziedzerim. Jau minēts, ka ļaudis pirms vairāk nekā simt gadiem lietoja vairogdziedzera ekstraktu. Tādas vielas kā efedrīns, kofeīns, β3 agonisti stimulē termoģenēzi un lipolīzi; ilgtermiņa pētījumu par šiem medikamentiem nav.
Vielas, kas rada kuņģa iestiepumu
Tautā par ēšanu un ar to saistītām lietām ir daudz joku un izteicienu, visbiežāk asociācijas saistītas ar kuņģi. Mēdz teikt: "man ir pilns kuņģis", "tukšs kuņģis" u.tml. Kuņģis pieder dobajiem orgāniem, ēšanas laikā tas uzpildās ar barību, kas rada iestiepumu. Šo iestiepuma sajūtu uz smadzenēm pārvada klejotājnervs (nervus vagus), veidojas sāta sajūta un signāli, ka ēšana jāpārtrauc. Un pretēji - ja kuņģis ir tukšs, iestiepuma nav, veidojas ēstgribas sajūta. Ne velti viena no efektīvākajām aptaukošanās ārstēšanas metodēm ir mākslīga kuņģa sienas iestiepuma radīšana. Gastrofibroskopiski kuņģī tiek ievietots silikona balons, ko no ārpuses piepilda ar sterilu fizioloģisku šķīdumu; balons iestiepj kuņģa sienu - smadzenēm tiek paziņots, ka tas ir pilns, tālab pat pēc nelielas maltītes cilvēkam vairs negribas ēst. Pēc līdzīga principa darbojas arī kuņģa gredzens. Šo principu zināja jau agrāk, kad vēl nebija modernu ķirurģisku metožu, un tādam nolūkam izmantoja uzbriestošas vielas. Tās visbiežāk ir gļotas veidojošas vielas - polisaharīdi, kas ūdenī un fizioloģiskos ķermeņa šķidrumos uzbriest, to tilpums palielinās, radot iestiepuma sajūtu. Paši polisaharīdi nav sagremojami un papildu kalorijas nedod. Piemēri: metilceluloze, guāra sveķi, Karaja sveķi, glukomanāns (hemiceluloze) un citi. Cilvēki, kas iepērkas interneta veikalos, jābrīdina, ka lielākoties dārgu un plaši reklamētu uztura bagātinātāju sastāvā visbiežāk ir tikai polisaharīdi un uzbriestošas vielas, gļotas formējoši līdzekļi, piemēram, no smilts ceļtekas (Plantago psyllium) un citiem augiem. [14]
Citas apetīti mazinošas un ķermeņa masu regulējošas vielas
Uztura bagātinātāji
Problēmu, kas saistītas ar palielinātu ķermeņa masu, risinājumu tirgus ir milzīgs. Piedāvājumā ir dažādi augu, dzīvnieku ekstrakti, tautas un netradicionālās medicīnas līdzekļi, TCM (traditional Chinese medicine), ājurvēdas zāles. Populārākie līdzekļi apkopoti tabulā. Šo sarakstu varētu turpināt - aptieku plaukti vai lūst no uztura bagātinātājiem; vēl arī ābolu sidra etiķis, konjugēta linolskābe (CLA), rūgtā apelsīna ekstrakts (sinefrīns), safrāns utt. [8]
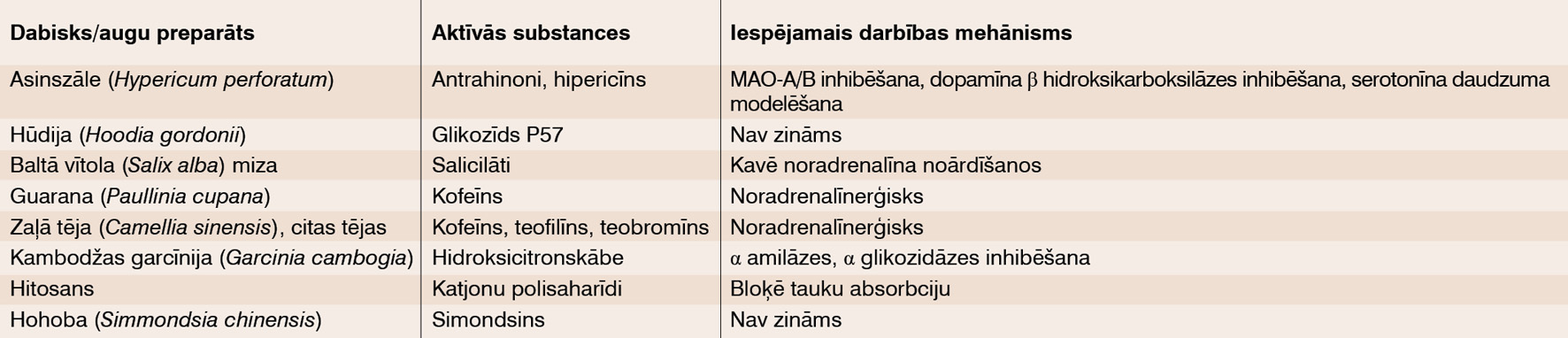

Tabula
Dabiskie preparāti/augu preparāti ķermeņa svara samazināšanai
No augiem dažus vērts aplūkot uzmanīgāk. Hūdija (Hoodia gordonii) ir sukulents, kas aug Dienvidāfrikas tuksnešos. Auga īpašību kavēt apetīti un slāpju sajūtu vietējie mednieki zinājuši jau sen. Pieaugot interesei par apetītes nomācējiem, zinātnieki sāka pētīt šo kaktusam līdzīgo augu. 1977. gadā izdalīja vielu P57, kas pēc ķīmiskās uzbūves ir glikozīds ar steroīdu struktūru. Pētījumos ar dzīvniekiem P57 ievade smadzenēs palielināja ATP daudzumu hipotalāmā, kas norāda uz to, ka pieaudzis enerģijas patēriņš. Ja hipotalāmā ir pietiekami daudz ATP, var domāt par ietekmi uz barošanas un sāta centriem. Efektivitāti apstiprinošu klīnisko pētījumu ar cilvēkiem nav. 2000. gadu sākumā savienojuma sarežģītās sintēzes, dažu blakņu un apšaubāmās efektivitātes dēļ tālākie P57 pētījumi tika apturēti. [15; 16]
Kambodžas garcīnija (Garcinia cambogia) ir neliels koks Dienvidaustrumu Āzijā ar dzelteniem ovāliem augļiem. Šajos augļos ir hidroksicitronskābes savienojums, kas, iespējams, atbild par svaru samazinošām īpašībām. Tas, kā iedarbojas šī skābe, nav noskaidrots. Daži pētījumi ar cilvēkiem pagaidām nav snieguši vienotu atbildi. Bet ir zināms, ka savienojums ir hepatotoksisks. [17]