Tā kā HOPS ir pietiekami bieža, bet, mūsuprāt, nepietiekami novērtēta plaušu slimība, šajā rakstā vēlamies aktualizēt dažus ar tās diagnostiku un klasifikāciju saistītus aspektus 2011. gada GOLD vadlīniju kontekstā, pievēršot arī uzmanību smēķēšanai kā šīs slimības riska faktoram. Pēdējās vadlīnijās būtiskākais ir slimības klasifikācijas maiņa, no slimības pakāpēm (viegla līdz smaga) pārejot uz klasēm A, B, C vai D. Mainīti arī principi, kas pamato slimības klasifikāciju, daudz lielāku nozīmi atvēlot slimības subjektīvajam aspektam, proti, pacienta sūdzībām, kā arī objektīvi novērtējamajam slimības uzliesmojumu skaitam pēdējā gadā.
Aktualitāte
Tiek uzskatīts, ka hroniska obstruktīva plaušu slimība skar ~ 9-10% pasaules iedzīvotāju pēc 40 gadu vecuma. Eiropā tie varētu būt aptuveni 8%, sastopamības biežumam variējot no vismaz 4% nesmēķētāju vidū līdz vismaz 15% smēķētāju vidū. [1] Tā kā par šo slimību raksta relatīvi maz un 2011. gada nogalē mainītas GOLD vadlīnijas, šoreiz vēlamies atgādināt par HOPS diagnostiku un ārstēšanu visnesenāko GOLD vadlīniju kontekstā. [6] Uzreiz gan būtu vērts norādīt, ka speciālistu viedoklis par vadlīniju jauno versiju atšķiras, jo daļa kritiski izsakās par jaunās klasifikācijas sistēmas piemērotību, bet Paula Stradiņa Klīniskās universitātes slimnīcas Plaušu slimību centrs šo klasifikācijas sistēmu turpinās izmantot vismaz līdz vienotu Latvijas vadlīniju iznākšanai, tāpēc arī ar šā raksta palīdzību ceram viest skaidrību par izmaiņām.
GOLD 2011
Definīcija
Kopš 2001. gada, kad izdots GOLD (Global Initiative for chronic Obstructive Lung Disease) pirmais dokuments, šīs vadlīnijas kļuvušas par galvenajām pasaulē, kas nosaka gan citu vadlīniju raksturu, gan klīnisko pētījumu organizatoriskos principus. [8] 2011. gada nogalē vadlīnijās visai būtiski mainīta slimības klasifikācija. Pēc tam vadlīnijas 2013. gadā vēl papildinātas ar jauniem pētījumiem, bet bez citām būtiskām izmaiņām. Dokuments visiem bez maksas pieejams tīmekļa vietnē www.goldcopd.org.
Jāuzsver, ka mainījusies pati HOPS definīcija. Lai arī vadlīniju autori norāda, ka izmaiņas neesot nozīmīgas un vairāk vērstas uz tās vienkāršošanu, ir kāda būtiska atšķirība: 2006. gada definīcijā norādīts, ka HOPS raksturo "gaisa plūsmas ierobežojums, kas nav pilnībā atgriezenisks", bet 2011. gada definīcijā gaisa plūsmas ierobežojums raksturots kā pastāvīgs un progresējošs. Un arī vēlāk vadlīnijās norādīts, ka atgriezeniskumam nav nozīmes, jo tas "nekad nav devis papildu informāciju par diagnozi, diferenciāldiagnozi no bronhiālās astmas vai iespējamo glikokortikoīdu terapijas efektu". [6]
2006. gada HOPS definīcija: HOPS ir novēršama un ārstējama slimība ar nozīmīgām sekām ārpus plaušām, kas var noteikt slimības smagumu individuāliem pacientiem. Tās pulmonālo komponentu raksturo gaisa plūsmas ierobežojums, kas nav pilnībā atgriezenisks. Gaisa plūsmas ierobežojums parasti ir progresējošs un saistīts ar neadekvātu plaušas iekaisīgu atbildi uz kaitīgām daļiņām vai gāzēm. Savukārt 2011. gada definīcija skan šādi: HOPS ir bieža, novēršama un ārstējama slimība, to raksturo pastāvīgs gaisa plūsmas ierobežojums, kas parasti ir progresējošs un saistīts ar pastiprinātu, hronisku iekaisuma atbildi elpceļos un plaušās uz kaitīgām daļiņām un gāzēm. Paasinājumi un pavadslimības pastiprina slimības smagumu individuāliem pacientiem.
Iemesls šādai definīcijas maiņai ir lielās atšķirības HOPS pacientu vidū. Autori norāda, ka pietiekami daudziem pacientiem vērojams nozīmīgs gaisa plūsmas ierobežojuma atgriezeniskums un ka to nevar izmantot kā kritēriju, lai HOPS diferencētu no astmas, jo mainās pat viena pacienta atkārtotos mērījumos. Atgriezeniskumu var ietekmēt slimības smagums un izvēlētā definīcija. Tāpat tas nenorāda uz bronhodilatatoru efektu ilgtermiņā. [9] Pacientiem ar HOPS gaisa plūsmas ierobežojuma atgriezeniskums četros mērījumos gada laikā neatšķīrās no smēķētājiem kontroles grupā. [10]
Riska faktori
Par galveno HOPS riska faktoru joprojām uzskata smēķēšanu, kam seko kaitīgi darba ap-stākļi, tabakas dūmi vidē jeb pasīvā smēķēšana un iekštelpu un āra gaisa piesārņojums, ko rada apkure un ēdiena gatavošana uz biomasas liesmas. Ja Latvijā to var neuzskatīt par nozīmīgu problēmu, tad lielā daļā mazattīstīto valstu mājsaimniecību telpu apsilde un ēdiena gatavošana notiek uz atklātas malkas/akmeņogļu u.tml. liesmas. Dūmu aerosola daļiņas nonāk telpas gaisā un ar ieelpu nokļūst plaušās.
Plašs pētījums Zviedrijā liecina, ka ap 7% nesmēķētāju bez identificējamiem riska faktoriem slimo ar HOPS un ka šo cilvēku saslimstība cieši saistīta ar vecumu. Šiem pacientiem parasti ir arī izteikti vairāk plaušu simptomu nekā pārējiem nesmēķētājiem šajā vecumā. [2]
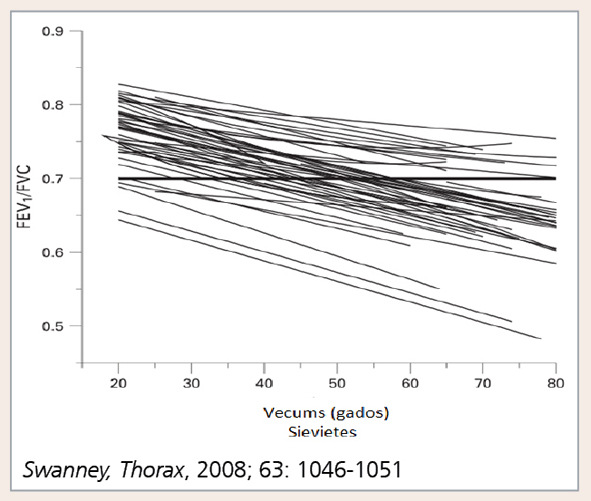
Jau 1977. gadā Fletcher konstatēja: lai arī noteikta FEV1 samazināšanās ar vecumu ir normāla parādība, tomēr daļai tabakas dūmu uzņēmīgu pacientu šī samazināšanās norit straujāk; ja smēķēšanu pārtrauc, FEV1 sarukšanas ātrums atgriežas iepriekšējā līmenī. [11] Arī ECLIPSE pētījuma dati apstiprinājuši, ka smēķēšanas turpināšana veicina FEV1 straujāku samazināšanos, taču šajā pētījumā kopējam ekspozīcijas laikam nebija ietekmes uz FEV1 dinamiku. [12] Tajā pašā laikā apgalvojums, ka HOPS saistīta ar FEV1 viennozīmīgu samazināšanos, pēdējā laikā tiek apšaubīts, jo ECLIPSE pētījumā, trīs gadus izvērtējot FEV1 mainības dinamiku 2163 pacientiem, konstatēts, ka FEV1 mērījumu vērtības var ievērojami variēt un daļai HOPS pacientu pat pieaugt. HOPS pacientiem ar FEV1 atgriezeniskumu (> 12%/200 ml) tā sākotnējās vērtības bija lielākas, bet trīs gados arī straujāk samazinājās. Tāpat pacientiem ar iepriekšējiem uzliesmojumiem pēdējā gadā sākotnējās FEV1 vērtības bija mazākas, bet uzliesmojumu skaits pētījuma laikā nepaātrināja FEV1 kritumu (skat. 1. attēlu). [12]
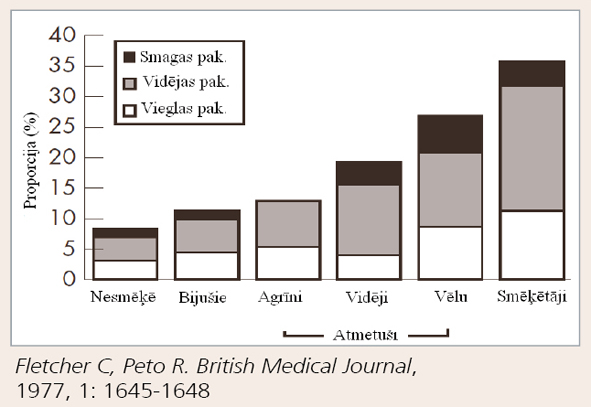

1. attēls
HOPS smaguma pakāpes smēķētājiem un nesmēķētājiem
Rennard un Vestbo gan norāda, ka šī Flet-cher ar kolēģiem veidotā diagramma, lai arī šobrīd neatņemama izpratnē par HOPS attīstību, būtu jāvērtē kritiski. Pētījums, kas to pamato, ilga astoņus gadus, kas HOPS kontekstā vairāk atbilst šķērsgriezuma, nevis longitudinālam pētījumam. Tāpat tajā nav attēloti nesmēķētāji, kam dzīves laikā attīstās HOPS, tādējādi ievērojami vispārinot HOPS attīstību. [13]
Daudz šķēpu lauzts par to, cik liela daļa smēķētāju ir uzņēmīgi pret tabakas dūmu kaitīgo iedarbību. Ilgstoši ticis uzskatīts, ka apmēram 15% smēķētāju laika gaitā attīstās HOPS, bet pēdējos gados parādās pētījumi, kas liek šo proporciju pārskatīt. Tā Lundback ar kolēģiem pēc plaša pētījuma Zviedrijā norāda, ka HOPS sastopamība pieaug līdz ar vecumu un, ja 45 gadu vecumā tā ir 11% (pēc GOLD klasifikācijas), tad 75 gadu vecumā vismaz 50% smēķētāju jau ir attīstījusies slimība. [14] Nedaudz piesardzīgāki ir Lokke un kolēģu publicētie dati. Autori pēc spirometrijas 2022 pacientiem 25 gadu garumā konstatēja, ka 25 gados vidēji smaga līdz ļoti smaga (tātad FEV1 < 80% aprēķinātās normas) HOPS sastopamība smēķētāju vidū sasniedz 27%, kamēr nekad nesmēķējušo vidū tā bija 6% (skat. 2. attēlu). [15]
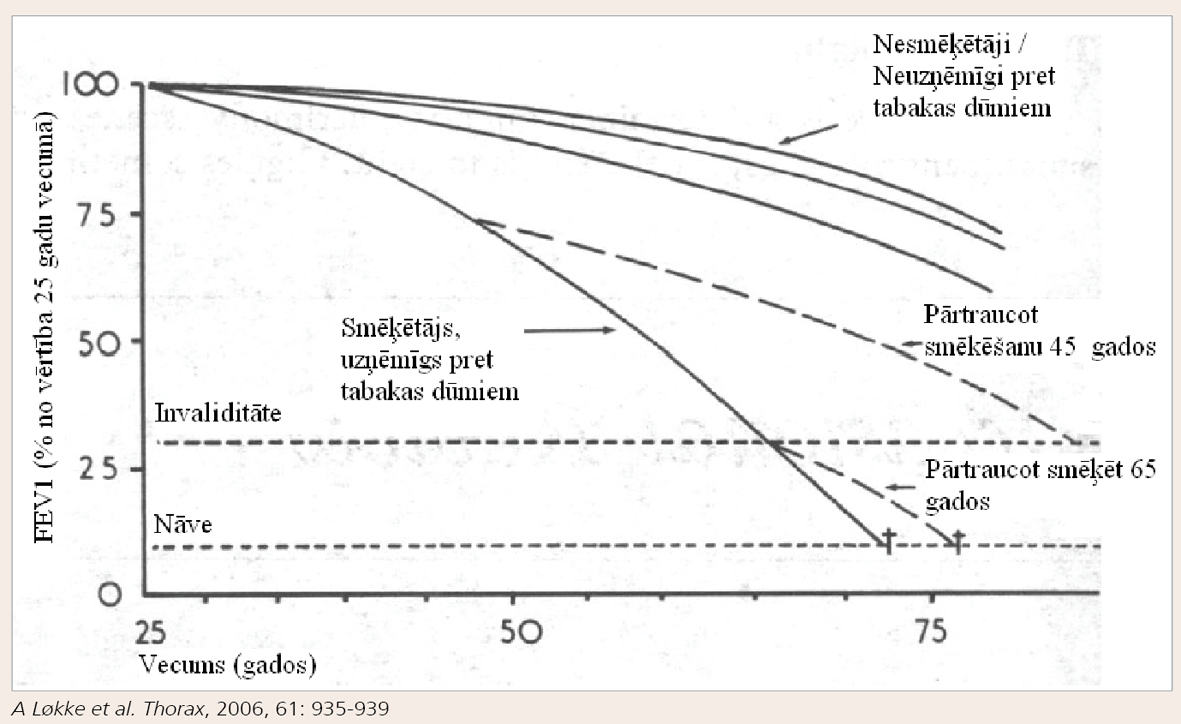

2. attēls
HOPS sastopamības biežums smēķētāju un nesmēķētāju vidū
Interesantus datus sniedz 14 gadus ilga epidemioloģiska pētījuma rezultāti no Kanādas, proti, līdz 80 gadu vecumam ~27% cilvēku attīstīsies HOPS. Pētījumā netika analizēti iespējamie veicinošie vai kavējošie faktori, līdz ar to tā rezultāti nav attiecināmi uz individuālu pacientu aprūpi. Tomēr šie dati rāda, ka 80 gadu vecumā pacientiem HOPS ir biežāk nekā, piemēram, cukura diabēts, hroniska sirds mazspēja vai virkne biežāko onkoloģisko slimību. [16] Žurnālā Lancet 2012. gada nogalē publicēts līdz šim lielākais epidemioloģiskais pētījums par smēķēšanu sieviešu vidū. Tajā pa pastu aptaujāti 1,2 miljoni sieviešu, kas dzimušas ap 1940. gadu (pirmā paaudze, kad būtiska sieviešu daļa kļuva par smēķētājām). Šā raksta kontekstā pētījuma dati rāda, ka smēķējošām sievietēm, salīdzinot ar nesmēķētājām, 10 gadu periodā ir vismaz trīs reizes lielāka mirstība neatkarīgi no cēloņa un pat 60 reižu lielāka mirstība no hroniskām plaušu slimībām (līdztekus tika konstatēta lineāra sakarība starp dienā izmēķēto cigarešu skaitu un mirstību no hroniskām plaušu slimībām). [17]
Kā rāda pētījums Zviedrijā, nesmēķētāju vidū vairākums (65%) slimo ar vieglas pakāpes HOPS un vienīgais identificējamais riska faktors ir pacienta vecums. [2] HOPS šobrīd ir piektais biežākais nāves cēlonis visā pasaulē, un tiek prognozēts, ka tuvākajos gados tas varētu pakāpties uz ceturto vietu, apsteidzot HIV/AIDS. [3] HOPS ir neatkarīgs riska faktors, palielinot mirstību, neatkarīgi no vecuma, dzimuma, aktuālā smēķēšanas statusa un pavadošām sirds slimībām. Turklāt līdz ar pacientu vecumu HOPS mirstību palielina arvien straujāk (skat. 3. attēlu). [4]
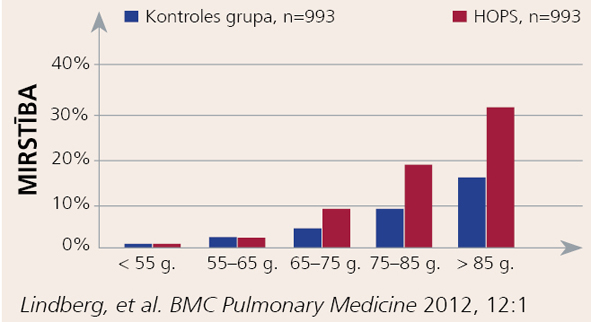

3. attēls
Mirstība HOPS dēļ pa vecumgrupām
Jāņem vērā, ka slimība prasa ievērojamus resursus no veselības aprūpes budžeta. Ne mazākas par tiešajiem ārstēšanas izdevumiem ir izmaksas, ko rada prombūtne no darba - gan paša pacienta, gan kāda ģimenes locekļa, kas paliek mājās pacientu kopt. [5] Kā uzsvēruši GOLD valīniju autori, HOPS darba nespējīgus padara divus cilvēkus - slimnieku un viņa aprūpētāju. [6]
Spirometrija
GOLD vadlīnijas HOPS pacientu gaisa plūsmas ierobežojumu elpceļos iedala četrās pakāpēs pēc FEV1 vērtības (pēc bronhodilatatora ieelpošanas) attiecībā pret aprēķināto normu, nosacījums FEV1/FVC ir < 0,7 (skat. 4. attēlu).
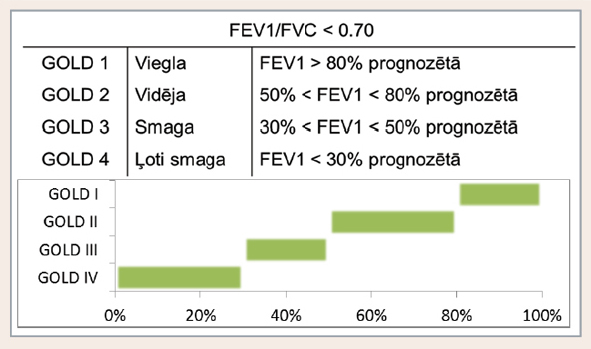

4. attēls
HOPS pacientu izelpas gaisa plūsmas ierobežojuma pakāpes
Tomēr tieši kritērijs, ka elpceļu obstrukcijas robeža ir FEV1/FVC < 0,7, izsaucis visai asus iebildumus. Tā kā FEV1 līdz ar vecumu samazinās straujāk nekā FVC, daļai pacientu, kuru normas vērtības ir tuvāk apakšējai robežai pēc 65 gadu vecuma, šī rādītāju attiecība būs mazāka par 0,7, bet nebūs elpceļu obstrukcijas. Sekas var būt HOPS diagnoze, kad medikamenti jālieto pacientiem, kam obstrukcijas patiesībā nemaz nav. Un pretēji - daļai pacientu, kas jaunāki par 65 gadiem, pat ar elpceļu obstrukciju šī attiecība būs lielāka par 0,7, tāpēc šiem pacientiem HOPS diagnozi varbūt nemaz nenoteiks, lai gan slimība viņiem ir. [18] Šo apsvērumu dēļ ieteikts par obstrukcijas pazīmi izmantot vecuma normas apakšējo robežu, t.i., vērtību, zem kuras atrodas vien 5% veselās populācijas. Tādējādi, spirometrijā iegūstot rezultātu, kas mazāks par noteikto normu, būtu vien 5% iespēja, ka pacientam patiesībā nav obstrukcijas. Un, kā rāda apkopotie dati no dažādiem populāciju pētījumiem, apakšējā normas robeža var būtiski atšķirties no vērtības GOLD vadlīnijās (skat. 5. attēlu). [19]

5. attēls
Apakšējā normas robeža sievietēm visā pasaulē
Lai gan vismaz vienā plašā pētījumā abas metodes devušas līdzīgu rezultātu [2], citi pētījumi rāda, ka pēc GOLD kritēriju izmantošanas viltus pozitīvu rezultātu skaits ir lielāks, kamēr pēc normas apakšējās robežas izmantošanas vairāk ir viltus negatīvu rezultātu. Tādējādi, izvērtējot, kuru metodi izmantot, jāizvēlas starp diviem ļaunumiem - vai nu daļu pacientu ārstēs lieki (viltus pozitīvi rezultāti), vai arī daļu pacientu neārstēs, kaut tas būtu jādara. [20; 21] 2011. gada sistemātiskā rakstu analīzē secināts, ka GOLD kritēriju izmantošanas dēļ kopumā ir lielāki HOPS sastopamības rādītāji. [20] Toties GOLD vadlīniju autori uzskata, ka pierādījumi par normas apakšējās robežas piemērotību obstrukcijas noteikšanai pagaidām neesot pietiekami, lai atteiktos no fiksētas robežvērtības. Izmantojot normas apakšējo robežu, tās vērtība ir ļoti atkarīga no izvēlētā aprēķināšanas vienādojuma. Tāpat, pēc vadlīniju autoru domām, hiper- un hipo- diagnostikas varbūtība ir neliela, jo spirometrijas rādītāji ir tikai viens no klīniskajiem kritērijiem diagnozes noteikšanai.
Uzliesmojumi
Plašos pētījumos pierādīts, ka pacientiem ar smagāku slimību uzliesmojumi ir biežāk un ka uzliesmojumu skaits pēdējā gada laikā ļauj prognozēt arī slimības gaitu. ECLIPSE, viens no lielākajiem šādiem pētījumiem, liecina, ka līdz ar slimības smaguma pieaugumu palielinās arī paasinājumu biežums: vairāk par diviem paasinājumiem gadā bija 47% pacientu ar ļoti smagu slimību un 22% pacientu ar vieglas pakāpes, un iepriekšējie slimības uzliesmojumi bija vienīgais prognozes faktors. [22] Tāpēc jaunajās GOLD vadlīnijās HOPS uzliesmojumu skaitam pēdējā gada laikā piešķirta būtiska nozīme slimības pakāpes klasifikācijā, tādējādi vadlīnijas un klasifikāciju virzot nevis vidējā, bet individuālā pacienta virzienā.
CAT tests
Ja iepriekš pacienta ikdienas sūdzības bija pakārtots faktors un izšķirīgi bija anamnēzes un objektīvās izmeklēšanas dati, tad šobrīd situācija radikāli mainījusies un neatņemama jaunās GOLD klasifikācijas daļa ir pacienta sūdzību smaguma izvērtējums. Šim mērķim piedāvāti divi instrumenti - CAT tests un modificētie MRCQ jautājumi. MRCQ šajā rakstā neaplūkosim, jo, salīdzinot ar CAT testu, Latvijā tos izmanto maz.
CAT tests, kas ir sasīsinājums no angļu COPD assesment test, tika izveidots, lai būtu vienkārša, bet pietiekami uzticama un standartizēta HOPS novērtēšanas un kontroles anketa. Vairākos pētījumos ar vairāk nekā 1500 pacientiem tika izvērtēta divdesmit viena jautājuma precizitāte, kuri bija izveidoti jau iepriekšējos pētījumos un labi korelēja ar HOPS smaguma pakāpi, pēc tam atlasīja astoņus jautājumus, kuru kombinācija šobrīd veido CAT testu. [23] Būtiski gan ir norādīt, ka CAT tests nav piemērots un paredzēts slimības diagnostikai - tā mērķis ir jau diagnosticēta HOPS pacienta stāvokļa izvērtēšana un novērtēšana ilgtermiņā, salīdzinot atkārtotu testu rezultātus. [23]
Vēl testa autori norāda: lai šādu testu izmantotu ikdienā, ārstu izpratnē ikvienai tā vērtībai jāatbilst kādam pacienta stāvokļa raksturojumam. Tāpēc izveidota arī aprakstoša skala, kurā abstraktajiem CAT testa punktiem piesaistīts pacienta sūdzību raksturojums. Jāpiebilst, ka pacientam, kam ir lielāks punktu skaits, jābūt arī mazākam punktu skaitam attiecīgajās sūdzībās (skat. 1. tabulu). [24]


1. tabula
CAT testa jautājumi un punktu skaits
Ikdienas darbā būtiskas ir klīniski nozīmīgās izmaiņas (minimal clinically important difference) testa rezultātā, kuras jūt pacients un kuru dēļ jāmaina terapijas veids un/vai aprūpes režīms. CAT testa gadījumā, pēc autoru pamatojuma, tie ir 1,6 punkti. [25] Lai arī tests tika izveidots klīniski stabilu pacientu izvērtēšanai, pēdējo gadu pētījumi rāda, ka tā vērtības izmaiņas pietiekami labi ļauj izvērtēt arī uzliesmojumus, testa rādījumiem korelējot gan ar FEV1, gan CRO izmaiņām. [26; 27] Pēc pulmonālas rehabilitācijas, uzlabojoties pacienta stāvoklim, samazinās arī CAT testa punktu skaits. [26] Testa izstrādi sponsorējis farmācijas uzņēmums GlaxoSmithkline, un internetā tas ir pieejams bez maksas (arī latviešu un krievu valodā) http://www.catestonline.org/english/index_Latvia.htm.
Klasifikācija
Pēc iepriekš minētajiem faktoriem - gaisa plūsmas ierobežojuma, uzliesmojumu skaita un CAT testa rezultāta - ir veidotas jaunās smaguma pakāpes, tās attēlojot grafikā, kur uz X ass ir CAT testa rezultāts, bet uz Y ass - gaisa plūsmas ierobežojuma pakāpe vai uzliesmojumu skaits pēdējā gada laikā, izvēloties smagāko no rādītājiem.
Četras pakāpes, ko apzīmē ar burtiem no A līdz D, izkārtotas kvadrāta formā (skat. 6. attēlu).
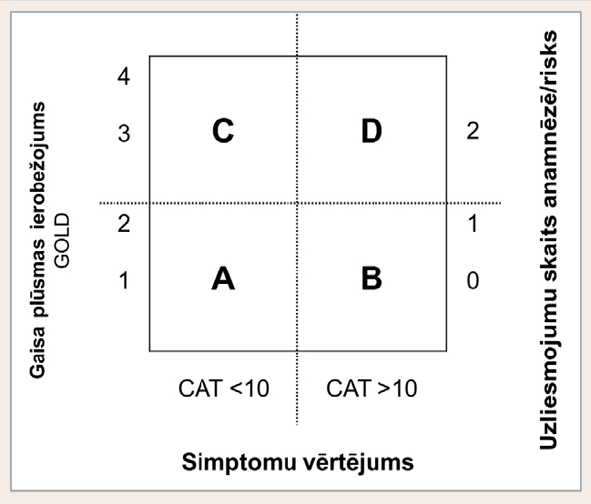

6. attēls
HOPS klasifikācija GOLD vadlīnijās
- Apakāpe (grafika kreisajā apakšējā stūrī) ir visvieglākā, ar vieglu vai vidēju gaisa plūsmas ierobežojumu, dažiem uzliesmojumiem un < 10 punktiem pēc CAT testa (skat. 7. attēlu).
- Bpakāpe (grafika labajā apakšējā stūrī) ar nelielu uzliesmojumu skaitu un vieglu vai vidēju gaisa plūsmas ierobežojumu, bet lielāku (> 10) punktu skaitu CAT testā (skat. 7. attēlu).
- Cpakāpe (grafika kreisajā augšējā stūrī): pacienti ar vidēji smagu/smagu gaisa plūsmas ierobežojumu vai vairāk nekā diviem slimības uzliesmojumiem pēdējā gada laikā un < 10 punktiem CAT testā (skat. 7. attēlu).
- Dpakāpe (grafika labajā augšējā stūrī): vissmagākie pacienti, kam ir daudz simptomu (CAT testā > 10 punktiem) un bieži uzliesmojumi vai izteikts gaisa plūsmas ierobežojums (skat. 7. attēlu).
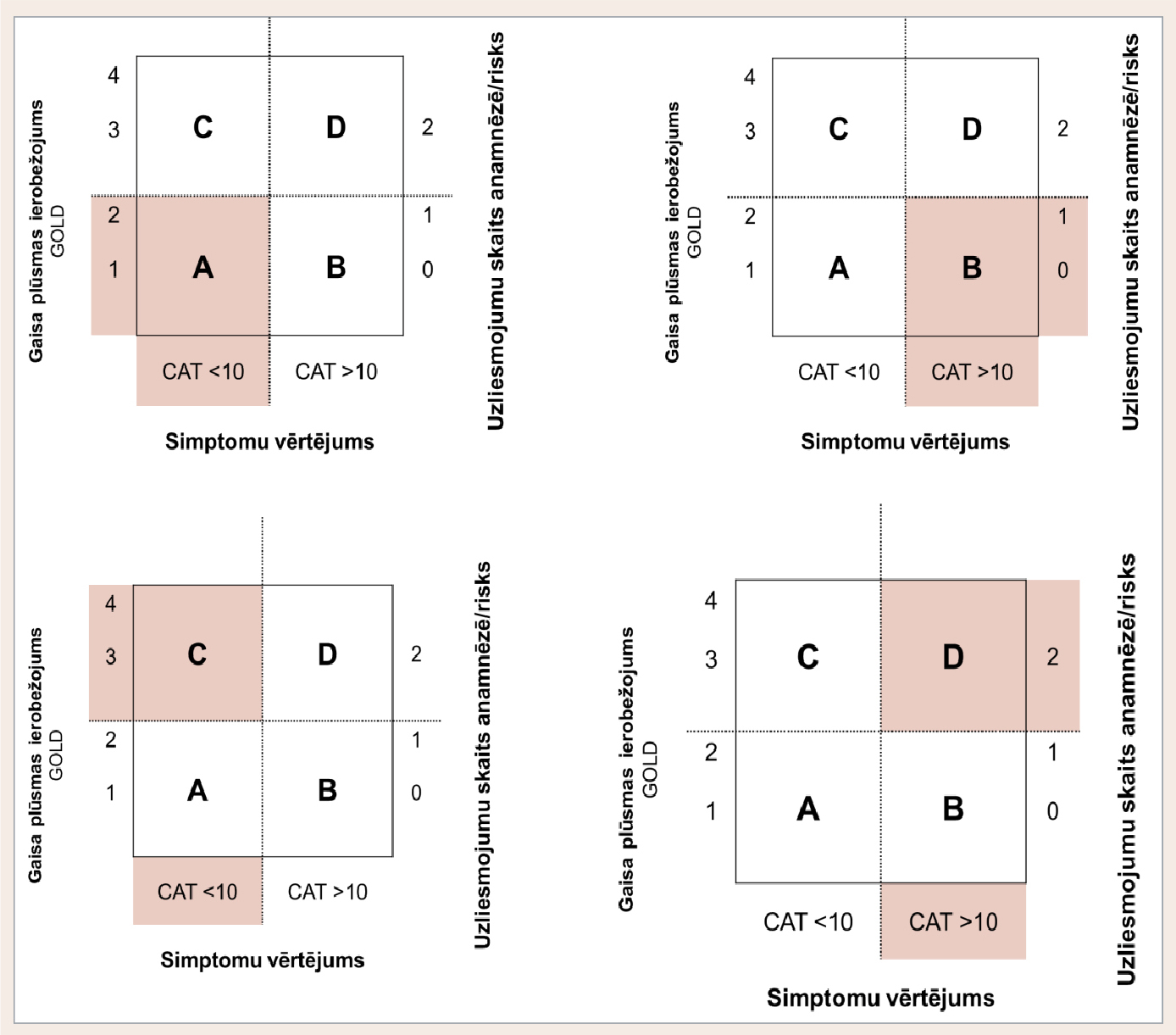

7. attēls
HOPS klasifikācijas pakāpes
Smaguma pakāpi, ko atspoguļo šī klasifikācija, labi var attēlot arī ar krāsām: A pakāpe ir daudz tuvāka zaļai krāsai, t.i., relatīvi viegla slimība, bet D pakāpe ir sarkanā krāsā, norādot uz ļoti smagu slimību. B un C pakāpe paliek vidū, un to, vai pacienta slimību klasificēt B vai C pakāpē, nosaka tas, kura no slimības pazīmēm pacientam ir vairāk izteikta (skat. 8. attēlu).
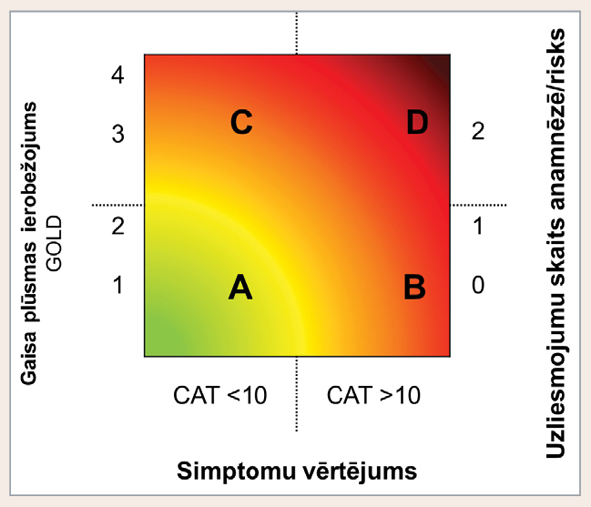

8. attēls
HOPS klasifikācija – krāsu skala
Terapija un tās mērķi
GOLD vadlīnijās par terapijas galvenajiem mērķiem norādīti slimības simptomu un ar slimību saistīto risku mazināšanas pasākumi. Aiz abiem šiem apzīmējumiem slēpjas virkne jau iepriekšējās vadlīnijās norādītu uzdevumu: slimības izpausmju, fiziskās aktivitātes ierobežojumu un vispārējā veselības stāvokļa uzlabošana, komplikāciju un paasinājumu novēršana vai ārstēšana, kā arī pacienta nāves aizkavēšana.
Vēlreiz uzsvērta nepieciešamība izglītot slimniekus, lai viņi apzinātos slimības dabu, tās progresu veicinošos faktorus, kā arī savu un veselības aprūpes darbinieku lomu slimības ārstēšanā.
Iepriekšējās vadlīnijās farmakoterapijas izvēli pamatoja princips, ka līdz ar slimības smaguma pakāpes pieaugumu terapijā pievieno medikamentus (skat. 9. attēlu). Pirmajās divās pakāpēs terapijā rekomendēja tikai bronhodilatatorus, bet inhalējamos glikokortikoīdus ieteica pievienot pacientiem ar vismaz smagas pakāpes ventilācijas funkcijas traucējumiem un biežiem paasinājumiem.
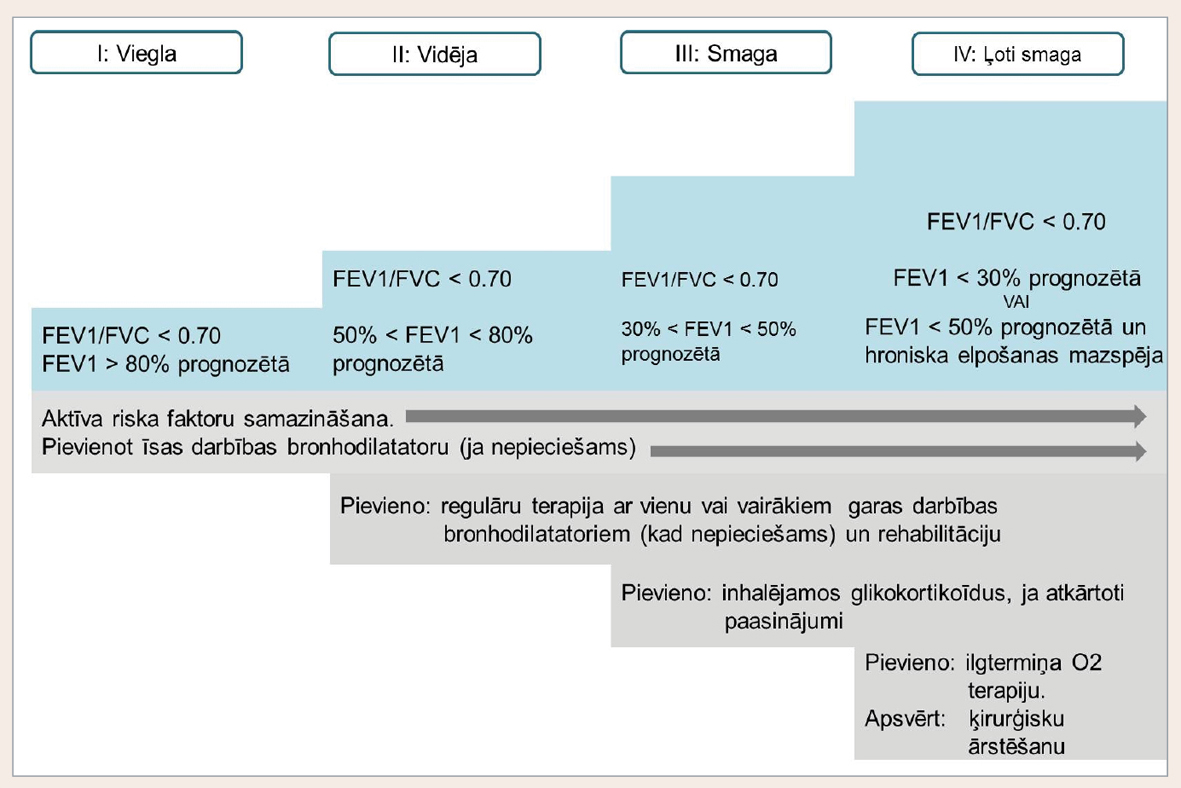

9. attēls
HOPS terapijas pakāpju shēma
Jaunajās vadlīnijās pakāpiena princips lielā mērā likvidēts. Joprojām vieglākas slimības gadījumā ieteikti tikai bronhodilatatori, bet vairs nekombinējot gan īsas, gan garas darbības preparātus. Inhalējamos glikokortikosteroīdus iesaka pievienot tad, ja ir smagas pakāpes ventilācijas funkcijas traucējumi vai bieži paasinājumi (GOLD C un D klasei).
GOLD A klasei iesakāmi tikai īsas darbības preparāti, jo pētījumi ar garas darbības bronhodilatatoriem veikti vien tādiem pacientiem, kuru plaušu funkcija bija ievērojami sliktāka. GOLD B klasei iesakāmi garas darbības bronhodilatatori, nepieciešamības gadījumā kombinējot bēta-2 agonistu ar holīnerģisku preparātu. GOLD C klasei rekomendēts pievienot inhalējamu glikokortikoīdu, bet D klasei atvēlētas visplašākās kombināciju iespējas, atspoguļojot pieaugošās grūtības šādu pacientu simptomu kontrolē (skat. 2. tabulu).
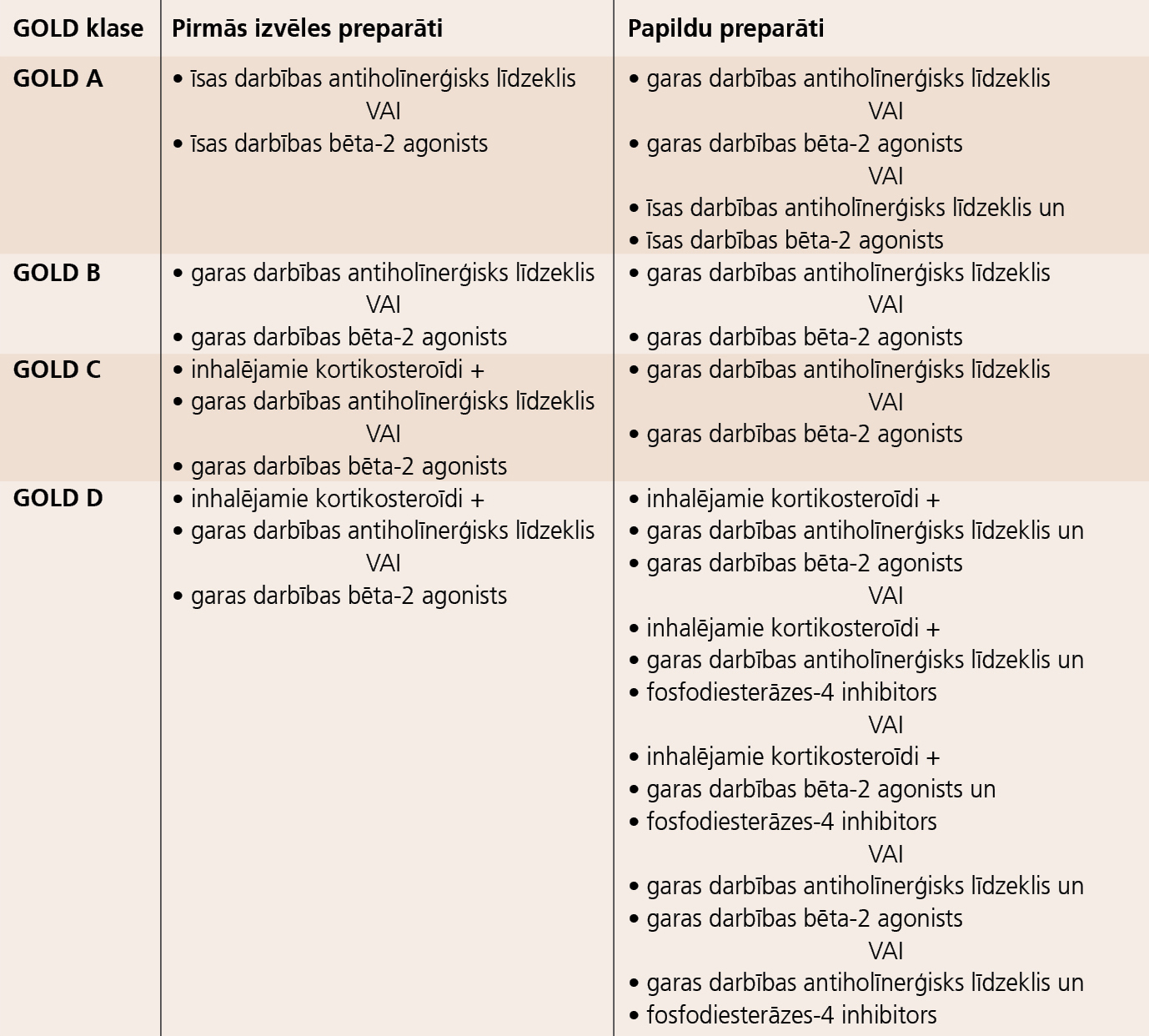

2. tabula
HOPS terapija pēc 2011. gada GOLD vadlīnijām
Jāatgādina, ka vienīgie līdzekļi, kam līdz šim skaidri pierādīta ietekme uz dzīv-ildzi, ir skābekļa terapija [29] un smēķēšanas pārtraukšana. [30] Par pārējo līdzekļu grupām, lai arī medikamenti nenoliedzami ietekmē simptomus un pacienta dzīves kvalitāti, pētījumu dati par to iedarbību, lietojot atsevišķi vai kombinācijās, variē. [31]
Visbeidzot ārpus šīm vadlīnijām, bet ciešā kontekstā ar tēzi "uz pacientu mērķēta aprūpe" ir Kanādas pētnieku veidots literatūras apskats, kur izvērtēti dati un pētījumi par pacientu attieksmi un pieredzi, slimojot ar HOPS. Secināts, ka visbiežāk pacienti pirmo reizi pie ārsta devušies ar akūta paasinājuma izraisītām sūdzībām, nevis ar lēni progresējošiem pamatsimptomiem un ka daudzi pacienti neapzinās slimības smago un nenovēršami fatālo raksturu. Arī daļa ārstu šo slimību agrīnā stadijā neuzskata par nāvējošu, līdz ar to laikus nepārrunā tās raksturu ar pacientiem.
Slimības paasinājumus biežāk mēdz saistīt ar sadzīves aktivitātēm, nevis ar slimības progresēšanu. Situāciju vēl vairāk sarežģī ārstu iekšējā pretestība savlaicīgi ar pacientu pārrunāt ilgtermiņa prognozi un dzīves noslēguma aprūpi [28], kas tikai parāda, ka par šo slimību vēl daudz runājams un skaidrojams.