Virkne medikamentu spēj izraisīt subklīnisku vai klīnisku nieru bojājumu. Kā no tā izvairīties? Atbilde ir – zinot galvenos nefrotoksiskos renālos sindromus, dažādu plaši pielietotu medikamentu nefrotoksicitātes mehānismus, nieru bojājuma riska faktorus un profilakses stratēģijas. Savlaicīgi pamanītas, izmaiņas pārsvarā ir labojamas, tāpēc nefrotoksicitātes agrīnas atpazīšanas nozīme var būt kritiska; ārstam jābūt informētam par viņa nozīmēto medikamentu nefrotoksisko potenciālu un jāprot izvērtēt viens vai otrs medikaments kā iespējamais nieru problēmu iemesls.
Nieres un medikamenti
Medikamentu izraisīts nieru bojājums var būt toksiskas, išēmiskas, iekaisīgas, obstruktīvas dabas vai arī saistīts ar pastiprinātu šķidruma zudumu, un klīniski var manifestēties kā akūta nieru mazspēja, nefrotisks sindroms, tubulāra disfunkcija, hroniska nieru slimība. Galvenie medikamenti, kas var izsaukt nieru bojājumu, ir diurētiskie līdzekļi, antibiotikas, atsevišķu grupu antihipertensīvie līdzekļi, imunosupresanti, antitrombotiskie līdzekļi, antivirālie, ķīmijterapetiskie līdzekļi, kontrastvielas, kā arī herbālie preparāti.
Kāpēc nieres ir tik viegli ievainojamas?
Farmakoloģiskās vielas pārsvarā tiek izdalītas no organisma caur nierēm, tādēļ tās ir pakļautas augstai šo vielu vai/un to metabolītu koncentrācijai. Turklāt nieru fizioloģiskās īpatnības nosaka nefrotoksīna akumulēšanās iespējas:
- tās ir labi vaskularizētas un saņem aptuveni 25% no sirds minūtes tilpuma miera stāvoklī;
- proksimālajiem nieru kanāliņiem ir liela virsma nefrotoksīnu piesaistīšanai un transportēšanai nieru epitēlijā;
- glomerulārā filtrāta reabsorbcijas rezultātā pakāpeniski paaugstinās nefrotoksīna intraluminālā koncentrācija, un tā transports nierē var izraisīt specifiskus dažādas lokalizācijas bojājumus.
Kā konstatēt medikamentu izraisītu nieru bojājumu?
Daudzos gadījumos nieru disfunkcija iesākas bez specifiskiem klīniskiem simptomiem un tikai ļoti rūpīga novērošana ļauj jau agrīni noteikt pareizo diagnozi. Tāpēc:
- nepieciešams mērīt nieru funkciju neilgi pēc jebkura jauna medikamenta terapijas uzsākšanas, īpaši, ja ir zināms tā nefrotoksiskais potenciāls;
- jāidentificē riska grupas pacienti, kuriem potenciāli nefrotoksiski medikamenti jānozīmē ar īpašu piesardzību, rūpīgi izsverot risku un ieguvumus (jāatceras, ka risku paaugstina polifarmācija);
- nepieciešamības gadījumā jākoriģē nieru mazspēja, palielinot uzņemtā šķidruma daudzumu, uzsākot dialīzi, koriģējot medikamenta devas, ordinējot steroīdus akūta intersticiāla nefrīta gadījumā un izslēdzot atkārtotu vainīgā medikamenta ekspozīciju;
- neskaidras izcelsmes nieru mazspējas gadījumos jāatceļ potenciāli nefrotoksiskie preparāti.
Kā novērst?
Būtiskākais moments medikamentu izraisītas nefrotoksicitātes terapijā ir nefrotoksīna ekspozīcijas pārtraukšana vai devas minimizēšana, ja tas iespējams. Citi pasākumi ietver medikamenta ievades stratēģijas pārskatīšanu, kā arī medikamentozu terapiju. Pamatprincipi tiks aplūkoti raksta ietvaros.
Pseidorenāla mazspēja
Farmakoloģiskās vielas var paaugstināt kreatinīna vai urīnvielas līmeni asinīs (azotēmija) arī normālas nieru funkcijas apstākļos (1. tabula). Tam ir vairāki mehānismi. Daži medikamenti konkurē ar kreatinīnu nieru kanāliņos, laboratoriski imitējot nieru mazspēju, kamēr citas klīniskās pazīmes vai urīna sedimenta izmaiņas pacientam nekonstatē. Steroīdi un tetraciklīns intensificē katabolos procesus, nesamērīgi palielinot urīnvielas līmeni asinīs attiecībā pret kreatinīna līmeni. Savukārt citiem medikamentiem nepiemīt sistēmisks efekts, taču tie traucē seruma kreatinīna līmeņa noteikšanu laboratorijas apstākļos. Minētajos gadījumos kreatinīna līmeņa pieaugums parasti ir neliels, stabils un pēc medikamenta atcelšanas ātri atgriežas izejas līmenī.


1. tabula
Medikamenti, kuri izraisa pseidorenālu mazspēju
Akūta medikamentu izraisīta nieru mazspēja
Jāprecizē, ka akūtas nieru mazspējas klasifikācija prerenālā un intrarenālā mazspējā ir tikai orientējoša, konceptuāla. Akūta nieru mazspēja būtībā ietver dinamisku spektru, sākot ar nelielām atgriezeniskām izmaiņām līdz klīniski nozīmīgai patoloģijai (1. attēls).
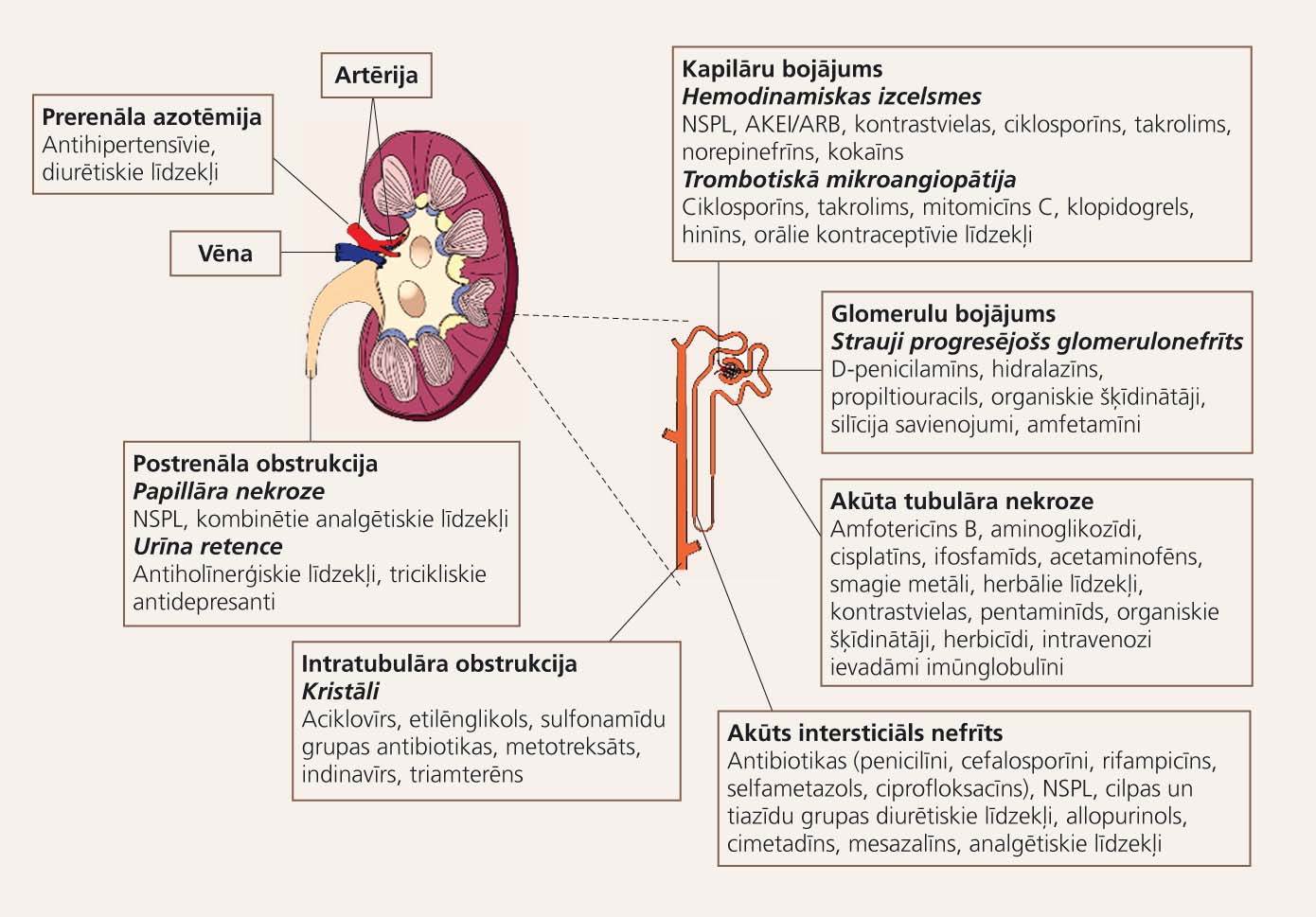

1. attēls
Akūta nieru mazspēja: nefrotoksīni un bojājuma lokalizācija
Prerenāla azotēmija
Akūtas nieru mazspējas diagnoze tiek noteikta, pamatojoties uz pēkšņu glomerulārās filtrācijas ātruma (GFĀ) samazināšanos, ko pavada azotēmija (slāpekļa vielu maiņas produktu - urīnvielas un kreatinīna - akumulācija) ilgāk par dažām dienām vai nedēļām.
Prerenālas jeb funkcionālas nieru mazspējas cēlonis ir nieru perfūzijas samazināšanās. Fizioloģiska reakcija uz asinsplūsmas samazināšanos nierēs ir aferentās arteriolas dilatācija/eferentās arteriolas konstrikcija, kā rezultātā pieaug filtrēto glomerulāro asiņu apjoms. Ja tiek pārsniegtas filtrācijas rezerves, urīnvielas un kreatinīna retence manifestējas kā azotēmija.
Medikamenti, kas var samazināt nierēm piegādāto asiņu apjomu un/vai spiedienu, ir diurētiskie līdzekļi, augstas osmolaritātes kontrastvielas, imunosupresanti (ciklosporīns un takrolims), nesteroīdie pretiekaisuma līdzekļi, interleikīns II, AKE inhibitori. Riska grupai pieder pacienti ar nieru asinsrites traucējumiem (bilaterālu nieru artērijas stenozi, aknu cirozi, sastrēguma sirds mazspēju). Lai gan nieres ir veselas, nepietiekamās asinsapgādes dēļ nātrija ekskrēcija ir zema, samazinās diurēze, pieaug urīna osmolalitāte. Urīna sedimenta izmaiņas, proteinūriju parasti nenovēro. Vainīgā medikamenta atcelšana parasti pilnībā normalizē stāvokli.
Intrarenāla nieru mazspēja
Akūta tubulāra nekroze (ATN)
Vairums medikamentu, kuri var izraisīt ATN, izdalās caur nierēm: aminoglikozīdu antibiotikas, amfotericīns B, cisplatīns, kontrastvielas, pentamidīns, kokaīns, intravenozi ievadāmie imunoglobulīni. ATN var izraisīt arī statīni - novēro rabdomiolīzes klīniskās pazīmes: mialģiju, paaugstinātu kreatinīnfosfokināzes līmeni, mioglobīnūriju.
Patoģenētiskie mehānismi ir multipli un bieži savstarpēji pārklājas. Tā var būt tieša tubulāra toksicitāte, šūnu energoprodukcijas traucējumi, brīvo radikāļu iedarbība, hēma izraisīta tubulāra toksicitāte, fosfolipīdu metabolisma traucējumi, intracelulāra kalcija toksicitāte. Osmolāras izmaiņas nierēs ar vakuolu veidošanos proksimālajos kanāliņos un ATN ir novērotas, lietojot imunoglobulīnus, mannitolu un polietilēnglikolu (kā saistviela intravenozi ievadāmos medikamentos).
Sākotnēji bojājumu konstatēt nav viegli, jo diurēze var būt normāla, oligūrija parādās vēlāk. Urīna sedimentā redz tumšus granulārus cilindrus un nieru epitēlijšūnas (atsevišķi vai ieslēgtas cilindros). Elektrolītu analīze parāda nātrija frakcionētās ekskrēcijas (FeNa+)1 pieaugumu virs diviem trim procentiem (norma
Atceļot nefrotoksisko aģentu, nieru funkcija parasti uzlabojas, bieži novēro pilnīgu atveseļošanos, tomēr daži nefrotoksiski aģenti vai atkārtota nefrotoskīnu ekspozīcija var izraisīt neatgriezeniskas izmaiņas.
Akūts intersticiāls nefrīts (AIN)
AIN bieži manifestējas kā sistēmiska hipersensivitāte ar drudzi, ādas izsitumiem, artralģijām, kas sākas trīs līdz piecas dienas pēc atkārtotas medikamenta ekspozīcijas, bet lielākoties dažas nedēļas pēc pirmās ekspozīcijas. Dažos gadījumos latentais periods ir mazāk par diennakti (piemēram, rifampicīna gadījumā) vai līdz pat 18 mēnešiem (NSPL izraisīts AIN). Bieži AIN izraisa antibiotikas, tai skaitā penicilīni, cefalosporīns, ciprofloksacīns, sulfonilamīdi, rifampīns, retāk - vankomicīns, bet visbiežāk - meticilīns. Citi medikamenti, kas var izraisīt AIN: nesteroīdie pretiekaisuma līdzekļi (NSPL), sevišķi fenoprofēns, COX-2 inhibitori, diurētiskie līdzekļi, litija preparāti, fentionīns, valproiskābe, amfotericīns B, streptokināze, 5-aminosalicilāti, allopurinols un daži Ķīnas herbālie preparāti.
Urīna sedimentā atrod leikocītus, eritrocītus, leikocitārus cilindrus. FeNa+ ap 1%, bet var samazināties, mazinoties diurēzei. Lai gan proteinūrija parasti ir neliela, gados veciem pacientiem un pacientiem ar NSPL izraisītu AIN tā var sasniegt nefrotiskā sindroma rādītājus (> 3 g/24h). Vairāk nekā 75% pacientu novēro eozinofiliju (izņemot NSPL izraisītu AIN, kad drudzis, izsitumi un eozinofilija nav raksturīgi), tomēr tās neesamība neizslēdz AIN diagnozi.
Retāk novēro tubulointersticiāla bojājuma klīniskās izpausmes, tādas kā Fankoni sindromu ar glikozūriju, bikarbonātūriju, fosfatūriju, aminoacidūriju un tubulāru acidozi.
Neraugoties uz to, ka klīniskā aina ir diezgan raksturīga, AIN diagnozi iespējams precizēt, tikai veicot nieru biopsiju.
Vairumā gadījumu nieru funkcija sāk normalizēties nedēļas laikā pēc nefrotoksiskā medikamenta atcelšanas. Ja disfunkcija saglabājas, indicēts īss steroīdu kurss (prednizolons orāli 1-2 mg/kg/d), lai gan steroīdu lietderība nav pierādīta randomizētos pētījumos. Ja nieru funkcija neatjaunojas četru līdz sešu nedēļu laikā pēc steroīdu kursa, var nozīmēt ciklofosfamīdu (arī nav randomizētu pētījumu).
Prognostiskie neatgriezeniska nieru bojājuma faktori ir nefrotoksiskā medikamenta ilgstoša lietošana (> 1 mēnesis), neatlaidīga nieru mazspēja, daudz intersticiālu granulomu biopsijā, vāja reakcija uz steroīdiem.
Trombotiskā mikroangiopātija (TM)
Trombotiskā mikroangiopātija parasti izsauc smagu akūtu nieru mazspēju. Patoloģisko procesu raksturo hialīnu trombu formēšanās iekšējo orgānu sīkajos asinsvados. Nierēs novēro aferentās arteriolas un glomerulu trombozi; ar elektronmikroskopu redz glomerulāro kapilāru sienas sabiezējumu ar fibrīna depozītiem.
Medikamenti, kas asociējas ar TM: ciklosporīns, takrolims, klopidogrels, ķīmijterapeitiskie līdzekļi (mitomicīns C, bleomicīns, cisplatīns, gemcitabīns), estrogēnus saturoši orālie kontracepcijas līdzekļi, hinīns, kokaīns. Kombinējot cisplatīnu ar bleomicīnu, TM incidence augstāka nekā monoterapijā.
TM klīniski var manifestēties ar drudzi, hemolītisku anēmiju, trombocitopēniju, nieru disfunkciju un CNS traucējumiem - visas šīs piecas trombotiskās trombocitopēniskās purpura pazīmes (TTP) biežāk novēro pieaugušajiem, taču ne visiem pacientiem, tāpēc TTP iespējamība jāpatur prātā visos gadījumos, kad pacientam ir hemolītiska urēmija, trombocitopēnija un nieru mazspēja uz kāda no minēto medikamentu terapijas fona.
Daļai pacientu predominē nieru mazspēja ar anēmiju un trombocitopēniju bez CNS iesaistes - hemolītiski urēmiskais sindroms (HUS). Lai gan patofizioloģiskie mehānismi ir līdzīgi, HUS gadījumā mikroangiopātija ir lokalizētāka. Visbiežāk ar HUS asociējas (2-10% pacientu) mitomicīns C - HUS parasti attīstās vienu, divus mēnešus pēc pēdējās devas (iespējams vēlāk, ja devas
Urīna analīzē mikrohematūrija, mērena proteinūrija, hialīnie un graudainie cilindri. Asinīs retikulocitoze, haptoglobīna līmenis zems, perifēro asiņu uztriepē šistocīti, augsts seruma LDH līmenis.
Prognoze variabla. Medikamenta lietošana jāizbeidz. Plazmas apmaiņas transfūzijas nozīme nav īsti skaidra, bet ir novērota nieru funkcijas uzlabošanās ciklosporīna izraisīta HUS gadījumos. Ciklosporīna aizstāšana ar takrolimu var dot uzlabošanos, bet vēlāk pacientam var attīstīties līdzīga reakcija arī pret to. Medikamentu izraisīta TTP-HUS gadījumā nieru funkcijas (atšķirībā no CNS traucējumiem) ne vienmēr atjaunojas pilnībā. Kopējā mirstība ir augsta, daudzos gadījumos pacientam nepieciešama hroniska dialīze. Steroīdu terapija nav efektīva.
Urīnceļu obstrukcija
Medikamentu izraisītu urīna atteces traucējumu iemesli var būt intratubulāra obstrukcija, intraureterāla obstrukcija kristālu nogulsnēšanās dēļ, kā arī ārēja ureterāla kompresija medikamentu (metizergīda) izraisītas retroperitoneālas fibrozes dēļ.
Medikamenti, kas saistīti ar kristālu formēšanos, ir aciklovīrs, sulfonilamīdi, metotreksāts, indinavīrs, triemtrēns, C vitamīns lielās devās. Ir novēroti reti famciklovīra izraisīti akūtas nieru mazspējas gadījumi pacientiem ar nieru slimībām, nepielāgojot preparāta devas nieru funkcijai. Arī gvaifenazīns un efedrīns veicina nierakmeņu veidošanos.
Kristālu izraisītas akūtas nieru mazspējas risku paaugstina hipovolēmija (hroniska diareja, diurētiskie līdzekļi, sastrēguma sirds mazspēja), preeksistējoša nieru slimība, medikamenta bolus deva, metabola acidoze vai alkaloze.
Urīna sedimentā var būt eritrocīti, leikocīti, dažādas formas kristāli (2. attēls).
![Indinavīra kristāli urīna sedimentā. Raksturīgi taisnstūri un rozetes [4]](https://cdn.doctus.lv/media/2011/11/2/original/28328e80237e.jpg)
![Indinavīra kristāli urīna sedimentā. Raksturīgi taisnstūri un rozetes [4]](https://cdn.doctus.lv/media/2011/11/2/original/28328e80237e.jpg)
2. attēls
Indinavīra kristāli urīna sedimentā. Raksturīgi taisnstūri un rozetes [4]
Nieru funkcija pēc medikamenta atcelšanas var atjaunoties, kompensējot cirkulējošā šķidruma apjomu un alkalizējot urīnu (urīna sārmainība samazina kristalūriju un nieru bojājumu pacientiem, kas lieto sulfonilamīdus, metotreksātu vai triemterēnu).
2. tabulā apkopoti akūtas medikamentu izraisītas nieru mazspējas prevencijas pasākumi.


2. tabula
Akūtas medikamentu izraisītas nieru mazspējas prevencija
Hroniska nieru mazspēja
Medikamentu izraisīta hroniska nieru slimība parasti manifestējas kā tubulointersticiāls bojājums. Šādu bojājumu var izraisīt ilgstoša analgētisko līdzekļu lietošana, litija sāļi, cisplatīns, ciklosporīni, nitrosurea grupas medikamenti, aristolohīnskābe (Ķīnas augu nefropātija).
Hroniska intersticiāla medikamentu izraisīta bojājuma gadījumā vēro lēni progresējošu (mēnešu vai gadu garumā) seruma kreatinīna līmeņa paaugstināšanos. Histoloģiski atrod intersticiālu fibrozi, tubulāru atrofiju, limfocitāru interstīcija infiltrāciju. Nieres parasti samazinātas izmēros. Urīna analīzē - leikocīti, eritrocīti, proteinūrija.
Vairumā gadījumu bojājums ir permanents. Dažreiz uzlabojas 5-aminosalicilskābes, mesalamīna, ifosfamīda izraisīti bojājumi (bet ne litija un ciklosporīna izraisītie).
Nefrotiskais sindroms
Nefrotisko sindromu - glomerulāras disfunkcijas rezultātu - raksturo izteikta proteinūrija. Pacientiem novēro tūskas, hipoalbuminēmiju. Iesaistītie medikamenti: NSPL, zelta sāļi, penicilamīns, alfa interferons, kaptoprils. Biežākā forma - membranoza nefropātija - ir asociēta ar visiem šiem preparātiem; minimālo pārmaiņu glomerulonefrītu apraksta pacientiem asociācijā ar noteiktiem NSPL. Alfa interferons, ciklosporīni, takrolims, litija sāļi un pamidronāts atsevišķos gadījumos var izraisīt fokālu segmentāru glomerulosklerozi.
Vairumā gadījumu medikamenta atcelšana novērš sindromu, bet iespējams arī neatgriezenisks bojājums.
Atsevišķu farmakoloģisko vielu nefrotoksicitāte
Analgētiskās vielas
Pasaulē tiek patērēts milzīgs daudzums bezrecepšu pretsāpju līdzekļu: aspirīns un citi NSPL, COX-2 inhibitori, acetaminofēns u. c. Nefroloģiski blakusefekti var attīstīties gan uz ilgstošas, pastāvīgas, gan tranzitoras (akūtā situācijā) lietošanas fona.
Analgētisko vielu izraisītas nefropātijas incidence dažādās valstīs variē atkarībā no bezrecepšu medikamentu pieejamības. Kopš kombinēto pretsāpju līdzekļu bezrecepšu tirdzniecības pārtraukšanas Austrālijā un ASV, krasi saruka analgētisko līdzekļu izraisītas nefropātijas incidence. Ir pētījumi, kas parāda augstāku analgētisko līdzekļu (acetaminofēna) ilgstošas lietošanas incidenci pacientiem ar dažāda veida hroniskām nefropātijām. Kombinētie pretsāpju līdzekļi, īpaši aspirīnu saturoši, ir nefrotoksiskāki nekā monopreparāti.
Analgētisko līdzekļu izraisītas nefropātijas klīnisko gaitu parasti raksturo lēni progresējoša nieru funkcijas samazināšanās ar akūtām pasliktināšanās epizodēm. Klasiski nieru bojājums raksturojas ar intersticiālu nefrītu un papillāru nekrozi.
Diagnozes atslēgas moments ir detalizēta hronisku sāpju un/vai pretsāpju medikamentu lietošanas (kāds medikaments, cik daudz) anamnēze. Laboratoriski konstatē sterilu piūriju (leikocītūriju bez baktēriūrijas), anēmiju, nieru ultrasonogrāfijā - nieres samazinātas izmēros, ar vai bez kalcifikācijas. Jaunākie pētījumi pierādījuši datortomogrāfijas nozīmi analgētiskās nefropātijas diagnostikā.
Dažiem pacientiem nieru bojājums turpina progresēt, neskatoties uz medikamenta atcelšanu, līdz pat dialīzes vai nieru transplantācijas nepieciešamībai. Visiem pacientiem indicēta ilgstoša novērošana, jo šajā grupā ir paaugstināta ļaundabīgu urīntrakta epiteliālo audzēju incidence.
NSPL izraisītie nefroloģiskie sindromi
Akūtu nieru mazspēju novēro 13-18% pacientu, kuri saņem ibuprofēnu. Jauniem, relatīvi veseliem cilvēkiem risks ir neliels, augstāks tas ir gados veciem pacientiem. Ņemot vērā NSPL patēriņa apjomus populācijā, cilvēku skaits, kuriem var attīsties akūta nieru mazspēja, varētu būt visai iespaidīgs.
Visbiežāk novēro prerenālu akūtu nieru mazspēju NSPL izraisītās vazodilatatoru (prostaglandīnu) sintēzes samazināšanās ietekmē, kas ved uz nieru asinsrites un glomerulārās filtrācijas pavājināšanos. Fizioloģiski nieru asinsrite nav kritiski atkarīga no prostaglandīniem, taču pacienti, kuriem nieru perfūzija jau ir samazināta hipovolēmijas dēļ (diurētisko līdzekļu lietošanas vai citu iemeslu dēļ), ir ievērojami jutīgāki pret prostaglandīnu koncentrācijas svārstībām.
NSPL izraisītas akūtas nieru mazspējas riska faktori ir preeksistējoši nieru funkcijas traucējumi, hipovolēmija, hroniska sirds mazspēja, aknu ciroze, nātrija un šķidruma zudums, lielāks vecums, vienlaicīga citu medikamentu (diurētisko līdzekļu, AKE inhibitoru) lietošana. Riska grupas pacientiem pavisam neilga NSPL lietošana, piemēram, sāpju mazināšanai pēc operācijas, var izraisīt akūtu nieru mazspēju.
NSPL izraisīts akūts alerģisks intersticiāls nefrīts visdrīzāk jāvērtē kā idiosinkrātiska reakcija (īpaši pret propionskābes atvasinājumiem - ibuprofēnu, naproksēnu, fenoprofēnu), un tas 90% gadījumu asociējas ar nefrotisko sindromu. Pretstatā citu medikamentu izraisītam akūtam AIN, NSPL-asociēta AIN gadījumā nenovēro sistēmisku hipersensivitāti - izsitumus, eozinofiliju vai eozinofilūriju. Proteinūrija parasti sasniedz nefrotisku līmeni.
NSPL var izmainīt kālija, nātrija un ūdens homeostāzi, izraisot hiperkaliēmiju, hipertensiju un hiponatriēmiju.
COX-2 inhibitoru asociēta nieru mazspēja
Arī COX-2 ihibitori (piemēram, celekoksibs) nomāc prostaglandīnu sintēzi. Sākotnēji bija cerības, ka šie medikamenti būs mazāk nefrotoksiski nekā tradicionālie NSPL, bet medicīniskajā literatūrā ir aprakstīts, ka celekoksibs izraisīja nieru bojājumu 5,6% pacientu.
Acetaminofēns
Acetaminofēns (paracetamols) retāk kā citi analgētiskie līdzekļi izraisa akūtu nieru mazspēju, jo neizsauc būtisku prostaglandīnu inhibīciju. Tomēr pēc Amerikā iegūtiem datiem acetaminofēns ir visbiežāk pārdozētais medikaments; akūta nieru mazspēja attīstās līdz 2% no saindēšanās ar acetaminofēnu gadījumiem un 10% smagas saindēšanās gadījumu. Pacientiem ar glutationa deficītu (hronisks alkoholisms, badošanās) vai, kuri lieto citohroma P-450 sistēmu inducējošus medikamentus (piemēram, antikonvulsantus), nefrotoksicitāte var izpausties arī lietojot terapeitiskas acetaminofēna devas.
Akūta nieru mazspēja manifestējas ar akūtu tubulāru nekrozi, kas var noritēt kopā ar hepatisku nekrozi. Azotēmija parasti ilgst septiņas līdz desmit dienas, taču ir atgriezeniska. Diagnoze apsverama visiem pacientiem ar kombinētu aknu un nieru disfunkciju, kā arī pacientiem ar ļoti izteiktu acidozi.
Terapija - kompensatora, iespējams - dialīze. Ja diagnoze noteikta agrīni, var nozīmēt N-acetilcisteīnu orāli.
Antibiotikas un pretvīrusu līdzekļi
Izplatīts medikamentu izraisīta nieru bojājuma cēlonis, sevišķi aminoglikozīdi hospitalizētiem pacientiem. Aminoglikozīdi galvenokārt izraisa ATN, kamēr citas antibiotikas izraisa AIN. Jāņem vērā, ka ar antibiotikām ārstējamo pacientu stāvoklis parasti ir smags pamatslimības dēļ, kura jau tā nelabvēlīgi ietekmē nieru funkcijas, paaugstinot nefrotoksicitātes risku.
Aminoglikozīdi
10-20% aminoglikozīdu grupas antibiotiku kursos attīstās nefrotoksicitāte. Pēc nefrotoksiskā potenciāla medikamentus var sarindot sekojoši (dilstošā secībā): gentamicīns ® tobramicīns ® amikacīns ® netilmicīns ® streptomicīns, kas tomēr nav absolūti, jo visi aminoglikozīdi var būt nefrotoksiski. Riska faktori - ilgstoša terapija, augsta zemākā plazmas koncentrācija (> 2 mg/l), atkārtots kurss īsā laika periodā, gados vecs pacients, malnutrīcija, dehidratācija, aknu un preeksistējošas nieru slimības, pastiprināts kālija un magnija zudums, citi nefrotoskiski preparāti vienlaikus. Kritiski slimi pacienti būtībā nav piemēroti kandidāti aminoglikozīdu terapijai, tomēr dažkārt, piemēram, kā smagas sepses gadījumos, ārstam var nebūt citas izvēles.
Klīniski aminoglikozīdu nefrotoksicitāte sākotnēji izpaužas kā neoligūriska akūta nieru mazspēja akūtas tubulāras nekrozes dēļ; urīna sedimentā - graudainie cilindri; dažkārt - Fankoni sindroms. Seruma kreatinīna līmenis paaugstinās piecu līdz desmit dienu laikā pēc terapijas sākuma, vai ātrāk sepses, hipotensijas gadījumos vai citu papildu nefrotoksīnu ietekmē. Nieru funkcija parasti ir atgriezeniska. Iespējama arī ototoksicitāte.
Pēdējā laikā ieteic apvienotu augstas devas aminoglikozīdu kursu (5-7 mg/kg/24h infūzijas veidā reizi dienā). Tā ir tikpat efektīva kā tradicionālā pieeja, kas skaidrojams ar tā saucamo postantibiotiku efektu (persistents baktericīds efekts pēc medikamenta atcelšanas) un koncentrācijas efektu (augstāka preparāta koncentrācija ātrāk un efektīvāk iznīcina patogēnu). Pagaidām nav līdz galam izprasts, kāpēc šāda stratēģija ir mazāk nefrotoksiska, bet tas varētu būt saistīts ar mazāk intensīvu aminoglikozīdu akumulāciju nierēs.
Cefalosporīni
Cefalosporīnu panesamība kopumā ir laba. Atsevišķos gadījumos ir aprakstīta cefalosporīnu izraisīta ATN, retāk AIN, biežāk saistībā ar cefaloridīnu, cefazolīnu, retāk - ar cefalotīnu un ceftazidīmu. Kombinējot ar aminoglikozīdiem vai furosemīdu, nefrotoksicitātes risks pieaug.
Aciklovīrs
Relatīvi maztoksisks. Pamatā izmanto herpesvīrusu infekcijas ārstēšanai. Perorāla uzņemšana tiek uzskatīta par drošu. Akūtu nieru mazspēju biežāk novēro, preparātu ievadot intravenozi, sevišķi, ja deva pārsniedz 500 mg/m2. Aciklovīrs vāji šķīst, tā kristāli izgulsnējas nieru kanāliņos, radot obstrukciju. Urīna sedimentā var atrast eritrocītus, leikocītus un raksturīgus - adatas formas - kristālus. Nieru funkcija parasti atgriezeniska. Toksicitāti pastiprina dehidratācija, bolus deva.
Amfotericīns B
Amfotericīns B joprojām ir sistēmiskas fungālas sepses ārstēšanas zelta standarts, lai gan daudziem pacientiem attīstās akūta nieru mazspēja saistībā ar magnija un kalcija pastiprinātu izdali ar urīnu, hipokaliēmiju, tubulāru acidozi un poliūriju diabetes insipidus dēļ. Nefrotoksicitāti izraisa deoksiholāta (amfotericīna B šķīdinātaja) tieša iedarbība uz nieru kanāliņiem un renāla vazokonstrikcija. Pārtraucot terapiju, toksicitāte izzūd. Nefrotoksicitātes risks lielā mērā atkarīgs no preparāta devas - pielietojot devu
Pentamidīns
Pentaminīdu izmanto Pneumocystis carinii ārstēšanai, galvenokārt HIV inficētiem pacientiem. Apmēram ceturtajai daļai pacientu novēro akūtu atgriezenisku nieru mazspēju un nozīmīgu hiperkaliēmiju. Tā kā HIV pacienti saņem daudz dažādu medikamentu, precīzi definēt pentaminīda lomu attiecībā uz nefrotoksicitāti ir sarežģīti. Nieru problēmu incidenci var mazināt (bet ne pilnībā izslēgt), ordinējot pentaminīdu inhalējama aerosola formā.
Penicilīni
Beta laktāmu antibiotikas, sevišķi penicilīni, ir biežākais medikamentu izraisīta AIN cēlonis. Meticilīnu, kas izsauc lielāko tiesu šo gadījumu, mūsdienās izmanto reti, bet arī visi pārējie penicilīnu analogi, lai gan retāk kā meticilīns, tomēr izraisa AIN. Drudzi, izsitumus un eozinofiliju uz akūtas oligūriskas nieru mazspējas fona novēro vismaz 30% pacientu ar beta laktāmu izraisītu AIN. Terapijā - preparāta atcelšana, var apsvērt steroīdu kursu (skat. iepriekš Akūts intersticiāls nefrīts).
Rifampīns
Ārstējot tuberkulozi, rifampīna asociētu AIN novēro bieži, pārsvarā intermitējošas terapijas fonā, vai, atsākot preparāta lietošanu, nereti stundas laikā pat pēc vienas rifampīna devas. Novēro gripai līdzīgus simptomus - paaugstinātu temperatūru, drebuļus, nespēku, galvassāpes; raksturīgas sāpes sānos, paaugstināts asinsspiediens; bieži - oligūrija. Divās trešdaļās gadījumu pacientam nepieciešama hemodialīze. Dažiem pacientiem novēro trombocitopēniju, aknu darbības traucējumus, hemolīzi. Nieru biopsijā atrod akūtu tubulāru nekrozi. Pacientu asins serumā ir konstatētas specifiskas antivielas pret rifampicīnu, bet pētījumos ar imūnfluorescences metodi - IgG depozīti kanāliņu bazālajās membrānās. Steroīdi nav efektīvi.
Antiretrovirālie (pret AIDS) līdzekļi
HIV inficētie pacienti ir akūtas nieru mazspējas augsta riska grupa. Iemesls tam ir pati HIV un citas ar to asociētās infekcijas no vienas puses un medikamenti, kurus izmanto šo pacientu ārstēšanai, no otras puses. Augstas aktivitātes antiretrovirālās terapijas preparātu (ritonavīra, adefovīra) izraisītā ATN visdrīzāk saistīta ar mitohondrālā DNS bojājumu. Turklāt ir ziņojumi par zidovudīna izraisītu smagu miopātiju un rabdomiolīzi, un, kā iepriekš minēts, indinavīra asociētu intratubulāru obstrukciju.
Kontrastvielas
Aprēķināts, ka 2003. gadā pasaulē veikti 80 miljoni izmeklējumu, patērējot 8 miljonus litru kontrastvielas. Kontrastvielas ieņem būtisku vietu starp jatrogēnas akūtas nieru mazspējas cēloņiem - ar kontrastvielas pielietošanu saista 10-12% stacionārā iegūtas akūtas nieru mazspējas gadījumu. Galvenie riska faktori parādīti 3. tabulā.


3. tabula
Kontrastvielas izraisītas nefrotoksicitātes riska faktori
Patoģenēzē, paralēli tiešai tubulārai toksicitātei, nozīme ir nieres serdes išēmijai spēcīgas un persistentas vazokonstrikcijas dēļ. Seruma kreatinīna līmenis paaugstinās pirmajā diennaktī pēc kontrastvielas ievades, maksimumu sasniedzot piecu līdz desmit dienu laikā. Nefropātija parasti ir neoligūriska ar vieglu, īslaicīgu nieru funkcijas samazināšanos. Būtiskas izmaiņas urīna sedimentā parasti nenovēro; raksturīgs izteikti zems FeNa+ rādītājs (
Domājot par profilaksi, iesaka apsvērt alternatīvas izm
eklēšanas metodes, piemēram, MRI, kurās neizmanto kontrastvielas, bet pielieto gadolīniju. Tomēr gadolīnijs var izsaukt tā dēvēto sistēmisko nefrogēno fibrozi ar multisitēmiskām fibrozējošām izmaiņām (ādā un orgānos). Pirms procedūras jāatceļ NSPL un diurētiskie līdzekļi. Fizioloģiskā šķīduma infūzija 12 stundas pirms un 12 stundas pēc procedūras ir lietderīga kā plānveida pasākums, bet nav realizējama akūtās situācijās. Praktiskāka ir izotoniskā nātrija bikarbonāta infūzija stundu (3 ml/kg/h) pirms procedūras un sešas stundas (1 ml/kg/ h) pēc procedūras. N-acetilcisteīnu, lai gan tam ir savi blakusefekti, nozīmē 600 mg devā dienu pirms un 48 stundas pēc izmeklēšanas.
Imūnsupresanti
Cilkosporīnu un takrolimu galvenokārt izmanto transplantācijas imunitātes novēršanai, lai gan to indikācijas mūsdienās paplašinās (piemēram, glomerulonefrīti). Preparāti var izraisīt gan akūtu atgriezenisku, gan hronisku permanentu nieru bojājumu. Akūta nefrotoksicitāte ir hemodinamiskas izcelsmes (vazokonstrikcija) un manifestējas terapijas pirmā pusgada gada laikā ar pēkšņu nieru disfunkciju. Izmaiņas ir devas atkarīgas un funkcija parasti uzlabojas pēc devas samazināšanas vai medikamenta atcelšanas. Pacientiem, kam veikta nieres transplantācija, akūta nefrotoksicitāte jādiferencē no transplantāta atgrūšanas.
Hroniska nefrtotoksicitāte intersticiālas fibrozes dēļ ar samazinātu GFĀ būtībā var veidoties visiem pacientiem, kuri ilgāk par gadu saņem terapijā ciklosporīnu vai takrolimu. Šī forma ir neatgriezeniska un bieži ved uz dialīzes nepieciešamību pacientiem ar jebkura veida transplantātiem.
Medikamenti, kuri ietekmē P450 sistēmas enzīmu aktivitāti, būtiski maina ciklosporīna metabolismu: eritromicīns, ketokonazols, verapamils - paaugstina preparāta koncentrāciju asinīs (palielinot nefrotoksicitātes risku); fenitoīns, barbiturātri un rifampīns paātrina ciklosporīna metabolismu, samazinot tā līmeni (transplantāta atgrūšanas risks).
Pretaudzēju līdzekļi
Daudzi medikamenti, kurus izmanto vēža terapijā, ir nefrotoksiski (4. tabula).
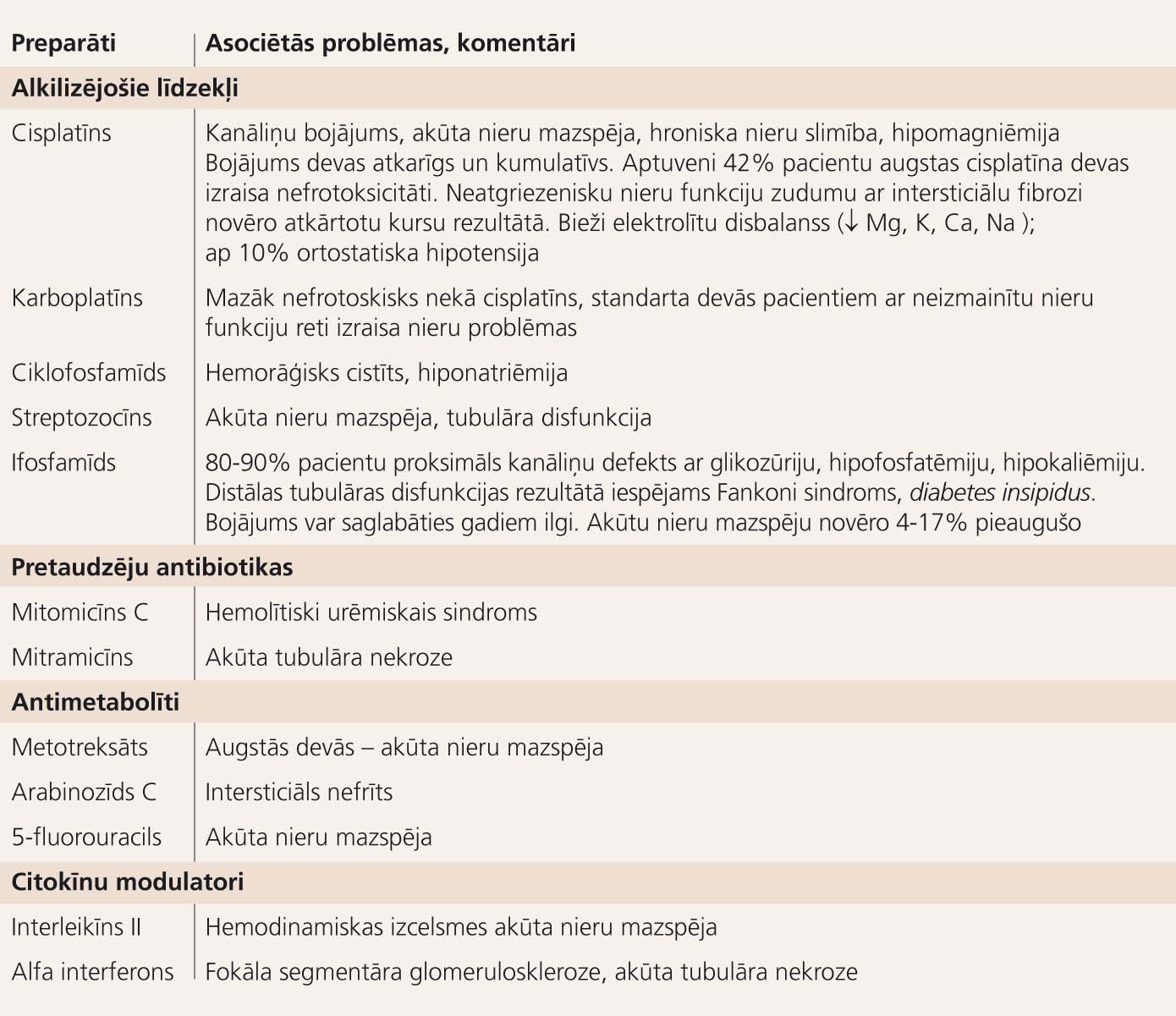

4. tabula
Ķīmijterapeitisko līdzekļu nefrotoksicitāte
Kardiovaskulārie līdzekļi
AKE inhibitori
AKE inhibitori kavē nieru slimības progresēšanu, nomāc angiotensīna II veidošanos un ietekmē audu remodelāciju, kura norit kā atbilde uz bojājumu. AKE inhibitori ir vieni no biežāk lietotajiem antihipertensīvajiem medikamentiem; ir labi zināma to nozīme hroniskas sirds mazspējas, diabētiskas nefropātijas un citu slimību ārstēšanā. Tomēr noteiktās situācijās tie var radīt nieru darbības traucējumus.
Jau drīz pēc AKE inhibitoru ieviešanas praksē novēroja akūtu nieru mazspēju pacientiem ar nieru artērijas stenozi. Šiem pacientiem glomerulārās filtrācijas ātrums ir tieši atkarīgs no angiotensīna II ietekmes uz eferento arteriolu - angiotensīns II te uztur GFĀ, tādējādi AKE inhibitori var izraisīt akūtu nieru mazspēju. Parasti, ņemot vērā citus potenciālos ieguvumus no AKE inhibitoriem, neliela seruma kreatinīna līmeņa paaugstināšanās ir pieļaujama. Savukārt GFĀ pirms terapijas uzsākšanas ir vienīgais ticamais prognostikais rādītājs attiecībā uz akūtas nieru mazspējas attīstību. Nieru mazspēja pacientiem ar renovaskulāru hipertensiju, kuri lieto AKE inhibitorus, attīstās 20-38% gadījumu. Riska faktori: vispārēja ateroskleroze, hipovolēmija, vienlaicīga diurētisko līdzekļu lietošana, sastrēguma sirds mazspēja, preeksistējoša nieru slimība ar seruma kretainīna līmeni >1,6 mg/dl.
AKE inhibitori pacientiem ar hronisku nieru slimību dažkārt asociējas ar hiperkaliēmiju. Tad, pirms atcelt AKE inhibitoru terapiju, lietderīgi vispirms pārskatīt citus lietotos medikamentus, un, ja iespējams, atcelt tos (piemēram, NSPL), kuri pasliktina kālija ekskrēciju. Pacientam jārekomendē diēta ar zemu kālija saturu. Hiperkaliēmiju mazina arī diurētiskie līdzekļi.
Galvenais AKE inhibitoru nefrotoksicitātes profilaksē ir riska faktoru apzināšana, piesardzīga preparātu nozīmēšana un šķidruma balansa nodrošināšana ar diurētisko līdzekļu samazināšanu. Ieteicams sākt ar nelielām kaptoprila devām (AKE-inhibitors ar īsu darbības laiku), tās pakāpeniski palielinot atbilstoši asinsspiediena rādītājiem un nieru funkcijai. Ja nieru funkcija ir stabila, var nozīmēt ilgstošas darbības AKE inhibitoru.
Angiotensīna II receptoru blokatori
Angiotensīna II receptoru blokatori (ARB) līdzvērtīgi AKE inhibitoriem pazemina arteriālo asinsspiedienu un samazina proteinūriju. Ir novērots, ka pacientiem ar nieru slimību ARB retāk nekā AKE inhibitori izraisa nieru darbības traucējumus. Selektīvais ARB losartāns ir drošs un efektīvs preparāts hipertensijas kontrolei pacientiem ar hronisku nieru slimību, un tā ietekme uz nieru hemodinamiku atbilst AKE inhibitoriem. Atvērts paliek jautājums, vai AKE inhibitora un ARB kombinācija ir efektīvāka par šiem preparātiem monoterapijā.
Īpaša situācija, kad AKE inhibitorus vai ARB var nozīmēt uz hroniskas nieru slimības fona, ir sklerodermijas izraisīts nieru bojājums.
Tāpat kā nozīmējot AKE inhibitorus, nepieciešams monitorēt nieru funkciju, šķidruma balansu un izvairīties no vienlaicīgas NSPL lietošanas.
Duirētiskie līdzekļi
Tiazīdu grupas diurētiskie līdzekļi un furosemīds paši par sevi reti izraisa nieru bojājumus. Problēmas saistās ar citu preparātu nefrotoksicitātes potencēšanu forsētas šķidruma izvades un hipokaliēmijas dēļ. Sevišķi bīstama šajā kontekstā ir vienlaicīga diurētisko līdzekļu, AKE inhibitoru un NSPL lietošana.
Statīni
Nav apstrīdama statīnu nozīme kardiovakulārā riska mazināšanā pacientiem ar dislipidēmiju. Tāpat statīni aizkavē nieru funkcijas pasliktināšanos pacientiem ar kardiovaskulārām slimībām. Nelabvēlīgie blakusefekti saistībā ar nierēm parasti ir viegli, īslaicīgi, un akūtu nieru mazspēju novēro reti.
Savulaik no apgrozības tika izņemts daudzsološais cervistatīns, parādoties ziņojumiem par miopātiju un rabdomiolīzi ar mioglobīnūriju, akūtu nieru mazspēju (līdz pat letālam iznākumam). Rabdomiolīzes risks, lietojot šobrīd pieejamos statīnus, ir zems, ja vien pacients nelieto medikamentus, kuri nomāc statīnu metabolismu (caur citohroma P-450 sistēmas inhibīciju) - ciklosporīnus, fibrātus, azolu grupas pretsēņu līdzekļus (piemēram, ketokonazolu), makrolīdu antibiotikas, nedihidropiridīnu kalcija kanālu antagonistus.
Pacientiem, kam indicēti statīni, vairumā gadījumu ir arī hipertensija un/vai koronārā sirds slimība, tāpēc terapijā nepieciešami vēl vairāki citi medikamenti, kas būtiski paaugstina medikamentu mijiedarbības risku. Ja pacientam ir kādas sūdzības par muskuļiem vai novēro nieru funkcijas pavājināšanos, nepieciešams noteikt kreatinīna līmeni asinīs un atcelt statīnu lietošanu.
Bifosfonāti
Turpina pieaugt ziņojumu skaits par nefrotoksicitāti pēc pamidronāta un zolendronāta lietošanas. Nefrotoksicitāte attīstās pēc vairākiem mēnešiem, seruma kreatinīna līmenim pieaugot pakāpeniski. Nieru funkcija pēc medikamenta atcelšanas parasti lēnām uzlabojas, bet ir arī neatgriezeniski bojājumi. Atsevišķās situācijās, ievadot bifosfonātus intravenozi pārāk strauji, augsta koncentrācija asinīs var izraisīt akūtu tubulāru nekrozi.
Litijs
Litija nefrotoksicitāte ir zināma jau izsenis. Nieru koncentrēšanas spējas ir traucētas apmēram 50% pacientu, poliūrija un polidipsija (diabetes insipidus) - 20% pacientu, kuri ilgstoši lieto litija sāļus. Turklāt izmaiņas saglabājas, neskatoties uz terapijas atcelšanu, kas liecina par hronisku nieru bojājumu. Intersticiālās fibrozes pakāpe atspoguļo terapijas ilgumu un preparātu kumulatīvo devu. Litija izraisīta nieru slimība progresē lēni, vairākus gadu desmitus, un var sasniegt terminālu stadiju.
Herbālie līdzekļi un pārtikas piedevas
Augu preparātu izmantošana dažādu slimību profilaksei un ārstēšanai ir ārkārtīgi populāra mūsdienu sabiedrībā. Ir pieejams milzīgs daudzums dažādu augu un citu dabiskas izcelsmes produktu, ko bez receptes var nopirkt gan aptiekā, gan veselības preču un pat pārtikas veikalos, kā arī ar interneta starpniecību. Bieži šos produktus nekontrolē neviena atbildīgā institūcija. Ir izplatīts uzskats, ka herbālie līdzekļi ir droši jau pēc savas būtības. Diemžēl daudzi augi satur substances, kurām piemīt toksiska ietekme uz nierēm. Bez tam nav izslēgta aktīvu farmakoloģisko vielu klātbūtne atsevišķos preparātos - piemēram, diurētiskie līdzekļi svara samazināšanai, NSPL vai glikokortikosteroīdi preparātos, kas paredzēti sāpju remdēšanai.
Nereti viens augs preparātā tiek aizstāts ar citu, iespējams toksiskāku. Tā ir izplatīta prakse Ķīnas tautas medicīnā. Bēdīgs piemērs tam ir tā sauktā Ķīnas augu nefropātija, kad gandrīz simts jaunām Beļģu sievietēm attīstījās strauji progresējoša nieru mazspēja pēc Ķīnas augu novājēšanas līdzekļa lietošanas. Divām trešdaļām šo sieviešu bija nepieciešama dialīze vai nieru transplantācija. Nefrotoksīns šajā gadījumā ir augos esošā aristolohīnskābe - turklāt 50% pacientu ar aristolohīnskābes izraisītu terminālu nieru mazspēju attīstās ļaundabīgi urīntrakta audzēji, novēro sirds vārstuļu patoloģijas.
Signāli par nevēlamiem blakusefektiem saistībā ar augu valsts izcelsmes preparātiem tiek saņemti pastāvīgi. Ārstam jāņem vērā, ka pacienti bieži vien neiekļauj herbālos līdzekļus (un pārtikas piedevas) atbildē uz jautājumu par lietotajiem medikamentiem, tāpēc visiem pacientiem ar neskaidras izcelsmes nieru mazspēju šādi dati jāprecizē mērķtiecīgi.
Kopsavilkumu skatīt 5. tabulā „Medikamentu izraisīts akūts nieru bojājums un renālie sindromi".
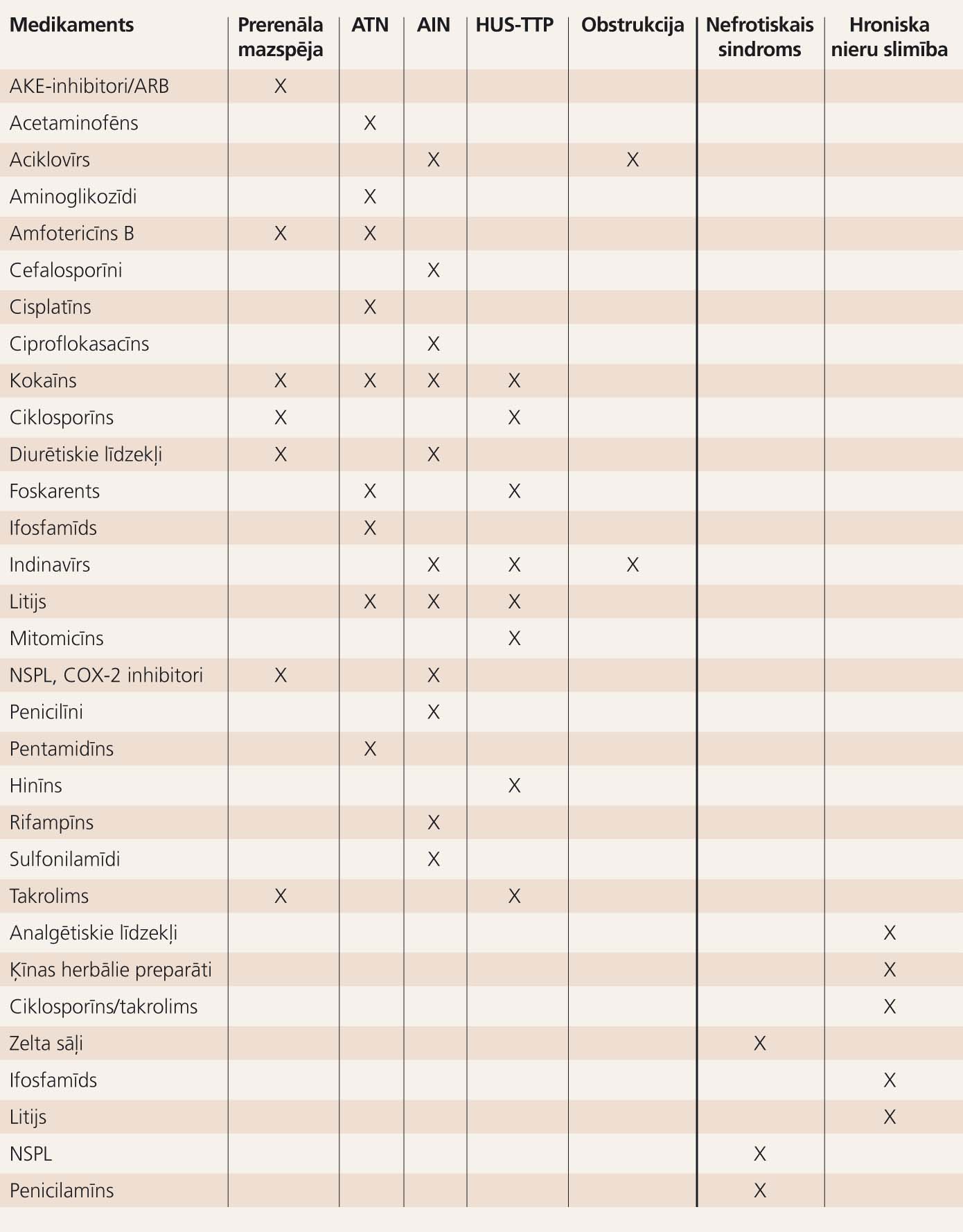

5. tabula
Medikamentu izraisīts akūts nieru bojājums un renālie sindromi
Nobeigums
Nav iespējams paturēt prātā visas zāļu vielas, kuras noteiktos apstākļos var izraisīt nefrotoksicitāti. Tādu ir daudz. Tomēr nelielu daļu no ikdienā plaši lietojamiem preparātiem praktizējošam ārstam būtu jāiegaumē. Jāzina aminoglikozīdu ietekme uz nierēm, jāprot atpazīt antibiotiku izraisītu AIN, pēc iespējas jāizvairās no NSPL un COX-2 inhibitoru nozīmēšanas. Pacientiem ar nieru slimībām ļoti piesardzīgi jālieto intravenozas kontrastvielas. Īpaša uzmanība jāvelta, ja pacients ir gados vecāks, cieš no dehidratācijas, pakļauts polifarmācijai. Pats svarīgākais - ārstam jāpazīst pacients, kuru viņš ārstē: daudziem ir vērojami riska faktori, kurus iespējams identificēt un modificēt, vai faktori, kas izslēdz kāda medikamenta pielietošanas iespējas.