Doctus decembra numurā iesākām rakstu par miokarda bojājuma bioķīmiskajiem marķieriem, galvenokārt akūta koronārā sindroma marķieriem, un sākām teorētisko daļu par biomehāniskā stresa marķieri – nātrijurētisko peptīdu. Šajā raksta daļā turpināsim par nātrijurētiskā peptīda biomarķiera lomu pie hroniskas sirds mazspējas, kā arī pievērsīsimies citiem biomehāniskā stresa, neirohormonālās aktivācijas, aterosklerotiskās pangas nestabilitātes un iekaisuma, kā arī citiem jaunākajiem marķieriem.
Biomehāniskā stresa marķieri
Nātrijurētiskā peptīda biomarķiera loma hroniskas sirds mazspējas gadījumā
Hroniskas sirds mazspējas pamatā ir cirkulējošo atriālā nātrijurētiskā peptīda (ANP) un smadzeņu nātrijurētiskā peptīda (BNP) paaugstināšanās, tāpēc tas ir nozīmīgs diagnostisks un prognostisks seruma marķieris. Sākotnējie izmeklējumi parāda, ka paaugstināts plazmas ANP korelē ar simptomātiskas sirds mazspējas funkcionālo kategoriju. Nākamie pētījumi koncentrējas uz pre-ANP N-terminālu, proti, nebioloģiski aktīvu prehormona un līdzatbrīvotāja fragmentu, kas satur bioloģiski aktīvas 28 aminoskābes C-terminālā ANP (C-ANP). N-ANP attīrās no asinīm daudz lēnāk, tāpēc cirkulē augstākā koncentrācijā nekā bioloģiski aktīvais C-ANP. Turklāt in vitro tas ir daudz stabilāks par C-ANP. Letman pārbaudīja tā specifiku un jutīgumu kā diagnostiskam testam, identificējot subjektus ar asimptomātisku kreisā kambara disfunkciju, kam sagatavota radionuklīdā angiogrāfija un klīniskais raksturojums. Šie izmeklējumi rāda, ka N-ANP neatlaidīgi paaugstinās Ņujorkas Sirds slimību asociācijas (NYHA) klasifikācijas I klases pacientiem ar asimptomātisku kreisā kambara disfunkciju un ka tas bija daudz jutīgāks un specifiskāks nekā C-termināla ANP, tādā veidā tas parādās kā svarīgs neinvazīvs seruma marķieris, ar ko var identificēt pacientus ar asimptomātisku kreisā kambara disfunkciju. Zinot, ka sirds mazspējas gadījumā plazmas BNP paaugstinās, pētījumi tika koncentrēti uz to diagnostisko izmantojamību hroniskas sirds mazspējas (HSM) noteikšanai.
Davis dati apliecināja, ka, paaugstinoties BNP līmenim, droši var noteikt kardiālu vai nekardiālu aizdusu.
Yamamoto pētījumos secināts, ka BNP rodas augstāk par N-terminālo vai C-terminālo ANP, tas darbojas kā marķieris kambaru sistoliskās vai diastoliskās disfunkcijas un kambaru hipertrofijas pacientiem, norādot uz kardiovaskulāro saslimšanu risku. BNP parāda daudz lielāku jutību un specifiskumu par N-terminālo vai C-terminālo ANP izsviedes samazināšanās vai kreisā kambara masas samazināšanās gadījumā.
Richards, sekojot līdzīgiem loģiskiem pamatojumiem par N-ANP, 2001. gadā ziņoja, ka, mērot NT-Pre-BNP 2-4 dienas pēc miokarda infarkta, bez citu mērījumu palīdzības varēja noteikt kreisā kambara funkciju un divu nākamo gadu izdzīvotības prognozi. Pašlaik apstiprināti trīs dažādi testu veidi BNP mērīšanai, lai veicinātu sirds mazspējas diagnostiku:
- 2000. gadā sabiedrība tika iepazīstināta ar ātru testu (point-of-care), kas nosaka BNP koncentrāciju plazmā (Triage BNP; BiositeDiagnostics, Sandjego Kalifornijā, ASV);
- Shionogi BNP tests ir "viena soļa" (one-step) immūnradiometrisks kvalitātes noteikšanas tests, kur izmanto divas dažādas mononukleāras antivielas, kas atpazīst C-termināla struktūru un disulfīda saiti aminoskābju gredzenā. Testa veikšanas ilgums ir 20stundas;
- 2002. gadā FDA apstiprināja pilnīgi automatizētu N-terminal pre-BNP (NT-Pro-BNP) kvantitatīvo asins testu (Roche Diagnostics).
Kopš 2000. gada parādījies ļoti daudz pētījumu un publikāciju par BNP un NT-pre-BNP mērīšanu un to saistību ar dažādām kardiālām saslimšanām. [3; 5; 7]
Hroniskas sirds mazspējas diagnostikas palīglīdzekļi
Lai gan sirds mazspējas diagnoze balstās klīniskajos simptomos un pazīmēs, bieži ir grūti noteikt precīzu diagnozi pacientam ar aizdusu neatliekamās palīdzības etapā vai ambulatorajā praksē. Labs apraksts, kā atšķirt sirds mazspējas elpas trūkumu no plaušu izraisītas aizdusas, ir Breathing Not Properly pētījumā. 1586 pacientiem, kas ar izteiktām sūdzībām par akūtu aizdusu ar neatliekamo palīdzību tika nogādāti slimnīcā, tika noteikts BNP. Pacientiem, kam noteica diagnozi "sirds mazspēja", bija daudz augstāks BNP nekā tiem, kam noteica citas slimības izraisītu aizdusu. Ja plazmā BNP > 100pg/ml, tad diagnoze "sirds mazspēja" ir jutīga, specifiska un precīza attiecīgi 90%, 76% un 83% gadījumu. Paredzamā sirds mazspējas diagnozes precizitāte pēc BNP ir līdzīga vai pat labāka nekā citām pamatmetodēm, tādām kā kardiomegālijas noteikšana krūškurvja rentgenā, sirds mazspējas anamnēze, fizioloģisko metožu izmantošana un trokšņu izmeklēšana plaušās.
BNP mērīšana pierādījusi sevi kā daudz labāka metode par plaši lietotajiem NHANES un Framingham kritērijiem, lai di agnosticētu sirds mazspēju (83% pret 67% un 73%). Šveices BASEL pētījumā tika noteikta efektivitātes vērtība, lietojot BNP kvalitātes noteikšanu kā sirds mazspējas diagnostikas metodi. Pacienti ar akūtu aizdusu (n=452) tika diagnostiski sadalīti ar divu metožu palīdzību - vai nu pēc BNP mērījuma (Biosite Triage BNP tests), vai pēc standarta metodēm, neizmantojot BNP. Izrakstot no slimnīcas, tikai 48% pacientu bija diagnoze "sirds mazspēja". Daudz mazāk pacientu no BNP grupas, salīdzinot ar kontroles grupu, tika hospitalizēti (75% pret 85%) vai ievietoti intensīvās terapijas nodaļā (15% pret 24%). Arī pacienta uzturēšanās ilgums slimnīcā bija daudz īsāks (8 dienas pret 11 dienām) un lētāks ($ 5410 pret $ 7264) BNP grupā, salīdzinot ar kontroles grupu.
Cowie novērtēja pacientus primārās aprūpes poliklīnikā ar aizdomām par sirds mazspēju pēc nātrijurētiskā peptīda daudzuma. 1022 pacientiem ar aizdomām par sirds mazspēju tika veikti dažādi neatkarīgu kardiologu novērtējumi, taču tos aizēnoja BNP dati. BNP, ANP un N-ANP tika izteikti skaitļos. Lai gan visi peptīdi korelēja ar diagnozi, BNP bija vislielākā jutība 97% un specifiskums 84%, diagnosticējot sirds mazspēju. [4; 5]
Daži mainīgie lielumi liek apsvērt, kad lietot BNPvai NT-Pre-BNP kā palīglīdzekli sirds mazspējas diagnozes noteikšanai. Daudzos pētījumos noskaidroti faktori, kas spēj ietekmēt to vērtības: vecums, dzimums, korpulence, lietotie medikamenti un nieru funkcija. Ir niansētas atšķirības starp vērtējumu sistēmām, abas BNPun NT-Pre-BNP ir daudz labākas par "izslēgšanas" vai "ieslēgšanas" metodēm sirds mazspējas diagnostikā. Visbeidzot, tāpat kā visi asins testi, arī BNPun NT-Pre-BNP nebūtu jālieto vieni, bet gan kā komplekss kopā ar klīniskiem simptomiem un citiem izmeklējumiem. [1; 5; 6; 7; 8; 10] Nātrijurētiskais peptīds kā hroniskas sirds mazspējas rādītājs redzams attēlā.
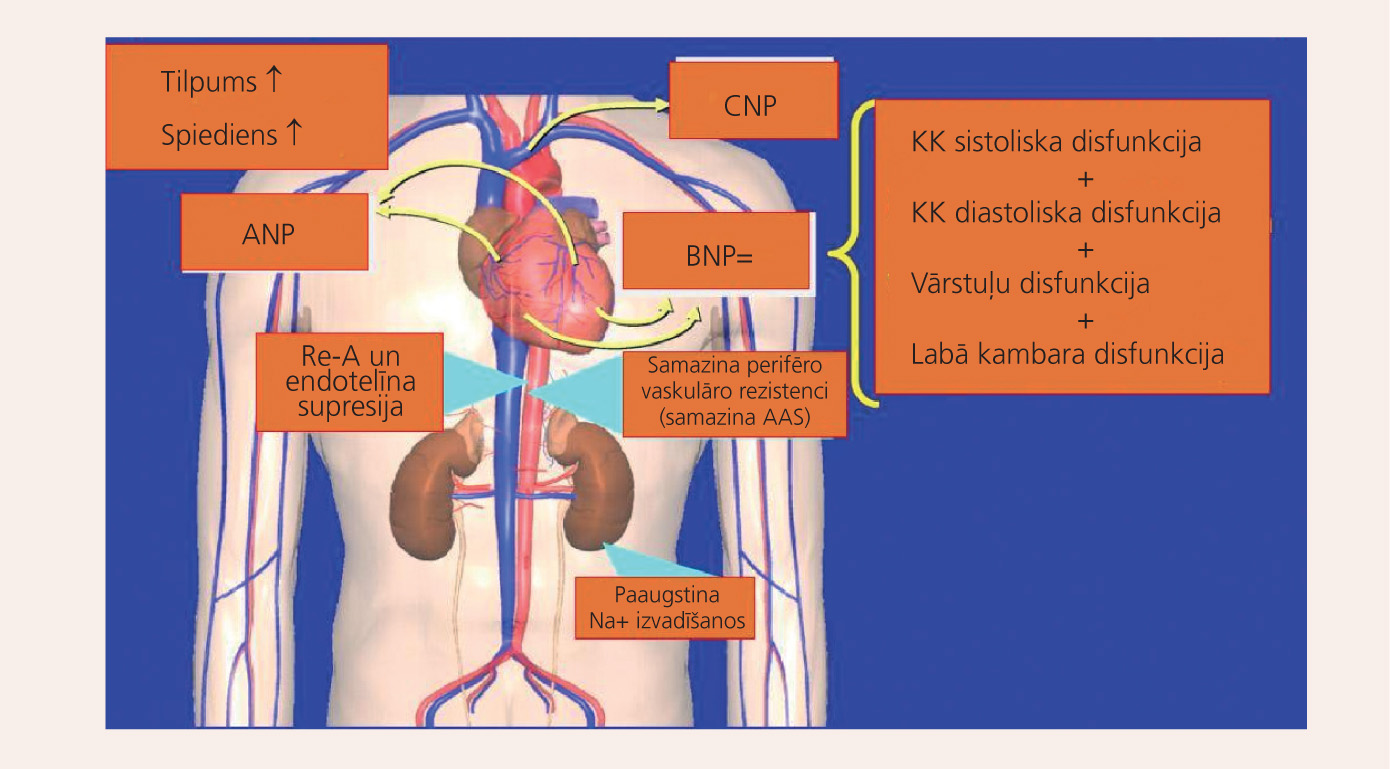

Attēls
Nātrijurētiskais peptīds – hroniskas sirds mazspējas kvantitatīvais rādītājs
BNP un NT-proBNP klīnisko ainu reāli neatspoguļojošie jeb "viltus pozitīvie" dati [7]:
- plaušu embolija;
- hroniska sirds mazspēja un elpas trūkums, kura iemesls nav hroniska sirds mazspēja;
- HOPS ar cor pulmonale;
- sepse;
- ne-kardiāls elpas trūkums un pieaugošs vecums;
- nieru darbības traucējumi (HNS);
- aptaukošanās;
- perikarda saaugumi;
- sirds tamponāde;
- HSM ar zemu BNP (retums).
Hroniskas sirds mazspējas diagnostiskie marķieri - kāpēc tik gari un tik daudz par nātrijurētiskajiem peptīdiem?
Visās četrās sirds mazspējas stadijās, no A līdz D, plazmas BNPvai NT-Pre-BNP nodrošina prognostisku informāciju. Val-HeFT izmēģinājuma apakšpētījumā noteikts, ka pacientiem, kuru plazmas BNP koncentrācija ir augšējā ceturksnī (≥ 238 pg/ml), ir daudz augstāks letalitātes risks nākamo 2 gadu laikā nekā pacientiem, kuru plazmas BNP koncentrācija ir zemākajā ceturksnī (≤ 41 pg/ml) (32,4% pret 9,7%). Ja pacientu hospitalizē ar sirds mazspējas diagnozi un pirms izrakstīšanās nosaka plazmas BNP, tad var paredzēt letalitātes vai atkārtotas hospitalizācijas risku. Meta-analīzē no 19 pētījumiem, kur plazmas BNP tika izmantots, lai novērtētu letalitātes risku vai kardiovaskulārās sistēmas klīnisku pasliktināšanos pacientiem ar sirds mazspēju, noskaidrojās, ka BNP palielināšanās par katriem 100 pg/ml saistīta ar 35% augstāku nāves relatīvo risku. Turklāt plazmas BNP ir labāks notikumu noteicējs nekā tradicionālie riska faktori, tādi kā sirds mazspējas funkcionālās klases pēc NYHA un kreisā kambara izsviedes frakcija. [3; 4; 8; 9; 10]
Augšanas diferenciācijas faktors - 15
Augšanas diferenciācijas faktors - 15 (Growth differentiation factor (GDF)-15) ir attāls transformējošo augšanas faktoru - b citokīnu grupas pārstāvis un pirmo reizi tika klonēts kā makrofāgu inhibitoru citokīns 1. GDF-15 izdale miokarda šūnās cieši saistīta ar dažādiem stresoriem, ieskaitot oksidācijas procesu produktus un iekaisuma citokīnus. GDF-15 izdali aktivizē spiediena pārslodze, kas apliecināts eksperimentos ar dzīvniekiem, kam ir dilatācijas kardiomiopātija. Literatūras dati apliecina, ka GDF-15 veicina antiapoptotiskos, antihipertrofiskos un antiremodelācijas procesus. Imūnradiometriskie mērījumi apliecina, ka pacientiem ar hronisku sirds mazspēju ir paaugstināts cirkulējošais GDF-15 līmenis. [10]
Ņemot vērā, ka GDF-15 var kalpot kā dažādu stresa norišu marķieris, paaugstināts GDF-15 līmenis sniedz prognostisku vērtējumu par HSM norisi. [10; 11]
Kempfa un līdzautoru rakstā apliecina, ka klīniskajā praksē izmantotie t.s. "klasiskie marķieri" kā NYHA klases, KKIF un NT-proBNP vai BNP apvienojumā ar cirkulējošā GDF-15 rādītājiem ir jo vairāk informatīvi un ļauj izvērtēt potenciālo risku.
GDF-15 ir paaugstināta mirstības riska marķieris pa cien tiem ar HSM, turklāt sniedz neatkarīgu prognostisko informāciju bez tiešas saistības ar "klasiskajiem marķieriem". Pēc literatūrā aplūkotajām riska analīzēm GDF-15 un KKIF ir būtiskākie mirstības riska rādītāji HSM pacientiem, turklāt GDF-15 informatīvā vērtība saglabājas pietiekami augsta arī tādām klīniski sarežģītām pacientu grupām kā atšķirīgs ķermeņa masas indekss, HSM etioloģija, nieru funkcija un dažādas anēmijas vai hiperurikēmija, kur, kā zināms, klasisko marķieru dati var būt gan viltus pozitīvi, gan negatīvi (BNP un NT-proBNP). GDF-15 ļauj precizēt pacientu riska grupas gan ar zemu, gan ar augstu BNP vai NT-proBNP.
GDF-15 līmenis neatkarīgi saistīts ar:
- pacientu vecumu,
- NYHA funkcionālo klasi,
- nieru funkcijas traucējumiem,
- urīnskābes līmeni,
- metabolajām anomālijām, ko novēro pacientiem ar HSM,
- miocītu iestiepuma marķieri NT-proBNP.
GDF-15 vērtējams kā nozīmīgs mirstības riska marķieris pacientiem ar HSM. Ja GDF-15 līmenis pārsniedz vidējo pieaugumu 2000 ng/l vai vairāk nekā 2729 ng/l, tas norāda uz ievērojami paaugstinātu mirstības risku un ir neatkarīgs riska apliecinājums pacientiem ar HSM un potenciāli paaugstinātu mirstības risku. [10; 11]
ST2
ST2 ir IL1-receptoriem līdzīgais proteīns, kura līmenis serumā palielinās, sirdij sastopoties ar mehānisku stresu. [15] ST2 ir informatīvs, lai prognozētu kardiovaskulāro nāvi pēc akūta koronārā sindroma (AKS). ST2 ir kā mērķis interleikīnam IL-33, kam atzīmē kardioprotektīvas īpašības un kas ir sastopams tikai gadījumos, ja miocītiem ir biomehānisks stress. [16] IL-33 antagonizē angiotenzīna II darbību un fenilepinefrīna inducētu kardiomiocītu hipertrofiju. Pastāv uzskats, ka ST2 un IL-33 mijiedarbība mazina ateromas attīstību, korelācija ar NTproBNP līmeni pēc akūta miokarda infarkta ļauj secināt par prognostisko vērtību mirstības prognozēšanā 6 mēnešu laikā pēc akūta miokarda infarkta. [17; 18] ST2 ir paaugstināts arī bronhiālās astmas paasinājumu un autoimūno saslimšanu gadījumā. [19; 20; 21]
ET1/CTproET1
Endotelīns-1 vai stabilākā pro-Endotelīna C-termināla daļa (CTproET1) arī ir viens no paaugstinātas mirstības riska vai sirds mazspējas attīstību prognozējošajiem marķieriem pacientiem pēc pārciesta akūta miokarda infarkta. [22] ET-1 ir peptīds ar potenciālām vazokonstriktora īpašībām, atrodams asinsvadu endotēlija šūnās, bet pēc tam var tikt izolēts plaušu, nieru un gludās muskulatūras šūnās. Tas aktivizē ETA un ETB receptorus, ETA receptori galvenokārt atrodas asinsvadu gludās muskulatūras šūnās, ietekmējot vazokonstrikciju un nātrija aizturi, savukārt ETB receptori galvenokārt atrodas endoteliālajās šūnās, kur kalpo kā starpnieki slāpekļa oksīda izdalei, nātrijurēzei un diurēzei. [23] Endotelīna pieaugums novērojams miokarda infarkta gadījumā, tam paplašinoties, un samazinātas koronārās plūsmas gadījumā, ievērojami endotelīna līmenis pieaug pēc kardiogēnā šoka. [24] ET-1 ir ļoti nestabils, un tā līmeņa noteikšana ir problemātiska, jo ET-1 ir tieksme saistīties ar citiem proteīniem un receptoriem, savukārt CTproET1 ir stabils prekursoru izdales blakusprodukts, kas ļauj noteikt endoteliālās sistēmas aktivitāti. ET-1 pieaugums līdzīgi kā CTproET1 pieaugums pacientiem pēc MI norāda uz paaugstinātu mirstības ris ku no sirds mazspējas. Mērījumus neietekmē vecums, Kilipa klases un nesenā anamnēze. CRproET1 koncentrācija plazmā augstāko līmeni sasniedz otrajā dienā. [25]
Neirohormonālās aktivācijas marķieri
Adrenomedullīns
Adrenomedullīns (ADM) pirmo reizi tika identificēts cilvēka feohromocitomas šūnās, taču tam raksturīga intensīva izdale arī endoteliālajās šūnās. ADM kalpo par starpnieku cAMP (cikliskā adenozīnmonofosfāta) izdalē ar sekojošu vazodilatāciju un hipotensiju. Literatūrā tiek aprakstīta ADM kardioprotektīvā loma pacientiem insulta laikā. ADM aktivitāte kardiovaskulārajā sistēmā ir līdzīga BNP: NO produkcijas pieaugums, vazodilatācija, nātrijurēze un diurēze. Līdzīgi BNP - ADM izdale ir proporcionāla sirds mazspējas smaguma pakāpei un apgriezti saistāma ar kreisā kambara izsviedes frakciju. [26; 27] ADM plazmā noteikt ir sarežģīti, jo tas daļēji saistās ar komplementu. Mērījumiem izmanto vidus reģiona fragmentu no proadrenomedullīna peptīda, kas ir stabilāks un tiek sekretēts līdzīgā koncentrācijā kā ADM. MRproADM līmeņa paaugstinājums pēc akūta miokarda infarkta saistās ar paaugstinātu mirstības, sirds mazspējas attīstības un abiem riskiem kopā, bet informativitāte ir samērojama ar NTproBNP. MRproADM līmenis mēdz būt augstāks sievietēm un pieaug līdz ar vecumu. [27; 28]
C termināla vazopresīns (kopeptīns)
Kopeptīns ir ne tikai tiešs miokarda šūnu bojājuma marķieris, bet tā izmaiņas sniedz arī prognostisku informāciju. Kopeptīna izmaiņas raksturo paaugstinātu mirstības risku no sirds mazspējas attīstības pacientiem pēc akūta miokarda infarkta 60 dienu laikā, taču saistība starp kopeptīnu un kreisā kambara disfunkciju saglabājas ievērojami ilgāk. [29; 30]
Aterosklerotiskās pangas nestabilitātes un iekaisuma biomarķieri
Augsta jutīguma C reaktīvais proteīns
Akūta koronārā sindroma patofizioloģijā viens no pamata stūrakmeņiem ir nestabilā aterosklerotiskā plātne. Ir pierādīts, ka viens no spēkiem, kas veicina ateromatozās plātnes plīsumu vai eroziju, kuras veicina kaskādi, kas noved pie koronārās artērijas oklūzijas, ir šīs plātnes iekaisums. Paaugstināts C reaktīvā proteīna (HsCRP (High-sensitivity C-reactive Protein)) līmenis arī šķietami veseliem indivīdiem liecina par paaugstinātu kardiovaskulāro risku, ko apliecina virkne liela apjoma pētījumu. [31]
C reaktīvā proteīna (CRP) un HsCRP loma riska noteikšanā ir apliecināta daudzos literatūras avotos, lai gan joprojām paliek diskutabli vairāki jautājumi, to skaitā informativitāte un tās vērtība pēc akūta koronāra sindroma vai miokarda infarkta. CRP pieaugums akūtā miokarda infarkta fāzē var liecināt par draudošu miokarda ruptūru, kambara sienas aneirismu un trombu veidošanos. [31; 32] Interesanti, ka CRP līmeņa pieaugums pēc akūta miokarda infarkta neliecina par paaugstinātu atkārtota infarkta risku. Problēma izmantot CRP kā precīzu diagnostisko marķieri ir tā nespecifiskums saistībā ar citām iekaisīgām saslimšanām un klīniskajiem stāvokļiem, kuru gadījumā pieaug iekaisuma marķieri (reimatoīdais artrīts, onkoloģiskās saslimšanas, citu orgānu sistēmu iekaisīgas patoloģijas), taču līdz ar jaunas, kvalitatīvas metodes noteikšanas iespējām (Human Pentraxin 3) iespējas uzlabojas. Human Pentraxin 3 ir izoforma, kas tiek sek retēta tikai asinsvadu endotēlijā un tādējādi var sniegt daudz precīzāku informāciju par iekaisīgām aktivitātēm aterosklerotiskajā pangā. [33; 34]
Mieloperoksidāze
Leikocītiem ir ļoti būtiska nozīme aterosklerotiskās pangas plīsuma norisē. Mieloperoksidāze (MPO) leikocītos aktivizē metaloproteināzes un inaktivizē plazminogēna aktivatora inhibīciju. Leikocīti turklāt patērē NO katalītiski, tādējādi veicinot vazokonstrikciju un endotēlija disfunkciju. MPO ir atrasta ateromatozajā plāksnē, pacientiem ar stabilu stenokardiju novēro neitrofīliju ar augstu MPO līmeni, kas ievērojami samazinās pēc akūta koronārā sindroma. [35; 36] Ja pēc akūta koronārā sindroma saglabājas augsts MPO līmenis, tā ir nelabvēlīgas prognozes pazīme - gada laikā augsts pēkšņas nāves vai akūta miokarda infarkta risks. MPO līmenis pēc akūta miokarda infarkta pieaug agrīni, stabilizējas un nekorelē ar troponīniem un neitrofīliju. MPO līmenim nav novērota saistība ar sirds mazspējas attīstības risku, nav datu par izmaiņām saistībā ar primāru intervencionālo ārstēšanu. [35; 36] Tajā pašā laikā paaugstināts MPO līmenis norāda uz augstu kardiālās nāves vai miokarda infarkta risku, ja NT-proBNP līmenis vienlaikus saglabājas zems vai vidējs. Ja paaugstināti abi šie radītāji, risks būtiski pieaug. [35; 36]
Epidemioloģiskajos pētījumos paaugstināts MPO un CRP līmenis norāda uz nākotnē paaugstinātu koronāras sirds slimības risku. [36]
Ar grūtniecību saistītais plazmas proteīns
Ar grūtniecību saistītais plazmas proteīns jeb PaPPA ir proaterosklerotiska metaloproteināze, kuras palielināta izdale novērojama saistībā ar nestabilu aterosklerotisko pangu un tās ekstracelulārajām matricēm. [40] PaPPA neizdalās stabilā pangā. Cirkulējošais PaPPA daudz augstākā koncentrācijā sastopams pacientiem ar nestabilu stenokardiju un akūtu miokarda infarktu, korelējot ar insulīnam līdzīgo augšanas faktoru un CRP, bet ne ar troponīnu. Interesanti, ka PaPPA > 2,9 mIU/l norāda uz 4,6 reizes augstāku kardiovaskulārās nāves, miokarda infarkta vai revaskularizācijas risku pat bez paaugstināta troponīna līmeņa. [41] Darbību raksturo insulīnam līdzīgā augšanas faktora (insulin-like growth factor 1 (IGF-1)) šķelšana kā pretējs efekts endotēlija disfunkcijai, jo saistās pie augstas piesaistes intensitātes vietām endotēlijā, kas aktivizē slāpekļa oksīda izdali. PaPPA atrodams bojājuma skartos audos, kur veicina atjaunošanās procesus, darbojoties kā iekaisuma kavētājs. [42]
Līdzīgi CRP - PaPPA palielināta izdale saistās ar nestabilas aterosklerotiskās pangas attīstību, tostarp arī miega artērijās. PaPPA līmeņa paaugstinājums var kalpot kā paaugstinātas kardiovaskulārās nāves riska, iespējama miokarda infarkta un revaskularizācijas pazīme, taču nav datu, ka PaPPA paaugstinājums norādītu uz sirds mazspējas attīstību. [41; 42]
Citi jauni biomarķieri
MMP9, MMP2, TIMP1
Strukturālā miokardiālās ekstracelulārās matrices (Extracellular Matrix (ECM)) vienotība ir atkarīga no endoganā cinka atkarīgajām endopeptidāzēm, kas zināmas kā matrices metaloproteināzes (matrix metalloproteinases (MMP)). Šo enzīmu regulēšanu nodrošina metaloproteināžu audu inhibitori (tissue inhibitors of metalloproteinases (TIMPs)). MMPs degradē miokarda ECM, kas izraisa kreisā kambara dilatāciju un sirds mazspēju. Šo enzīmu inhibīcija eksperimentālajā akūta miokarda infarkta modelī saistās ar samazinātu kreisā kambara dilatāciju un sienas stresu. [43; 44] Līdzīgi NTproBNP - TIMP1 un MMP9 saistās gan ar kardiovaskulāro nāvi, gan ar sirds mazspēju vai abām kopā, taču TIMP1 un MMP9 nav saistības ar atkārtotu infarktu. MMP2 līmenis pēc miokarda infarkta ir paaugstināts, [45] un šis paaugstinājums saistāms ar nelabvēlīgu prognozi. [46] MMP3 pieaugums maksimumu sasniedz 72 stundās, bet plato līmenis saistās ar palielinātu kreisā kambara tilpumu un zemu kreisā kambara izsviedes frakciju nākotnē. [46; 47]
* Raksta pirmā daļa Doctus 2010. gada decembra numurā.