Šajā klīniskajā gadījumā aprakstīta grūti atklājama diagnoze, kas praksē nav sastopama bieži. Simptomi ir nespecifiski un spilgti izpaužas tikai slimības vēlākajās stadijās, tāpēc ārstēšana var būt arī novēlota.
Klīniskais gadījums
Paciente, 31 gadu veca, 2012. gada 2. februārī 34. grūtniecības nedēļā piedzīvo spontānas priekšlaicīgas dzemdības savam otrajam bērnam. Pēc bērna piedzimšanas seko izteikta, pastāvīga asiņošana no dzimumceļiem menstruāciju laikā.
Pēc vairākām konsultācijām pie ģimenes ārsta un ginekologa dzemdes asiņošanas iemesls netiek noskaidrots. 2012. gada jūnijā ginekoloģiskajā ultrasonogrāfijā nav redzamas patoloģiskas izmaiņas, lai gan konstatē paaugstinātu β–hCG līmeni serumā (2690 mU/ml; norma < 5 mU/ml). Pēc dzemdībām uz sešiem mēnešiem parakstīta orālā hormonālā kontracepcija.
Plaušu artērijas trombembolija
2013. gada augustā paciente piedzīvo epizodi ar asām durošām sāpēm krūškurvja kreisajā pusē un klepu vairāku dienu garumā. Ģimenes ārsts pacientei veic krūškurvja rentgenogrāfiju un sakarā ar aizdomām par pneimoniju paraksta empīrisku antibakteriālu terapiju.
2013. gada septembrī, saglabājoties sūdzībām, paciente tiek stacionēta plašākai izmeklēšanai. Datortomogrāfijā krūškurvim ar kontrastvielu atklāj abpusēju plaušu artērijas trombemboliju. Labās plaušas artērijā novēro oklūziju ar rekanalizācijas pazīmēm, bet kreisās lejasdaivas artērijā redzamas svaigas okluzīvas pārmaiņas. Pacientei redzamas arī varikozas vēnas mazajā iegurnī un nehomogēna dzemdes struktūra.
EKG, asinsaina, rutīnas asins bioķīmija un koagulogramma normas robežās. Pacientei sāk antikoagulāciju ar rivaroksabānu un kā trombembolijas riska faktoru atceļ hormonālo kontracepciju. Pacienti ambulatori atkārtoti konsultē ginekologs, bet nozīmīgas novirzes neatrod.
2013. gada oktobrī kāju vēnu dupleksa ultrasonogrāfijā nav redzamas dziļo vēnu trombozes pazīmes. 2013. gada decembrī veikta kontroles plaušu datortomogrāfija ar kontrastvielu, kur novēro jaunu infarktpneimoniju labajā lejasdaivā un rekanalizāciju kreisās lejasdaivas artērijā. Mazā iegurņa vēnas bez izmaiņām dinamikā. Arī atkārtotā ginekoloģiskajā ultrasonogrāfijā nekādas patoloģiskas novirzes netiek atrastas. Asins analīzes saglabājas normas robežās, izņemot viegli paaugstinātu CRO līmeni (20,2 mg/l; norma < 5 mg/l). Veic ģenētisko testēšanu uz biežākajām iedzimtas trombofīlijas mutācijām, kuras ir negatīvas. Turpina terapiju ar rivaroksabānu.
2014. gada maijā izmeklējumos redzams, ka progresējusi vēnu varikoze mazajā iegurnī. 2014. gada jūlijā nolemj veikt v. cava inferior filtra implantāciju un v. uterina sinistra embolizāciju, lai novērstu tālāku trombemboliju. Pacientei attīstās sekundāra anēmija izteiktas menstruālās asiņošanas dēļ, ko pastiprina antikoagulācija. 2014. gada augustā pacientei plānveidā veic laparotomisku histerektomiju bez piedēkļiem. Dzemdes histoloģiskajā preparātā novēro palielināšanos, kas atbilst 5.—6. grūtniecības nedēļai, taču citas patoloģiskas novirzes neredz.
Stāvokļa pasliktināšanās
2014. gada septembrī pacientes vispārējais stāvoklis pasliktinās, progresē elpas trūkums, nespēks, tūska uz kājām. Seko atkārtotas ārstu konsultācijas un pārbaudes uz kardioloģiskām, autoimūnām, hematoloģiskām, endokrīnām, onkoloģiskām slimībām. Simptomu pasliktināšanās cēlonis paliek bez izskaidrojuma.
2014. gada novembrī bronhodilatācijas testā redzami viegli nereversibli obstruktīva tipa ventilācijas traucējumi.
2015. gada janvārī paciente nokļūst PSKUS Neatliekamās medicīnas centrā ar smagu aizdusu un akrocianozi. Paciente tiek izmeklēta Latvijas Kardioloģijas centrā: D dimēru līmenis ir 1,82 mg/l (norma < 0,50 mg/l). Plaušu datortomogrāfijā redzama hroniska PATE un salīdzinājumā ar iepriekšējo izmeklējumu palielinājies trombotisko masu apjoms. Plaušu asinsvadu zīmējumā novērojamas diseminētas izmaiņas ar rupjšķiedrainu fibrozi un matstikla aizēnojumiem. Pacientes sirds mazspēja vērtējama ar IV funkcionālo klasi pēc NYHA.
Ehokardiogrāfiski redzama sirds labo daļu dilatācija, mērena trikuspidāla regurgitācija, aprēķinātais sPAP (sistoliskais plaušu artērijas spiediens) — 75 mmHg. Tāpēc tiek veikta sirds labo daļu katetrizācija, kur konstatē mPAP (vidējo plaušu artērijas spiedienu) 30 mmHg, apstiprinot pulmonālo hipertensiju. Tiek sākta specifiska medikamentoza terapija ar riociguatu, kas būtisku klīnisku uzlabojumu nedod.
Papildus tam pacientei konstatē subklīnisku hipertireozi.
Pulmonālā endarterektomija
Ar pacientes gadījumu iepazīstina speciālistus Vīnes Universitātes slimnīcā, lai apsvērtu ķirurģisku pulmonālu endarterektomiju (PEA). 2015. gada 9. martā paciente iestājas šīs slimnīcas torakālās ķirurģijas nodaļā. Tiek atkārtoti attēldiagnostikas izmeklējumi — ehokardiogrāfijā redzams mazs kreisais kambaris ar normālu sienas biezumu un hiperdinamisku sistolisko funkciju, viegli palielināti priekškambari, dilatēts labais kambaris ar mērenas līdz augstas pakāpes disfunkciju, normāls aortas vārstulis, viegla mitrāla regurgitācija, augstas pakāpes trikuspidāla regurgitācija. Aprēķinātais sPAP — 103 mmHg, minimāls saturs perikardā.
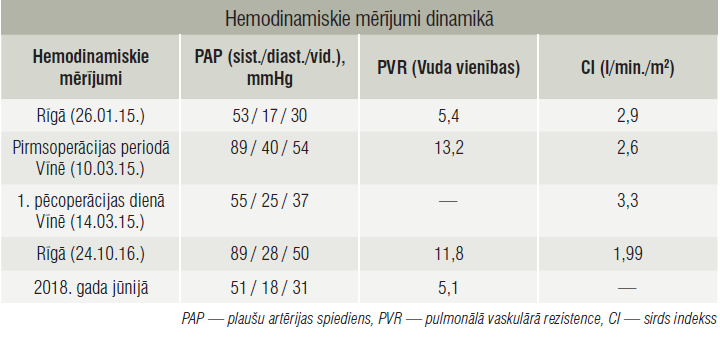

Tabula
Hemodinamiskie mērījumi dinamikā
Koronārā angiogrāfija bez nozīmīgām stenozēm. Labo sirds daļu katetrizācijā redzams hemodinamisko traucējumu progress (tabula). Diagnostiskie testi saskan ar hroniskas trombemboliskas pulmonālas hipertensijas (HTEPH) diagnozi, taču pildījuma defekts, kas aizņem visu labo plaušu artēriju, rosina aizdomas par angiosarkomu. Starpdisciplinārā HTEPH komandas konsilijā nolemj, ka PEA ieguvumi pārsniedz risku, tāpēc 2015. gada 13. martā pacientei veic PEA bez sarežģījumiem (1. attēls).
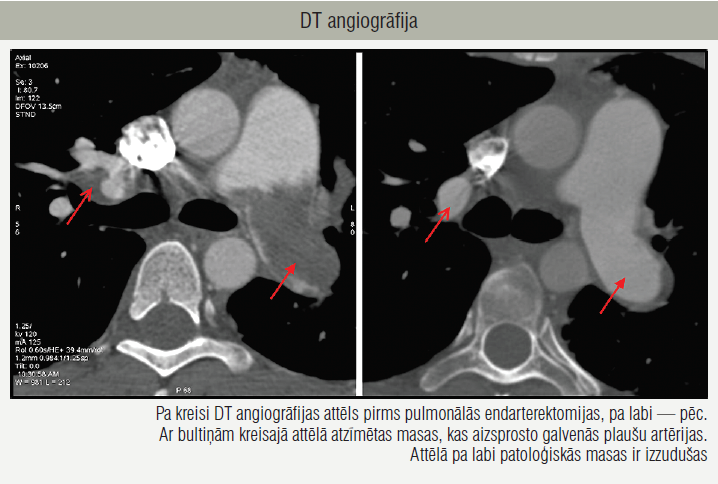

1. attēls
DT angiogrāfija
No labās plaušu artērijas izņemts tumors, kas sniedzies līdz daivu un segmentu artērijām. Histoloģiski audzējs atbilst horionkarcinomai. Retrospektīvā pacientes seruma analīzē pirms operācijas β–hCG līmenis bijis 294 742 mU/ml. Pēc onkologu rekomendācijām pacientei sākta ķīmijterapija pēc PEB shēmas četros ciklos.
Pēdējais ķīmijterapijas kurss pabeigts 2015. gada jūlijā ar labu panesību. 2015. gada septembrī β–hCG — 6,3 mU/ml. Pacientei atjaunojas pilnas funkcionālās spējas. Funkcionālā klase pēc NYHA no IV klases pazeminās līdz I—II klasei. 2016. gada augustā kontroles datortomogrāfija uzrāda gandrīz pilnu abu plaušu artēriju revaskularizāciju.
Balona pulmonālā angioplastika
Tomēr 2016.—2017. gadā pacientei pakāpeniski atjaunojas simptomi. Ehokardiogrāfiski redzama sirds labo daļu pārslodze un paaugstināts sistoliskais plaušu artērijas spiediens.
Pēc Eiropas Kardiologu biedrības vadlīnijām nākamais solis HTEPH izvērtēšanā ir plaušu ventilācijas—prefūzijas scintigrāfija jeb V/Q scan, kādu Latvijā neveic, tāpēc to izdara Tartu, Igaunijā (Latvijā veic plaušu perfūzijas scintigrāfiju, bet ne ventilācijas sadaļu, kas ļauj novērtēt perfūzijas defektus plaušu apvidos ar normālu ventilāciju).
2016. gada jūnijā minētajā izmeklējumā redzama ventilācijas—perfūzijas nesaderība (perfūzijas defekti) hroniskas distālas trombemboliskas pulmonālas hipertensijas dēļ.
Konvencionāla pulmonālā angiogrāfija apstiprina okluzīvas izmaiņas plaušu artēriju distālajās daļās. Pacientes simptomātika atbilst sirds mazspējas III funkcionālajai klasei pēc NYHA. Tālākajā ārstēšanā nolemts lietot balona pulmonālo angioplastiku (BPA) Vīnes Universitātes slimnīcā. 2017. gada novembrī veikta pirmā BPA sesija, 2018. gada martā — otrā, jūnijā — trešā, septembrī — ceturtā.
Raksta publicēšanas brīdī pacientes funkcionālais stāvoklis ir uzlabojies — I klase pēc NYHA. Sešu minūšu iešanas testā paciente noiet 525 metrus, elpas trūkums — 2 balles no 10 pēc Borga skalas.
Pacientes medikamentozā terapija patlaban:
- riociguats 2,5 mg 3 × dienā,
- varfarīns 5 mg 1 × dienā,
- ivabradīns 7,5 mg 2 × dienā,
- torasemīds 10 mg 1 × dienā,
- spironolaktons 25 mg 1 × dienā,
- tiamazols un tiroksīns pēc endokrinologa norādījumiem.
Teorētiskais pārskats
Horionkarcinoma
Horionkarcinoma ir gestācijas trofoblasta slimības paveids, kam raksturīga izteikti ļaundabīga gaita ar agrīnu vaskulāru invāziju un plašām hematogēnām metastāzēm. Horionkarcinoma ir histoloģiski agresīvākais gestācijas trofoblasta slimību veids.
Tā sākas no audiem, kas normālā gadījumā kļūtu par placentu, un sastāv no anaplastiskām sincitiotrofoblasta un citotrofoblasta šūnām bez bārkstiņām. Lielākoties patoloģija rodas dzemdē, taču ārpusdzemdes grūtniecība var radīt primāro lokalizāciju citviet. Kopumā horionkarcinoma veidojas vienā no 30 000 grūtniecībām. [1]
Horionkarcinoma var attīstīties pēc jebkāda veida grūtniecības, bet visbiežāk pēc molāras grūtniecības (situācijas, kad kļūdainas olšūnas apaugļošanās gadījumā rodas defektīvas horija bārkstiņas ar trofoblasta hiperplāziju, bet neattīstās embrijs). Retākos gadījumos horionkarcinoma rodas pēc nemolāras grūtniecības — šajā gadījumā diagnoze nereti ir novēlota, tāpēc biežāk vērojamas metastāzes. Metastazēšanās gadījumā biežākās lokalizācijas ir plaušas (80 %), smadzenes, aknas, iegurnis, maksts, liesa, zarnas, nieres. [2]
Horionkarcinomas biežākās izpausmes ir pastiprināta asiņošana no dzimumceļiem un paaugstināts β–hCG līmenis asinīs. Pastiprināta asiņošana vairāk nekā sešas nedēļas pēc grūtniecības jāizmeklē, nosakot β–hCG, kas var norādīt uz jaunu grūtniecību vai gestācijas trofoblasta slimību. Saistībā ar klīnisko gadījumu jāpiemin, ka paaugstināts β–hCG līmenis stimulē TSH receptorus, kas var izraisīt hipertireozi. Biežākās plaušu metastāžu izpausmes ir nespecifiskas: elpas trūkums, sāpes krūtīs, klepus, asins spļaušana, kas drīzāk radītu aizdomas par pneimoniju, tuberkulozi vai PATE. [2]
Horionkarcinomas terapijā efektīva ir ķīmijterapija, kas dažādās shēmās samērīgi audzēja stadijai nodrošina remisiju pat 91 % gadījumu. Ķirurģiska iejaukšanās nav standarta metode horionkarcinomas ārstēšanā. Pēc ESMO vadlīnijām [3] operācija atlieku audiem pēc pabeigtas ķīmijterapijas nav jāveic, jo recidīva risks ir tikai 3 %. Operācija apsverama rezistentas horionkarcinomas un progresēšanas gadījumā.
Primāra plaušu horionkarcinoma ir reta klīniska situācija, kas medicīniskajā literatūrā aprakstīta desmitos mērāmā gadījumu skaitā. Tā kā plaušas ir biežākā metastazēšanās vieta, rūpīgi jāizslēdz primārā lokalizācija dzemdē, gonādās, retroperitoneāli u.c. Teorētiski primāra plaušu horionkarcinoma iespējama vairākos veidos:
- plaušu metastāzes ar primārā audzēja spontānu regresiju,
- cilmes šūnu migrācija uz plaušām embrioģenēzes laikā,
- trofoblasta emboli no molāras grūtniecības pēc ilga latentā perioda,
- primāra plaušu vēža diferenciācija par trofoblasta šūnām. [4]
Klīniskajā gadījumā apskatītajai pacientei horionkarcinoma bija attīstījusies plaušu artērijās, kuras fonā paciente piedzīvoja plaušu artērijas tromb-emboliju, kam sekoja HTEPH attīstība. Pēc PEA un audzēja ķīmijterapijas pacientei saglabājas distāla HTEPH. Nav zināms, vai audzējs šajā gadījumā bija primāra plaušu horionkarcinoma vai izolēta meta-stazēšanās plaušās no neatklāta primārā audzēja. Histerektomijas histoloģiskajā materiālā horionkarcinomas pazīmes nebija redzamas arī pēc atkārtota patologa izvērtējuma.
Hroniska trombemboliska pulmonāla hipertensija
Hroniska trombemboliska plaušu hipertensija tiek uzskatīta par akūtas plaušu artērijas trombembolijas vēlīnu komplikāciju, kas, spriežot pēc dažādiem avotiem, pirmajos divos gados pēc PATE attīstās 0,1—9,1 % pacientu.
Interesanti, ka aptuveni ceturtdaļai pacientu ar diagnosticētu HTEPH nav ziņu par PATE anamnēzē. Kopumā slimība gadā skar aptuveni piecus cilvēkus no miljona. [5] Viens no galvenajiem slimības cēloņiem ir plaušu artēriju pastāvīgs, ilgstošs aizsprostojums ar trombemboliem, kuros ieaug saistaudi, neļaujot tiem izzust. Tam seko mazo neaizsprostoto asinsvadu pārveidošanās jeb remodelācija. [6] HTEPH rašanos var veicināt neadekvāta antikoagulācija, liela trombu masa, atlieku trombi un venozās trombembolijas atkārtošanās. [5]
Citi novērotie riska faktori ir iepriekš veikta splenektomija, vairogdziedzera hormonu aizstājterapija, ļaundabīgi audzēji, hroniskas iekaisuma slimības u.c. [6] Izmaiņas plaušu artērijās rada palielinātu asinsvadu pretestību, kas, savukārt, paaugstina tajos asinsspiedienu un rezultējas ar sirds labās puses mazspējas simptomiem — elpas trūkumu, tūskām, cianozi, nogurumu u.c.
HTEPH grūti diagnosticēt, jo simptomi ir nespecifiski un spilgti izpaužas tikai slimības vēlākajās stadijās, tāpēc diagnoze bieži tiek noteikta novēloti. [7] HTEPH raksturīga arī epizodiska norise ar simptomātiskiem plaušu trombembolijas notikumiem, kam seko bezsimptomu periodi. [6] Svarīgi aizdomāties par HTEPH diagnozes iespējamību pacientiem, kuriem ilgstoši saglabājas elpas trūkums slodzes laikā pēc akūtas PATE. Elektrokardiogramma ar izmaiņām, kas raksturīgas pie sirds labās puses pārslodzes pulmonālās hipertensijas gadījumā, apskatāma 2. attēlā.
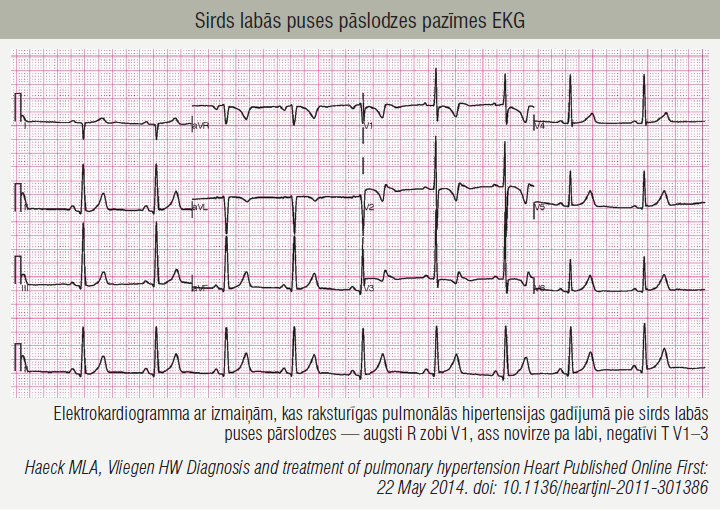

2. attēls
Sirds labās puses pāslodzes pazīmes EKG
Diagnozes noteikšanas posmi:
- ehokardiogrāfija — labā kambara disfunkcijas un plaušu hipertensijas pazīmju gadījumā jāveic tālāka izmeklēšana;
- plaušu ventilācijas/perfūzijas scintigrāfija (V/Q scan) — perfūzijas defektu novērtēšana plaušu zonās ar normālu ventilāciju (Latvijā ventilācijas sadaļa metodei netiek veikta);
- labās sirds puses katetrizācija — plaušu hipertensijas tiešai noteikšanai;
- konvencionālā plaušu angiogrāfija vai DT ar kontrastvielu — asinsvadu aizsprostojumu izvērtēšanai.
Sirds labo daļu katetrizācijā (sirds zondēšanā) HTEPH definē kā prekapilāru plaušu hipertensiju (mPAP ≥ 25 mmHg, vidējais plaušu kapilāru ieķīlēšanās spiediens ≤ 15 mmHg) vienlaikus ar hroniskiem trombiem elastīgajās plaušu artērijās. Šīm pazīmēm joprojām jābūt pēc vismaz trīs mēnešus ilgas antikoagulantu lietošanas, jo normālā gadījumā antikoagulācijas fonā trombotiskajām masām pēc PATE vajadzētu uzsūkties minēto trīs mēnešu laikā.
Lai gan datortomogrāfijas plaušu angiogrāfija ir izvēles metode PATE diagnostikā, ar to nepietiek, lai izslēgtu HTEPH, jo DTPA neuzrāda distālu embolizāciju un remodelāciju sīkajos zaros. Šajā ziņā daudz informatīvāka ir V/Q scintigrāfija. [7]
Ārstēšana
Pulmonālā endarterektomija
HTEPH ārstēšanā pirmās izvēles metode ir ķirurģiska plaušu endarterektomija — atvērta krūškurvja operācija mākslīgajā asinsritē un hipotermijā. Operācijas laikā trombemboliskais materiāls tiek abpusēji izņemts no plaušu artērijām kopā ar intīmas slāni un virspusējo vidējo slāni.
Vairumam pacientu pēc operācijas atjaunojas gandrīz normāla hemodinamika un ievērojami uzlabojas simptomātika. [6] Operāciju veic ekspertu centros ar pieredzi metodes izmantošanā. Pacientu pirms endarterektomijas izvērtē daudzdisciplīnu HTEPH ārstu komanda, jo operācijas iespējamība atkarīga gan no tehniskas trombotisko masu sasniedzamības, gan pacienta vispārējā stāvokļa. Latvijā endarterektomija pagaidām netiek veikta, tāpēc klīniskajā gadījumā apskatīto pacienti operēja Vīnē.
Medikamentozajā terapijā ESC vadlīnijas šobrīd rekomendē vienu specifisku orāli lietojamu medikamentu — riociguatu, šķīstošās guanilātciklāzes stimulatoru. Neoperējamiem pacientiem var apsvērt arī citu grupu pulmonālas arteriālas hipertensijas zāļu lietošanu ārpus indikācijām (II b klase, B līmenis). Visiem HTEPH pacientiem antikoagulanti jālieto mūža garumā. [7]
Balona pulmonālā angioplastika
Papildus apsverama metode neoperējamiem pacientiem vai pacientiem pēc endarterektomijas ar simptomu turpināšanos ir balona pulmonālā angioplastika, kad ar balonkatetra palīdzību tiek izplesti plaušu artēriju sašaurinājumi. [7]
Procedūru parasti veic 6—8 posmos, pakāpeniski paplašinot plaušu artēriju zarus dažādās vietās. Vienā reizē metode netiek veikta tādēļ, lai novērstu t.s. reperfūzijas bojājumu — tūskas rašanos plaušu apgabalos, kur ilgstoši bijuši apasiņošanas traucējumi, kā arī tādēļ, lai samazinātu kontrastvielas slodzi pacientam. Metode no šā gada nogales tiks izmantota arī Latvijas Kardioloģijas centrā.