Muguras lejasdaļas sāpes ir milzīga medicīniska un sociālekonomiska problēma visā pasaulē. Tas ir viens no biežākajiem ģimenes ārsta apmeklējuma iemesliem, ieņemot otro vietu aiz augšējo elpceļu slimībām.
Gandrīz katrs pieaugušais dzīves laikā pieredzējis vienu vai divas muguras sāpju epizodes, aptuveni katrs ceturtais ASV iedzīvotājs atzīmē sāpes vismaz vienu dienu pēdējos trīs mēnešos. [1; 7] Pirmā akūtu muguras lejasdaļas sāpju epizode parasti piemeklē 20—40 gadu vecumā.
Lielākajai daļai pacientu slimības gaita būs labdabīga un pašlimitējoša, tomēr līdz 31 % pacientu pēc sešiem mēnešiem vēl nebūs pilnībā atveseļojušies, bet 25—62 % pacientu nākamajos divos gados sāpes atkārtosies. [2]
Muguras lejasdaļas sāpes parasti tiek definētas kā sāpes, stīvums, muskuļu saspringums zemāk par ribu loku un virs gluteālā rajona. Pēc simptomu norises ilguma muguras sāpes iedala:
- akūtas (ilgst līdz 6 nedēļām),
- subakūtas jeb ieilgušas sāpēs (ilgst 6—12 nedēļas),
- hroniskas (ilgst > 12 nedēļas jeb trīs mēnešus).
Vēl muguras sāpes tiek klasificētas kā specifiskas un nespecifiskas. Specifiskas sāpes atbilst simptomiem, ko rada kāds specifisks patofizioloģisks mehānisms, piemēram, diska trūce, infekcija, iekaisums, lūzums vai audzējs. Tikai ~ 10 % pacientu tiek identificēts specifisks sāpju iemesls, ambulatorajā praksē specifiska patoloģija sastopama vēl retāk. Lielākajai daļai pacientu muguras lejasdaļas sāpes ir nespecifiskas — sāpes bez specifiska nociceptīva iemesla.
Sāpes jādiferencē
Viens no pirmajiem primārās veselības aprūpes speciālistu uzdevumiem pirms terapijas sākšanas ir rūpīga anamnēzes ievākšana un fizikālā izmeklēšana, kas mērķēta uz “sarkano karogu” identificēšanu (1. tabula).
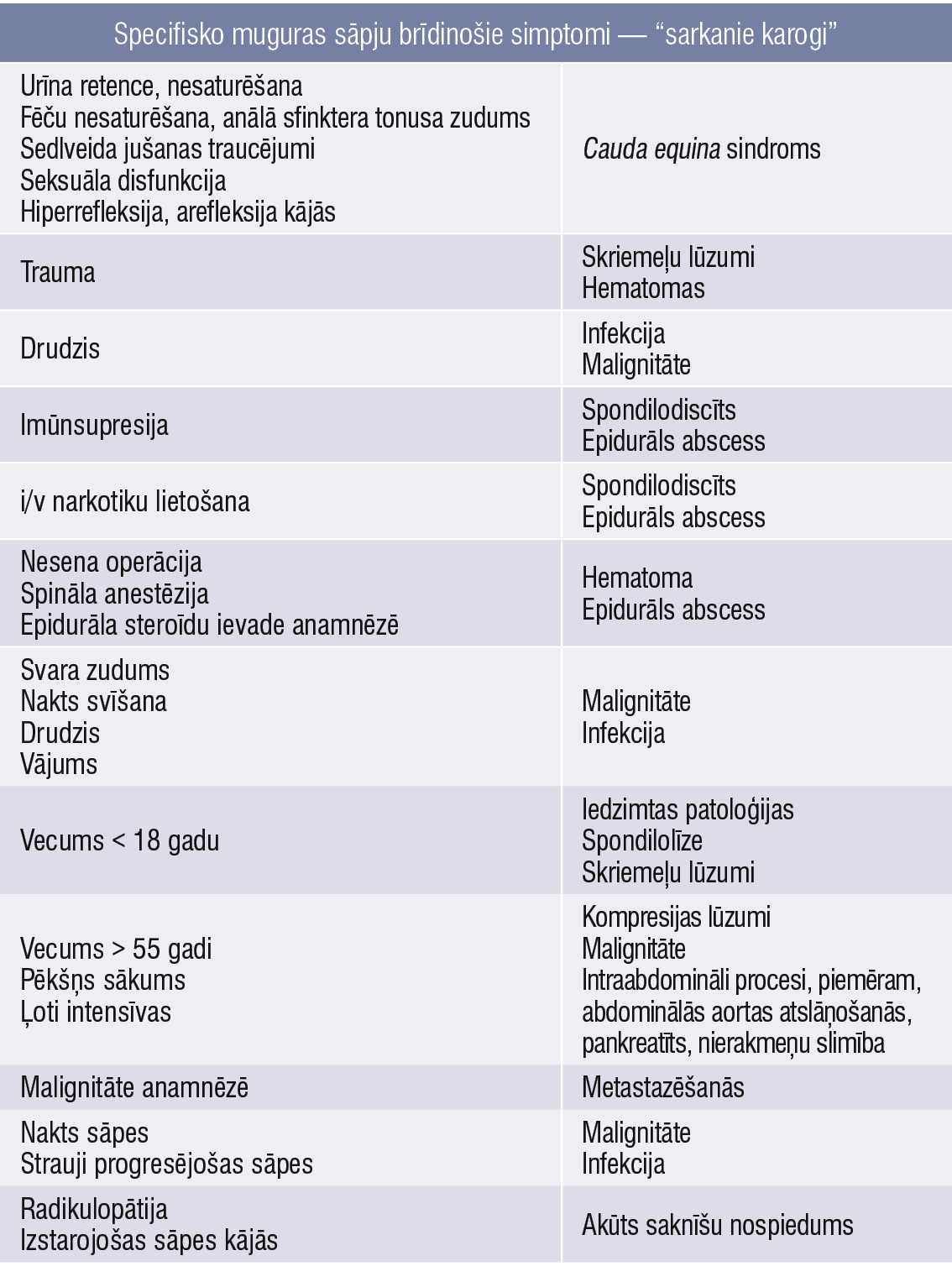

1. tabula
Specifisko muguras sāpju brīdinošie simptomi — “sarkanie karogi”
Pacienti ar konstatētiem “sarkanā karoga” simptomiem nekavējoties jānovirza mērķtiecīgai papildizmeklēšanai (visinformatīvākā ir magnētiskā rezonanse) un jāveic atbilstošas laboratoriskās analīzes; ja ir aizdomas par cauda equina, pacients neatliekami jāstacionē.
Ja salīdzinām ar specifiskām muguras lejasdaļas sāpēm, tad nespecifiskas muguras sāpes rada daudzu notikumu kopums — mijiedarbība starp biomehāniskiem, psiholoģiskiem un sociāliem faktoriem. Nespecifiskas muguras lejasdaļas sāpes ir klīniska diagnoze, ko nosaka pēc pacienta anamnēzes un fizikālās izmeklēšanas.
Pacientam ar akūtām pirmreizējām muguras lejasdaļas sāpēm bez aizdomām par specifisku sāpju cēloni attēldiagnostiskie izmeklējumi neuzlabo klīnisko iznākumu, tāpēc tūlītēja to veikšana nav nepieciešama. [8] Visbiežāk jostas daļas sāpes ir mehāniskas — saistītas ar balsta—kustību aparāta pārpūli (piemēram, sastiepumi) vai anatomisko struktūru bojājums, piemēram, diska trūce, starpskriemeļu atveru iekaisums. Šiem pacientiem sāk ambulatoru sāpju terapiju, atkārtotās vizītēs atkal vērtē brīdinošos simptomus.
Akūto sāpju ārstēšana
Akūtu muguras sāpju ārstēšanas galvenie mērķi ir mazināt sāpes, uzlabot funkciju, saīsināt darbnespējas laiku un izglītot pacientu. Sāpju ārstēšanas optimizācija samazina varbūtību, ka attīstīsies hroniskas sāpes.
Jackson ar līdzautoriem (2014) starptautisko tiesību dokumentā sāpju mazināšanu apraksta kā cilvēka pamattiesības, un valstis ir ētiski pilnvarotas nodrošināt sāpju ārstēšanu kā daļu no to pamatpienākumiem saskaņā ar tiesībām uz veselību.
Ārstējot akūtas sāpes, parasti vadās no šādiem principiem:
neārstētām stiprām sāpēm ir nelabvēlīgi fizioloģiskie un psiholoģiskie efekti,
- pacienti jāiesaista savu sāpju novērtēšanā un ārstēšanā,
- lai sāpju ārstēšana būtu efektīva, tai jābūt elastīgai un pielāgotai indivīda vajadzībām,
- sāpes jāārstē savlaicīgi; konstatētas stipras sāpes ārstējamas grūtāk,
- jābūt iespējai samazināt sāpes līdz pieļaujamam līmenim.
Ir būtiska saistība starp katastrofizēšanu akūtu un subakūtu muguras sāpju gadījumā un sāpēm un invaliditāti vēlākos laika punktos.
Ārstēšanas plāns tiek izstrādāts tā, lai palīdzētu akūtu sāpju epizodes laikā atgriezties pie normālas funkcijas. Plānā jāparedz darbības, kas pacientam un ārstam jāveic sāpju saasināšanās vai atkārtošanās, vai lēnas atveseļošanās gadījumā. Jāparedz iespēja pacientam uzņemties atbildību par savu rehabilitāciju (paturot prātā, ka dažiem cilvēkiem būs nepieciešams lielāks atbalsts un palīdzība) vai, ja nepieciešams, meklēt palīdzību pie klīnicista.
Akūtu sāpju terapijas efektivitātes mērīšanai jāizmanto funkcionālie rezultāti, nevis tikai sāpju rādītāji, respektīvi, jāņem vērā pacienta spēja nodarboties ar ārstniecisko vingrošanu, veikt fiziskas aktivitātes un strādāt. Optimāla akūtu un subakūtu sāpju ārstēšana var samazināt hronisku sāpju un nepareizas recepšu opioīdu lietošanas radīto slogu.
Pierādīti pamatotā medicīna primārā akūtu sāpju ārstēšanā lielu uzsvaru liek uz pacientu izglītošanu par gaidāmo simptomu izzušanu tuvākajās četrās nedēļās.
Pacientiem tiek rekomendēts saglabāt normālu ikdienas aktivitāti iespēju robežās, tiek uzsvērts izvairīties no palikšanas gultā. [4] Vingrojumu veikšana mājās un fizioterapija samazina iespējamās ķirurģiskās un invazīvās terapijas varbūtību. [5]
Medikamentozā terapija — efektivitātes izvērtējums
Pirmās izvēles medikamenti ir NSPL un acetaminofēns (paracetamols); tiek ieteikts atturēties no rutīnas opioīdu nozīmēšanas, tomēr tie ir apsverami stipru sāpju gadījumā.
Pretsāpju zāles var ievadīt vairākos veidos, paļaujoties uz sistēmisku vai lokālu iedarbību, var arī šos veidus kombinēt. Ievades ceļa izvēli var noteikt dažādi faktori: sāpju etioloģija, smagums, lokalizācija un veids, pacienta vispārējais stāvoklis. Papildu faktori, kas jāņem vērā, izvēloties ievadīšanas veidu, ir lietošanas vienkāršība, pieejamība, pretsāpju līdzekļa iedarbības ātrums, iedarbības uzticamība, darbības ilgums, pacienta akcepts un izmaksas.
Pretsāpju līdzekļu iekšķīga ievadīšana ir vienkārša, neinvazīva, tai ir laba efektivitāte vairākumā gadījumu, un tā ir ļoti pieņemama pacientiem. Izņemot stipru akūtu sāpju ārstēšanu un ar nosacījumu, ka tā lietošanai nav kontrindikāciju, tas ir izvēles veids lielākajai daļai pretsāpju līdzekļu. [9]
Ierobežojumi iekšķīgai lietošanai ietver vemšanu vai aizkavētu kuņģa iztukšošanos, tad, iespējams, tiek traucēta zāļu uzsūkšanās. Izvēloties medikamentus, jāņem vērā to klīniskā efektivitāte un zināmas kontrindikācijas katram individuālam pacientam (2. tabula).
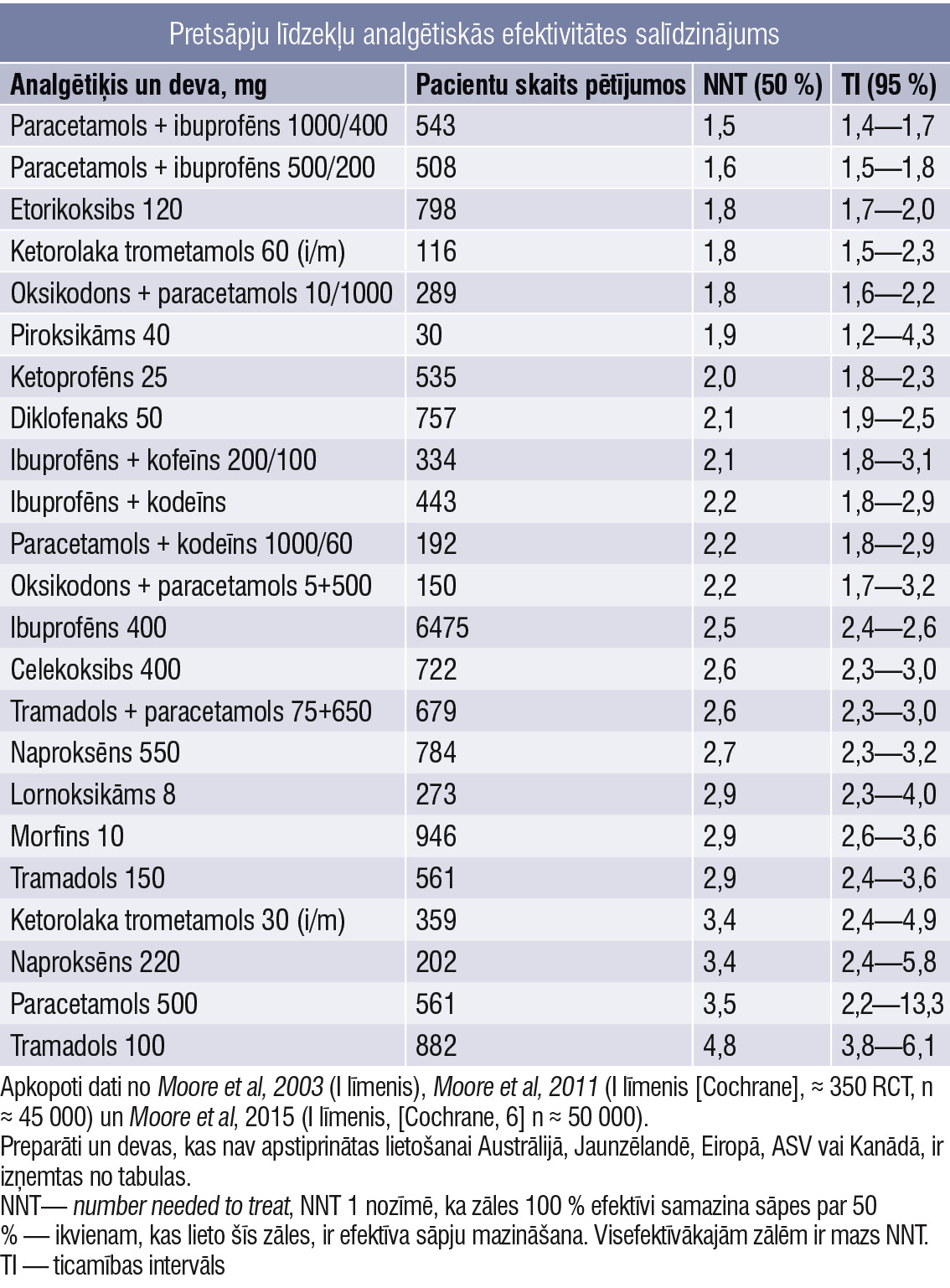

2. tabula
Pretsāpju līdzekļu analgētiskās efektivitātes salīdzinājums
Daudzcentru nejaušinātos pētījumos pierādīts, ka:
- Perorālās paracetamola/ibuprofēna kombinācijas nodrošina labāku pretsāpju efektu nekā paracetamols/kodeīns; taču abas šīs kombinācijas ir efektīvākas par atsevišķām zālēm un tām ir devas—atbildes efekts (I līmenis []).
- Perorālas paracetamola/tramadola kombinācijas ir efektīvākas nekā atsevišķas zāles, un tām ir devas—atbildes efekts (I līmenis).
- Parenterāli vai rektāli ievadītie NSPL nav efektīvāki un neizraisa mazāk blakusparādību kā tās pašas zāles, ko lieto iekšķīgi (I līmenis).
- Iekšķīgi lietojamo NSPL sastāvs (piemēram, ātras darbības [], nātrija un kālija sāls) var ievērojami ietekmēt to efektivitāti (N) (I līmenis).
- Perorālie opioīdi var būt nepieciešami, lai mazinātu stipras sāpes balsta—kustību aparātā. Īsas darbības opioīdu ieteicams ievadīt regulāri, nevis tikai tad, ja sāpes stipras.
- Lēnas darbības opioīdu preparātus parasti neiesaka lietot akūtu sāpju mazināšanai pacientiem, kuri iepriekš nav lietojuši opioīdus.
- Ja pacientam ir pastāvīga nepieciešamība pēc opioīdiem, jāveic papildu izmeklēšana un izvērtēšana.
- Muskuļu relaksantu ieguvumus var atsvērt to nelabvēlīgā ietekme, tāpēc tos nevar ieteikt regulārai lietošanai. [10]
Zāļu ievades veids
Izņemot stipru akūtu sāpju ārstēšanu un ar nosacījumu, ka nav kontrindikāciju zāļu lietošanai, lielākajai daļai pretsāpju līdzekļu tiek izvēlēts iekšķīgais ievadīšanas veids. Pretsāpju līdzekļu (parasti opioīdu) intramuskulārās un zemādas injekcijas joprojām mēdz izmantot mērenu vai stipru sāpju ārstēšanai.
Salīdzinot ar perorāliem NSPL, pašlaik intramuskulārai injekcijai ir tikai relatīvi ierobežots NSPL vai COX–2 selektīvo inhibitoru skaits un vēl mazāk ar I līmeņa pierādījumiem par individuālo efektivitāti, piemēram, i/m ketorolaks (Lloyd 2009 I līmenis [], 7 RCT, n = 1446). Diklofenaka intramuskulāra ievadīšana var būt saistīta ar mīksto audu nekrozi, īpaši pacientiem ar aptaukošanos, kad adata var nebūt pietiekami gara, lai sasniegtu muskuļus, minēts Dadaci 2015. gada publikācijā. Pēdējās vadlīnijās akūto pēcoperācijas sāpju ārstēšanā medikamentu intramuskulāra ievadīšana ir stingri noliegta.
Potenciālais blakņu profils
Runājot par medikamentu blaknēm un komplikācijām akūtu sāpju ārstēšanā, pēdējie dati uzrāda dažas atšķirības, medikamentus izmantojot īslaicīgi.
Paracetamols ir efektīvs pretsāpju līdzeklis akūtām sāpēm; blakusparādību biežums salīdzināms ar placebo (U) (I līmenis []). Hepatotoksicitāte, lietojot paracetamolu terapeitiskās devās, ir ārkārtīgi reta un nav saistīta ar alkohola lietošanu (I līmenis []).
Neselektīvie NSPL ir efektīvi akūtu pēcoperācijas sāpju, nieru koliku, migrēnas, primāras dismenorejas (I līmenis []), akūtu muskuļu traumu (I līmenis []), muguras sāpju ārstēšanā (U) (I līmenis []) un akūtu sastiepumu gadījumā (I līmenis). Koksibi ir tikpat efektīvi kā neselektīvie NSPL akūtu sāpju (arī pēcoperācijas sāpju) (I līmenis []), muguras sāpju (I līmenis []) un osteoartrīta ārstēšanai (I līmenis []).
Neselektīvie NSPL, ko lieto papildus paracetamolam, uzlabo atsāpināšanu ar abām zālēm (I līmenis), jo īpaši ibuprofēns kombinācijā ar paracetamolu (U) (I līmenis []). Pacientiem ar normālu nieru darbību neselektīvie NSPL īsā periodā nedaudz paaugstina kreatinīna līmeni serumā, bet ietekme uz akūtu nieru bojājumu un nieru aizstājterapijas nepieciešamību nav skaidra pierādījumu trūkuma dēļ (W) (I līmenis []).
Neselektīvie NSPL (bet ne koksibi) var izraisīt bronhu spazmas cilvēkiem, kuru anamnēzē ir zināma NSPL izraisīta elpceļu slimība (I līmenis []). Īslaicīga koksibu un citu NSPL lietošana nepalielina kardiovaskulāro notikumu risku (III–2 līmenis).]