Aterosklerotiska procesa patofizioloģija
Artēriju sieniņa sastāv no endotēlija slāņa (intima), muskuļa slāņa (media) un saistaudu apvalka (adventitia). Endotēlijs ir plāna asinsvada iekšpusi klājoša epitēlija šūnu membrāna. Endotēlija iekaisuma rašanos veicina dažādi riska faktori. [2] Endotēlija bojājums veidojas pakāpeniski: no putu šūnu krāšanās, kas vēl ir atgriezeniskais process, līdz ateromas izveidei (1. attēls).
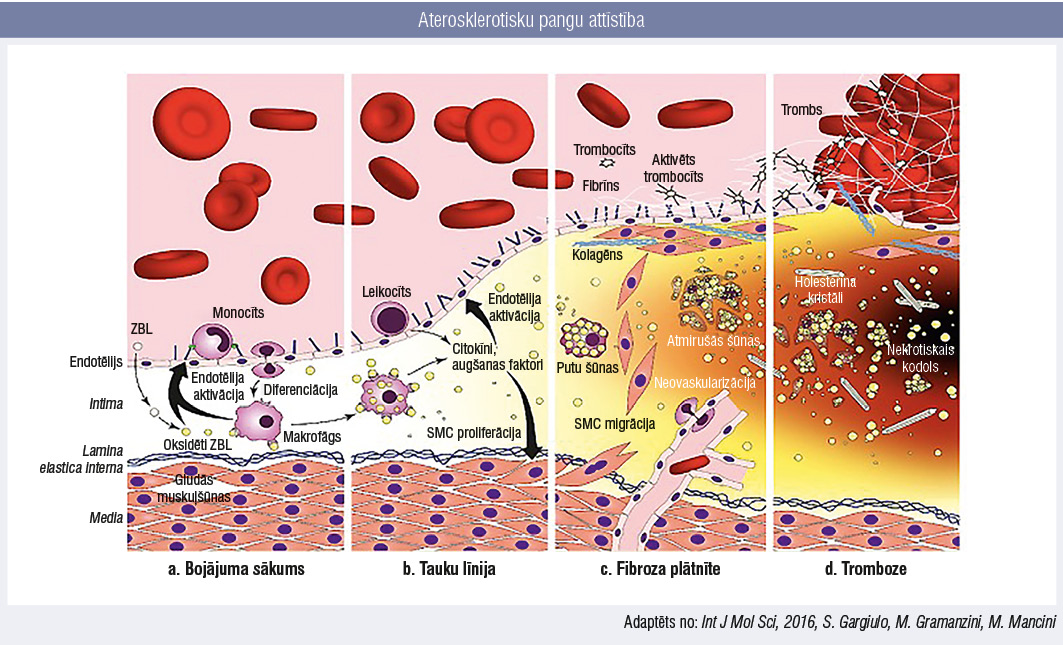

1. attēls
Aterosklerotisku pangu attīstība
Endotēlija slāņa bojājumi izraisa antitrombotisko un fibrinolītisko faktoru samazināšanos, kā arī slāpekļa oksīda izsīkumu un pastiprinātu vazokonstriktoru izdalīšanos. Endotēlija destrukcijas zonā notiek trombocītu agregācija, tāpēc intima media iekļūst monocīti. Tie fagocitē toksiskas molekulas, piemēram, oksidētus zema blīvuma lipoproteīnus (ZBL), producē iekaisuma citokīnus un pārvēršas dendrītiskās šūnās.
Kad monocīti saskaras ar tauku nogulsnēm, tie tiek aktivēti un kopā ar holesterīnu, šūnu atkritumproduktiem, kalcija un fibrīna nogulsnēm uzkrājas artērijas sieniņas veidojošos bojājumos — notiek mīkstas nestabilas ateromas nekrotiska kodola attīstība. Vēlāk veidojas gludās muskulatūras šūnas saturoša fibroza (šķiedraina) kapsula, kas ļauj stabilizēt aterosklerotisko plātnīti. [3; 4]
Katrā šā procesa posmā iesaistās iekaisuma citokīni, tādējādi aterosklerozes process kļūst par hronisku iekaisuma slimību. [5] Plātnītes iekaisums izraisa gludās muskulatūras šūnu zudumu un matrices metaloproteināžu veidošanos, kas vājina fibrozo kapsulu, radot kapsulas plīsuma risku. [6]
Biezajā nekrotiskajā lipīdu kodolā veidojas hipoksija, kas stimulē angioģenēzi un aterosklerotiskajā plātnītē ieaug nenobrieduši mikroasinsvadi, savukārt tie rada risku saasiņojumiem plātnītes iekšienē. [7]
Tiek uzskatīts, ka aterosklerotiskās plātnītes pārkaļķošanās ir dzīšanas process, kas veidojas kā reakcija uz nekrotiskā kodola iekaisumu. [8] Turpretī mikrokalcifikācija ir rupturējošas un nestabilas aterosklerotiskas plātnītes pazīme — tā norāda uz nepilnīgu dzīšanas procesu, aktīvi noritošu iekaisumu, turklāt nelielie kalcija depozīti fibrozo kapsulu vājina. [9; 10]
Parasti attīstīta ateroma formējas tuvu 50 gadu vecumam, kad pieaug insulta un miokarda infarkta risks. Insults ir otrs izplatītākais mirstības cēlonis un otrs izplatītākais invaliditātes cēlonis pasaulē. [1]] Globālā slimību sloga 1990.—2019. gada pētījumu sistemātiskā analīzē novērtēts, ka išēmiski insulti sastopami 62 %, intracerebrāla hemorāģija 28 % un subarahnoidāla hemorāģija 10 % visu insultu. [12]
Biežākie išēmiska insulta iemesli ir miega artēriju stenoze, arteriāla hipertensija un aritmija. [13] Miega artēriju stenoze var būt saistīta ar transitorisku išēmisku lēkmi (TIL), kas ir nozīmīgs riska faktors insulta attīstībai. Kumulatīvais insulta attīstības risks pēc TIL, kas saistīta ar izteiktu miega artēriju stenozi, pirmajā gadā pēc simptomu parādīšanās ir 12—13 %, bet piektā gada beigās 30—35 %. [14; 15]
Aterosklerotiskas plātnītes novērtēšana
Novērtējot aterosklerozes risku insulta attīstībā, skaidri iezīmējas savlaicīgas diagnostikas nepieciešamība. Plašāk tiek izmantoti trīs aterosklerozes vizualizācijas izmeklējumi: krāsu kodēta duplex ultrasonogrāfija (DUS), datortomogrāfijas angiogrāfija (CTA) un magnētiskās rezonanses angiogrāfija (MRA).
CTA joprojām skaitās “zelta standarts” asinsvadu izmeklēšanā, bet tieši DUS ir patiesi neinvazīva, plaši pieejama un lēta izmeklējumu metode, kas nav saistīta ar papildu nevēlamu iedarbību (radiāciju, intravenozi ievadītas kontrastvielas izmantošanu).
DUS nodrošina augstas jutības specifisku iekšējās miega artērijas stenozes diagnosticēšanu, un pašlaik DUS ir izvēles metode miega artēriju slimības sākotnējai novērtēšanai. [16]
DUS tehnika ietver artēriju sieniņu novērtēšanu sonogrāfijas B režīmā un impulsa viļņu Doplera spektra analīzi asins plūsmas ātruma mērīšanai. B režīmā iespējams identificēt un raksturot aterosklerotiskās plātnītes morfoloģiju, kā arī telpisko izvietojumu.
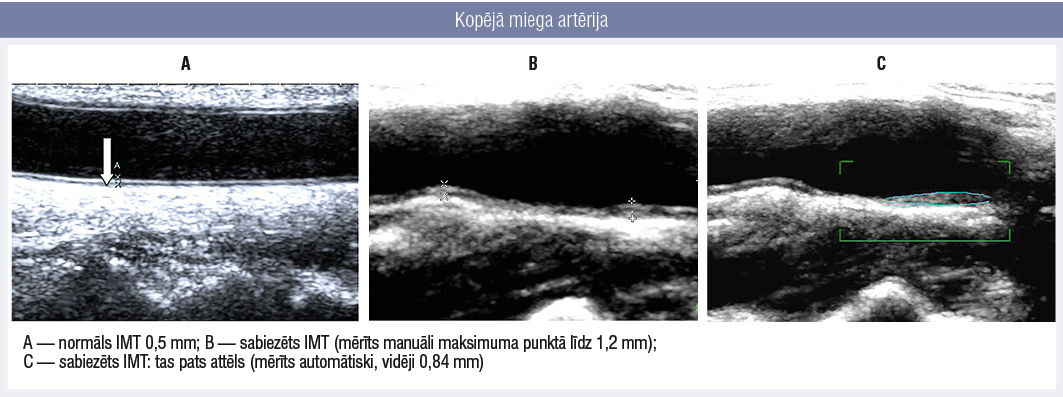
Ar DUS ir iespēja izvērtēt asinsvada sienas biezumu (intima/media slāņa jeb IMT biezumu) un izmaiņas dinamikā (2. attēls).

2. attēls
Kopējā miega artērija
Tā kā tieši IMT biezuma pieaugums norāda uz aterosklerotiskas pangas rašanās risku, tās novērtējums ir ļoti svarīgs, lai sāktu savlaicīgu aterosklerotiska procesa profilaksi. Pēdējās paaudzes DUS tehnika ļauj izvērtēt pangas morfoloģiju, izmērus un ietekmi uz asinsriti.
Asinsriti novērtē, lietojot Doplera režīmu un mērot plūsmas ātrumu, virzienu un pulsāciju (perifēro vaskulāro rezistenci).
Latvijā brahiocefālā DUS izmeklējuma laikā abpusēji kakla daļā tiek novērtēta kopējā, iekšējā un ārējā miega artērija, zematslēgas artērija un mugurkaula artērija. Kopumā DUS tiek izmantota kā pirmās izvēles izmeklējuma metode pacientiem ar neseniem cerebrovaskulāriem notikumiem, lai novērtētu aterosklerotiskas izmaiņas. [17]
Apsverot slimību profilakses iespējas, vēlams savlaicīgi noteikt aterosklerotiskas pangas attīstību asimptomātiskiem pacientiem ar kardiovaskulāriem un cerebrovaskulāriem riska faktoriem. Pēc mūsu speciālistu datiem visbiežāk aterosklerotisko pangu atrade korelē ar arteriālu hipertensiju un dislipidēmiju. [18]
2019. gadā Eiropas Kardiologu biedrības vadlīnijas hronisku koronāro sindromu diagnostikai un ārstēšanai iesaka (II a klases ieteikums, C līmenis) B režīma US miega artērijām, kuru var veikt, lai identificētu aterosklerotiskas izmaiņas pacientiem ar aizdomām par hronisku koronāro sindromu, kuriem nav zināma aterosklerozes slimība. [19]
Normāls miega artērijas sieniņas biezums vai aterosklerotiska plātnīte?
Katra DUS izmeklējuma laikā tiek veikti IMT biezuma mērījumi kopējā miega artērijā (ACC) pirms bifurkācijas gareniskā virzienā B režīmā, un tie tiek atspoguļoti brahiocefālo asinsvadu DUS izmeklējuma protokolā. [20; 21]
Ir nelielas IMT atšķirības vecuma, dzimuma un rases dēļ, tomēr ESH/ESC hipertensijas vadlīnijās (2013) a. carotis communis IMT > 0,9 mm norādīts kā asimptomātisks orgānu bojājuma marķieris. Par pieauguša cilvēka normālu IMT tiek uzskatīti rādījumi 0,65—0,9 mm, katru gadu kritērijiem palielinoties par 0—0,04 mm. [22; 23]
IMT robežās no 0,9 mm līdz 1,4 mm tiek saukts par sabiezētu. Normāli un sabiezēti IMT mērījumi redzami 2. attēlā.
Manheimas konsenss miega artērijas pangu definēja kā “fokālu struktūru, kas arteriālajā lūmenā iespiežas vairāk nekā 0,5 mm, vai 50 % no blakus IMT vērtības, vai uzrāda biezumu > 1,5 mm, mērot no media–adventitia pamatnes līdz intima–lūmena saskares zonai”. Vienkāršojot IMT 1,5 mm un vairāk dēvē par aterosklerotisku plātnīti jeb pangu. [24] Jo lielāka panga, jo lielāka iespēja, ka tā izraisīs asinsvada stenozi un asinsrites nepietiekamību attiecīgajā baseinā. Bet ne tikai pangas izmērs ir svarīgs, izvērtējot išēmiska smadzeņu infarkta risku.
Novērtējot aterosklerozes procesu, tiek izvērtēti pangas rādījumi:
- izmērs,
- blīvums jeb ehogenitāte (ehogēniska, izoehogēniska, hipoehogēniska),
- virsmas gludums (gluda, negluda, čūlaina),
- kalcifikācija,
- trombotiskas masas esība,
- fibrozas kapsulas esība.
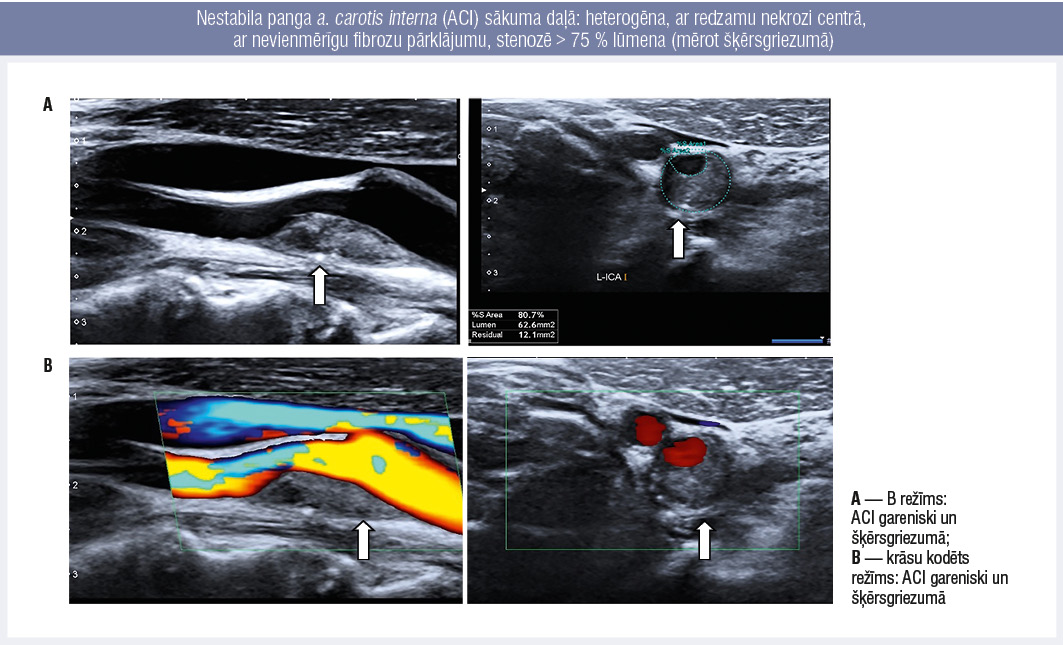

3. attēls
Nestabila panga a. carotis interna (ACI) sākuma daļā: heterogēna, ar redzamu nekrozi centrā, ar nevienmērīgu fibrozu pārklājumu, stenozē > 75 % lūmena (mērot šķērsgriezumā)
Par bīstamu (vai nestabilu) aterosklerotisku plātnīti tiek uzskatīta panga, kas stenozē > 75 % asinsvada lūmena, panga ar samazinātu blīvumu (hipoehogēna) vai nevienmērīgu blīvumu (heterogēna), ar negludu virsmu, ar trombotisku uzslāņojumu vai ar fibrozā slāņa ruptūru (3. attēls).
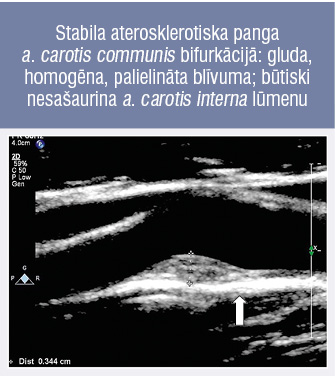

4. attēls
Stabila aterosklerotiska panga a. carotis communis bifurkācijā: gluda, homogēna, palielināta blīvuma; būtiski nesašaurina a. carotis interna lūmenu
Nestabila aterosklerotiska plātnīte var rupturēt, izraisot trombotisku embolizāciju smadzeņu artērijās. Šādai pangai ir patoloģiskas īpašības: nekrotisks lipīdu centrs, plāna fibroza kapsula, intraaterosklerotiska hemorāģija un mikrokalcifikācija. Stabilai aterosklerotiskai plātnītei (4. attēls) ir zems ruptūras risks — tai ir bieza fibroza kapsula, makroskopiska kalcifikācija.
Laba ultrasonogrāfijas aparatūra un pieredzējis ultrasonogrāfijas speciālists ir nozīmīgi faktori pilnvērtīgai aterosklerotiskas plātnītes riska novērtēšanai. [25]
Ar pangas apjoma augšanu kompensējoši paplašinās artērijas lūmens. Kad panga aizņem 40 % lūmena, artērija vairs nepaplašinās un turpmākais pangas pieaugums ievērojami reducē artērijas lūmenu. Pie stenozes > 75 % lūmena ievērojami mainās asins plūsma stenozes vietā: paātrinās un paliek turbulenta, izraisot trombembolijas risku (5. attēls). [26]
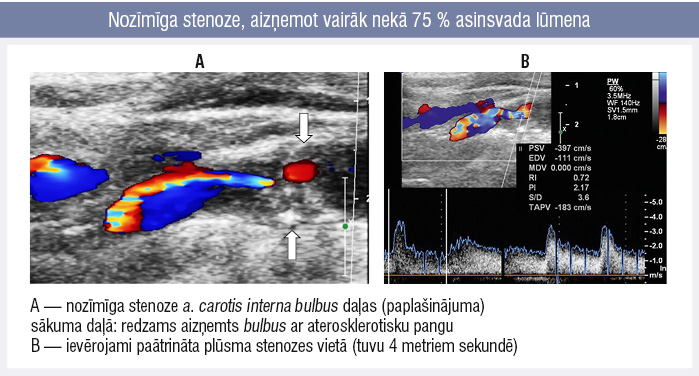

5. attēls
Nozīmīga stenoze, aizņemot vairāk nekā 75 % asinsvada lūmena
Ko darīt ar simptomātisku aterosklerotisku plātnīti?
Pacientam pēc ipsilaterāliem okulāriem simptomiem (amaurosis fugax, tīklenes artērijas oklūzija, išēmiska optiska neiropātija), TIL vai išēmiska insulta 180 dienu laikā kopš notikuma ateroskleroze uzskatāma par simptomātisku un apsverama revaskularizācijas procedūra. [27]
Dažādās vadlīnijās ķirurģiska revaskularizācija rekomendēta gadījumos, ja novēro simptomātisku 50—99 % miega artērijas stenozi. [28; 29]
Simptomātisku miega artēriju stenožu identificēšanas nozīmīgākais mērķis ir izvairīšanās no atkārtota išēmiska notikuma vai nāves. [30]
Saritphat Orrapin 2017. gadā Cohrane datubāzē publicētajā pārskatā “Carotid endarterectomy for symptomatic carotid stenosis (Review)” novērtē, ka miega artērijas aterosklerozes endarterektomija sniedz zināmu labumu pacientiem ar 50—69 % simptomātisku stenozi (vidējas kvalitātes pierādījumi) un ir ļoti labvēlīga pacientiem, kam ir 70—99 % stenoze bez oklūzijas (vidējas kvalitātes pierādījumi).
Nav aprakstīts ieguvums no endarterektomijas pacientiem ar miega artērijas suboklūziju (99 %), (augstas kvalitātes pierādījumi). [31]
Ziemeļamerikas simptomātiskas miega artēriju endarterektomijas pētījumu grupas dati liecina, ka klīniski ārstētiem pacientiem ar 70—99 % miega artērijas stenozi atkārtota ipsilaterāla insulta risks divu gadu laikā ir 26 %, bet pacientiem, kam veikta ķirurģiska endarterektomija, risks samazinās līdz 9 %. [32]
Ja endarterektomija nav indicēta
Holesterīnu mazinoša terapija
Tika uzskatīts, ka aterogēns lipoproteīnu profils veidojas apstākļos, kad ir paaugstināts zema blīvuma lipoproteīnu (ZBL) holesterīna, triglicerīdu un B apolipoproteīnu līmenis asinīs reizē ar pazeminātu augsta blīvuma lipoproteīnu holesterīna līmeni. Pēdējos gados pierādīta tieši zemo frakciju ZBL palielinājuma galvenā loma aterosklerozes veidošanās procesā. [33]
Pierādīts, kā statīni vienlaicīgi ar holesterīna pazemināšanu bremzē aterosklerotiskas pangas attīstību, kā arī stabilizē bīstamas pangas. [34; 35] Tāpēc pacientiem ar miega artēriju stenozi efektīvi izmanto terapiju ar statīniem.
Pašreizējās vadlīnijas par statīnu lietošanu primārajai profilaksei vērstas uz terapijas intensitātes pielāgošanu, to pamatojot ar paredzamo sirds—asinsvadu sistēmas slimību risku. [36] Turklāt regulāra izmeklēšana ar DUS ļauj izvērtēt terapijas efektivitāti, piemēram, ja dinamikā palielinās pangu apjoms, var pārskatīt statīnu devu.
Antiagregantu lietošana
Aspirīns un klopidogrels ir efektīvi išēmiska insulta sekundārajā profilaksē pacientiem ar nekardioembolisku insultu. [37] Lai gan aspirīna ilgstoša lietošana monoterapijā nav indicēta primārai insulta profilaksei cilvēkiem ar zemu insulta risku, [38] Amerikas Sirds slimību asociācija un Amerikas Insulta asociācija iesaka pacientiem ar obstruktīvu vai neobstruktīvu ekstrakraniālu miega artēriju aterosklerozi lietot 75—325 mg aspirīna dienā. [28]
Aspirīns nepārprotami samazina insulta risku pacientiem, kuriem iepriekš bijis išēmisks insults vai TIL. [39] Tomēr nav skaidri pierādīts, ka aspirīns novērš insultu asimptomātiskiem pacientiem ar aterosklerotiskām izmaiņām miega artērijās vai stenozi. [40]
Ilgstoša divkārša antiagregantu terapija (DAT) ar aspirīnu un klopidogrelu parasti nav indicēta sekundārai insulta profilaksei paaugstinātā asiņošanas riska dēļ, parasti to neizmanto primārai insulta profilaksei. [40]
Citas būtiskas intervences
Veikti daudzi veiksmīgi klīniskie pētījumi par dažādām citām primārām un sekundārām insulta profilakses stratēģijām.
Asinsspiediena kontrole ir būtiska, lai novērstu insultu, koronāro sirds slimību un sirds mazspēju. [41] Pētījumos, kur antihipertensīvo terapiju novērtē akūta insulta laikā, nav pārliecinošu pierādījumu par būtisku spiediena pazemināšanas ietekmi uz īstermiņa/ilgtermiņa rezultātiem. [41]
Strauja asinsspiediena pazemināšana akūta insulta gadījumā pacientam ar simptomātisku miega artērijas stenozi var palielināt infarkta apjomu un pasliktināt neiroloģiskus traucējumus.
Asimptomātiskas miega artēriju stenozes pacientiem Amerikas Sirds slimību asociācija stingri iesaka uzturēt asinsspiedienu zem 140/90 mm/Hg. [42]
Ir pierādījumi par smēķēšanas saistību ar lielāku miega artēriju aterosklerozes izplatību, kā arī par to, ka smēķēšanas atmešana mazina iekaisuma marķierus un subklīniskas asinsvadu slimības. [43]
Aptaukošanās ir vēl viens modificējams riska faktors. Pierādīts, ka bariatriska operācija par 50 % samazina insulta risku. [44]
Pacientiem ar cukura diabētu ieteicama intensīva glikozes kontrole, lai gan ieguvumi no insulta profilakses nav precīzi novērtēti. [45] Metaboliskā sindroma ārstēšanai visās vecumgrupās primāri iesakāmas izmaiņas dzīvesveidā.