Normāls lipīdu metabolisms
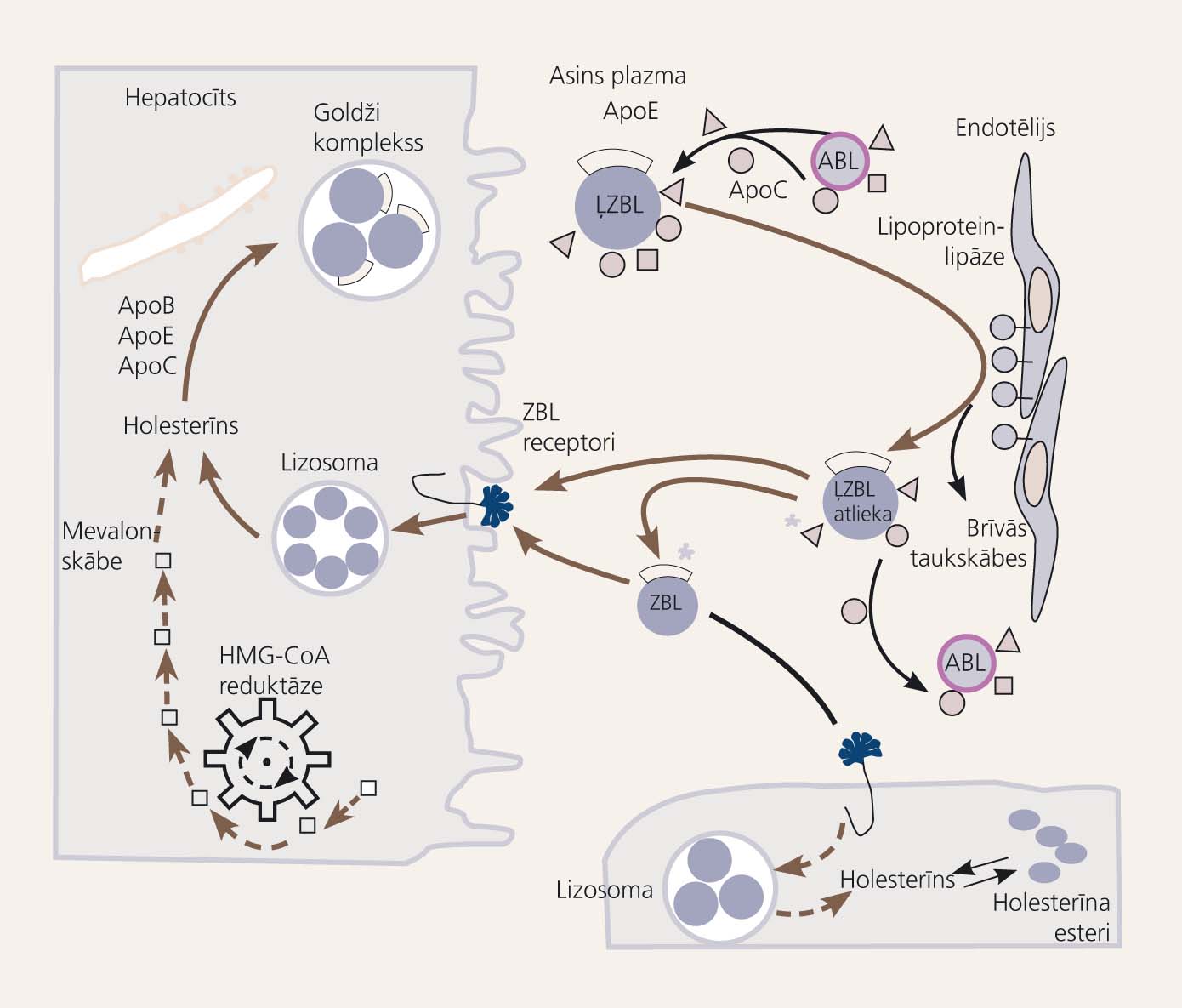
Ar uzturu uzņemtie un aknās sintezētie lipīdi asins plazmā cirkulē lipoproteīnu - hilomikronu, ļoti zema blīvuma lipoproteīnu (ĻZBL), zema blīvuma lipoproteīnu (ZBL) un augsta blīvuma lipoproteīnu (ABL) - sastāvā (1. attēls). [2]

1. attēls
Lipīdu metabolisms
- Hilomikroni, kas satur ar uzturu uzņemtos triglicerīdus (TG), kā arī neesterificēto holesterīnu un holesterīna esterus, tiek formēti zarnu epitēlijā un caur limfas plūsmu transportēti asinsritē. Iedarbojoties kapilāru endotēlija enzīmam lipoproteīnu lipāzei, asinsritē tiek atšķelti TG, kas tiek izmantoti kā enerģijas avots miokarda un skeleta muskuļu šūnās vai arī uzkrāti adipocītos. Pēc TG atšķelšanas hilomikronā atlikušie virsmas lipīdi un apoproteīni tiek pārvietoti uz ABL.
- Hilomikroniem līdzīgs sastāvs ir arī aknās veidotajiem ĻZBL, kas arī pēc nonākšanas perifērajā asinsritē tiek pakļauti minētā enzīma iedarbībai - pēc vairākkārtējas TG atšķelšanas ĻZBL pārtop par ZBL. ZBL savukārt tālāk tiek katabolizēti gan hepatocītos, gan arī ārpusaknu audos, kur atšķeļas brīvais holesterīns, izmanto šūnu membrānu sintēzei. Otrs holesterīna ieguves veids hepatocītos ir tā sintēze no šūnā esošā acetilkoenzīma A caur enzīmu HMG-CoA reduktāzi. Gan šī enzīma, gan ZBL receptoru (uztver ZBL no asinīm hepatocītā) aktivitāti nosaka pašregulējošs mehānisms - šūnā esošā holesterīna daudzums. Tieši plazmā esošā ZBL holesterīna frakcija ir sevišķi aterogēna un salīdzinoši visprecīzāk korelē ar kardiovaskulāro risku.
- ABL sastāv no apoproteīnu daļas, kas tiek sintezēta hepatocītos un enterocītos, un brīvā holesterīna, kas uzkrājies perifērajos audos ZBL sašķelšanās rezultātā. Šīs holesterīna frakcijas funkcija ir audos uzkrātā holesterīna pārpalikuma transportēšana atpakaļ uz aknām. Tādējādi ABL holesterīns darbojas kā kardiovaskulārā antiriska faktors.
Hiperlipidēmijas iedalījums
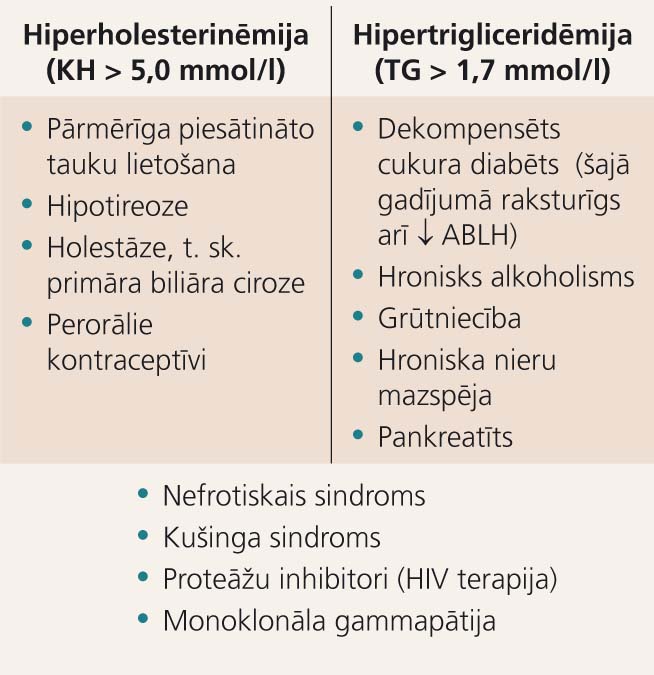
Sekmīgai terapijas taktikas izvēlei ir lietderīgi atcerēties ne tikai dislipidēmijas klīnisko klasifikāciju atkarībā no izmainītās lipīdu frakcijas, t. i., hiperholesterinēmija, hipertrigliceridēmija un jaukta hiperlipidēmija, bet arī etioloģisko momentu - primāru un sekundāru hiperlipidēmiju.

1. tabula
Sekundāras dislipidēmijas iemesli
- Primāras jeb ģimenes hiperlipidēmijas gadījumā lielākoties ir sagaidāms izteikts lipīdu līmeņa paaugstinājums - kopējais holesterīns (KH) > 8,0 mmol/l un/vai TG > 4,5 mmol/l.
- Sekundāras hiperlipidēmijas iemesli attēloti 1. tabulā. Šo potenciālo iemeslu skrīningam ir noderīgi tādi izmeklējumi kā TSH, ALAT, GGT, glikozes, glikozētā hemoglobīna, albumīna un kreatinīna noteikšana asins plazmā, kā arī glikozes un proteīna noteikšana urīnā. [1; 3]
Precīzai lipīdu spektra noteikšanai nepieciešams ievērot, ka KH un ABLH līmeni iespējams noteikt arī neatkarīgi no ēšanas, taču TG un ZBLH jānosaka tukšā dūšā (rekomendēts pat 12 stundas pēc ēšanas).
Lipīdu spektra mērķi
Ņemot vērā faktu, ka daudzos prospektīvos pētījumos ir pierādīta tieši ZBLH korelācija ar kardiovaskulāro slimību risku un prognozi, šī lipīdu frakcija kalpo kā holesterinēmijas kontroles atskaites punkts. Pētījumu dati liecina, ka, pazeminot ZBLH par 1%, risks tiek mazināts par 1%.

2. attēls
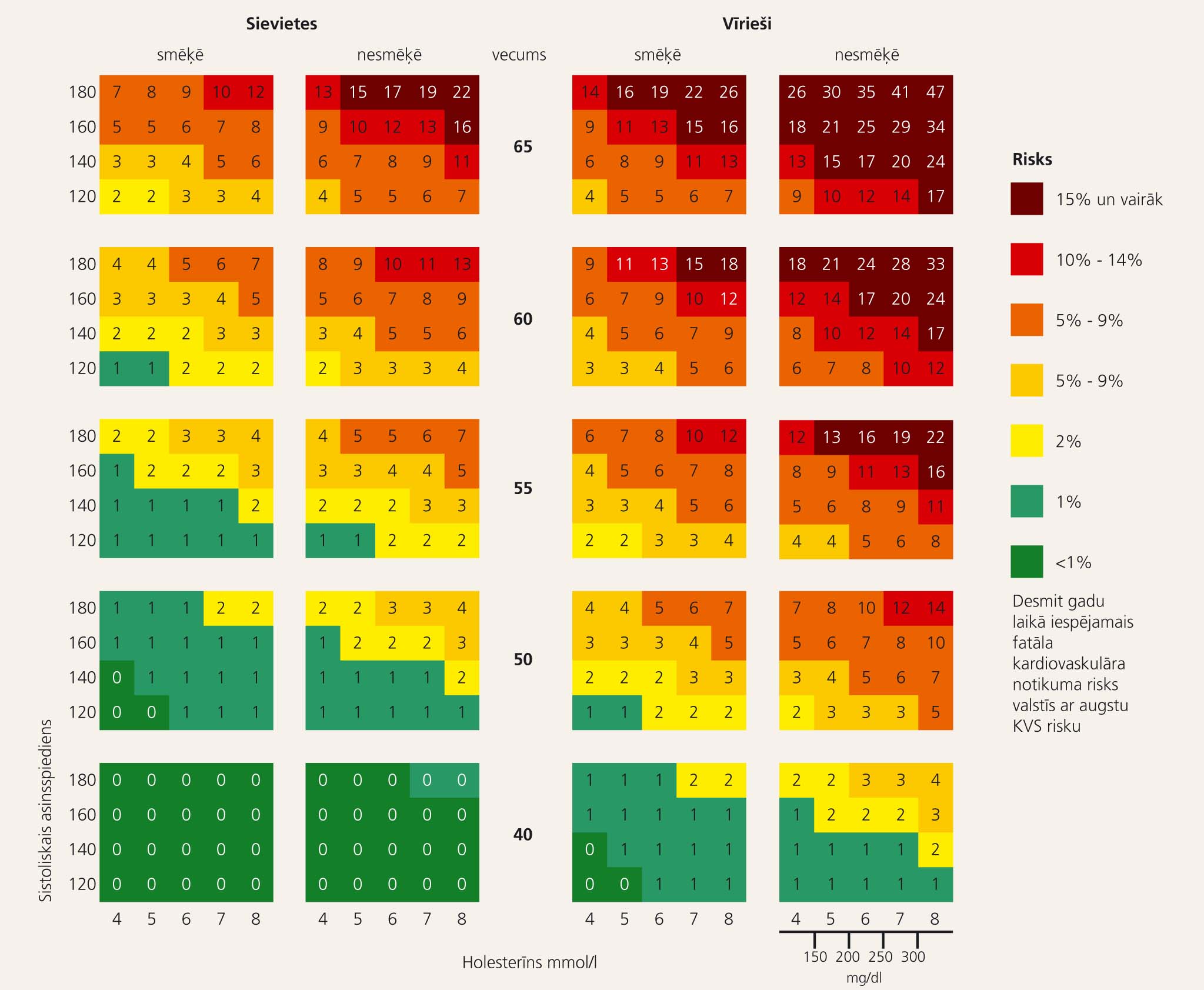
SCORE modelis individuālā kardiovaskulārā riska novērtēšanai
Izvirzot lipīdu frakciju sasniedzamos mērķa lielumus galvenokārt primārajā un arī sekundārajā profilaksē, ir nepieciešams noteikt konkrētā pacienta riska grupu. Šī riska novērtēšanai izmantojams SCORE (Systemic Coronary Risk Evaluation) modelis, kura ietvaros, ņemot vērā pacienta vecumu, dzimumu, sistolisko asinsspiedienu, kopējā holesterīna līmeni (vai KH attiecību pret ABLH) un smēķēšanas statusu, nosakāms fatāla kardiovaskulāra notikuma (FKVN) risks desmit gadu laikā. (2. attēls) [1; 3] Par augsta riska grupu ir uzskatāmi pacienti, kam FKVN risks sasniedz 5-10%, kā arī pacienti ar pierādītu kardiovaskulāru slimību, pacienti ar 1. tipa cukura diabētu un mikroalbuminūriju, pacienti, kam ievērojami paaugstināti atsevišķi riska faktori (sistoliskais asinsspiediens ≥180 mmHG un/vai diastoliskais asinsspiediens ≥ 110 mmHg, KH ≥ 8 mmol/l un/vai ZBLH ≥ 6 mmol/l).
Sekundārās profilakses mērķi
Saskaņā ar kardiovaskulāro slimību profilakses vadlīnijām sekundārajā profilaksē visi pacienti ar pierādītu kardiovaskulāru slimību ir uzskatāmi par augsta riska grupu, tādēļ ZBLH mērķa līmenis noteikts visai radikāls:
Primārās profilakses mērķi
Primārajā profilaksē sasniedzamie mērķa lielumi ir atkarīgi no katram pacientam noteiktā FKVN riska.
- Augsta riska grupai (FKVN risks ≥ 5-10% ) par vēlamo mērķi ir uzskatāms ZBLH
- Pacientiem ar ļoti augstu risku (FKVN risks ≥ 10%) noteiktais ZBLH mērķis ir tāds pats kā pacientiem ar jau esošu kardiovaskulāru slimību -
- Mērenas riska grupas pacientiem (FKVN risks 3-4%) pieļaujamais ZBLH mērķis ir
- Neliela un zema riska grupas pacientiem (FKVN risks 0-2%) optimālais lipīdu līmenis ir šāds: KH 1,2 mmol/l sievietēm un >1,0 mmol/l vīriešiem, TG
Dislipidēmijas rādītāju korelācija un mijiedarbība ar citiem riska faktoriem
Praksē būtiska nozīme ir ne tikai atsevišķu lipīdu frakciju kā kardiovaskulārā riska marķieru skaitliskajiem lielumiem, bet arī to korelācijai un mijiedarbībai ar citiem riska faktoriem. Zināms, ka, savstarpēji kombinējoties vairākiem riska faktoriem, to negatīvā ietekme ne tikai summējas, bet, pateicoties savstarpējai mijiedarbībai, bieži arī potencējas. Kā piemērs minama pazemināta ABLH un paaugstināta TG līmeņa kombinēšanās metabolā sindroma ietvaros, kas daudz vairāk paaugstina gan cukura diabēta, gan aterosklerotiskas kardiovaskulāras saslimšanas risku nekā minētie riska faktori to spētu atsevišķi. [4]
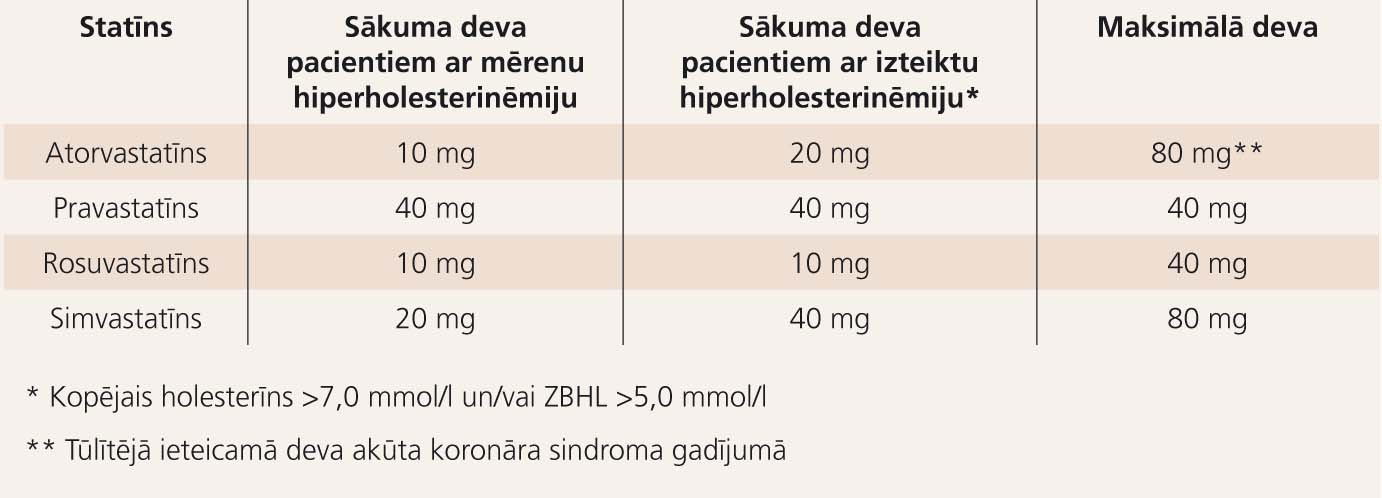

2. tabula
Ieteicamās statīnu terapijas devas
- Ir novērots, ka dislipidēmijas gadījumā diabēta pacientiem dominē izmaiņas tieši TG un ABLH rādītājos, kamēr KH un ZBLH rādītāji parasti saglabājas normas robežās. [5] Pētījumu dati liecina, ka minētā sakarība vairāk izteikta un arī prognostiski nelabvēlīgāka ir sievietēm.
- Ir konstatēta interesanta saistība starp ABLH un tādiem kardiovaskulārā riska faktoriem kā smēķēšana un adipozitāte - pētījumos vērojama pozitīva korelācija starp šiem rādītājiem. Savdabīgi, ka, pārtraucot smēķēšanu, vērojama ABLH līmeņa paaugstināšanās dinamikā. [6]
- Savukārt paaugstinātam TG līmenim ir konstatēta pozitīva korelācija ar tādiem koagulācijas rādītājiem kā fibrinogēna, asinsreces VII un X faktora sintēze, kā arī fibrinolīzes kavēšana, tādējādi sekmējot asins trombogenitāti. [4]
Terapijas izvēle
Paralēli dzīvesveida izmaiņām (veselīga uztura rekomendāciju ievērošanai, pietiekamai fiziskajai aktivitātei), kam vajadzētu būt kardiovaskulārās profilakses pirmajam solim neatkarīgi no riska pakāpes, medikamentoza lipīdu līmeņa pazemināšana jāuzsāk asimptomātiskiem augsta riska pacientiem (FKVN risks ≥ 5%), kam mērķa lipīdu līmeni trīs mēnešu laikā nav izdevies sasniegt ar minētajām nefarmakoloģiskajām metodēm, kā arī pacientiem sekundārajā profilaksē mērķa lipīdu spektra sasniegšanai un noturēšanai. Atsevišķi izdalāmi primāras hiperlipidēmijas pacienti, kam jau sākotnēji jārēķinās ar ierobežotiem panākumiem nefarmakoloģiskā ceļā, agrīnu profilaktisko farmakoterapijas uzsākšanu un lielām, nereti maksimālajām efektīvajām medikamentu devām. Svarīgi uzsvērt, ka, uzsākot hipolipidemizējošo terapiju, tā jāturpina regulāri un ilgstoši [1; 7].
Pastāvot indikācijām uzsākt hipolipidemizējošu terapiju, preparāta izvēle ir atkarīga no izmainītā lipīdu spektra. Hiperholesterinēmijas gadījumos pirmās izvēles preparāti ir HMG CoA reduktāzes inhibitori jeb statīni, izolētas hipertrigliceridēmijas gadījumos (situācijā, kad ZBLH līmenis atbilst konkrētā pacienta mērķa lielumam atkarībā no riska) it īpaši, ja TG līmenis ir izteikti paaugstināts, - fibrāti un/vai omega- 3 taukskābes, savukārt jauktas hiperlipidēmijas gadījumā preparāta izvēle atkarīga no TG līmeņa - līdz 10 mmol/l) priekšroka dodama fibrātiem. Retos gadījumos, kad uz normāla pārējo lipīdu frakciju fona ir izolēti pazemināts ABLH līmenis, terapijas taktikā tiek rekomendēts samazināt ne-ABLH līmeni uz ZBLH rēķina ar statīnu palīdzību.
Statīni
Pašlaik efektīvākie un visplašāk lietojamie medikamenti dislipidēmijas kontrolei ir HMG CoA reduktāzes inhibitori jeb statīni. Šīs grupas preparātu darbība pamatojas uz aknu enzīma HMG CoA reduktāzes bloķēšanu, tādējādi mazinot endogēnā holesterīna biosintēzi. Statīni ir visefektīvākie tieši KH un ZBLH mazināšanai, taču vienlaicīgi tie mēreni mazina arī TG līmeni un nedaudz paaugstina ABLH līmeni.
Uzskata, ka statīnu pozitīvā ietekme uz kardiovaskulārā riska mazināšanu tiek panākta, ne tikai samazinot minētos lipīdu skaitliskos rādītājus, bet arī ar tā dēvētajiem pleijotropajiem efektiem - mazinot iekaisuma rādītājus (galvenokārt C-reaktīvo olbaltumu) un to aktivitāti, kā arī miocītu proliferāciju aterosklerotiskajā pangā un trombocītu agregāciju, tādējādi stabilizējot pangu. [8]
Statīnu monoterapija primārajā un sekundārajā profilaksē tiek saistīta ar kardiovaskulāro notikumu mazināšanos par 25-60% un letālitātes mazināšanos par 30%. Literatūrā ir dati, ka, mazinoties ZBLH līmenim par katru vienu mmol/l, tiek par 20% mazināts kardiovaskulāro notikumu risks tuvāko piecu gadu laikā, kā arī kopējais letalitātes risks samazināts par 12%. Rezultāti no pētījumiem, kuros statīnus saņēmušiem pacientiem dinamikā tika veikta intravaskulāra ultrasonogrāfija koronarogrāfijas laikā, liecina ne tikai par statīnu spēju kavēt aterosklerotiskās pangas tālāku progresēšanu (80 mg atorvastatīna 18 mēnešu laikā REVERSAL pētījumā), bet arī panākt artēriju ateromas regresiju (40 mg rosuvastatīna 24 mēnešu laikā ASTEROID pētījumā). [9]
Devas
Statīni ir izvēles medikamenti gan hiperholesterinēmijas (primāras un sekundāras), gan jauktas dislipidēmijas (ar prevalējošu ZBLH paaugstinājumu pār TG) terapijā. Dažādu statīnu devas minētas 2. tabulā. Primārajā profilaksē terapiju rekomendēts sākt ar nelielām devām, laika gaitā pēc nepieciešamības devu titrējot, līdz sasniegts lipīdu mērķis. Savukārt sekundārajā profilaksē pangas ātrākai stabilizēšanai un vēlamā skaitliskā lipīdu mērķa sasniegšanai ieteicamas lielas vai pat maksimālas statīnu devas. Šis ieteikums attiecas arī uz primāro profilaksi augsta riska pacientiem ar izteikti paaugstinātu KH un ZBLH līmeni. [10]
Kā zināmu trūkumu statīniem var minēt faktu, ka nepieciešamības gadījumā veiktā statīna devas dubultošana katrā reizē pazemina ZBLH par 6%, t. i., titrējot, atorvastatīna devu no sākotnējās līdz maksimālajai (10mg-20mg-40mg-80mg), iegūtais ZBLH pazeminājums būs 18% no izejas līmeņa, kas var izrādīties nepietiekams mērķa sasniegšanā pacientiem ar smagu primāru hiperholesterinēmiju.
Blaknes
Statīnu terapijai lielākoties ir sastopamas divas blaknes - transamināžu pieaugums un miotoksiskums, tādēļ terapijas laikā jāveic regulāra transamināžu (ALAT, ASAT) un kreatīnfosfokināzes (KFK) līmeņa kontrole. [8; 10]
Nelielai daļai pacientu, uzsākot statīnu terapiju, novērojama asimtomātiska trans-amināžu līmeņa paaugstināšanās, kas izzūd pēc statīnu lietošanas pārtraukšanas vai devas mazināšanas. Jāpiebilst, ka statīna deva ir jāmazina vai terapija jāpārtrauc, ja transamināzes paaugstinās vairāk nekā trīskārtēji virs augšējās normas robežas, kā arī gadījumos, kad rodas aizdomas par iepriekš nediagnosticētu aknu slimību. Pētījumos nav pārliecinošu pierādījumu, ka statīnu inducētam transamināžu pieaugumam būtu saistība ar aknu bojājumu. Transamināžu un arī bilirubīna pieaugumam ir konstatēta korelācija ar statīna devu, taču, pat lietojot statīnus augstās devās, nav pierādīta to saistība ar hepatītu vai aknu mazspēju. ALAT un ASAT kontrole nepieciešama, terapiju uzsākot, pēc četrām līdz sešām nedēļām, vēlreiz pēc sešiem mēnešiem un turpmāk reizi gadā, ja nav papildu indikāciju biežākai kontrolei. [1; 11]
Otra praksē sastopamā statīnu blakne ir miotoksiskums - visiem praksē lietotajiem statīniem ir dokumentēti miopātijas gadījumi, kas potenciāli varētu progresēt līdz rabdomiolīzei ar draudošu nieru mazspēju, taču, lietojot standarta statīnu devas, šāds iznākums sastopams vienam no 10 000 pacientu, pārsvarā gadījumos, kad vienlaicīgi lietoti arī fibrāti. Rodoties aizdomām par miopātiju (muskuļu vājums vai sāpes muskuļos, īpaši palpējot), nepieciešams noteikt KFK līmeni un pārtraukt terapiju, ja, simptomiem saglabājoties, tā vairāk nekā trīs reizes pārsniedz augšējo normas robežu. Plānveidīgi KFK līmeni ieteicams noteikt, uzsākot terapiju un pēc tam reizi gadā. [1; 11]
Duāla inhibīcija
Gadījumos, kad ar lielām vai maksimālām statīnu devām nav panākts mērķa lipīdu spektrs, papildus terapijā rekomendē pievienot holesterīna absorbcijas inhibitoru ezetimibu. Monoterapijā ezetimibs piemērots pacientiem ar aktīvu aknu slimību, kad ir absolūti kontrindicēti gan statīni, gan fibrāti. Šī preparāta darbības princips balstās uz endogēnā un eksogēna holesterīna absorbcijas kavēšanu enterocītos. [12]
Pētījumu rezultāti par šo preparātu ir pretrunīgi - no vienas puses - ir pierādīts, ka, pievienojot ezetimibu nelielai statīna devai, tiek panākts tāds pats ZBLH samazinājums, kā izmantojot maksimālu statīna devu, taču - no otras puses - nav pārliecinošu pierādījumu, ka šādi iegūtais ZBLH mērķa lielums būtu saistāms ar izteiktāku aterosklerotiskās pangas augšanas kavēšanu un kardiovaskulāro notikumu incidences mazināšanos salīdzinājumā ar statīnu monoterapijā. [13]
Fibrāti
Fibrāti ir izvēles preparāti pacientiem ar izolētu hipertrigliceridēmiju un jauktu hiperholesterinēmiju, ja individuālai normai atbilstošu rādītāju gadījumā KH un ZBLH ir augsts TG (> 4 mmol/l) un zems ABLH (
Omega-3 taukskābju preparāti
Pēdējā laikā aizvien lielāku lomu dislipidēmijas korekcijā ieņem omega-3 taukskābju preparāti. Tie ir ieteicami devā 1 g diennaktī sekundārajā kardiovaskulārajā profilaksē augsta riska pacientiem, visbiežāk tomēr kombinācijā ar statīnu pamatterapiju. Ir pētījuma dati, kas liecina par koronāro notikumu pēc miokarda infarkta mazināšanos, lietojot omega-3 taukskābes minētajā devā. Otra situācija, kad piemēroti šie preparāti, ir smaga izolēta hipertrigliceridēmija (kombinācijā ar fibrātiem omega-3 taukskābes ieteicamas vēl lielākā devā - 2-3 g diennaktī). [14]
Nikotīnskābes preparāti
Šie preparāti ir salīdzinoši mazāk populāri, galvenokārt saistībā ar nereti izraisītajām blaknēm (perifērā vazodilatācija - ādas apsārtums un nieze). Salīdzinot ar statīniem, šīs grupas preparāti pētīti mazāk, taču ir dati par nikotīnskābes ietekmi ne tikai uz ZBLH līmeņa pazemināšanu (efekts gan vājāks kā statīniem), gan īpaši ABLH paaugstināšanu. Rekomendēti arī kombinācijā ar statīniem. [14]
Kanabinoīdu receptoru blokatori
Visjaunākā perspektīvā medikamentu grupa dislipidēmijas kontrolē ir kanabinoīdu-1 receptoru blokatori, kas īpaši piemēroti pacientiem ar paaugstinātu ķermeņa masu. Šīs grupas galvenais terapeitiskais efekts paralēli svara samazināšanai ir TG līmeņa pazemināšana un ABLH līmeņa pieaugums. Pašlaik vienīgais pieejamais šīs grupas preparāts ir rimonabants, tā rekomendētā deva - 20 mg diennaktī [14].
Nobeigumā varam secināt, ka dislipidēmija ir nozīmīgs, bet labi koriģējams kardiovaskulārā riska faktors, kas kombinācijā ar citu riska faktoru korekciju dod ievērojamu ieguldījumu gan primārajā, gan sekundārajā kardiovaskulāro slimību profilaksē un aterosklerozes ārstēšanā.