Raksta mērķis ir atšifrēt informāciju, kas liecina par mikrometastāzi reģionālajā limfmezglā, lai atturētu no steidzīgas, nepamatotas limfadenektomijas, kas var inducēt melanomas progresiju.
Melanomas invāzijas dziļums un reģionālā limfmezgla imūnkompetence
Ilgstošā pārliecība par primārās melanomas tradicionālo plašo ekscīziju pēdējos gados, pamatojoties uz trīs plašiem kooperatīviem randomizētiem pētījumiem1, ir pārvērtēta par labu ekonomiskām operācijām. Ir radusies pārliecība, ka melanomas turpmāko gaitu pēc primārā perēkļa ekscīzijas nenosaka ekscīzijas plašums, bet tā ir atkarīga no melanomas invāzijas dziļuma ādā, kas nosaka arī reģionālā limfmezgla protekcijas raksturu. Šī patiesība atklājās arī mūsu pētījumos.
Kad melanoma ir tikai ādas kārpiņu slānī, jau pirms primārā perēkļa ekscīzijas novēro CD8+ šūnu aktivitāti, ko nenovēro ne I B, ne II A stadijā, kad melanoma jau iesniedzas ādas retikulārajā (tīklainajā) slānī. Primārās melanomas invāzija retikulārajā slānī saistīta ar HLA-DR+ receptoru šūnu un monocītu pārmērīgi palielinātu skaitu, kas liecina par melanomas progresijas iespēju. Imūnanalīzes I A stadijā pēc primārā perēkļa ekscīzijas atšķiras no I B un vēl vairāk - no II A stadijas - pēc primārā perēkļa ekscīzijas (jāpiebilst, ka mūsu analizētajiem slimniekiem primārā melanoma bija ekscidēta ar tradicionālo trīs līdz piecu centimetru atkāpes metodi).
Melanomas progresiju neatkarīgi no stadijas piecu gadu periodā novēro 44% slimnieku
Ja I A stadijā trīs mēnešus pēc primārā perēkļa ekscīzijas novēro limfmezglu aktivāciju, ko novēro arī pēc gada ar jau izteiktu reaktīvo limfmezglu ainu (indeksi Ly/Mo un visu subpopulāciju CD4/Mo , CD8/Mo , CD38/Mo ), tad vēlākos periodos (pēc trīs līdz pieciem gadiem) tas nav vērojams, bet parādās viens otrs HLA-DR+ receptoru šūnu aktivācijas simptoms un šo šūnu diskorelācija ar T sistēmas šūnām. Jautājumam, kas to izraisa (kur lokalizējušās, slēpjas vēža šūnas vai antigēns), viennozīmīgas atbildes nav, bet, ja melanomas metastāzes nekonstatē, šādi atsevišķi simptomi pamato bioterapiju ar mērķi aktivēt limfmezglu protektīvās reakcijas.
Pēdējo gadu literatūras dati liecina, ka pēc melanomas primārā perēkļa ekscīzijas (I B, II A un II B stadijās) neatkarīgi no ekscīzijas taktikas - plašās vai ekonomiskās - melanomas turpmākā gaita ir statistiski vienāda. Melanomas progresiju neatkarīgi no stadijas piecu gadu periodā novēro 44% slimnieku, turklāt visātrāk parādās limfmezglu metastāzes (21%), vēlāk attālās metastāzes un metastāzes iekšējos orgānos (23%). Vietējie recidīvi ir reti. Visretāk melanoma piecu gadu periodā progresē, ja ekscidēta I B stadijā (7-11%). Pēc ekscīzijas II A stadijā progresija ir 41% slimnieku; no tiem 21% ir limfmezglu metastāzes, 15,6% attālās metastāzes un 5,2% - vietējie recidīvi.
II B stadijā, kad melanoma pilnībā iekļuvusi retikulārajā slānī, progresiju novēro 51% slimnieku, bet pirmās metastāzes nav vērojamas limfmezglos, bet iekšējos orgānos (attālās).
Pēc mūsu datiem, I B stadijā pirms ekscīzijas konstatē normālu T šūnu skaitu un normālas šo šūnu savstarpējās attiecības (CD8=CD38), bet starp monocītiem un HLA-DR+ receptoru šūnām vērojams vienādošanās fenomens, kas raksturīgs primāram perēklim agrīnā I A stadijā (Mo=HLA-DR), kad mēreni aktivētas ir HLA-DR+ receptoru šūnas.
II A stadijā, kad melanoma jau pilnībā ieaugusi retikulārajā slānī jau pirms ekscīzijas, limfocītu un T šūnu skaitam ir tendence pazemināties. Diskorelē CD8+ un CD38+ šūnu skaits (CD8 > CD38) un HLA-DR+ receptoru šūnu skaits pārsniedz monocītu skaitu. Šāda imūnsituācija - T sistēmas supresija un HLA-DR+ receptoru šūnu hiperaktivācija - šai stadijai ir ļoti raksturīga.
Tātad, šodien ir pilnīgi skaidrs, ka melanomas procesa prognoze atkarīga no primārās melanomas dziļuma ādā, precīzāk - kādā ādas slānī tā ieaug, jo no tā atkarīga limfmezglu protekcijas intensitāte.
Agrīnās stadijās, kad melanoma aug kārpiņu slānī (I A) vai tikai nedaudz iesniedzas retikulārajā slānī (I B), tā atrodas daudzu imunitātei nozīmīgu imūnšūnu ielenkumā: monocīti, makrofāgi, Langerhansa šūnas, dendrītu šūnas, visas antigēnu prezentējošās šūnas. Pa limfas ceļiem melanomas šūnas visātrāk nokļūst limfmezglos. No literatūras datiem zināms, ka melanomas primārā perēkļa periodā 95% slimnieku imūnprocesā jau iesaistīti viens vai divi limfmezgli (Morton at al.), kur arī izšķiras - būt vai nebūt limfmezglos noritošo procesu protekcijas raksturam. Vēlīnās stadijās retikulārajā slānī imūnšūnas mazāk apņem melanomas šūnas un tām ir vieglāk iekļūt asinsvados.
Neskatoties uz šodienas diagnostikas tehniku medicīnā, lai noteiktu limfātiskā aparāta minimālos bojājumus (izņemot histoloģiju, kad datus iegūst pēc limfadenektomijas), pilnīgi pārliecinošas metodes joprojām nav. Zinātniekiem ir liela interese izprast mikrometastāžu simptomus, limfmezglu imūnkompetenci limfmezglos - kas noris mikrometastāžu periodā? Pēta S-100 proteīnus, ar melanomu asociētos antigēnus, melanomas membrānas struktūru, lai noteiktu atgrūšanas vai progresijas MAGE antigēnus u.c.
Nedaudz par limfmezgliem
Limfmezgli ir asinsrades orgāni. Limfātisko audu sakopojumi ir iekapsulēti un neiekapsulēti. Iekapsulētie ir limfmezgli. Neiekapsulētie atrodas gļotādās. Ierosi limfmezglu aktivitātei nosaka tur nokļuvušais antigēns, kas pievelk B limfocītus, kuri, antigēna rosināti, vairojas neiekapsulētajos limfātisko audu sakopojumos, veidojot folīkulus. Folīkulos B šūnas pārveidojas par plazmocītiem un sintezē antivielas. Neiekapsulētie limfātisko audu sakopojumi saņem antigēno informāciju no audu šķidruma, bet limfmezgliem to piegādā limfa pa limfvadu ceļiem. Limfa bagātina limfmezglus arī ar limfocītiem un makrofāgiem.
Limfocītu subpopulācijas lokalizējas noteiktās zonās: T limfocīti atrodas dziļi garozā - parakortikālā zonā, t.i., tur, kur sākas medulārie pavedieni. B limfocīti atrodas folīkula sekundārajos mezgliņos - tā vidus zonā - reaktīvajā centrā. Medulārā - serdes daļā atrodas T šūnas, B šūnas - apņemtas ar makrofāgiem. Limfmezglu stroma ir šūnas, kas nodrošina limfocītu subpopulāciju lokalizāciju - iemājošanos (homing). B limfocītu zonā atrodas dendrītiskās šūnas, kuru virsma nosegta ar antivielām, kas saista antigēnu. T limfocītu zonā ir interdigitējošās šūnas, kuras pastiprināti ekspresē MHC II klases virsmas antigēnus, spēj prezentēt svešo antigēnu T sistēmas šūnām (helperiem) un veicina T limfocītu transformāciju limfoblastos. To nodrošina šo šūnu ciešais kontakts, jo starp pirkstveidīgiem izaugumiem iespiežas T limfocītu kopojumi. Makrofāgi ir izvietoti limfas sinusos un medulāros pavedienos.
Limfmezglu funkcija
Limfmezglu funkcija ir saistīta ar imūnreakcijām un limfas attīrīšanu, kas notiek sinusos un to veic makrofāgi, fagocitējot mikrobus un citus antigēnus. Noteiktās limfmezglu zonās antigēns rosina attiecīgu limfocītu subpopulāciju attīstību. Reaktīvajos centros norit imūnatbilde, ko nosaka trīs šūnu mijiedarbība; B limfocīti no makrofāgiem saņem informāciju par antigēnu, bet no T-helperiem (CD4+) - indukciju imunoģenēzei. Aktivētie B limfocīti transformējas plazmoblastos, no kuriem rodas plazmocītu kloni, kas sintezē vajadzīgās antivielas. Pirmā saskare ar antigēnu imūnatbildē realizējas trīs līdz četru dienu laikā, otrreizējā saskare - 24 stundu laikā. Šo paātrinājumu veic atmiņšūnas.
Liela nozīme imūnatbildē ir makrofāgu skaitam. Ja tas ir nepietiekams, sintezējas nespecifiski gamma globulīni. Ja nepietiek T-helperu šūnu, iet bojā B limfocīti un antivielas neveidojas. [1]
Perifēro asiņu imūnanalīzēs atspoguļojas imūnnorises limfoīdajos audos un limfmezglos. Limfmezgls ir dinamiska struktūra, un tā funkcijas realizējas, sadarbojoties visām imūnšūnām, kuru savstarpējā sadarbība un melanomas asociētā antigēna veidošanās intensitāte melanomas metastāzes gadījumā nosaka arī limfmezgla funkcionālās norises rezultātu - imūnprotekciju vai supresiju.
Sargmezgls - organisma aizsardzībai
1977. gadā Kabanas (R. M. Cabanas) izstrādāja koncepciju par tā dēvēto sargmezglu (sentinel). Tās būtība: no jebkura organisma rajona limfas pasāža notiek uz noteiktu limfmezglu - sargmezglu. Tajos realizējas pirmās ļaundabīgā audzēja metastāzes! Lai noteiktu šo sargmezglu, koncepcijas autors ieteica netiešu kontrasta limfangiogrāfijas metodi.
1992. gadā Mortons (D. Morton et al.) pēc ilgstošiem limfmezglu reakcijas pētījumiem onkoloģiskiem slimniekiem, lai diagnosticētu sargmezglu, ieteica operācijas laikā to diagnosticēt ar radioizotopo limfoscintigrāfiju un pierādīja tā efektivitāti klīniski nediagnosticējamai melanomas un krūts dziedzera vēža limfmezglu metastāžu atklāšanai. Operatīvi vienlaicīgi evakuē primāro perēkli un sargmezglu, līdz ar to sargmezgls, kas vēl var būt spējīgs organisma aizsardzībai, tiek likvidēts un radioaktīvie izotopi savukārt nomāc T-šūnu un visvairāk CD8+ šūnas citotoksisko aktivitāti. No 99 melanomas slimniekiem 3-18 mēnešu periodā 2% konstatēja metastāzes plaušās un 1% - lokālo recidīvu.
Limfmezglu metastāzes pēc sargmezgla evakuācijas konstatē ļoti reti. Tās nekad nekonstatēja arī tad, kad melanomu Latvijā vēl ārstēja (līdz 1984. gadam) ar staru terapiju, kas šodien, saskaņā ar Eiropas Savienības medicīniskās onkoloģijas (ESMO) rekomendācijām ir aizliegta. Šiem starotajiem pacientiem melanomas tālākā gaitā 80% gadījumos bija zemādas metastāzes. Pamatojoties uz Latvijas ZA Mikrobioloģijas institūta Vēža viroterapijas laboratorijas ierosinājumiem, 1984. gadā Latvijas Veselības aizsardzības ministrija izdeva pavēli, aizliedzot melanomas slimniekiem pielietot staru terapiju.
Reģionālie limfmezgli ādas melanomas slimniekiem
Ļoti rūpīgus pētījumus par ādas melanomas slimnieku reģionālajiem limfmezgliem veikuši G. Franks un E. Jakubova. [2] Autori salīdzina kontroli ar trīs limfmezgliem: melanomas slimnieku reaktīviem limfmezgliem bez metastāzēm, limfmezgliem ar metastāzēm un ar bakteriālas patoloģijas izraisītiem hiperplastizētiem reaktīviem limfmezgliem (1.attēls).
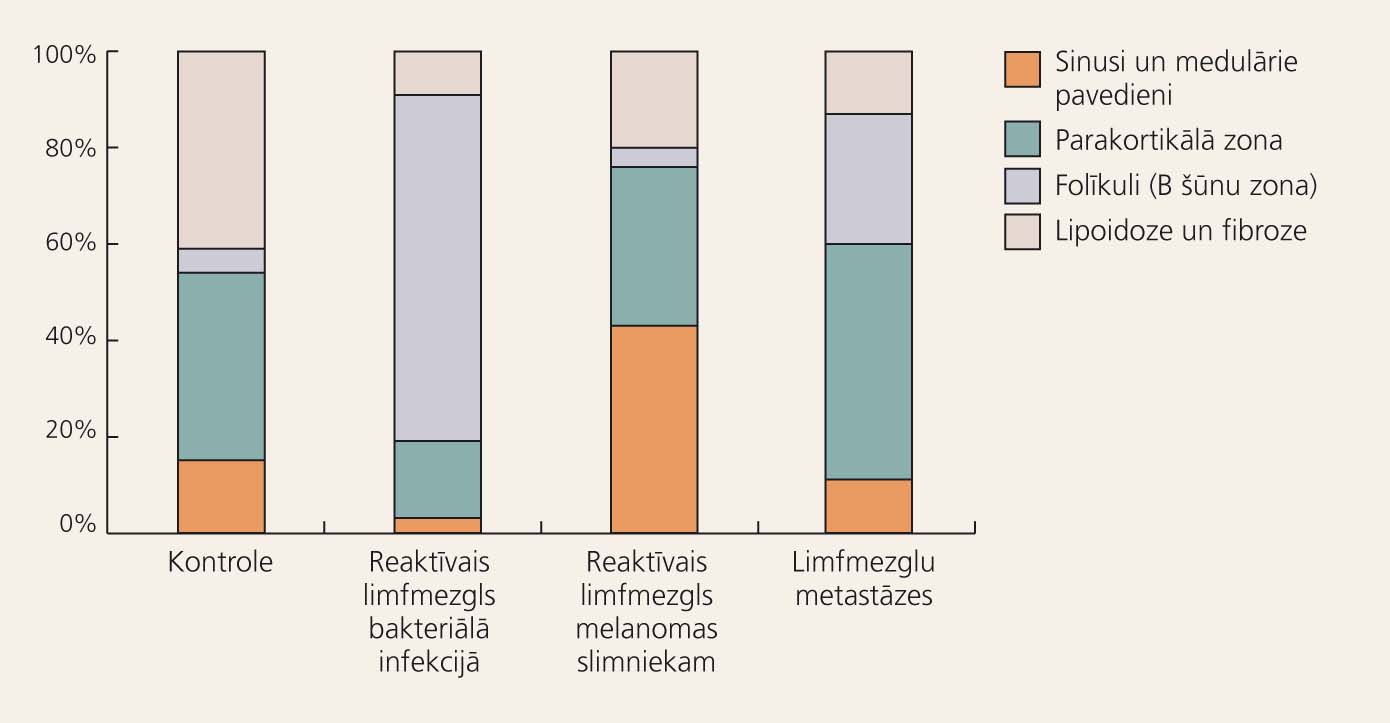

1. attēls
Limfmezgla summārā histogramma izmeklētās grupās
- Kontrolē prevalē lipoidozes, sklerozes un parakortikālās T limfocītu zonas, aizņemot 77,2% no limfātiskā mezgla tilpuma. Sinusi un medulārie pavedieni, kuros T sistēmas šūnas kontaktē ar monocītiem, ir maz izteikti, bet B šūnu zonas praktiski nav. Hiperplastizētos reaktīvos limfmezglos prevalē folīkuli ar B limfocītu centriem, kas aizņem 71% tilpuma. Tādas parādības melanomas slimniekiem nenovēro.
- Melanomas inducētie reaktīvie limfmezgli ar bakteriālās patoloģijas reaktīvajiem limfmezgliem nav salīdzināmi, tie ir strukturāli atšķirīgi.
- Melanomas slimniekiem ar metastāzēm neskartajos reaktīvajos limfmezglos prevalē sinusu, medulāro pavedienu un parakortikālās zonas (līdzīgi kontroles limfmezgliem, folīkuli ar B limfocītu centriem aizņem limfmezglos minimālo tilpumu).
Analizējot metastātiskos limfmezglus, autori atzīmē, ka metastāžu lielums var būt ļoti atšķirīgs - no nelieliem perēklīšiem malas sinusos, līdz metastāzēm, kas pilnīgi aizņem visas limfmezgla struktūras (apmēram divas trešdaļas), izņemot folīkulus un B šūnu centrus. Limfmezgla metastāzēs vislielāko limfmezglu neskarto tilpumu aizņem parakortikālā zona, palielināta ir B zona ar sekundārajiem mezgliņiem, kas izteikti atšķiras no melanomas slimnieku reaktīvajiem limfmezgliem. Limfmezglos ar melanomas metastāzēm konstatē arī nelielu sinusu un medulāro pavedienu zonu, kas melanomas reaktīvajos limfmezglos ir vislielākā.
Visas trīs salīdzināmās zonas atšķiras no kontroles rādītājiem. Reaktīvajiem limfmezgliem melanomā nav palielināta B zona, kas ir izteikti bakteriālās infekcijas un arī melanomas metastāžu gadījumos.
Jāsecina, ka primārā perēkļa ekscīzijas radikalitātē būtiska ir reaktīvā limfmezgla fāze kā pirms, tā pēc primārā perēkļa ekscīzijas. Nozīme ir limfmezglu mikrometastāzēm un to turpmākai norisei - redukcijai vai progresijai. Imūnprocesi, kas noris limfmezglos mikrometastāzes laikā, būtiski ietekmējami ar biopreparātiem (Latvijā izstrādātiem Rigvir un Larifan, kas uzskatāmi par autovakcīnas induktoriem organismā un nodrošina ilgstošu melanomas procesa stabilitāti).
Sargmezglu diagnostika ar radioaktīvām metodēm un reaktīvo limfmezglu operatīvā evakuācija - pretaudzēju imunitātes aborts
Reaktīvo limfmezglu operatīvā evakuācija abortē veidojošos imunitāti, kas ir gandrīz nāves spriedums pacientam (par to Mortons ar kolēģiem brīdina jau 1989. gadā). To apliecina arī mūsu novērojumi deviņdesmito gadu sākumā ar 14 slimniekiem, 11 no kuriem (80%) melanomas process pēc reģionālā reaktīvā limfmezgla limfadektomijas ar hematogēno izsēju strauji progresēja iekšējos orgānos, smadzenēs un zemādā, ar exitus letalis 6-18 mēnešu periodā (nepublicēti dati).
Mēs noliedzam sargmezgla diagnostiku ar radioaktīvām metodēm tieši melanomas slimniekiem, jo melanomas šūnas ir nejūtīgas pret staru terapiju. Tādi paši priekšstati izteikti 2004. gada Eiropas medicīniskās onkoloģijas sabiedrības (ESMO) minimālajās klīniskajās rekomendācijās; tās neiesaka melanomas slimniekiem kā rutīnu izvēles limfadenektomiju vai staru terapiju uz limfātiskiem mezgliem. Iespējams, ka limfmezglu diagnostika ar radioaktīvām metodēm ir iespējama to audzēju gadījumos, kas ir jutīgi pret staru terapiju. Melanomas slimniekiem iesakām imūnanalīzes, kas ir pilnīgi nekaitīgas un attiecībā uz melanomas limfmezglu metastāžu diagnostiku - jau šodien informatīvas.
Reaktīvo un metastātisko limfmezglu funkcionālās aktivitātes izpratne - terapijas taktikas izvēles nosacījums
Kā liecina literatūras dati un mūsu pieredze, ekscīzijas I A, retāk I B stadijā ir radikālas. Melanomas I A stadijas primārais perēklis aug ādas kārpiņu slānī daudzu antigēnu prezentējošo šūnu ielenkumā, kas arī zināmā mērā nosaka ekscīzijas radikalitāti. Analizējot desmit melanomas klīnisko grupu imūnanalīzes tika novērots, ka I A stadijā primārā perēkļa laikā diskorelācijā atrodas sekojošas pozīcijas: CD8/Mo , CD=B+NK, Ly/HLA-DR¯, liecinot par imūnsistēmas aktivāciju reģionālajā limfmezglā (detalizēta, pilnīga informācija - [3]). Trīs mēnešus pēc I A stadijas melanomas ekscīzijas cerīgs simtoms ir CD8+ šūnu palielināts skaits (>30%), saglabājot normālas attiecības ar CD38+ šūnu skaitu. Primārā perēkļa ekscīzijas radikalitāti apliecina arī klīniski un ultrasonogrāfiski kontrolētie normālie reģionālie limfmezgli viena līdz piecu gadu periodā. Šiem slimniekiem imūnanalīzē ir tendenciozi palielinātas visas imūnšūnas, normāls monocītu skaits un normālas visu šūnu savstarpējās attiecības un šo imūnparametru ilgstoša stabilizācija.
Par ko informē reģionālie reaktīvie limfmezgli?
Primārā perēkļa ekscīzijas radikalitāti un imūnsistēmā notiekošās protekcijas rakstura norises apliecina reģionālo reaktīvo limfmezglu veidošanās.
Reģionālie reaktīvie limfmezgli pēc primārā perēkļa ekscīzijas, manuāli taustot, ir pamīksti, aptverti ar reaktīvajiem audiem - ieguldīti it kā spilventiņā. Tos visbiežāk novēro trīs mēnešus pēc operācijas I A, I B stadijā. Tie var veidoties arī vēlāk. Visticamāk tos raksturo izteikti samazināts monocītu skaits uz limfocītu, T sistēmas šūnu (CD3+) un to subpopulāciju palielinātu šūnu skaita fona. Statistiski ticami palielināts ir B+NK šūnu kopas skaits, līdzīgi kā zemādas metastāzēs. Palielinātais HLA-DR+ receptoru šūnu skaits pārsniedz monocītu skaitu, un indekss Mo/HLA-DR ir izteikti pazemināts. Pēdējo simptomu novēro arī primārās melanomas II A stadijā un aknu metastāzēs. Tas liek domāt, ka daži reaktīvo limfmezglu simptomi ir arī ādas un aknu metastāzēs, t.i., orgānos, kuros ir daudz monocītu/makrofāgu šūnu.
Reaktīvo limfmezglu veidošanās laikā limfocītu un T šūnu savstarpējās attiecības un arī attiecības ar B+NK šūnu kopu ir korelētas. Limfocīti, T sistēmas šūnas un to subpopulācijas diskorelē ar monocītiem (Ly/Mo, CD3/Mo, CD4/Mo, CD38/Mo); tas liecina, ka monocītu migrācija perifērajās asinīs ir kavēta, jo tie mobilizēti limfmezglos. Sinusu un medulāro pavedienu zonā, kur notiek imūnprotekcijas reakcijas, iespējama T sistēmas aktivācijas reakcija pret mikrometastāzēm. Imūnprotekcijā iesaistās arī B+NK šūnu kopa, ko apliecina indekss B+NK/Mo, kas ir vienīgais 18 grupu analīzē. Reaktīvo limfmezglu raksturo arī imūnšūnu vienādošanās fenomens CD8=CD38=B+NK. Tas liecina par līdzsvarotu, korelētu CD8+, CD38+ un B+NK šūnu kopas aktivācijas ainu. Reaktīvo limfmezglu slimniekiem HLA-DR+ receptoru šūnas, kaut gan to skaits pārsniedz normu vairāk nekā par 50%, korelē ar limfocītiem un T sistēmas šūnām. Šī normālā korelācija ir izteikts limfmezglu protekcijas simptoms.
Reaktīvā limfmezgla un vēlīno reģionālā limfmezgla metastāžu atšķirības imūnšūnu analīzēs
Ja reaktīvo limfmezglu periodā visu T sistēmas subpopulāciju skaits ir korelatīvi palielināts, ir palielināts arī HLA-DR+ šūnu un B+NK kopas skaits un izteikti pazemināts monocītu skaits, tad melanomas metastāzes veidošanās limfmezglā realizējas ar limfocītu skaita pazemināšanās tendenci, kas raksturīga ir arī B+NK kopai. HLA-DR+ šūnu skaits neatšķiras no normas, toties monocītu skaits ir izteikti palielināts - divreiz pārsniedzot HLA-DR+ šūnu skaitu. Reģionālā nobriedušā limfmezgla metastāzēs imūnšūnu indeksu simptomi ir:
- ar monocītiem diskorelētie limfocīti un visas T sistēmas šūnas (Ly/Mo¯, CD3/Mo¯¯, CD4/Mo¯, CD8/Mo¯¯=, CD38/Mo¯ ¯=), arī B+NK šūnas, vienlaikus ar paaugstinātu indeksu Mo/HLA-DR; pēdējais simptoms nav vērojams nevienā citā melanomas klīniskajā grupā;
- šūnu skaita vienādošanās triplets (2. attēls).

2. attēls
Limfmezglu metastāzēm raksturīgais šūnu triplets
Šī informācija liecina, ka imūnsupresiju agresīvi augošās melanomas metastāzes izraisītās limfmezgla mazspējas dēļ izraisa monocīti.
Reģionālā limfmezgla agrīnā metastāze trīs mēnešus pēc primārā perēkļa ekscīzijas
Ja limfmezglu metastāze izveidojas pēc primārā perēkļa ekscīzijas, par mikrometastāzi informē indeksi: CD4/CD8, B+NK/CD8±, CD3/CD38±, B+NK/CD38±, kas liecina par vienlaicīgu, bet korelētu CD8+ un CD38+ šūnu supresiju (CD8=CD38). Tas ir T sistēmas aktivācijas mazspējas aizsākums, ko acīmredzot izraisa B sistēmas aktivācija un palielinātā HLA-DR+ receptoru šūnu veidošanās. Ir arī indeksi, kas liecina par monocītu aktivitātes kontroli: Ly/Mo ± un CD4/Mo±, kamēr attiecības CD8/Mo, CD38/Mo ir normālas. Šie pēdējie simptomi vērtējami kā imūnprotekcija.
Ja reģionālā limfmezgla metastāze parādās trīs mēnešus pēc primārā perēkļa ekscīzijas, tad perifēro asiņu imūnanalīze ir ļoti līdzīga slimnieku grupai ar limfmezglu metastāzēm. Limfocītu un T sistēmas subpopulāciju šūnu skaitam ir korelēta samazināšanās tendence. HLA-DR+ receptoru šūnu skaits nav palielināts, līdzīgi nobriedušām limfmezglu metastāzēm, bet monocītu skaits nepārsniedz normu un šo divu šūnu (Mo un HLA-DR+ receptoru šūnu) attiecības ir normālas un vēl korelētas. Neskatoties uz normālu monocītu skaitu, tie diskorelē ar limfocītiem, T sistēmas šūnām un to subpopulācijām un var veidot limfmezglu metastāzēm raksturīgo šūnu tripletu (2. attēls).
B+NK šūnu kopa diskorelē nevis ar monocītiem, bet ar CD38+ šūnām: B+NK/CD38 , kas liecina par T sistēmas aktivācijas defektu. Pēc primārā perēkļa ekscīzijas agrīnas limfmezglu metastāzes veidošanās sākumposmā ir vēl daži protekcijas simptomi, proti, indeksi CD8/HLA-DR=N, Mo/HLA-DR=N, B+NK/HLA-DR=N. Tātad limfmezgla imūnprotekcija vēl nav pilnīgi nomākta un bioterapija var to palielināt un normalizēt. Ir nepieciešama ik mēneša limfmezgla kontrole klīniski un ar ultrasonogrāfijas metodi, savlaicīga limfadektomija, pēc kuras jāturpina bioterapija un attālāko limfmezglu aktivācija uz imūnnorišu kontroles fona. Ja novēro diskorelāciju CD16+ un CD19+ šūnu skaita attiecībās, šiem slimniekiem ir ieteicams kombinēt preparātus Rigvir ar Larifan, jo larifāns minēto šūnu attiecības normalizē.
Ja limfmezglu metastāze progresē, terapijas taktika ir limfadenektomija, pēc kuras nepieciešama limfmezglu aktivējoša bioterapija (Rigvir, Larifan reģionāla un ilgstoša pielietošana uz imunitātes kontroles fona). Dzīvildzes rezultāti pēc limfadenektomijas ir vēl labāki, ja Rigvir preparāts saņemts pirms un pēc primārā perēkļa ekscīzijas un līdz ar to jau ir rosinājis limfmezglu protektīvās imūnnorises.
Jāpiebilst, ka monocītu skaitu vislabāk var novērtēt ar mikroskopisko metodi, jo automātiskās aparatūras programma ir izstrādāta pagājušā gadsimta septiņdesmitajos gados, kad vēl nebija pietiekamas informācijas, ka lieluma ziņā monocītiem līdzīgi ir lielie granulārie limfocīti, kas ir dabīgās galētājšūnas, tādēļ aparatūras analīze nevar dot precīzu informāciju par monocītu skaitu.
Limfmezglu mikrometastāžu veidošanās izpausme perifēro asiņu imūnanalīzēs
Limfmezglu mikrometastāžu atspoguļojumu perifēro asiņu imūnšūnu skaitā un to attiecībās un tā nozīmi melanomas progresijas protekcijā vislabāk var vērot slimnieku grupā, kuriem limfadenektomija izdarīta 6-12 mēnešu laikā pēc primārā perēkļa ekscīzijas, metastātiskie limfmezgli apstiprināti histoloģiski un imūnanalīzes veiktas regulāri pirms limfadenektomijas. Šādas analīzes salīdzinātas ar to slimnieku analīzēm, kuriem pēc primārā perēkļa ekscīzijas gada garumā limfmezgli klīniski ir normāli, un slimniekiem, kuriem trīs līdz piecu gadu periodā pēc primārā perēkļa ekscīzijas novērota procesa stabilizācija. Šo trīs grupu slimniekiem ir vairāki vienādi imūnprotekcijas simptomi:
- tendenciozi un korelēti palielināts limfocītu, CD3+, CD4+ un B+NK kopas šūnu skaits;
- CD8+, CD38+ šūnu skaits normas līmenī un normālās attiecībās (=);
- normāls monocītu skaits;
- HLA-DR+ receptoru šūnu skaits palielināts (+45%) un vienādā skaitā ar monocītiem (līdzīgi slimniekiem agrīnās melanomas stadijās un pēc radikālām operācijām);
- šūnu skaita vienādošanās CD4=B+NK;
- nenovēro limfocītu un T sistēmas šūnu savstarpējo diskorelāciju un klasisko limfmezglu metastāzēm raksturīgo diskorelāciju ar monocītiem;
- indeksi Ly/Mo, CD4/Mo ir reaktīvo limfmezglu simptomi;
- visiem šo triju grupu slimniekiem T sistēmas šūnu un to subpopulāciju skaits diskorelē ar HLA-DR+ receptoru šūnām.
Ja limfmezgla metastāze izveidojas pēc primārā perēkļa ekscīzijas, par mikrometastāzi informē indeksi CD4/CD8, B+NK/CD8±, CD3/CD38±, B+NK/CD38±, kas liecina par vienlaicīgu, bet korelētu CD8 un CD38 supresiju (CD8=CD38). Tas ir T sistēmas aktivācijas mazspējas aizsākums, ko acīmredzot izraisa B sistēmas aktivācija un palielinātā HLA-DR+ receptoru šūnu veidošanās. Ir arī indeksi, kas liecina par monocītu aktivitātes kontroli: Ly/Mo± un CD4/Mo±, kamēr attiecības CD8/Mo, CD38/Mo ir normālas. Šie pēdējie simptomi vērtējami kā imūnprotekcija.
Tātad analizētajās slimnieku grupās nav melanomas šūnu hematogēnās izsējas simptomu, nav metastāžu iekšējos orgānos, nav limfmezglu metastāžu klasisko simptomu. Visās trijās grupās ir vienādi šūnu skaita vienādošanās fenomeni CD8=CD38, Mo=HLA-DR+. Ja limfmezgli gada laikā nemainīgi ir normāli, šiem slimniekiem ir tā dēvētā imūnsistēmas normalizācijas fāze, bet tā nenodrošina pret melanomas progresiju, kas var izveidoties pat četrus gadus pēc primārā perēkļa ekscīzijas. Kamēr vēža slimnieks saglabā šo normalizācijas fāzi imunitātē, no bioterapijas ir sagaidāms pozitīvs efekts.
Tipiskākie mikrometastāžu simptomi
- CD4+ šūnu skaita palielināšanās un to pārsvars pār CD8+ šūnām, kuru skaits ir normāls (CD4>CD8).
- CD38+ normālas attiecības ar CD8+ šūnu (CD8=CD38) un monocītiem (CD38>Mo).
- HLA-DR+ receptoru šūnu palielināts skaits, kas korelē ar CD8+ un B+NK šūnu kopu un ir vienādots ar monocītiem (Mo=HLA-DR+).
Slimniekiem ar mikrometastāzēm jāsaīsina kontroles intervāls un jāuzsāk bioterapija ar preparātiem, kas aktivē limfmezglus, aktivē CD8+ šūnas citotoksicitāti un saglabā HLA-DR+ receptoru šūnu mēreni paaugstinātu skaitu, t.i., uztur limfmezglu imūnprotektīvo aktivitāti.

3. attēls
Imūnsupresijas atspoguļojums perifērajās asinīs (skat. tekstā)
Limfmezglu mikrometastāžu periodā bioterapija ar Latvijā izstrādātiem dabas izcelsmes imūnmodulatoriem (Ritgv un Larifan) ir terapijas praksē pamatota, jo tie aktivē un normalizē sargmezgla funkcijas (aktivē primāro imunogenēzi - IgM sintēzi -, ja tā ir nomākta, rosina pārslēgšanos uz sekundāro imunogenēzi - IgG aktivāciju, - kuru savukārt aktivē Rigvir vakcīna; aktivē limfopoēzi, T sistēmas un tās subpopulāciju veidošanos un to regulēšanas sistēmas; aktivē CD8+ šūnu citotoksisko aktivitāti un normalizē monocītu/makrofagālo un mononukleāro šūnu kooperāciju; inducē interleikīnus - interferonus a, b, g -, neaktivē trombocītu ģenēzi). Abu preparātu efekts uz audzējšūnu virsmas struktūrām ir atšķirīgs, bet savstarpēji saskanīgs. Rigvir samazina melanomas šūnu MAGE grupas progresijas antigēnus, larifāns inducē diferencēšanās antigēnus - tirozināzi, tā kompleksi samazinot melanomas un citu jutīgo audzēju augšanas agresivitāti un ar izteikti fizioloģisku efektu normalizē onkopatoloģijas diskorelēto imunitāti.
Imūnsupresijas atšķirīgie veidi, to raksturojums kontekstā ar reaktīvo limfmezglu funkciju
Sākotnējās limfmezglu mazspējas izraisīta imūnsupresija
Supresiju izraisa sākotnējā limfmezglu mazspēja un primārā perēkļa agresīvas augšanas produkti konkrētā limfmezglā, kas nomāc imūnprotekcijas procesu veidošanos. Perifērajās asinīs imūnmazspēju raksturo pazemināts limfocītu, CD4+, CD8+ šūnu skaits, vienlaikus ar supresētām B šūnām, kas nespēj producēt plazmocītus, līdz ar to iestājas limfmezglu funkcionālā mazspēja. To raksturo IgM un IgG pazemināta sintēze, līmeņu diskorelācija un savstarpēja diskorelācija arī ar IgA līmeni asins serumā. Perifērajās asinīs monocītu skaits palielinās un izmainās imūnšūnu skaita normālais (CD8=CD38) līdzsvars - CD8 > vai
Īpatnēja ir monocītu un CD95+ apoptozes receptora šūnu skaita vienādošanās. Rodas iespaids, ka imūnsupresijā vienlaicīgi sadarbojas CD38+ šūnas ar monocītiem un HLA-DR+ receptoru šūnām, jo šīs šūnas savstarpēji korelē. Savdabīgs šūnu skaita vienādošanās fenomens vērojams arī AIDS pataloģijā: tas norāda, ka defektīvie monocīti supresē gan T, gan B sistēmu.
Hiperaktivētais imūnsupresijas veids, melanomai metastazējoties iekšējos orgānos ar limfoīdo audu un limfmezglu metastāžu totālu iesaisti
- Perifērās asinīs palielinātā skaitā limfocīti un visas T sistēmas imūnšūnas, visvairāk CD38+; monocītu skaits ir divkārt un pat trīskārt lielāks par normu. Ar abām šīm šūnām diskorelē pārējās apskatītās šūnas.
- Visvairāk serumā palielināts ir vai nu IgA, vai IgM līmenis.
- Ādas reakcijas ir hiperaktivētas.
- Hiperaktivētām CD38+ šūnām to antigēns ir uz visām B pirmšūnām, dabīgām galētājšūnām (NK) un uz CD8+ šūnām, kas liecina par CD38+ šūnu supresīvo efektu. CD38+ šūnas pārvērtības mehānisms, kad tā no T sistēmas aktivētājas šūnas kļūst par imūnsupresijas veicinātāju, nav izprasts.
- Problemātiski ir divi diskorelācijas indeksi, proti, CD3/HLA-DR¯ un CD38/HLA-DR¯¯, kuri nav tipiski ne limfmezgla metastāzei, ne reaktīviem limfmezgliem, bet sastopami primārā perēkļa vēlīnā periodā un iekšējos orgānos, melanomas procesam progresējot.
Nekādi imūnprotekcijas simptomi melanomas totālā progresijā nav konstatēti, tādēļ ar bioterapijas metodēm slimniekam palīdzēt nav iespējams. Šajos gadījumos jāpielieto visi zināmie dezintoksikācijas terapijas paņēmieni un audzēja augšanas supresori - nekortikoīdie pretiekaisuma preparāti (indometacīns, diklofenaks un aspirīns).
Zemādas metastāzes ar reaktīvo limfmezglu simptomiem
Lai gan zemādas metastāzes ir tipisks melanomas šūnu hematogēnās izsējas rezultāts, šajā klīniskajā periodā novēro vairākus imūnprotekcijas simptomus. Zemādas metastāzes noris ar limfocitozi, līdzīgi reaktīviem limfmezgliem, bet atšķiras no melanomas totālās progresijas imūnsimptomiem.
- Zemādas metastāzēs nenovēro CD38+ šūnu un monocītu skaita pārmērīgu palielināšanos perifērajās asinīs.
- Monocītu skaits ir līdzsvarots ar HLA-DR+ receptoru šūnu skaitu, kā tas ir primārā melanomā, un norāda uz zināmu imūnprotekciju limfmezglos.
- Nav limfocītu, T sistēmas un to subpopulāciju savstarpējas diskorelācijas. CD8+ šūnu skaits ir līdzsvarots ar CD38+ šūnu skaitu.
- Indekss B+NK/Mo¯¯¯, ko novēro totālas progresijas procesā un kas ir klasisks simptoms limfmezglu metastāzēs, zemādas metastāzēs ir normāls, liecinot par protektīvām imūnnorisēm. Tādēļ, ja zemādas metastāzes ir nelielā skaitā (mūsu pieredzē viena līdz piecas), nav vēl melanomas totālas progresijas situācija, ar bioterapijas metodēm, kas aktivizē limfmezglus, izdodas apturēt progresijas procesu uz ilgiem gadiem (>10 gadi), kā tas izdevās mūsu praksē ar Rigvir preparātu divu trīs gadu pielietojumā. Tāds pats efekts bija, kombinējot Rigvir ar larifānu, kad primārā perēkļa ekscīzija izdarīta I B, II A stadijā.
Tātad zemādas (subkutānās) metastāzēs saglabājas vēl korelēta aktivētā T sistēma, kas nediskorelē arī ar monocītiem un neliecina par metastāžu progresiju limfmezglā, drīzāk par limfmezglu funkcionālu defektu vai primārā perēkļa ieaugšanu retikulārajā slānī. Diskorelācijas indekss ar monocītiem (CD4/Mo) norāda uz CD4+ aktivāciju. Par limfmezglu imūnprotektīvo procesu iesaisti zemādas metastāzēs liecina B+NK kopas šūnu skaita palielināšanās, kas ir tipisks reaktīvo limfmezglu simptoms.
Ko var redzēt asinsainā?
- Kamēr leikocītu, limfocītu un monocītu attiecības ir normālas (Lei/Ly = 22‑34, Lei/Mo = 13-23, Ly/Mo = 4-8), turpinās imūnprocesi, kas tik nozīmīgi melanomas progresijas protekcijai. Imūnsupresiju raksturo imūnšūnu pamatpopulācijas diskorelācija: Lei/Ly, Lei/Mo¯, Ly/Mo¯, ko uzsāktā bioterapija var aizkavēt un pat novērst melanomas progresiju.
- Imūnprotekcija ir atkarīga no normālas korelētas leikopoēzes un pārējo imūnorgānu un citu organisma sistēmu sadarbības, kas, antigēna rosinātas, izraisa imūnšūnu reprodukciju, interleikīnu, to receptoru un citu nozīmīgu imūnfaktoru indukciju, visu šo šūnu un molekulu saskanīgu sadarbības kaskādi antigēna likvidēšanai. Limfoīdā sistēmā un limfmezglos sintezētie imūnglobulīni ir normālā līmenī, savstarpēji koordinēti.
Histologu un imunologu iegūtā informācija spēj atšķirt limfmezglos un limfoīdos audos notiekošos procesus, palīdz prognozēt melanomas un arī citu audzēju gaitu un izlemt bioterapijas taktiku.
1 (WHO Melanoma programm, 1988, 1991; French Cooperative Melanoma Study, 1995; Intergroup Melanoma Trial, USA, 1993)