Apzināts kontakts ar apkārtējo pasauli cilvēkam miega laikā zūd, miegs ir vitāli svarīgs organisma stāvoklis un nepieciešamība pēc tā ir nepārvarama. Apmēram trešdaļu dzīves cilvēks pavada miegā. Miega laikā samazinās visu CNS daļu aktivitāte, īpaši garozā, kas spilgti izpaužas galvas smadzeņu biopotenciālu pierakstā — elektroencefalogrammā.
Miega traucējumi ir gana aktuāla tēma, lai gan mūsu valstī līdz šim nav veikts pētnieciskais darbs, kur apkopotu datus par šo slimību kopu, jo pilns polisomnogrāfijas izmeklējums pagaidām nav iespējams, taču, lai nedaudz iezīmētu aktualitāti, sniegti ASV pēdējie ar miegu saistīto patoloģiju dati (1. tabula). Ar polisomnogrāfijas izmeklējuma palīdzību, ko veido elektroencefalogrāfija (EEG), elektookulogrāfija (EOG), elektromiogrāfija (EMG), kā arī elektrokardiogramma (EKG) un respiratorās funkcijas izvērtējums, skaidri var izdalīt un izvērtēt normālas miega fāzes un attiecīgi to veidotos miega ciklus.


1. tabula
Ar miegu saistīto patoloģiju statistiskie dati
Miega fāzes
Izdala divas miega fāzes — REM (rapid–eye–movement) un NREM (non–rapid–eye–movement) miegu, NREM miega fāze dalās trīs apakšstadijās (pēc vecās klasifikācijas — četrās). Miega fāzes nakts laikā seko viena otrai un veido miega ciklus, naktī aptuveni 5—7, cikla vidējais garums 90 minūtes, nakts laikā cikla intervāls pagarinās līdz 100—120 minūtēm, procentuāli — NREM 1—5 %, NREM 2—45 %, NREM 3—25 %, REM — 25 % (shematiska miega struktūra 2. attēlā; miega fāžu raksturojums 2. tabulā). Zīdaiņiem REM miega fāze var ilgt pat 85 % no viena pilna miega cikla: tas saistāms ar atmiņas konsolidācijas procesiem, lielas informācijas uzņemšanu un daudzu jaunu stimulu uztveri ikdienā. Miega fāžu attiecības izlīdzinās līdz 6—10 gadu vecumam. Vecākiem cilvēkiem pretēji — pieaug miega latences periods (iemigšana), saīsinās REM miega fāžu garums.
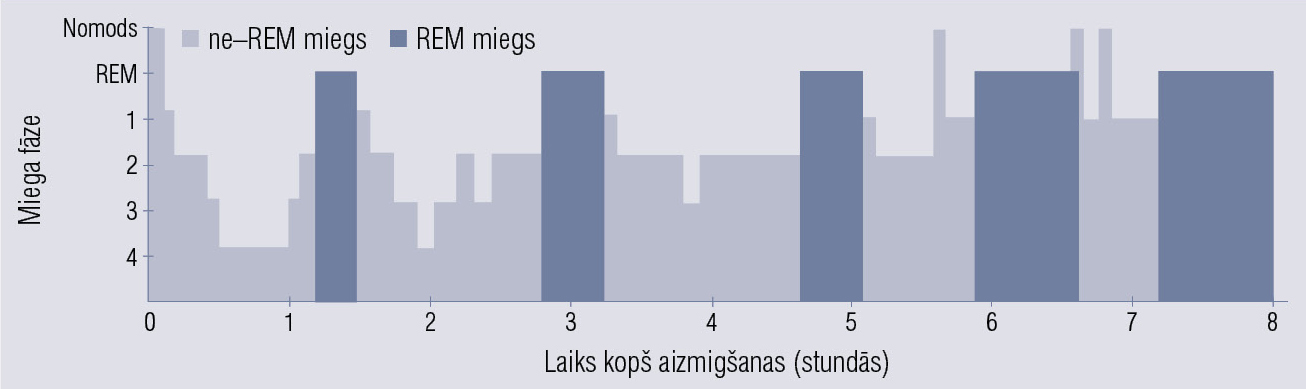

2. attēls
Miega fāzes nakts laikā
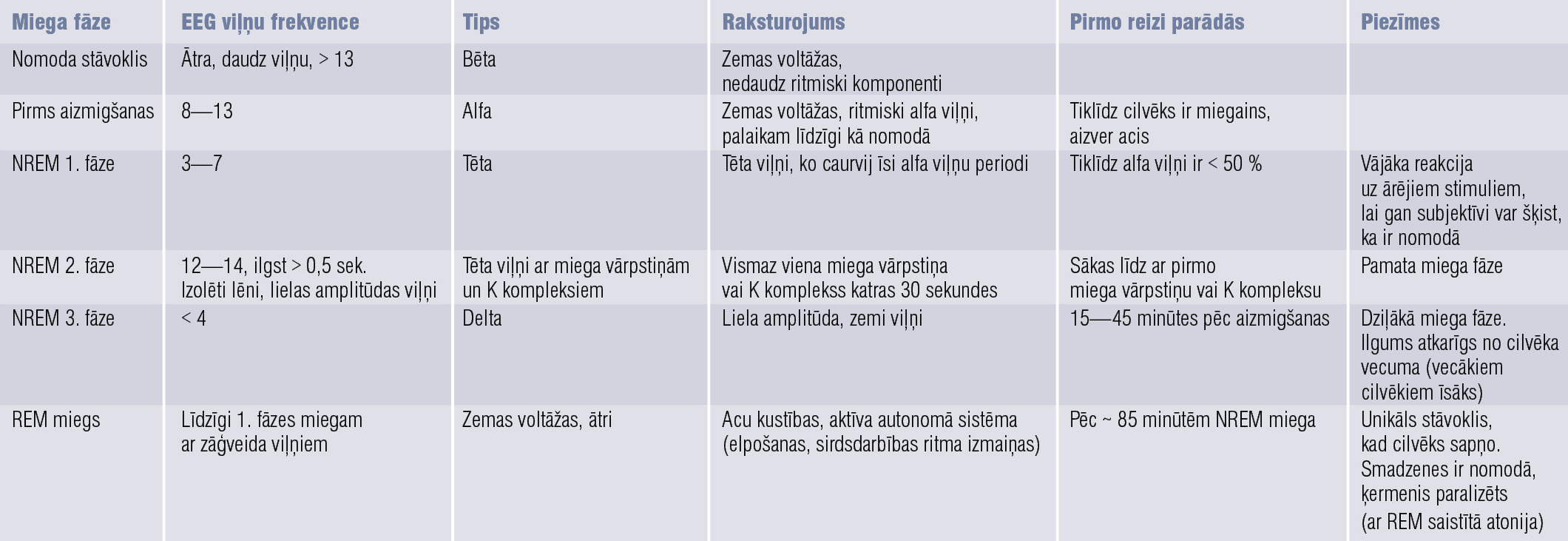

2. tabula
Miega fāžu raksturojums
NREM 1
Starpstāvoklis starp nomodu un miegu, kas ilgst 1—10 minūtes, virspusējs miegs, no kura īsā periodā viegli atmosties pilnībā. Šajā fāzē EEG var novērot elektrisko biopotenciālu tendenci uz sinhronizāciju, tas ir bēta un gamma ritms (frekvences 12—30 Hz un 25—100 Hz), kas ir vadošie ritmi nomodā, evolucionē uz vairāk sinhronizētu un lēnāku — alfa ritmu (8—13 Hz) un vēlāk tēta ritmu (4—7 Hz). NREM 1 laikā elpošanas intensitāte mazinās un kļūst regulāra, sirds ritms kļūst lēnāks, šajā miega fāzē sapņošana ir reta, bet mēdz attīstīties hipniskas noraustīšanās (hypnic jerks) jeb īsas atmošanās periodi (micro–awakenings), kas asociējas ar krišanas sajūtu. No miega kopējā ilguma šis starpstāvoklis veido aptuveni 5 %.
NREM 2
Arteriālais spiediens un sirds ritms,vispārējs atslābums,muskuļu tonuss turpina samazināties. Šajā miega fāzē EEG prevalē tēta ritms tāpat kā NREM 1, taču NREM 2 raksturīgi šādi EEG fenomeni: miega vārpstiņas (īsi 12—14 Hz smadzeņu aktivitātes periodi, kas ilgst ap sekundi) un K kompleksi — īsi negatīvi pīķi, kam seko lēnāki pozitīvi kompleksi, tad atkal negatīvs pīķis, katrs komplekss ilgst 1—2 minūtes (1. attēlā). Šie kompleksi aizsargā miegu un nomāc ārējos stimulus, potencē atmiņas konsolidēšanos un jaunās uzņemtās informācijas apstrādi. No miega kopējā ilguma šī fāze veido 45—50 %.
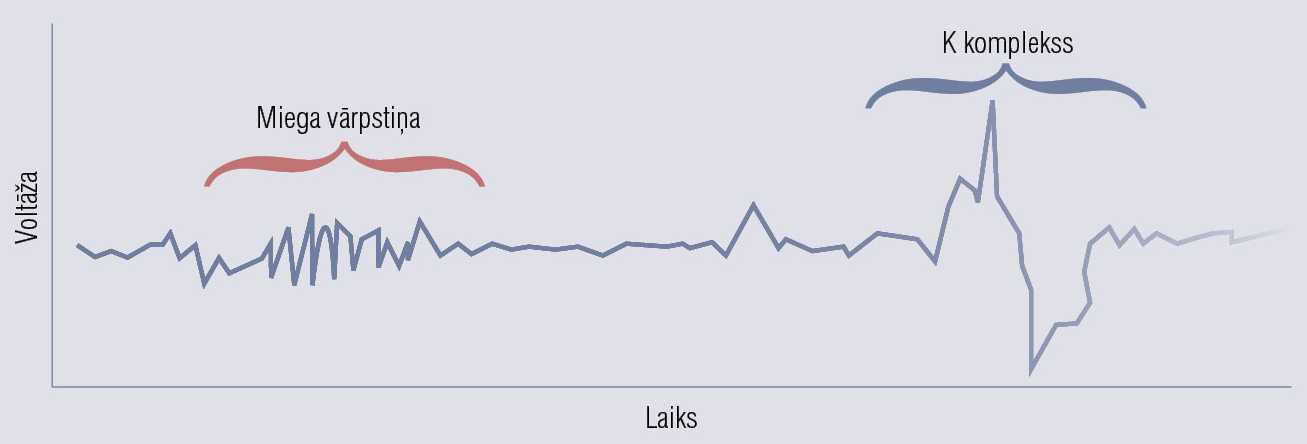

1. attēls
NREM raksturīgie EEG fenomeni
NREM 3
Sauc arī par dziļo, delta vai lēno viļņu miegu (SWS — slow–wave sleep), šī miega fāze pirmajos miega ciklos intervāla ziņā ir garāka nekā pēdējos, no miega kopējā ilguma tā veido 15—20 %. Raksturīgs delta ritms (0,5—4 Hz), šajā stadijā var būt miega vārpstiņas, bet mazākā skaitā nekā NREM 2. Šajā miega fāzē ir viszemākie vitālie rādītāji. No NREM 3 miega fāzes cilvēku atmodināt grūti, ja tas notiek, cilvēks var justies apdullis un normālu pašsajūtu atgūst pēc aptuveni 30 minūtēm. Šīs miega fāzes parasomnijas ir “nakts šausmas”(pavor nocturnus), somnambulisms, runāšana miegā, nakts enurēze. NREM 2, NREM 3 un REM miega fāzes nodrošina ar miegu saistītās atmiņas konsolidācijas procesus. Jauniem cilvēkiem šī fāze ir ievērojami garāka, salīdzinot ar senioriem, kam NREM 3 var pat iztrūkt.
REM
Miega fāze ilgst aptuveni 20—25 % no kopējā miega pieaugušajiem, katrs nākamais REM fāzes intervāls nedaudz pieaug, respektīvi, visgarākais tieši pirms pamošanās. Šajā miega fāzē EOG tiek reģistrētas acu kustības, ko skaidro ar vizuāla attēla uztveri sapņojot. EEG aktivitāti REM fāzes laikā var raksturot kā mazas amplitūdas, jauktas frekvences ritmu, līdzīgu nomoda stāvokļa raksturīgajam ritmam — tēta, alfa ritms, arī augstas frekvences bēta ritms, kas vairāk asociējas ar aktīvu koncentrēšanās procesu, sinonīms šai fāzei ir “paradoksālā miega fāze”. REM miega fāzē enerģijas patēriņš un nepieciešamība pēc skābekļa ir liela, pat lielāka nekā nomoda stāvoklī. Elpošana kļūst neregulārāka un ātrāka nekā NREM miega laikā, arteriālais spiediens un sirds ritma frekvence pieaug, šķērssvītrotā muskulatūra kļūst atoniska, locus coeruleus (tilta rajonā) ar neirotransmitera norepinefrīna palīdzību pilnīgi nomāc apzināto kustību CNS centrus. Visspilgtākie un izteiksmīgākie sapņi asociējami tieši ar REM miega fāzi, un šī muskulatūras atonija ir kā aizsargmehānisms, lai indivīds sapņojot nesavainotos.
REM miega fāze ir svarīga jaunas informācijas un atmiņas konsolidācijas procesiem, tāpēc zīdaiņiem un maziem bērniem šīs fāzes ir daudz garākas, jo notiek aktīvs mācīšanās process. Ja kāda iemesla dēļ miegs tiek traucēts (no 6—8 stundām guļ, piemēram, 3—4 stundas), pie “nākamās izdevības” notiek REM miega fāzes rebound efekts, kad NREM 1, NREM 2, NREM 3 fāzes cita citā pāriet ātrāk un REM fāzes procentuālā attiecība ir lielāka nekā normā. Ilg-stoša neizgulēšanās galu galā saistāma ar sākotnēji viegliem atmiņas un jaunas informācijas apstrādes traucējumiem. Ja pacientam ir REM miega fāzes traucējumi, jāseko līdzi arī lietotajām zālēm, jo dažas medikamentu grupas ietekmē REM miega fāzi (gan nomāc, gan potencē).
Parasomnijas
NREM parasomnijas
No visiem miega traucējumiem šīs miega fāzes parasomnijas ir visbiežākās un ir nozīmīgas diferenciāldiagnostikā ar epilepsiju. Parasti šīs parasomnijas sākotnēji izpaužas bērnībā; gadiem ejot, traucējumi pāriet. Zināms, ka 15—20 % cilvēku bērnībā bijusi vismaz viena somnambulisma epizode, tikai 1—4 % pieaugušo sastopamas NREM parasomnijas. NREM parasomnijas var iedalīt:
- pēkšņa atmošanās ar sekojošu apjukumu, var kombinēties ar motorisku vai autonomu komponentu — tahikardiju, diaforēzi;
- somnambulisms (mēnessērdzība) — saistāms ar motorisku aktivitāti miegā, tipiski staigāšana miegā vai tiek veiktas atkārtotas bezmērķīgas kustības, pārvietojot objektus, ģērbšanās, ēšana, dzeršana;
- pavor nocturnus (“nakts šausmas”) — dramatiski uzvedības traucējumi miegā ar skaļu monotonu kliegšanu, kas kombinējas ar autonomu komponentu — baiļu izteiksmi sejā, tahikardiju, diaforēzi.
Nepilnīgi pamostoties no NREM 3 miega fāzes, tiek sasniegts overlapping miega un nomoda statuss, patofizioloģiskais mehānisms tiek skaidrots šādi: pirmkārt, indivīdam jābūt ģenētiskai predispozīcijai šādiem notikumiem, otrkārt, tādi palaidējfaktori kā miega trūkums vai lietotie medikamenti, kas ietekmē miega fāžu attiecību sadali, piemēram, pretepilepsijas līdzekļi un sedatīvi, treškārt, fināla palaidējfaktors, piemēram, obstruktīvās miega apnojas sindroms (OMAS), kas potencē NREM miega traucējumu attīstības risku. NREM miega fāzes traucējumiem tendence izpausties nakts pirmajā daļā, pēc 1—1,5 h miega, kad iestājusies NREM 3 dziļā miega fāze (slow–wave sleep) (3. attēlā).
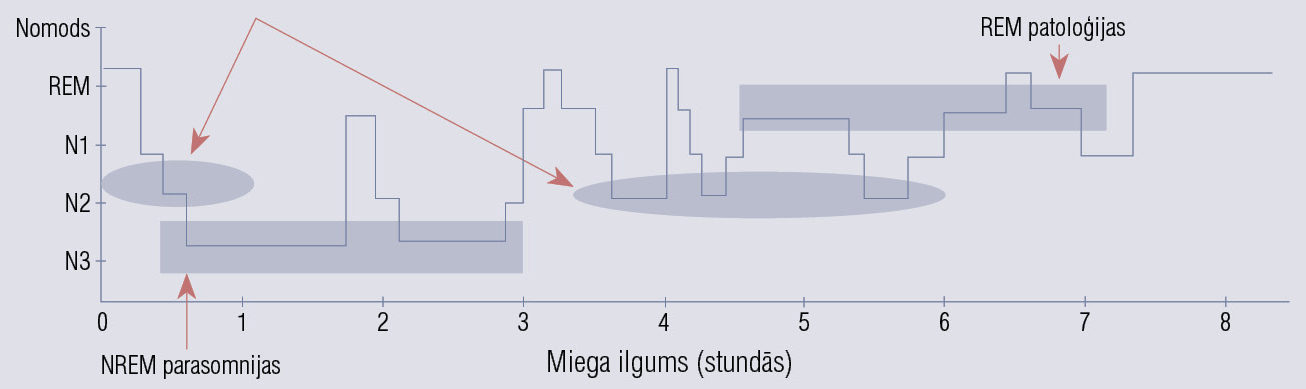

3. attēls
NREM un REM miega fāzes traucējumu izpausmes laiks
REM miega fāzes traucējumi
Šie traucējumi pārsvarā skar cilvēkus ap 50 gadu vecumu, prevalē vīriešu kārtas pārstāvjiem (80 %), saistīti ar neirodeģeneratīvām slimībām (α sinukleinopātijām, piemēram, Parkinsona slimību, multisistēmu atrofiju). REM miega traucējumu klīniskā aina skaidrojama ar šķērssvītrotās muskulatūras normālas atonijas redukciju, kas izpaužas ar ekstremitāšu motorisku aktivitāti miega un sapņošanas laikā (var izrādīties traumatiski ne tikai pacientam, bet arī viņa dzīvesbiedram). Klīniskās izpausmes vērojamas pārsvarā nakts otrajā pusē, kad REM miega fāzes intervāli pagarinās. Šie traucējumi mēdz izpausties ar vardarbīgu rīcību, kliegšanu, sišanu un ekspresīvu žestikulāciju, salīdzinot ar NREM miega traucējumiem, un nakts frontālās daivas epileptiskām lēkmēm. REM miega traucējumu gadījumā pacienti vertikalizēsies ļoti reti, bet var būt sūdzības par izkrišanu no gultas.
Overlap parasomnijas
Ir pacientu grupa, kuru klīniskā simptomātika pārklāj gan NREM, gan REM miega traucējumu raksturīgās izpausmes, arī šā tipa parasomnijas tiek asociētas ar neirodeģeneratīvām slimībām.
Obstruktīvas miega apnojas hipopnojas sindroms
Definīcija
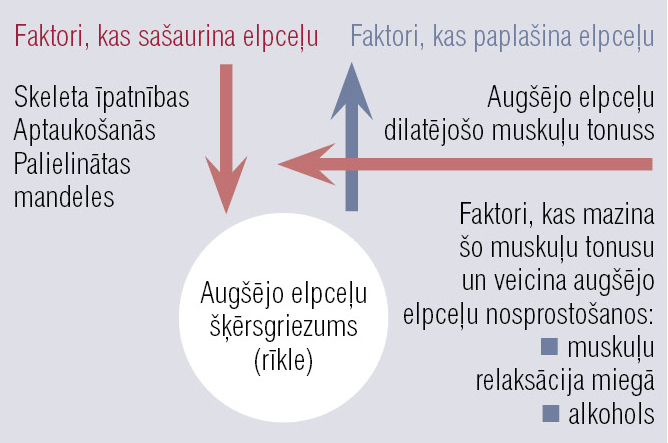
OMAS ir plaši izplatīta medicīniska un sociāla problēma. Miega apnoja (MA) ir elpošanas apstāšanās epizode miegā no grieķu vārda apnos — bez elpas. Tā ir samērā bieža parādība, neliels šo epizožu skaits nav uzskatāms par patoloģiju. Krākšana, kas ir šīs patoloģijas biežākais pavadošais simptoms, visbiežāk nerada veselības traucējumus, tomēr tā liecina par sašaurinātiem augšējiem elpceļiem (AE) miegā. Miegā pazeminoties muskulatūras tonusam un darbojoties citiem elpceļus sašaurinošiem faktoriem, AE sasniedz kritisku izmēru, gaisa plūsmas ātrums elpceļos palielinās un tās radītais negatīvais spiediens kļūst stiprāks par AE dilatējošo muskuļu spēku, kas rada elpceļu nosprostošanos (4. un 5. attēls). Apnojas epizodes miegā rada sašaurināti elpceļi un fizikāli spēki, kas tajos darbojas. Pasaulē miega apnojas radītajiem veselības traucējumiem uzmanība tika pievērsta pagājušā gadsimta 70. gados. Kopš tā laika šajā jomā veikti daudzi pētījumi un sakrāti pārliecinoši pierādījumi par MA iesaisti tādu izplatītu slimību patoģenēzē kā sirds—asinsvadu sistēmas slimības, vielmaiņas un kognitīvi traucējumi, kas ir vieni no galvenajiem kardiovaskulārā riska faktoriem. Tomēr elpošanas traucējumu nozīme šajos gadījumos joprojām bieži netiek novērtēta un novērsta. Pacienti par šiem elpošanas traucējumiem nereti pat nenojauš, jo tie var notikt tikai dziļās miega fāzēs, kad muskulatūras tonuss ir zems. Rezultātā par šīm problēmām ārstus visbiežāk neinformē.

4. attēls
Spēki, kas ietekmē augšējo elpceļu lūmenu
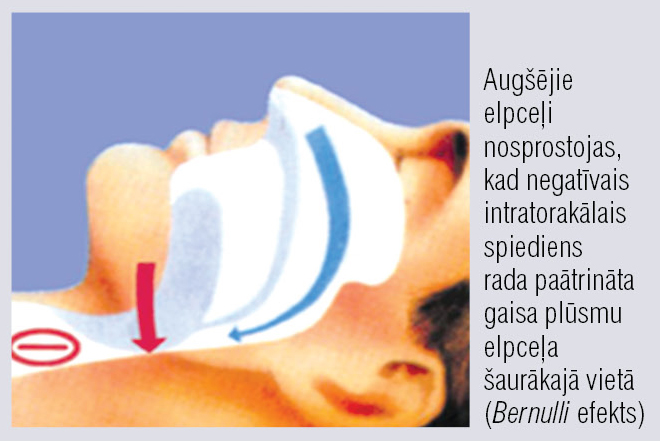

5. attēls
Augšējo elpceļu nosprostošanās mehānisms
OMAS patoģenēze
Miega apnojas cēloņi un OMAS patoģenēze atšķiras. Sākotnēji vērojamas atsevišķas apnojas epizodes, bet, ja to skaits nav liels, visbiežāk tam nav būtiskas klīniskas nozīmes. Par faktoriem, kas izraisa miega apnoju (bet ne miega apnojas sindromu), jāuzskata visi tie iemesli, kuru dēļ sašaurinās augšējie elpceļi. [1] Faktorus, kas sašaurina AE, var iedalīt trīs grupās:
- kraniofaciālā skeleta novirzes no normas jeb patoloģijas — retrognātiski (atpakaļ atvirzīti) žokļi vai kraniofaciālie sindromi (Pierre Robin, Creuozone sindroms), kam raksturīgas sejas un žokļu skeleta anomālijas, kas sašaurina AE. Nelielas sejas skeleta atkāpes no normas, piemēram, mazs apakšžoklis vai augšžoklis, ir samērā bieži novērojamas īpatnības, kas šos indivīdus predisponē miega apnojas attīstībai;
- AE mīksto audu morfoloģiskas izmaiņas, kas sašaurina elpceļus, patomorfoloģiskās izmaiņas audos, kas rodas ilgstošas krākšanas un audu traumatizācijas rezultātā. Tās izpaužas kā iekaisums, muskuļšķiedru atrofija, distrofija, inervācijas un cirkulācijas traucējumi audos [2; 3], veicinot audu tūsku, to funkciju traucējumu un elpceļu lūmena sašaurināšanos;
- kā biežākais AE sašaurināšanās iemesls minēta aptaukošanās, kam seko parafaringeāla tauku infiltrācija, kas visbiežāk vērojama cilvēkiem ar viscerālo aptaukošanās tipu. [4; 5]
OMAS kā sindroma attīstība parasti ir neārstētas miega apnojas sekas, un tā attīstība visbiežāk ir ilgstoša, mērāma daudzos gados.
OMAS galvenie patoģenētiskie faktori
Simpātiskās nervu sistēmas (SNS) aktivācija un kognitīvie traucējumi
Hipoksija apnojas laikā aktivē hemorefleksus un palielina SNS aktivitāti, tāpēc paaugstinās asinsspiediens, sirds izsviede, miokarda kontraktilitāte un perifēro asinsvadu pretestība. CO2 uzkrāšanās rada acidozi, kas arī veicina SNS aktivitātes palielināšanos. Šie ir galvenie kardiovaskulārā riska faktori, kas daudz pētīti pēdējos gados. [6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17] OMAS kardiovaskulāro komplikāciju patoģenēzes mehānismi parādīti 6. attēlā. Aizsargmehānisms, kas neļauj hipoksijai sasniegt dzīvībai bīstamu līmeni, ir mikropamošanās epizodes. Tās izraisa pieaugoša SNS aktivitāte. Parasti šīs epizodes ilgst 3—8 sekundes, pacients atgriežas seklākā miega fāzē, tonizējas elpceļu muskulatūra, pieaug ieelpas spēks, atjaunojas elpošana. Visbiežāk pacienti šīs epizodes neatceras. Pēc neilga laika, ieslīg-stot dziļākā miegā, cikls atkārtojas. Par smagu MA formu uzskata gadījumus, kad apnoju un hipopnoju (hiponopja — daļēja elpošanas apstāšanās ar desaturāciju) skaits vienā naktī pārsniedz 200 epizodes, bet ļoti smagos gadījumos šo epizožu skaits sasniedz 500—800 reizes naktī. Periodiskā SNS aktivācija ar sekojošu mikropamošanās epizodi deformē normālo miega struktūru; procesu kopumā sauc par miega fragmentāciju, kas ir iemesls patoloģiskai miegainībai. Ar gadiem šiem pacientiem SNS aktivitāte saglabājas palielināta arī dienā, turklāt ar arteriālu hipertensiju kā vienu no izpausmēm. Eiropas Neirologu asociāciju federācija (EFNS) vadlīnijās elpošanas traucējumus miegā minējusi kā biežus kognitīvo funkciju traucējumu un neirodeģeneratīvu izmaiņu cēloni, kas būtiski ietekmē pacientu dzīves kvalitāti, palielina morbiditāti un mortalitāti. [18] Šobrīd aktualizēts jautājums par OMAS kognitīvo traucējumu nopietnību. Sekojot ES direktīvai, Latvijā stājušies spēkā MK 940. noteikumi, kas paredz, ka smagu OMAS formu gadījumā tiks liegta iespēja iegūt vai atjaunot autovadīšanas tiesības. Ar šā gada 1. janvāri, izsniedzot veselības izziņu autovadītājam vai pretendentam, palielināta OMAS riska gadījumā jāveic miega izmeklējums, lai šo diagnozi apstiprinātu vai izslēgtu. MK noteikumi [19] paredz arī auto vadīšanas tiesību atjaunošanu gadījumos, kad pacients ārstējas un elpošanas traucējumi, kas rada miegainību, novērsti. [20] Šo lēmumu, kas jau labu laiku ir spēkā vairākumā ES valstu, ASV, Kanādā, Austrālijā u.c., pamato daudzi pētījumi un ekonomiski aprēķini par palielinātu satiksmes negadījumu risku autovadītājiem ar OMAS, kā arī cilvēciskie un ekonomiskie ieguvumi, ārstējot OMAS pacientus. [21] Katram autovadītājam kaut reizi gadījies braukt nogurušam vai miegainam, un visi, kas to pieredzējuši, zina, cik tas ir bīstami, cik maz nepieciešams, lai kļūdītos. Smagos OMAS gadījumos cilvēks atrodas šādā stāvoklī katru dienu, gadu no gada, vairs nezinot, ka var būt citādi, un uztver to kā ikdienišķu, “normālu” parādību. Domājams, ka neviens sabiedrības loceklis negribētu, lai viņu, viņa bērnus uz darbu vai skolu ved pusaizmidzis sabiedriskā transportlīdzekļa vadītājs, kas daudzus gadus naktī smok 400 reizes un vienmēr ir miegains un noguris. Tikpat labi tas var būt arī pretimbraucošā automobiļa vadītājs. Nav šaubu, ka sabiedrības interesēs ir šā lēmuma iespējami drīza īstenošana praksē.
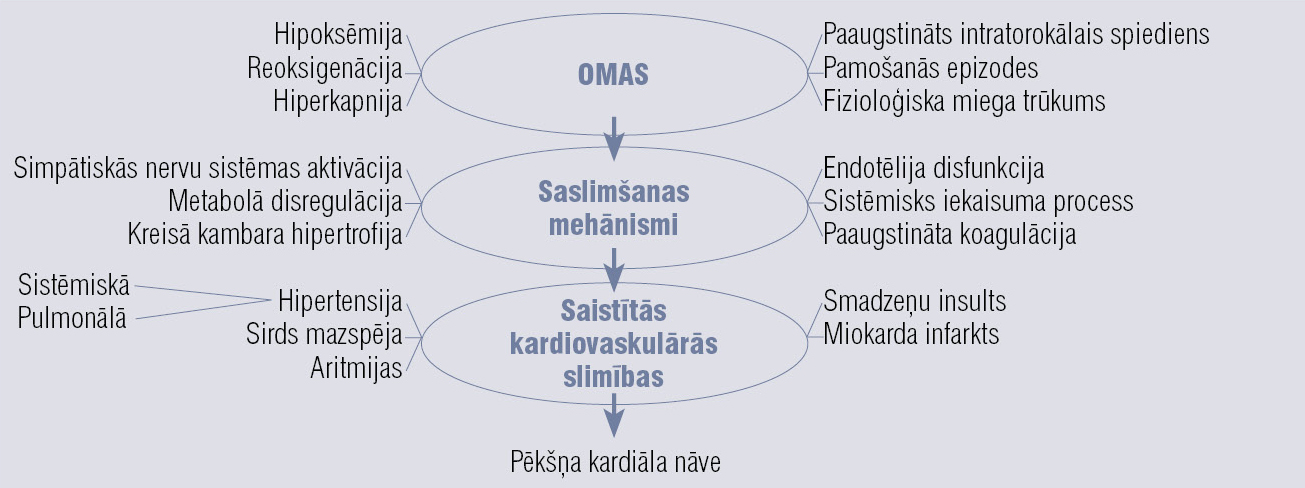

6. attēls
OMAS kardiovaskulāro komplikāciju patoģenēzes mehānismi
Iekaisums
OMA pacienti miega laikā piedzīvo atkārtotus hipoksijas, hiperkapnijas un tai sekojošus straujus reoksigenācijas ciklus. Šī intermitējošā hip-oksija uztur oksidatīvo stresu un veicina C reaktīvā olbaltuma, amiloīda A līmeņa serumā, citokīnu (TNFα, IL–6, IL–8) un citu brīvo radikāļu līmeņa paaugstināšanos. Novērojama arī iekaisuma šūnu (limfocītu un monocītu) aktivācija, kas konstatēta gan atsevišķos pētījumos, gan meta–analīzē, kas aptver 512 pētījumus. [22] Šie iekaisuma faktori atzīti par nopietniem kardiovaskulārā riska faktoriem. [23]
Endotēlija disfunkcija
Endotēlijs nav tikai mehāniska barjera, bet arī ļoti nozīmīgs asinsvadu tonusa regulators, tāpēc tieši endotēlija funkciju traucējumi ir pamatā vairākumam kardiovaskulāro slimību. Viens no endotēlija disfunkcijas veicinātājiem ir oksidatīvais stress, kas OMA slimniekiem ir palielināts. [24] Normālas endotēlija šūnas izdala slāpekļa oksīdu (NO), kas ir spēcīgs vazodilatators, taču OMA pacientiem NO daudzums ir samazināts, kas ir agrīna aterosklerozes pazīme. Būtisks šajā procesā ir oksidatīvais stress un paaugstināts iekaisuma marķieru līmenis. [25]
Metaboliskā disregulācija
Lai gan OMA var būt pacientam ar normālu ĶMI, pilnībā pierādīts, ka aptaukošanās un svara pārmaiņas ietekmē OMA smagumu. [26] Pētījumi liecina, ka OMA pacientiem ir paaugstināts leptīna un pazemināts grelīna līmenis asinīs. Šie hormoni regulē vielmaiņu, un šādas pārmaiņas veicina liekā svara palielināšanos. OMA slimniekiem raksturīga insulīna rezistence, taču tā ir neatkarīga no adipozitātes. Šie pacienti ir arī predisponēti 2. tipa cukura diabētam. Starptautiskā Diabēta federācija rekomendējusi [27], diagnosticējot vienu no šīm slimībām (OMAS vai 2. tipa diabēts), veikt izmeklējumus, lai noteiktu vai izslēgtu otras klātbūtni. [28; 29; 30; 31; 32; 33; 34; 35; 36]
Negatīvs intratorakālais spiediens apnojas laikā
Apnojas laikā pieaugošais negatīvais intratorakālais spiediens palielina venozo pieplūdi labajam priekškambarim un kambarim, palielinās pēcslodze, tas pārpildās ar asinīm, ar gadiem var attīstīties labo sirds daļu dilatācija. Tam seko sastrēgums mazajā asinsrites lokā un plaušu hipertensija. [38] Labā priekškambara dilatācija nakts miega laikā veicina priekškambaru nātrijurētiskā peptīda (ANP) sekrēcijas palielināšanos, kas klīniski izpaužas kā niktūrija.
Gastroezofageālā atviļņa slimība (GEAS)
Atviļņa iemesls ir apnojas laikā radītais negatīvais intratorakālais spiediens, kas veicina kuņģa satura nonākšanu barības vadā. Pacienti mēdz sūdzēties par skābām atraugām vai rūgtumu mutē. Raksturīgi, ka šīs epizodes OMAS gadījumā notiek nakts laikā.
Seksuāla disfunkcija
OMAS pacientiem konstatē arī seksuālo funkciju vājināšanos. Tas galvenokārt saistīts ne vien ar miegainības un noguruma izraisīto dzimumtieksmes vājināšanos, bet arī ar erektilās funkcijas pasliktināšanos REM miega fāzes traucējumu dēļ. [39]
OMAS izplatība
Spriežot pēc literatūras datiem, OMAS izplatība populācijā ir 3—7 % pieaugušiem vīriešiem un 2—5 % pieaugušām sievietēm. [40] 2003. gadā pētījumā par primāras aprūpes pacientiem, kam novēro kardiovaskulāras slimības vai vielmaiņas traucējumus, palielināts OMA risks konstatēts 38 % vīriešu un 28 % sieviešu. [41] Citās augstākas pakāpes riska grupās OMA izplatība ir šāda: pacientiem ar cukura diabētu — 36 % [42], ar rezistentu arteriālu hipertensiju — 63 % [43], pirmreizēju insultu — 44—72 %, hipotireozi — 45 %, alkoholismu — 17 %, akromegāliju < 80 %. Lēš, ka vidēja vecuma ķirurģisko pacientu grupā sindroma izplatība var būt pat 10 %. Ār-stiem zināms, ka pacientiem ar aptaukošanos bieži attīstās hipertensija un citas sirds—asinsvadu sistēmas slimības, 2. tipa cukura diabēts. Viņi nereti ir miegaini, sūdzas par nogurumu, depresiju, naktī krāc, tomēr līdz samērā nesenai pagātnei nebija noskaidrota elpošanas traucējumu nozīme šajos gadījumos. Ja pavērojam pacientus dažādās veselības aprūpes iestādēs, tad samērā liela daļa atbilst palielināta OMAS riska grupai. Klīniski iespējams noteikt vienīgi miega apnojas riska pakāpi no nelielas līdz aug-stai. Diagnozes apstiprināšanai nepieciešams miega izmeklējums. Vieglāk OMAS klīnisko diagnozi noteikt gadījumos, kad sindroms ir attīstījies un vērojamas visas raksturīgās blakusslimības, fiziskie un klīniskie riska faktori. Visbiežāk tie ir vīrieši vai sievietes menopauzē ar palielinātu ķermeņa masas indeksu (ĶMI), viscerālu aptaukošanos, resnu kaklu, sliktu elpceļu vizualizāciju (Mallampati III un IV klases, palielinātas rīkles mandeles). No anamnēzes par palielinātu OMAS risku liecinās arteriāla hipertensija, prediabēts — glikozes intolerance (visbiežāk) vai 2. tipa cukura diabēts, dati par elpošanas traucējumiem miegā (skaļa krākšana, pauzes elpošanā), niktūrija, gastroezofageāls reflukss naktī, depresija, personības izmaiņas.
OMAS palielināta riska noteikšanai rekomendētas vairākas anketas un aptaujas, no kurām par vērtīgākajām uzskata Berlīnes aptaujas lapu un STOP—Bang testu (7. attēlā), kura jutīguma līmenis ir 88—95 % pacientiem ar smagu OMAS. [44]


7. attēls
STOP—Bang tests miega apnojas palielināta riska noteikšanai
Citi miega traucējumi
- Ritmisko kustību traucējumi (jactatio capitis nocturna), kas izpaužas ar stereotipiskām, atkārtotām kustībām galvā un kaklā iemiegot, NREM 1 fāzes laikā, sastopami zīdaiņiem un bērniem, līdz aptuveni piecu gadu vecumam klīniskā simptomātika mazinās, neraksturīgi pieaugušajiem, asociējas ar autismu un kognitīvās funkcijas traucējumiem. Diferenciāldiagnostika ar epileptiskiem paroksismiem.
- Periodiski ekstremitāšu kustību traucējumi — NREM miega laikā atkārtotas, intermitējošas, stereotipiskas kustības kājās (tipiski — pēdas pirmā pirksta ekstensija, pēdas dorsofleksija), nereti kombinējas ar augšējo ekstremitāšu kustībām, šīs epizodes atkārtojas paredzamos intervālos (5—90 s) vai pat no minūtēm līdz stundām.
- Labdabīgs iemigšanas mioklonuss (sleep start/hypnic jerks) — sastopams bieži, asociējas ar halucinogēnu krišanas sajūtu iemiegot, var būt izteikts un sērijveidā, kas potencē sleep—onset insomniju.
Noslēgumā
Miega traucējumi ir gana plašs traucējumu spektrs ar nozīmīgu diferenciāldiagnostiku, arī ar epileptiskiem paroksismiem, tāpēc pilns polisomnogrāfijas izmeklējums Latvijā ar laiku būtu jāievieš, lai arī pie mums varētu diagnosticēt miega traucējumus un iespējami uzlabot pacientu dzīves kvalitāti. Pagaidām pacientiem ir svarīgi ieteikt pareizu miega higiēnu (3. tabulā).


3. tabula
Ieteikumi par miega higiēnu