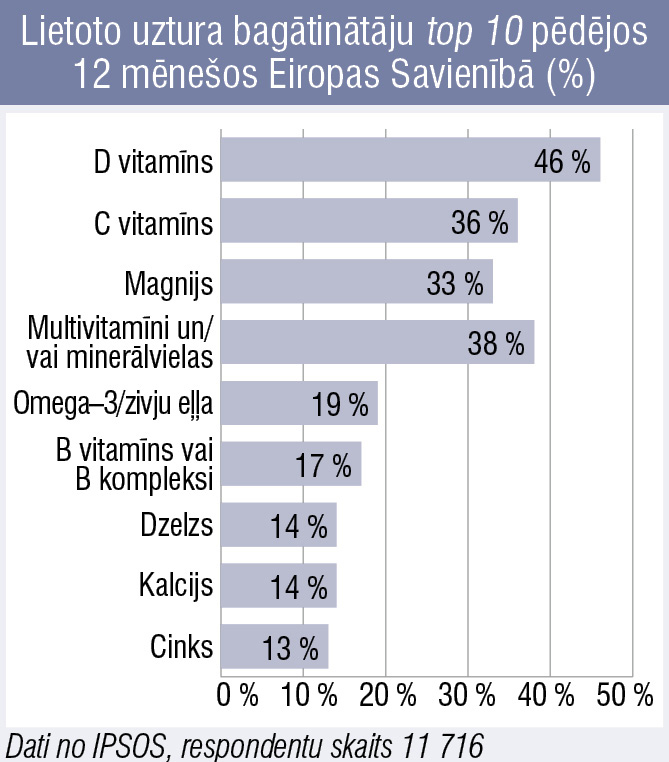
Minerālvielas uztura bagātinātājos. Ko der zināt?

Magnijs

Magnijs (Mg) iesaistīts vairāk nekā 300 enzīmu reakcijās, kas regulē dzīvībai svarīgas funkcijas, piemēram, olbaltumvielu sintēzi, nervu un muskuļu darbību, cukura līmeni asinīs un asinsspiedienu. [66] Ap 60 % no mūsu ķermeņa Mg atrodas kaulos, 39 % muskuļos un 1 % mīkstajos audos, asinīs un citos šķidrumos. [58]
Mg deficīts izpaužas kā apetītes zudums, slikta dūša, smagākos gadījumos kā krampji un sirdsdarbības traucējumi. Trūkumu var izraisīt hroniskas slimības, pārmērīga alkohola lietošana, kuņģa—zarnu trakta problēmas u.c. slimības. [9; 35]
Mūsdienu cilvēka uzturs nodrošina tikai ~ 50 % no ieteicamās Mg dienas devas.
Tievā zarna ir galvenā Mg uzsūkšanās vieta, mazāka loma ir resnajai zarnai. [58] Tā kā Mg no uzņemtā daudzuma uzsūcas 30—40 % apmērā, jāpievērš uzmanība biopieejamībai, kas atkarīga no Mg sāļiem. Neorganiskie preparāti (piemēram, Mg oksīds, sulfāts un Mg hlorīds) ir mazāk biopieejami nekā organiskie (piemēram, Mg citrāts, Mg laktāts, Mg aspartāts un Mg glicināts), absorbcija atkarīga no devas. [21] Piemēram, Mg oksīda (60,5 % elementārā Mg) absorbcija ir par 4 % mazāka. [126] Mg aspartāts, citrāts, laktāts un hlorīds nodrošina labāku biopieejamību nekā Mg oksīds vai sulfāts. [117]
Salīdzinot ar Mg taurātu (8,9 % elementārā magnija) un Mg glicinātu (14,1 %), kur abos ir maz elementārā Mg, biopieejamāks ir Mg glicināts (biglicināts). Tā uzsūkšanās spēja ir 14,1 %. Ieteicams pacientiem, kam ir Mg deficīts, uzlabo miegu, relaksē, uzlabo atmiņu un piedalās vielmaiņas traucējumu ārstēšanā. [124] Tikmēr pētījumi liecina, ka Mg taurāts uzlabo Mg profilu šūnās, kas ir būtiski kaulu veidošanās procesā, kā arī orgānu un muskuļu darbībā. [127]
Mg malāts un Mg acetiltaurāts ir galvenie biopieejamības ziņā, bet, piemēram, Mg oksīdam un Mg citrātam ir viszemākā biopieejamība salīdzinājumā ar kontroles grupu. [100] Pētījumi liecina, ka zarnās labāk uzsūcas šķidrās Mg formas. [118]
Ieguvumi veselībai
Asinsspiediens
Mg hlorīds, aspartāts, Mg pidolāts u.c. dienas devā (DD) 365—450 mg, lietojot 1—6 mēnešus, ievērojami pazemina asinsspiedienu indivīdiem ar insulīnrezistenci, prediabētu vai citām hroniskām ne–infekcijas slimībām. [24]
Miega kvalitāte
Novērots, ka, lietojot DD 320—729 mg Mg oksīda un citrāta, saīsinās iemigšanas laiks un paildzinās kopējais laiks miega stāvoklī. [57; 111]
Sirds slimību riska samazināšana
Uzturu papildinot ar Mg UB (vismaz 370 mg iekšķīgi lietojama Mg oksīda DD), sistoliskais un diastoliskais spiediens ievērojami pazeminās. [12]
Glikozes līmenis asinīs
Konstatēts, ka, trīs mēnešus tukšā dūšā dzerot 300 mg Mg sulfāta DD, ievērojami uzlabojas glikozes līmenis. [92] Novērota cieša saikne starp Mg uzņemšanu un samazinātu risku 2. tipa cukura diabēta un insulta attīstībai. [102]
Migrēnas atvieglošana
Migrēnas pacientiem nereti ir zems Mg līmenis. [35] Pētījumi rāda, ka 500 mg Mg oksīda DD līdzīgi nātrija valproātam ir efektīvs migrēnas profilaksē. [46]
Dati no sistemātiska pārskata apstiprina, ka migrēnas ārstēšanai nepieciešama DD 600 mg Mg. [103] Grūtniecēm Mg samazina hospitalizācijas risku, mazina migrēnas intensitāti un biežumu. [102]
Citi efekti
Mg ir būtisks taukskābju metabolisma līdzfaktors, kas ietekmē hormonālo veselību. [31] Secināts, ka menopauzes laikā var ciest no hipomagnēmijas, tāpēc var attīstīties vairogdziedzera un citi hormonālie traucējumi. [50] Desmit nedēļas lietojot vienu 30 mg Zn glikonāta kapsulu dienā, vienu 250 mg Mg oksīda tableti dienā un vienu 25 000 SV A vitamīna kapsulu 2 × nedēļā, iespējama labvēlīga iedarbība pacientiem ar hipotireozi un slimībām, kas saistītas ar hipertireozi. [74]
Noguruma un nespēka mazināšanai deva 8 mg uz kg svara dienā jālieto septiņas nedēļas. [96]
Pacientēm (18—40 gadu vecumā) ar PCOS, kuras astoņas nedēļas lietoja Mg kopā ar melatonīnu, novērota būtiska hirsūtisma mazināšanās. [63]
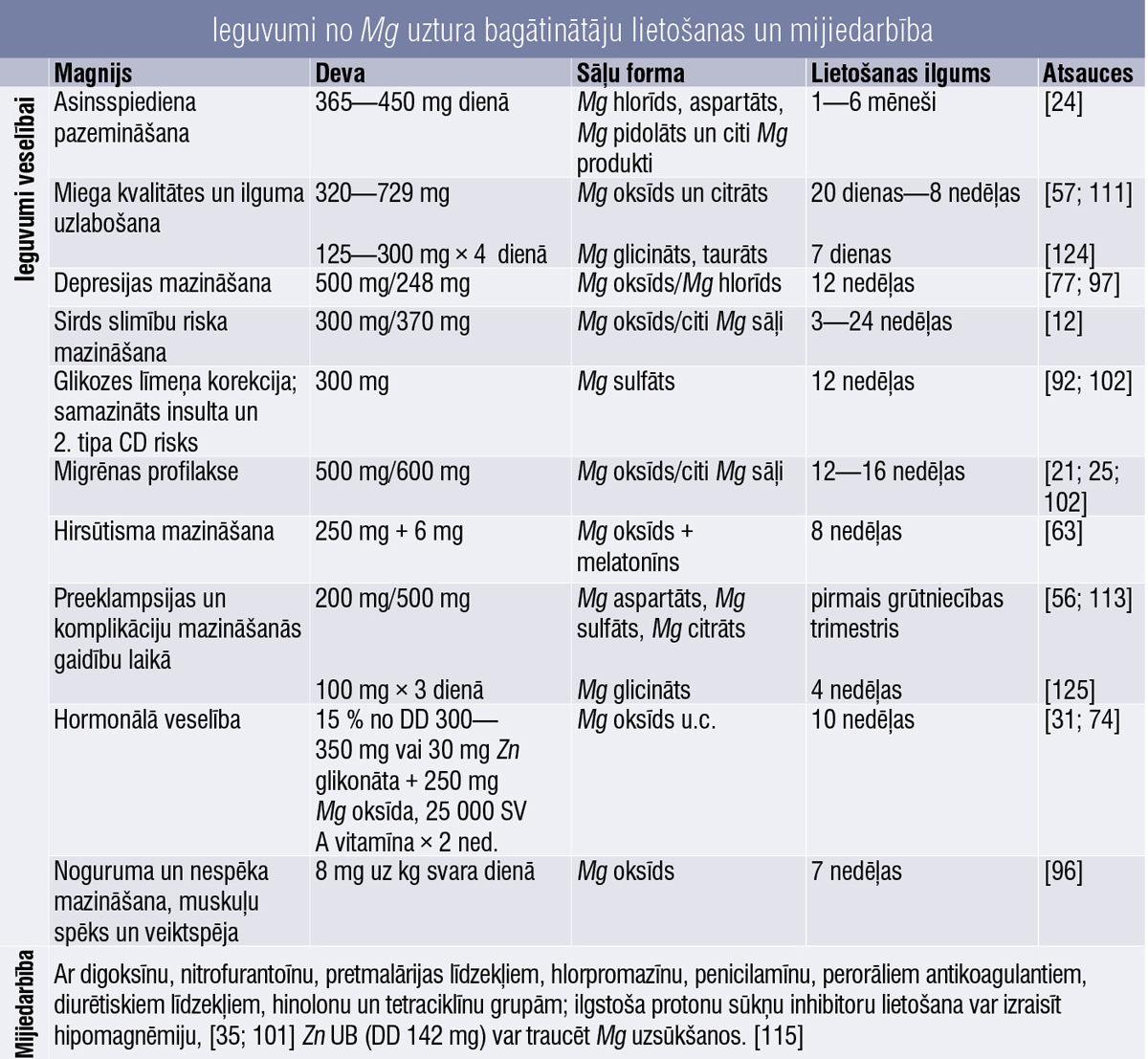

Perorāla Mg oksīda 500 mg DD lietošana pirms 25. grūtniecības nedēļas saistīta ar mazāku priekšlaicīgu dzemdību biežumu. Mg pazemina kalcija līmeni dzemdes muskuļos, veicinot muskuļu relaksāciju un vazodilatāciju, [56; 113] un mazina nevēlamu grūtniecības iznākumu, [113] tikmēr dati no citiem pētījumiem ir pretrunīgi. [23]
Magnija deficīts var izraisīt kālija deficītu vai pasliktināt pašreizējo stāvokli, izraisot vienlaicīgu abu elektrolītu samazināšanos, — attīstās sekundārs K deficīts. Jāatzīmē, ka K līmeņa pazemināšanās neizraisa Mg līmeņa pazemināšanos. [120]
Pierādīts, ka Mg un K kombinācija var pazemināt asinsspiedienu. Cilvēkiem ar traucētu glikozes panesību lielāka Mg un K uzņemšana ar uzturu saistīta ar samazinātu ķermeņa tauku daudzumu, [21] novērš hronisku vielmaiņas komplikāciju attīstību, [122] var uzlabot kardiovaskulāro drošumu pacientiem ar hipertensiju. [123] Ieguvumi apkopoti 1. tabulā.
Lietošanas rekomendācijas
Ieteikumi par devu variē: DD 200—1000 mg ēdienreizes laikā vai tūlīt pēc ēšanas, uzdzerot glāzi ūdens. Pieaugušajiem noteiktā adekvātā deva (AD) Eiropas Savienībā ir 350 mg dienā vīriešiem un 300 mg dienā sievietēm. Grūtniecēm un zīdītājām ir tāda pati AD kā pārējām sievietēm, nav jālieto palielināta deva. [28]
Dažiem pacientiem (īpaši ar pavājinātu nieru darbību) var izpausties tādas blakusparādības kā caureja, depresija. Nieru mazspējas gadījumā iespējama intoksikācija ar Mg. [89] Blakusparādības kuņģa—zarnu traktā biežāk var izraisīt Mg oksīds (neorganiskais sāls) vājās uzsūkšanās dēļ. [65]
Cinks
Cinks (Zn) ir otrais visvairāk sastopamais mikroelements cilvēka organismā ar būtisku nozīmi imūnsistēmai, tas atbalsta šūnu dalīšanos, regulē glikozes līmeni asinīs, nepieciešams brūču dzīšanai, garšai, smaržai, redzei. [75]
Zn trūkums rada tādus simptomus kā augšanas problēmas, apetītes zudums, imūnsistēmas traucējumi, matu izkrišana un trausli nagi, balti plankumi uz nagiem. Lielākam Zn deficīta riskam pakļauti zīdaiņi, gados vecāki pieaugušie un grūtnieces. Zn daudzumu organismā ietekmē dažādu faktoru kombinācija:
- uztura faktori: Zn deficītu var veicināt nepietiekams gaļas patēriņš, pārmērīgā daudzumā lietoti fitāti (atrodami pākšaugos, sēklās, sojas produktos, veselos graudos), oksalāti (atrodami tādos pārtikas produktos kā spināti, okra, rieksti, tēja), stingras veģetāras diētas un tādi apstākļi kā anorexia nervosa; [73; 90]
- iegūto Zn deficītu var izraisīt hroniskas slimības, piemēram, kuņģa—zarnu trakta slimības, diabēts, aknu slimības, sirpjveida šūnu anēmija, nieru slimības, pārmērīgs alkohola patēriņš un HIV infekcija; [90]
- absorbcijas traucējumi var rasties, ja Zn tiek uzņemts kopā ar tādām vielām kā fitāti, kalcijs (Ca) un fosfāts. [88] Nepietiekamas uzsūkšanās cēloņi ir tādi stāvokļi kā Krona slimība, kairinātu zarnu sindroms, āķtārpu invāzija un aizkuņģa dziedzera mazspēja; [73; 90]
- pārmērīgu Zn zudumu rada tādi apstākļi kā apdegumi, hemodialīze, hemolīze, caureja, alkohola lietošana un medikamenti. [84]
Cinks tiek absorbēts tievajā zarnā, bet galvenā Zn uzsūkšanās vieta cilvēkiem joprojām ir pretrunīga. Veseliem indivīdiem galvenās absorbcijas vietas ir gan divpadsmitpirkstu zarnā (duodenum), gan tukšajā zarnā (jejunum). [54]
Cinka sulfāts ir vislētākā forma, tomēr ar mazāku biopieejamību un var izraisīt kuņģa darbības traucējumus. Labāka biopieejamība ir Zn pikolinātam, Zn citrātam, Zn acetātam, glicerātam un monometionīnam, kas ir arī labāk panesami. [67]
Ieguvumi veselībai
Noguruma mazināšanās
Pierādīts, ka ≥ 60 gadus veciem pacientiem, kuri 30 minūtes pēc pusdienām lieto 30 mg cinka DD, septiņu dienu laikā ievērojami mazinās nogurums. [3]
Glikozes līmenis
Zn izšķirīgi pārvalda glikozes līmeni asinīs, uzlabojot jutību pret insulīnu un mazinot insulīnrezistenci, tāpēc potenciāls ieguvums pacientiem ar tādu stāvokli kā 2. tipa cukura diabēts (CD). [22; 33; 94]
Pētījumā novēroja insulīnrezistences un glikozes līmeņa serumā pazemināšanos, vienlaikus uzlabojot β šūnu darbību. Palēnināta slimības progresēšana līdz CD, kā arī tika novērota UB labvēlīgā ietekme uz kopējo un ZBL holesterīnu. [79]
Imūnās funkcijas uzlabošana
Zn acetāta lietošana saīsina saaukstēšanās simptomus par 40 %, Zn glikonāta — par 28 %. Zn 80—92 mg DD saaukstēšanās ilgumu mazina par 33 %, bet 192—207 mg DD par 35 %. [37; 39]
Sirds veselība
Zn UB lietošana saistīta ar zemāku holesterīna līmeni, pazeminātu triglicerīdu līmeni asinīs un iespējamu sistoliskā asinsspiediena pazemināšanos. Būtisku uzlabojumu uzrāda šādas formas: Zn sulfāts (DD 20 mg, 22 mg, 160 mg, 600 mg, 660 mg), Zn glikonāts (DD 50 mg, 75 mg). [79; 116]
Aknes ārstēšana
Pētījumā, kur 12 nedēļas 2 × dienā lietoja 200 mg Zn sulfāta DD, secināts, ka Zn ir laba alternatīva limeciklīna (tetraciklīna) lietošanai vieglas vai vidēji smagas papulopustulāru izsitumu acne vulgaris ārstēšanā. [11; 98]
Psihiskā veselība
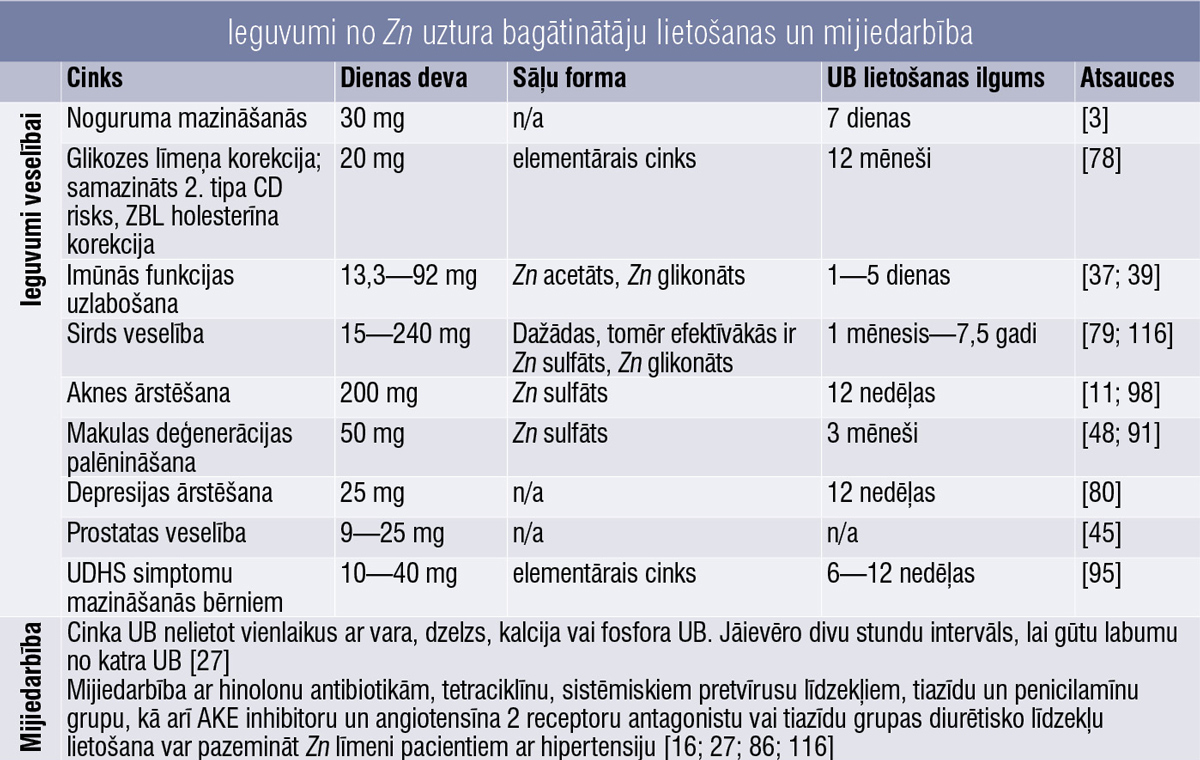

Pētījumā, kas ilga 12 nedēļas, līdztekus antidepresantiem (SSAI) lietojot 25 mg Zn dienā, pacientiem ar smagu depresiju pētījumā uzlabojumi novēroti jau ap sesto nedēļu. [80]
Meta–analīzē konstatēts, ka Zn UB var labvēlīgi ietekmēt UDHS simptomu mazināšanos bērniem. Zn UB dienas deva 10—40 mg, lietošanas ilgums 6—12 nedēļas. [95] Ieguvumi apkopoti 2. tabulā.
Drošuma profils
Pieaugušajiem, lietojot ilgstoši un pārsniedzot pieļaujamo augšējo uzņemšanas līmeni 40 mg/dienā, novērots vara un dzelzs deficīts. [72] Blakusparādības izpaužas kā caureja, urīna aizture, slikta dūša, muskuļu vājums, vemšana, letarģija, zems asinsspiediens, elpošanas un sirdsdarbības traucējumi.
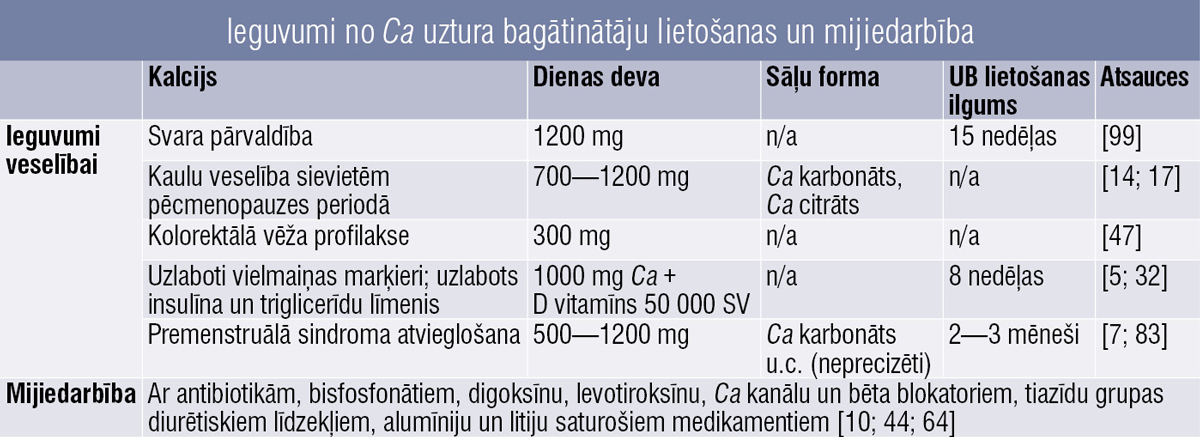
Kalcijs
Kalcija (Ca) deficīts uzturā ir globāla problēma, jo skar apmēram pusi pasaules iedzīvotāju. [93] Ca būtisks daudziem fizioloģiskiem procesiem cilvēka organismā. Tam ir izšķirīga nozīme kaulu struktūrā, nervu impulsu pārvadē, hormonu regulēšanā, muskuļu un asinsvadu darbībā. [19] Nepietiekamu Ca daudzumu organisms kompensē, iegūstot Ca no kauliem un zobiem, tādējādi tos novājinot.
Ca uzsūkšanās no KZT ietver divus ceļus: starpšūnu un paracelulāru. Transcelulārais ceļš darbojas pret koncentrācijas gradientu un ir galvenais Ca uzsūkšanās mehānisms zarnu sākotnējās daļās. Paracelulārais transports novērots, ja zarnās ir pietiekams Ca daudzums. [105]
Ca pieejams dažādās formās, piemēram, karbonāts, citrāts, acetāts, fosfāts, laktāts, glikonāts. Helātu Ca un Ca lizinātam ir labāka biopieejamība nekā citiem Ca sāļiem. [87]
Ca piedevas var būt noderīgas, ja:
- uzturā nepietiek kalcija,
- sasniegta menopauze,
- vegāna diēta,
- diēta ar augstu olbaltumvielu vai nātrija saturu,
- veselības apstākļi, kas traucē Ca uzsūkšanos, piemēram, Krona slimība,
- veikta bariatriska operācija,
- ilgstoša kortikosteroīdu lietošana,
- osteoporoze.
Ieguvums veselībai
Svara pārvaldība
Nepietiekama kalcija uzņemšana saistīta ar augstu ķermeņa masas indeksu (ĶMI) un ķermeņa tauku procentuālo daudzumu. [59; 60; 108] Jāteic, ka dati tomēr ir pretrunīgi.
Kaulu veselība
Sievietēm pēcmenopauzes periodā var novērot kaulu masas zudumu. [17]
Vadlīnijās rekomendētā Ca uzņemšanas deva pēc menopauzes iestāšanās ir 700—1200 mg dienā.
Tomēr dažos pētījumos apgalvots, ka kaulu zudums pēcmenopauzes periodā nav saistīts ar Ca uzņemšanu ar uzturu, kas neietekmē pēcmenopauzes osteoporozes sastopamību un saslimstību ar to. [85]
Uzlaboti vielmaiņas marķieri
Ca UB kombinācijā ar D vitamīnu var uzlabot vielmaiņas marķierus. Grūtniecēm novērota asinsspiediena normalizēšanās un samazināti iekaisuma marķieri. [6]
Sievietēm ar lieko svaru un ar PCOS mazinājās iekaisums, uzlabojās insulīna un triglicerīdu līmenis. [32]
Premenstruālā sindroma (PMS) atvieglošana
Pētījumi liecina, ka PMS simptomus var mazināt Ca un Mg uzņemšana. [7; 83] Ieguvumi apkopoti 3. tabulā.

Iespējamie riski
- Ca uzņemšana virs 1200—2000 mg dienā var palielināt risku nierakmeņu attīstībai. [20]
- Saikne starp Ca uzņemšanu un prostatas vēža risku joprojām ir pretrunīga. Daži pētījumi liecina par lielāku risku, lietojot piena produktus, bet ne ar Ca UB [8; 13] un vice versa. [76]
- Pārmērīgs Ca piedevu patēriņš, īpaši kombinācijā ar D vitamīnu var izraisīt hiperkalcēmiju, kas izpaužas kā sāpes vēderā, slikta dūša, aizkaitināmība un depresija. [55] Vairogdziedzera slimības un dehidratācija var saasināt hiperkalcēmiju. [2; 18]
Devas
Eiropas Pārtikas nekaitīguma iestāde (EFSA) pieaugušajiem no 25 gadu vecuma rekomendē DD 750—950 mg. [26; 38] DD sievietēm pēc 50 gadu vecuma un vīriešiem pēc 70 gadu vecuma 1200 mg. Papildus jāiesaka D vitamīns 800—1000 SV dienā.
Optimālai biopieejamībai Ca deva nedrīkst pārsniegt 500 mg vienā devā neatkarīgi no Ca formas, tāpēc gadījumā, ja ir jāuzņem vairāk, deva jāsadala. Ca karbonāts ir lētāks, tomēr var izraisīt aizcietējumus un vēdera pūšanos. [14; 68]
Ca UB var ietekmēt dzelzs (Fe) uzsūkšanos (dati pretrunīgi), tāpēc Ca lieto ēdienreizes laikā, bet Fe preparātus 1 h pirms vai 2 h pēc ēšanas. [1; 52; 82; 119]
Noslēgumā
Minerālvielu rekomendēšana jāpielāgo pacienta individuālajām vajadzībām pēc labākajiem zinātniskajiem pierādījumiem, ņemot vērā pacienta vecumu, dzīvesveidu, izrakstītos medikamentus. Diemžēl trūkst vadlīniju vai rokasgrāmatu, lai speciālists, vadoties pēc sāļu veida un adekvātām devām, spētu īsā laikā pieņemt lēmumu.
Pētījumos ne vienmēr minēti minerālvielu veidi, dažkārt norādīts tikai “magnijs”, “cinks”, “kalcijs”, tāpēc ne visos gadījumos iespējams izvērtēt vai paredzēt produktu efektivitāti.
Literatūra
- Abioye AI, Okuneye TA, Odesanya AO, et al. (2021). Calcium Intake and Iron Status in Human Studies: A Systematic Review and Dose-Response Meta-Analysis of Randomized Trials and Crossover Studies. The Journal of nutrition, 151(5), 1084–1101. doi.org/10.1093/jn/nxaa437
- Acharya R, Winters DM, Rowe C, et al. (2021). An unusual case of severe hypercalcemia: as dehydrated as a bone. Journal of community hospital internal medicine perspectives, 11(1), 135–138. doi.org/10.1080/20009666.2020.1851859
- Afzali A, Goli S, Moravveji A, et al. (2021). The effect of zinc supplementation on fatigue among elderly community dwellers: A parallel clinical trial. Health science reports, 4(2), e301. doi.org/10.1002/hsr2.301
- Anderson JJ, Kruszka B, Delaney JA, et al. (2016). Calcium Intake From Diet and Supplements and the Risk of Coronary Artery Calcification and its Progression Among Older Adults: 10-Year Follow-up of the Multi-Ethnic Study of Atherosclerosis (MESA). Journal of the American Heart Association, 5(10), e003815. doi.org/10.1161/JAHA.116.003815
- Asemi Z, Foroozanfard F, Hashemi T, et al. (2015). Calcium plus vitamin D supplementation affects glucose metabolism and lipid concentrations in overweight and obese vitamin D deficient women with polycystic ovary syndrome. Clinical nutrition (Edinburgh, Scotland), 34(4), 586–592. doi.org/10.1016/j.clnu.2014.09.015
- Asemi Z, Samimi M, Siavashani MA, et al. (2016). Calcium-Vitamin D Co-supplementation Affects Metabolic Profiles, but not Pregnancy Outcomes, in Healthy Pregnant Women. International journal of preventive medicine, 7, 49. doi.org/10.4103/2008-7802.177895
- Arab A, Rafie N, et al. (2020). Beneficial Role of Calcium in Premenstrual Syndrome: A Systematic Review of Current Literature. International journal of preventive medicine, 11, 156. doi.org/10.4103/ijpvm.IJPVM_243_19
- Aune D, Navarro Rosenblatt DA, Chan DS, et al. (2015). Dairy products, calcium, and prostate cancer risk: a systematic review and meta-analysis of cohort studies. The American journal of clinical nutrition, 101(1), 87–117. doi.org/10.3945/ajcn.113.067157
- Ayuk J, Gittoes NJ. (2011). How should hypomagnesaemia be investigated and treated?. Clinical endocrinology, 75(6), 743–746. doi.org/10.1111/j.1365-2265.2011.04092.x
- Aznar-Lou I, Carbonell-Duacastella C, Rodriguez A, et al. (2019). Prevalence of Medication-Dietary Supplement Combined Use and Associated Factors. Nutrients, 11(10), 2466. doi.org/10.3390/nu11102466
- Bae YS, Hill ND, Bibi Y, et al. (2010). Innovative uses for zinc in dermatology. Dermatologic clinics, 28(3), 587–597. doi.org/10.1016/j.det.2010.03.006
- Banjanin N, Belojevic G. Changes of Blood Pressure and Hemodynamic Parameters after Oral Magnesium Supplementation in Patients with Essential Hypertension—An Intervention Study. Nutrients. 2018; 10(5):581. doi.org/10.3390/nu10050581
- Baron JA, Beach M, Wallace K, et al. (2005). Risk of prostate cancer in a randomized clinical trial of calcium supplementation. Cancer epidemiology, biomarkers & prevention: a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology, 14(3), 586–589. doi.org/10.1158/1055-9965.EPI-04-0319
- Bauer DC. (2013). Calcium Supplements and Fracture Prevention. New England Journal of Medicine, 369(16), 1537–1543. doi:10.1056/nejmcp1210380
- Barrie SA, Wright JV, Pizzorno JE, et al. (1987). Comparative absorption of zinc picolinate, zinc citrate and zinc gluconate in humans. Agents and actions, 21(1-2), 223–228. doi.org/10.1007/BF01974946
- Braun LA, Rosenfeldt F. (2013). Pharmaco-nutrient interactions - a systematic review of zinc and antihypertensive therapy. International journal of clinical practice, 67(8), 717–725. doi.org/10.1111/ijcp.12040
- Cano A, Chedraui P, Goulis DG, et al. (2018). Calcium in the prevention of postmenopausal osteoporosis: EMAS clinical guide. Maturitas, 107, 7–12. doi.org/10.1016/j.maturitas.2017.10.004
- Chen K, Xie Y, et al. (2017). Hyperthyroidism-associated hypercalcemic crisis: A case report and review of the literature. Medicine, 96(4), e6017. doi.org/10.1097/MD.0000000000006017
- Chen Y, Strasser S, Cao Y, et al. (2015). Calcium intake and hypertension among obese adults in United States: associations and implications explored. Journal of human hypertension, 29(9), 541–547. doi.org/10.1038/jhh.2014.126
- Cosman F, de Beur SJ, et al, & National Osteoporosis Foundation (2014). Clinician's Guide to Prevention and Treatment of Osteoporosis. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA, 25(10), 2359–2381. doi.org/10.1007/s00198-014-2794-2
- Coudray C, et al (2005). Magnesium Bioavailability from Mineral Water: A Study in Adult Men. The American Journal of Clinical Nutrition.
- Cruz KJ, Morais JB, de Oliveira AR, et al. (2017). The Effect of Zinc Supplementation on Insulin Resistance in Obese Subjects: a Systematic Review. Biological trace element research, 176(2), 239–243. doi.org/10.1007/s12011-016-0835-8
- de Araújo CAL, Ray JG, Figueiroa JN, et al. BRAzil magnesium (BRAMAG) trial: a double-masked randomized clinical trial of oral magnesium supplementation in pregnancy. BMC Pregnancy Childbirth 20, 234 (2020). doi.org/10.1186/s12884-020-02935-7
- Dibaba DT, Xun P, Song Y, et al. (2017). The effect of magnesium supplementation on blood pressure in individuals with insulin resistance, prediabetes, or noncommunicable chronic diseases: a meta-analysis of randomized controlled trials. The American journal of clinical nutrition, 106(3), 921–929. doi.org/10.3945/ajcn.117.155291
- Dietary Supplement Label Database, dsld.od.nih.gov/browse-ingredients/by_keyword/zinc/0/100
- EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 2015. Scientific Opinion on Dietary Reference Values for calcium. EFSA Journal 2015; 13(5):4101. doi.org/10.2903/j.efsa.2015.4101
- EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 2014. Scientific Opinion on Dietary Reference Values for zInc. EFSA Journal 2014; 12(10):3844, 76 pp. doi:10.2903/j.efsa.2014.3844
- EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 2015. Scientific Opinion on Dietary Reference Values for magnesium. EFSA Journal 2015; 13(7):4186, 63 pp. doi:10.2903/j.efsa.2015.4186.
- EFSA Panel on Dietetic Products, skatīts 14.10.2023 www.efsa.europa.eu/sites/default/files/consultation/140514%2C0.pdf
- Ervin RB, Kennedy-Stephenson J. (2002). Mineral Intakes of Elderly Adult Supplement and Non-Supplement Users in the Third National Health and Nutrition Examination Survey. The Journal of Nutrition, 132(11), 3422–3427. doi:10.1093/jn/132.11.3422
- EU Register on nutrition and health claims, 2013, skatīts 30.10.2023 ec.europa.eu/food/food-feed-portal/backend/claims/files/euregister.pdf
- Foroozanfard F, Jamilian M, Bahmani F, et al. (2015). Calcium plus vitamin D supplementation influences biomarkers of inflammation and oxidative stress in overweight and vitamin D-deficient women with polycystic ovary syndrome: a randomized double-blind placebo-controlled clinical trial. Clinical endocrinology, 83(6), 888–894. doi.org/10.1111/cen.12840
- Fukunaka A, Fujitani Y. Role of Zinc Homeostasis in the Pathogenesis of Diabetes and Obesity. International Journal of Molecular Sciences. 2018; 19(2):476. doi.org/10.3390/ijms19020476
- Garg MK, Mahalle N. (2019). Calcium Supplementation: Why, Which, and How?. Indian journal of endocrinology and metabolism, 23(4), 387–390. doi.org/10.4103/2230-8210.268505
- Gröber U, et al (2015). Magnesium in prevention and therapy. Nutrients.
- Hashemian M, Poustchi H, et al. (2015). Systematic review of zinc biochemical indicators and risk of coronary heart disease. ARYA atherosclerosis, 11(6), 357–365.
- Hemilä H. (2017). Zinc lozenges and the common cold: a meta-analysis comparing zinc acetate and zinc gluconate, and the role of zinc dosage. JRSM open, 8(5), 2054270417694291. doi.org/10.1177/2054270417694291
- efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2015.4101
- Hunter J, Arentz S, Goldenberg J, et al. (2021). Zinc for the prevention or treatment of acute viral respiratory tract infections in adults: a rapid systematic review and meta-analysis of randomised controlled trials. BMJ open, 11(11), e047474. doi.org/10.1136/bmjopen-2020-047474
- Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium; Ross AC, Taylor CL, Yaktine AL, et al, editors. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US); 2011. 6, Tolerable Upper Intake Levels: Calcium and Vitamin D. Available from: www.ncbi.nlm.nih.gov/books/NBK56058/
- IPSOS, Nutrition in a pill: Europeans’ attitudes towards food supplements, skatīts 04.10.2023, www.ipsos.com/en/nutrition-pill-europeans-attitudes-towards-food-supplements
- Jamshidi F, Kelishadi R. (2015). A systematic review on the effects of maternal calcium supplementation on offspring's blood pressure. Journal of research in medical sciences : the official journal of Isfahan University of Medical Sciences, 20(10), 994–999. doi.org/10.4103/1735-1995.172794
- Jarosz M, Olbert M, Wyszogrodzka G, et al. Antioxidant and anti-inflammatory effects of zinc. Zinc-dependent NF-κB signaling. Inflammopharmacol 25, 11–24 (2017). doi.org/10.1007/s10787-017-0309-4
- Jones BJ, Twomey PJ. (2009). Requesting patterns for serum calcium concentration in patients on long-term lithium therapy. International journal of clinical practice, 63(1), 170–172. doi.org/10.1111/j.1742-1241.2008.01918.x
- Karunasinghe N. (2022). Zinc in Prostate Health and Disease: A Mini Review. Biomedicines, 10(12), 3206. doi.org/10.3390/biomedicines10123206
- Karimi N, et al (2021). The effectiveness of magnesium oxide supplementation on preventing migraine: A systematic review and meta-analysis. Pain Physician.
- Keum, N, Aune, D, Greenwood, D. C, et al. (2014). Calcium intake and colorectal cancer risk: dose-response meta-analysis of prospective observational studies. International journal of cancer, 135(8), 1940–1948. doi.org/10.1002/ijc.28840
- Khoo HE, Ng HS, et al. (2019). Nutrients for Prevention of Macular Degeneration and Eye-Related Diseases. Antioxidants (Basel, Switzerland), 8(4), 85. doi.org/10.3390/antiox8040085
- Kim KJ, Kim MS, Hong N, et al. (2022). Cardiovascular risks associated with calcium supplementation in patients with osteoporosis: a nationwide cohort study. European heart journal. Cardiovascular pharmacotherapy, 8(6), 568–577. doi.org/10.1093/ehjcvp/pvab054
- Kolanu BR, Vadakedath S, et al. (2020). Activities of Serum Magnesium and Thyroid Hormones in Pre-, Peri-, and Post-menopausal Women. Cureus, 12(1), e6554. doi.org/10.7759/cureus.6554
- Liu C, Kuang X, et al. (2020). Effects of combined calcium and vitamin D supplementation on osteoporosis in postmenopausal women: a systematic review and meta-analysis of randomized controlled trials. Food & function, 11(12), 10817–10827. doi.org/10.1039/d0fo00787k
- Lönnerdal B. (2010). Calcium and iron absorption--mechanisms and public health relevance. International journal for vitamin and nutrition research. Internationale Zeitschrift fur Vitamin- und Ernahrungsforschung. Journal international de vitaminologie et de nutrition, 80(4-5), 293–299. doi.org/10.1024/0300-9831/a000036
- Lopez-Caleya JF, Ortega-Valín L, Fernández-Villa T, et al. (2022). The role of calcium and vitamin D dietary intake on risk of colorectal cancer: systematic review and meta-analysis of case-control studies. Cancer causes & control: CCC, 33(2), 167–182. doi.org/10.1007/s10552-021-01512-3
- Maares M, Haase H. (2020). A Guide to Human Zinc Absorption: General Overview and Recent Advances of In Vitro Intestinal Models. Nutrients, 12(3), 762. doi.org/10.3390/nu12030762
- Machado MC, Bruce-Mensah A, et al A. (2015). Hypercalcemia Associated with Calcium Supplement Use: Prevalence and Characteristics in Hospitalized Patients. Journal of clinical medicine, 4(3), 414–424. doi.org/10.3390/jcm4030414
- Makrides M, Crowther CA. (2001). Magnesium supplementation in pregnancy. The Cochrane database of systematic reviews, (4), CD000937. doi.org/10.1002/14651858.CD000937
- Mah J, Pitre T. (2021). A review of magnesium supplements for improved sleep, stress, and depression. Journal of Complementary and Integrative Medicine.
- Maier JA, et al. (2020). Magnesium: Novel Applications in Cardiovascular Disease - A Review of the Literature. Annals of Nutrition and Metabolism.
- Marabujo T, Ramos E, Lopes C. (2018). Dairy products and total calcium intake at 13 years of age and its association with obesity at 21 years of age. European journal of clinical nutrition, 72(4), 541–547. doi.org/10.1038/s41430-017-0082-x
- Marotte C, Bryk G, Gonzales Chaves MM, et al. (2014). Low dietary calcium and obesity: a comparative study in genetically obese and normal rats during early growth. European journal of nutrition, 53(3), 769–778. doi.org/10.1007/s00394-013-0581-z
- Maxfield L, Shukla S, Crane JS. Zinc Deficiency. [Updated 2023 Jun 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-. Available from: www.ncbi.nlm.nih.gov/books/NBK493231/
- Mousavi SM, Mofrad MD, do Nascimento IJB, et al. (2020). The effect of zinc supplementation on blood pressure: a systematic review and dose-response meta-analysis of randomized-controlled trials. European journal of nutrition, 59(5), 1815–1827. doi.org/10.1007/s00394-020-02204-5
- Mousavi R, Alizadeh M, Asghari Jafarabadi M, et al. (2022). Effects of Melatonin and/or Magnesium Supplementation on Biomarkers of Inflammation and Oxidative Stress in Women with Polycystic Ovary Syndrome: a Randomized, Double-Blind, Placebo-Controlled Trial. Biological trace element research, 200(3), 1010–1019. doi.org/10.1007/s12011-021-02725-y
- Morini E, Catalano A, Lasco A, et al. (2019). L-thyroxine malabsorption due to calcium carbonate impairs blood pressure, total cholesterolemia, and fasting glycemia. Endocrine, 64(2), 284–292. doi.org/10.1007/s12020-018-1798-7
- Morishita D, Tomita T, Mori S, et al. Senna versus magnesium oxide for the treatment of chronic constipation: a randomized, placebo-controlled trial. Am J Gastroenterol, 2021; 116(1): 152-161.doi: 10.14309/ajg.0000000000000942.
- National Institutes of Health. (2016). Office of Dietary Supplements - Magnesium. National Institutes of Health, skatīts 08.10.2023 ods.od.nih.gov/factsheets/Magnesium-HealthProfessional/
- Ośko J, Pierlejewska W, Grembecka M. (2023). Comparison of the Potential Relative Bioaccessibility of Zinc Supplements-In Vitro Studies. Nutrients, 15(12), 2813. doi.org/10.3390/nu15122813
- Office of Dietary Supplements - Calcium. (n.d.). Ods.od.nih.gov. , skatīts 26.10.2023, ods.od.nih.gov/factsheets/Calcium-HealthProfessional/
- Ovary Syndrome: a Randomized, Double-Blind, Placebo-Controlled Trial. Biological Trace Element Research. 2022 Mar;200(3):1010-1019. DOI: 10.1007/s12011-021-02725-y. PMID: 34009514.
- Myung SK, Kim HB, Lee YJ, et al. (2021). Calcium Supplements and Risk of Cardiovascular Disease: A Meta-Analysis of Clinical Trials. Nutrients, 13(2), 368. doi.org/10.3390/nu13020368
- Office of Dietary Supplements - magnesium. ods.od.nih.gov/factsheets/Magnesium-HealthProfessional/
- Plum LM, Rink L, Haase H. The Essential Toxin: Impact of Zinc on Human Health. International Journal of Environmental Research and Public Health. 2010; 7(4):1342-1365. doi.org/10.3390/ijerph7041342
- Prasad AS. (2009). Impact of the discovery of human zinc deficiency on health. Journal of the American College of Nutrition, 28(3), 257–265. doi.org/10.1080/07315724.2009.10719780
- Rabbani E, Golgiri F, Janani L, et al. Randomized Study of the Effects of Zinc, Vitamin A, and Magnesium Co-supplementation on Thyroid Function, Oxidative Stress, and hs-CRP in Patients with Hypothyroidism. Biol Trace Elem Res 199, 4074–4083 (2021). doi.org/10.1007/s12011-020-02548-3
- Rabinovich D, Smadi Y. Zinc. [Updated 2023 May 1]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-. www.ncbi.nlm.nih.gov/books/NBK547698/
- Rahmati S, Azami M, Delpisheh A, et al. (2018). Total Calcium (Dietary and Supplementary) Intake and Prostate Cancer: a Systematic Review and Meta-Analysis. Asian Pacific journal of cancer prevention: APJCP, 19(6), 1449–1456. doi.org/10.22034/APJCP.2018.19.6.1449
- Rajizadeh A, et al. (2017). The effect of magnesium supplementation on primary insomnia in elderly: A double-blind placebo-controlled clinical trial. Journal of Research in Medical Sciences.
- Ranasinghe P, Wathurapatha WS, Galappatthy P, et al. (2018). Zinc supplementation in prediabetes: A randomized double-blind placebo-controlled clinical trial. Journal of Diabetes, 10(5), 386–397. doi:10.1111/1753-0407.12621
- Ranasinghe P, Wathurapatha WS, Ishara MH, et al. (2015). Effects of Zinc supplementation on serum lipids: a systematic review and meta-analysis. Nutrition & metabolism, 12, 26. doi.org/10.1186/s12986-015-0023-4
- Ranjbar E, Kasaei MS, Mohammad-Shirazi M, et al. (2013). Effects of zinc supplementation in patients with major depression: a randomized clinical trial. Iranian journal of psychiatry, 8(2), 73–79.
- Reid IR, Bristow SM. (2020). Calcium and Bone. Handbook of experimental pharmacology, 262, 259–280. doi.org/10.1007/164_2019_324
- Ríos-Castillo I, Olivares M, Brito A, et al. (2014). One-month of calcium supplementation does not affect iron bioavailability: a randomized controlled trial. Nutrition (Burbank, Los Angeles County, Calif.), 30(1), 44–48. doi.org/10.1016/j.nut.2013.06.007
- Saeedian Kia A, Amani R, Cheraghian B. (2015). The Association between the Risk of Premenstrual Syndrome and Vitamin D, Calcium, and Magnesium Status among University Students: A Case Control Study. Health promotion perspectives, 5(3), 225–230. doi.org/10.15171/hpp.2015.027
- Santos CA, Fonseca J, Lopes MT, et al. (2017). Serum zinc evolution in dysphagic patients that underwent endoscopic gastrostomy for long term enteral feeding. Asia Pacific journal of clinical nutrition, 26(2), 227–233. doi.org/10.6133/apjcn.022016.03
- Sarah M Bristow, Anne M Horne, et al. Dietary Calcium Intake and Bone Loss Over 6 Years in Osteopenic Postmenopausal Women, The Journal of Clinical Endocrinology & Metabolism, 2019; 104(8): 3576–3584, doi.org/10.1210/jc.2019-00111
- Schlegel P, Windisch W. (2006). Bioavailability of zinc glycinate in comparison with zinc sulphate in the presence of dietary phytate in an animal model with 65Zn labelled rats. Journal of Animal Physiology and Animal Nutrition, 90(5-6), 216–222. doi:10.1111/j.1439-0396.2005.00583.x
- Shankar KMS, Raizada P, Jain R. (2018). A Randomized Open-Label Clinical Study Comparing the Efficacy, Safety, and Bioavailability of Calcium Lysinate with Calcium Carbonate and Calcium Citrate Malate in Osteopenia Patients. Journal of orthopaedic case reports, 8(4), 15–19. doi.org/10.13107/jocr.2250-0685.1138
- Shkembi B, Huppertz T. (2021). Influence of Dairy Products on Bioavailability of Zinc from Other Food Products: A Review of Complementarity at a Meal Level. Nutrients, 13(12), 4253. doi.org/10.3390/nu13124253
- Schwalfenberg GK, Genuis SJ. (2017). The Importance of Magnesium in Clinical Healthcare. Scientifica, 2017, 4179326. doi.org/10.1155/2017/4179326
- Silvia Bel-Serrat, Anna-Louise Stammers, et al, the EURRECA Network, Factors that affect zinc bioavailability and losses in adult and elderly populations. Nutrition Reviews, 2014; 72(5): 334–352, doi.org/10.1111/nure.12105
- Smailhodzic D, van Asten F, Blom AM, et al. (2014). Zinc supplementation inhibits complement activation in age-related macular degeneration. PloS one, 9(11), e112682. doi.org/10.1371/journal.pone.0112682
- Solati M. (2014). Oral magnesium supplementation in type II diabetic patients. Diabetologia Croatica.
- Song L. (2017). Calcium and Bone Metabolism Indices. Advances in clinical chemistry, 82, 1–46. doi.org/10.1016/bs.acc.2017.06.005
- Tamura Y. (2021). The Role of Zinc Homeostasis in the Prevention of Diabetes Mellitus and Cardiovascular Diseases. Journal of atherosclerosis and thrombosis, 28(11), 1109–1122. doi.org/10.5551/jat.RV17057
- Talebi S, Miraghajani M, et al. (2022). The effect of zinc supplementation in children with attention deficit hyperactivity disorder: A systematic review and dose-response meta‑analysis of randomized clinical trials. Critical reviews in food science and nutrition, 62(32), 9093–9102. doi.org/10.1080/10408398.2021.1940833
- Tardy AL, Pouteau E, Marquez D, et al. (2020). Vitamins and Minerals for Energy, Fatigue and Cognition: A Narrative Review of the Biochemical and Clinical Evidence. Nutrients, 12(1), 228. doi.org/10.3390/nu12010228
- Tarleton EK, et al. (2017). Role of magnesium supplementation in the treatment of depression: A randomized clinical trial. PLoS ONE.
- Tolino E, Skroza N, Mambrin A, et al. (2021). An Open-label Study Comparing Oral Zinc to Lymecycline in the Treatment of Acne
- Université Laval. (2009, March 19). Diet Rich In Calcium Aids Weight Loss In People With Calcium Deficient Diets. ScienceDaily. Retrieved October 31, 2023 from www.sciencedaily.com/releases/2009/03/090312115053.htmVulgaris. The Journal of clinical and aesthetic dermatology, 14(5), 56–58.
- Uysal N, et al (2019). The effects of magnesium supplementation on subjective anxiety and stress – a systematic review. Nutritional Neurosciences.
- U.S. Food and Drug Administration. Proton Pump Inhibitor Drugs (PPIs): Drug Safety Communication—Low Magnesium Levels Can Be Associated With Long-Term Use, skatīts 26.10.2023 www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-low-magnesium-levels-can-be-associated-long-term-use-proton-pump
- Veronese N, et al. (2020). Effect of magnesium supplementation on glucose metabolism in people with or at risk of diabetes: a systematic review and meta-analysis of double-blind randomized controlled trials. European Journal of Clinical Nutrition.
- von Luckner A, Riederer F. (2018). The magnesium luminal processing of in vitro tPA-activated recombinant prourokinase. Thrombosis Research.
- Waldman T, Sarbaziha R, et al. (2015). Calcium Supplements and Cardiovascular Disease: A Review. American journal of lifestyle medicine, 9(4), 298–307. doi.org/10.1177/1559827613512593
- Wawrzyniak N, Suliburska J. (2021). Nutritional and health factors affecting the bioavailability of calcium: a narrative review. Nutrition Reviews. doi:10.1093/nutrit/nuaa138
- Winter MU. of S. (n.d.). Magnesium - 12MG: Historical information. WebElements Periodic Table " Magnesium " historical information, www.webelements.com/magnesium/history.html
- Wu J, Xu L, Lv Y, et al. Quantitative analysis of efficacy and associated factors of calcium intake on bone mineral density in postmenopausal women. Osteoporos Int 28, 2003–2010 (2017). doi.org/10.1007/s00198-017-3993-4
- Zhang F, Ye J, Zhu X, et al. (2019). Anti-Obesity Effects of Dietary Calcium: The Evidence and Possible Mechanisms. International journal of molecular sciences, 20(12), 3072. doi.org/10.3390/ijms20123072
- Zhang X, Keum N, et al. (2016). Calcium intake and colorectal cancer risk: Results from the nurses' health study and health professionals follow-up study. International journal of cancer, 139(10), 2232–2242. doi.org/10.1002/ijc.30293
- Zhang X, Li J, et al (2016). The Effects of Oral Magnesium Supplementation on Glycemic Control in Type 2 Diabetes Patients. Medicine.
- Zhang Y, et al (2021). Magnesium supplementation for primary hypertension: A systematic review and meta-analysis of randomized clinical trials. Journal of Hypertension.
- Zhang Y, Song M, et al. (2022). Zinc supplement use and risk of aggressive prostate cancer: a 30-year follow-up study. European journal of epidemiology, 37(12), 1251–1260. doi.org/10.1007/s10654-022-00922-0
- Zarean E, Tarjan, A. (2017). Effect of Magnesium Supplement on Pregnancy Outcomes: A Randomized Control Trial. Advanced biomedical research, 6, 109. doi.org/10.4103/2277-9175.213879
- Zhu W, Cai D, et al. (2013). Calcium plus vitamin D3 supplementation facilitated fat loss in overweight and obese college students with very-low calcium consumption: a randomized controlled trial. Nutrition journal, 12, 8. doi.org/10.1186/1475-2891-12-8
- Spencer H, Norris C, Williams D. (1994). Inhibitory effects of zinc on magnesium balance and magnesium absorption in man. Journal of the American College of Nutrition, 13(5), 479–484. doi.org/10.1080/07315724.1994.10718438
- Little PJ, Bhattacharya R, Moreyra AE, Korichneva I. (2010). Zinc and cardiovascular disease. Nutrition, 26(11–12), 1050–1057. doi.org/10.1016/j.nut.2010.03.007
- Serefko A, Szopa A, Poleszak E. (2016). Magnesium and depression. Magnesium research, 29(3), 112–119. doi.org/10.1684/mrh.2016.0407
- Ranade VV, Somberg JC. (2001). Bioavailability and pharmacokinetics of magnesium after administration of magnesium salts to humans. American journal of therapeutics, 8(5), 345–357. doi.org/10.1097/00045391-200109000-00008
- Cook JD, Dassenko SA, Whittaker P. (1991). Calcium supplementation: effect on iron absorption. The American Journal of Clinical Nutrition, 53(1), 106–111. doi:10.1093/ajcn/53.1.106
- Stuart L. Linas, Shailendra Sharma, 2013, Chapter 44 - Hypokalemia and Hyperkalemia, www.sciencedirect.com/science/article/abs/pii/B978032308500700045X Skatīts 10.12.2023
- Chu, N., Chan, T. Y., Chu, Y. K., Ling, J., He, J., Leung, K., Ma, R. C. W., Chan, J. C. N., & Chow, E. (2023). Higher dietary magnesium and potassium intake are associated with lower body fat in people with impaired glucose tolerance. Frontiers in nutrition, 10, 1169705. doi.org/10.3389/fnut.2023.1169705
- Pogozheva, A. V., Kodentsova, V. M., & Sharafetdinov, K. K. (2022). Voprosy pitaniia, 91(5), 29–42. doi.org/10.33029/0042-8833-2022-91-5-29-42
- Vongpatanasin, W., Giacona, J. M., Pittman, D., Murillo, A., Khan, G., Wang, J., Johnson, T., Ren, J., Moe, O. W., & Pak, C. C. Y. (2023). Potassium Magnesium Citrate Is Superior to Potassium Chloride in Reversing Metabolic Side Effects of Chlorthalidone. Hypertension (Dallas, Tex. : 1979), 80(12), 2611–2620. doi.org/10.1161/HYPERTENSIONAHA.123.21932
- Eby, G. A., & Eby, K. L. (2006). Rapid recovery from major depression using magnesium treatment. Medical hypotheses, 67(2), 362–370. doi.org/10.1016/j.mehy.2006.01.047
- Supakatisant, C., & Phupong, V. (2012). Oral magnesium for relief in pregnancy-induced leg cramps: a randomised controlled trial. Maternal & Child Nutrition, 11(2), 139–145. doi:10.1111/j.1740-8709.2012.00440.x
- Firoz M, Graber M. Bioavailability of US commercial magnesium preparations. Magnes Res. 2001;14(4):257-262.
- Choi, M. K., & Bae, Y. J. (2015). Association of Magnesium Intake with High Blood Pressure in Korean Adults: Korea National Health and Nutrition Examination Survey 2007-2009. PloS one, 10(6), e0130405. doi.org/10.1371/journal.pone.0130405