Cukura diabēts, arteriāla hipertensija un hroniskas sāpes ir trīs slimības, kas visā pasaulē nopietni ietekmē pacienta dzīvildzi. To veiksmīga pārvaldība ir stūrakmens pacienta dzīves kvalitātes uzlabošanā. Process kļūst sarežģītāks, kad iesaistās nieres, un terapija jāpielāgo atbilstīgi to funkcijai.
Cukura diabēta terapija pacientam ar nieru mazspēju

1. attēls
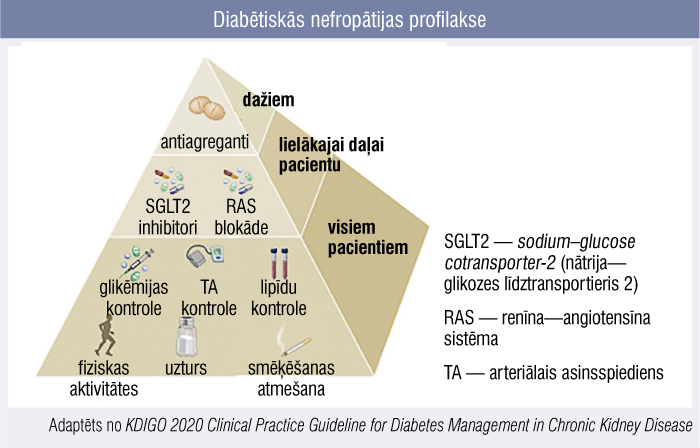
Diabētiskās nefropātijas profilakse
Pēdējos gados saslimstība ar cukura diabētu (CD) un jo īpaši ar 2. tipa cukura diabētu (2TCD) tikai pieaug, radot nozīmīgu slogu veselības aprūpei visā pasaulē. [1; 2] Starptautiskās Diabēta federācijas dati liecina, ka cukura diabēts ir 8,8 % pasaules iedzīvotāju. Prognozē, ka pacientu skaits nākotnē turpinās pieaugt un 2040. gadā CD būs jau 10,4 % pasaules iedzīvotāju. [3]
Skaidrs arī tas, ka cukura diabēts ir viens no galvenajiem hroniskas nieru slimības (HNS) un tālāk arī terminālas nieru mazspējas cēloņiem.
Turklāt pacientiem ar CD un HNS ievērojami pieaug kardiovaskulārais risks, tāpēc ļoti būtiska ir slimības agrīna diagnostika un ārstēšana, kas uzlabo pacienta dzīves kvalitāti un pagarina dzīvildzi. [1; 4]
Ikdienas praksē nereti šādi pacienti ir polimorbīdi un pielāgot optimālu terapiju ir izaicinājums ārstam. Bieži vien tas prasa multidisciplināru pieeju, sadarbojoties ģimenes ārstam, nefrologam, endokrinologam, diabēta māsai un citiem.
Stūrakmens diabētiskas nefropātijas aizkavēšanā un ārstēšanā ir vispārējo risku mazināšana: arteriālā asinsspiediena un glikēmijas kontrole (mērķi ir individuāli), lipīdu profila kontrole un dzīvesveida maiņa (piemēram, smēķēšanas atmešana, svara mazināšana; (1. attēls).
Mikroalbuminūrijas terapija
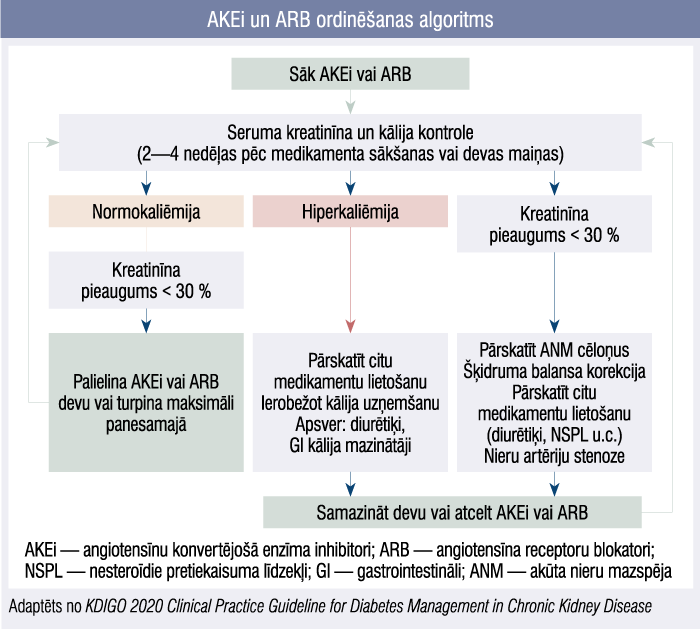
Pacientiem ar cukura diabētu un mikroalbuminūriju (30—300 mg/dnn) un pat normālu arteriālo asinsspiedienu jāsāk terapija ar angiotensīnu konvertējošā enzīma inhibitoriem (AKEi) vai angiotensīna receptoru blokatoriem (ARB) maksimāli panesamajās devās, lai bremzētu HNS progresēšanu. Būtiski atcerēties, ka, sākot un turpinot terapiju ar AKEi vai ARB, cieši jākontrolē nieru funkcija (kreatinīns serumā, glomerulu filtrācijas ātrums jeb GFĀ), kālijs asinīs un arteriālais asinsspiediens. [5]

2. attēls
AKEi un ARB ordinēšanas algoritms
Medikamenti ne tikai pazemina arteriālo asinsspiedienu, bet arī veicina nieru eferentās arteriolas dilatāciju, tādējādi pazeminot intraglomerulāro spiedienu, kas tālāk var mazināt GFĀ. Savukārt hiperkaliēmijas (kālijs > 5,5 mmol/l) risks saistāms ar aldosterona izdales nomākumu. [6] Novērojot pacientam šīs komplikācijas, vienmēr jāizvērtē, vai to pamatā nav kāds cits iemesls, piemēram, citu medikamentu lietošana, kas var potencēt hiperkaliēmiju (aldosterona receptoru antagonisti) vai nieru mazspēju (nesteroīdie pretiekaisuma līdzekļi).
AKEi kombinācijā ar ARB ir bīstami, tāpēc pacientam var izrakstīt vai nu vienas, vai otras grupas medikamentu. Par normu tiek uzskatīts, ja kreatinīna pieaugums serumā nepārsniedz 30 % (2. attēls). Ņemot vērā šo faktu, medikamentu nefroprotektīvās īpašības slimības aizkavēšanā ir tieši agrīnās HNS stadijās, tos sākot pakāpeniski un devas kāpinot. Kad GFĀ sasniedz < 30 ml/min./1,73 m2, medikamenti lietojami ar stingru piesardzību, ja reiz lietoti iepriekš, tomēr to sākšana pacientam ar GFĀ < 15 ml/min./1,73 m2 nebūtu vēlama. [14]
Glikēmijas kontrole un terapija
Ir dažādi faktori, kas jāņem vērā glikēmijas kontrolei pacientiem ar HNS. Pirmkārt, būtiski ir nospraustie mērķi, kas pielāgojami individuāli un atkarīgi no pacienta blakusslimībām, hipoglikēmijas riska un spēšanas to atpazīt, kā arī tikt ar to galā.
Otrkārt, no nieru mazspējas smaguma. HbA1c mērķi variē no < 6,5 % līdz < 8 % pacientiem bez dialīzes. Protams, sākotnēji ir nefarmakoloģiskās ārstēšanas metodes: fiziska aktivitāte, cukura diabētam atbilstoši sabalansēts uzturs un svara pakāpeniska mazināšana, ja tas nepieciešams. Tam seko farmakoloģiska korekcija. Pēdējos gados pieaudzis pretdiabēta medikamentu klāsts, kuri saistāmi ar mazāku risku hipoglikēmiju attīstībai.
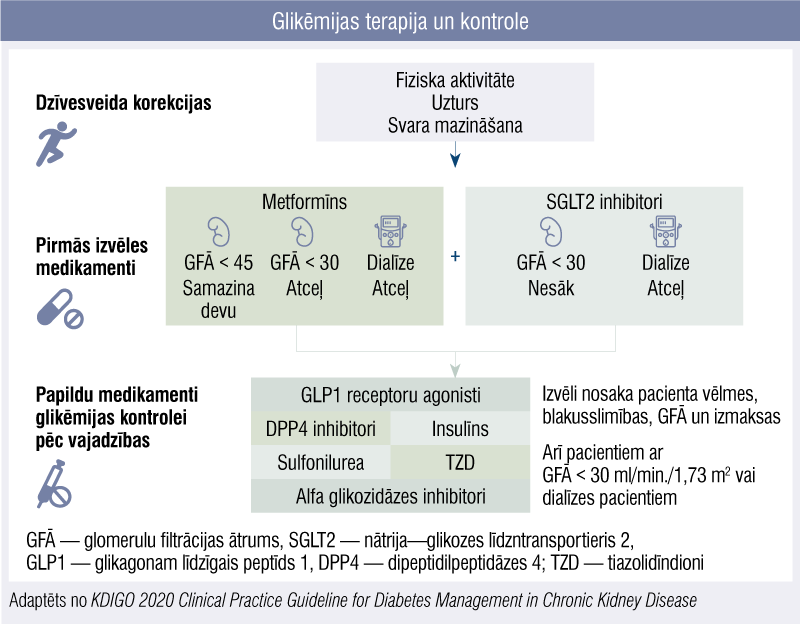
Pirms sākt terapiju, noteikti jānosaka kreatinīns serumā un jāaprēķina GFĀ (kalkulatori ir gan e–vidē, gan viedtālruņos lejupielādējamu lietotņu veidā), jo, mazinoties GFĀ, sarūk medikamentu skaits, ko lietot diabēta ārstēšanā. Pēc pēdējām Kidney Disease: Improving Global Outcomes (KDIGO) 2020. gada vadlīnijām kā pirmās izvēles medikamenti 2TCD kontrolei un pacientam ar GFĀ ≥ 30 ml/min./1,73 m2 rekomendēti metformīns un nātrija—glikozes līdztransportiera 2 (SGLT2) inhibitori. [5]

3. attēls
Glikēmijas terapija un kontrole
Ja ir šo medikamentu nepanesība vai netiek sasniegti mērķi, terapijā pievienojamas papildu zāles, ņemot vērā blakusslimības, izmaksas, pacienta vēlmes (3. attēls). Piemēram, pacientiem ar dialīzi vai GFĀ< 15 ml/min./1,73 m2 sākotnēji kā vēlamākus var nozīmēt dipeptidilpeptidāzes 4 inhibitorus (DPP4i), tiazolidīndionus (TZD) vai insulīnu, bet pacientiem ar sirds mazspēju — glikagonam līdzīgā peptīda 1 agonistus (GLP1).
Metformīna deva pacientiem ar GFĀ < 45 ml/min./1,73 m2 jāreducē uz pusi (t.i., dienas maksimālā deva ir 1000 mg), savukārt < 30 ml/min./1,73 m2 gadījumā — jāatceļ, jo iespējama intoksikācija. [8] Ievērojot to, ka medikamentu devas un lietošana jāpielāgo GFĀ, der atcerēties, ka pacientiem ar GFĀ< 60 ml/min./1,73 m2 vismaz reizi 3—6 mēnešos būtu vēlama nieru funkcijas kontrole.
Arteriālā hipertensija un hroniska nieru slimība
Arteriālā hipertensija (AH) mūsu dienās nebūt nav retums. Pasaules Veselības organizācijas aplēses rāda, ka visā pasaulē aptuveni 1,3 miljardus cilvēku skar AH, kuras komplikācijas ir tādas nopietnas slimības kā sirds mazspēja, insults, nieru mazspēja. [13]
Turklāt hroniska nieru slimība per se palielina risku sirds—asinsvadu slimību attīstībai, bet kombinācijā ar arteriālu hipertensiju riski (arī cerebrovaskulāriem notikumiem) tikai pieaug.
67—92 % pacientu ar hronisku nieru slimību (HNS) ir arteriālā hipertensija, un izplatība pieaug, progresējot nieru mazspējai. [9]
Eiropas Sirds slimību asociācija arteriālo hipertensiju definē kā sistolisko arteriālo spiedienu ≥ 140 mmHg un/vai diastolisko arteriālo spiedienu ≥ 90 mmHg. [8]
Pacientiem ar hronisku nieru slimību AH var būt gan primāra (un var veicināt nieru mazspējas progresēšanu), gan sekundāra. Renovaskulāras hipertensijas patoģenēzes pamatā ir samazināta nieru perfūzija un renīna—angiotensīna—aldosterona sistēmas (RAAS) aktivācija.
Atbildot tādai stimulācijai kā a) samazināta perfūzija nieru baroreceptoros, b) pazemināts nātrija hlorīda līmenis macula densa un c) bēta adrenerģiska stimulācija, nieres jukstaglomerulārajās šūnās izdalās renīns. Renīns tālāk iedarbojas uz angiotenzinogēnu, veidojot angiotensīnu I, kas angiotensīnu konvertējošā enzīma (AKE) ietekmē tiek konvertēts par angiotensīnu II. [12]
Mērķa asinsspiediens
HNS pacientiem sistoliskā arteriālā spiediena (SAS) mērķi dažādās vadlīnijās atšķiras, tomēr pēc pēdējām KDIGO (2021) vadlīnijām, ja vien pacients panes un nav sācis dialīzi, mērķis ir < 120 mmHg, kas patiesībā ir samērā agresīva spiediena pazemināšana. Turklāt strauja arteriālā asinsspiediena pazemināšana var provocēt akūtu nieru mazspēju, tādējādi pasliktinot nieru iznākumus.
Praksē, protams, jāņem vērā pacienta vecums, blakusslimības, paredzamā dzīvildze un tas, kā pacients jūtas, lietojot antihipertensīvo terapiju. Tāpēc būtisks ir balanss starp ieguvumiem un kaitējumiem pacientam. Individuāli mērķi ir pietiekami arī, piemēram, tad, ja SAS < 130 vai < 140 mmHg. [14] Nepietiekama šķidruma uzņemšana vai šķidruma zudums (piemēram, svīšana karstā laikā) ir riska faktori akūtai nieru mazspējai, ko hipotensija var tikai potencēt.
Pacienti sākotnējās HNS stadijās (I—IV) un ar proteinūriju būtu ieguvēji, lietojot vai nu AKEi, vai ARB, gan medikamentu nefroprotektīvo īpašību dēļ, gan arī tādējādi mazinot kardiovaskulāro risku, tomēr jāņem vērā iespējamās blaknes (sīkāku informāciju skatīt sadaļā pie cukura diabēta, 2. attēlā).
Tomēr antihipertensīvā medikamenta izvēle nav tik būtiska, cik paša arteriālā spiediena pazemināšana. [9] Bieži nieru mazspējas pacientiem arteriālā hipertensija ir grūti kontrolējama, nepieciešami divi medikamenti un vairāk, tāpēc nevajadzētu baidīties nozīmēt adekvātu antihipertensīvu terapiju, lai sasniegtu mērķus. Pie zāļu izvēles iespējām pieskaitāmi arī kalcija kanālu blokatori, centrālas darbības medikamenti, garas darbības α1 blokatori, bēta blokatori un diurētiķi.
Urīndzenošie medikamenti palīdz, jo nereti viens no AH mehānismiem ir tieši šķidruma pārslodze. Tiazīdu diurētiķi zaudē efektivitāti, mazinoties GFĀ < 30 ml/min./1,73 m2, savukārt cilpas diurētiķiem ir efekts arī mazāka GFĀ gadījumā. Nozīmējot šos medikamentus, jāseko kālija un magnija līmenim, kas var kristies. [14] Izrakstot minerālkortikoīdu receptoru agonistus (piemēram, spironolaktonu), īpaši pacientiem, kas lieto arī AKEi vai ARB un kam GFĀ < 45 ml/min./1,73 m2, ir augsts hiperkaliēmijas un nieru slimības progresēšanas risks, tāpēc to lietošana stingri izvērtējama, tomēr, ja pacients tos lieto, nepieciešama kālija kontrole asinīs.
Dialīzes pacienti un hipertensija
Pacientiem, kuri ir dialīzē, AH mazināšanā būtiska ir izglītošana par šķidruma patēriņu (arī to, kas ir augļos, zupā u.c.) — tā pārmērīga uzņemšana veicina hiperhidratāciju un tālāk hipertensiju. Protams, jāierobežo arī sāls uzņemšana, kas būtu < 5 g vārāmā sāls diennaktī. Farmakoloģiskā terapijā lietojami principā tie paši medikamenti, kas pārējiem HNS pacientiem, ar dažiem izņēmumiem.
Diurētiķus (šajā gadījumā cilpas diurētiķus) var nozīmēt tad, ja pacientam ir saglabāta reziduālā nieru funkcija, tomēr jāatceras, ka, mazinoties GFĀ, arī to iedarbība vairs nav tik efektīva. Šobrīd nav pietiekamu pierādījumu pētījumiem par AKEi vai ARB lietošanas drošumu pacientiem ar HNS V, tomēr praksē arī šo grupu medikamentus mēdz lietot nelielās devās, stingri kontrolējot kālija līmeni asinīs.
Sāpju pārvaldīšana pacientam ar hronisku nieru slimību
Sāpju etioloģija var būt dažāda, tomēr sāpes jebkurā gadījumā dramatiski pasliktina pacienta dzīves kvalitāti. Savukārt ilgstoša pretsāpju līdzekļu lietošana (īpaši hroniskām sāpēm) var atstāt nopietnas sekas cilvēka organismā, radīt atkarību. Ir būtiski atrast vidusceļu starp šīm divām galējībām tā, lai mēs nekaitētu pacientam un vienlaikus atvieglotu viņa ikdienu.
Lai palīdzētu pacientam, ir vērts izprast sāpju raksturu. Akūtas sāpes definējamas kā pēkšņas, dažādu stipruma pakāpju sāpes kā reakcija uz audu bojājumu un tālāku autonomās nervu sistēmas un aizsargrefleksu (muskuļu spazmu u.c.) aktivāciju. Tiek aktivizēti nociceptori un/vai sensibilizēti centrālie neironi, radot nepatīkamas sajūtas, kas mazinās, beidzoties kairinājumam.
Turpretī hroniskas sāpes ir ieildzis audu bojājums ar pastāvīgu nociceptoru aktivāciju. Bojāto audu vietā novēro iekaisuma šūnu infiltrāciju, kas turpina kairināt nociceptorus, radot hroniskas sāpes. Sāpes var būt neiropātiskas (patoloģiskais process rada tiešu somatosensoriskās sistēmas bojājumu) un ne–neiropātiskas — neiropātiskas sāpes bez zināmas neironu disfunkcijas un/vai bojājuma. [15]
Pretsāpju līdzekļu arsenāls
Plaša analgētisko (un arī antipirētisko un pretiekaisuma) medikamentu grupa ir nesteroīdie pretiekaisuma līdzekļi (NSPL), kuru darbības pamatā ir enzīma ciklooksigenāzes (COX) inhibīcija. Tos iedala neselektīvos NSPL (ibuprofēns, ketorolaks, naproksēns u.c.), COX–2 selektīvos (piemēram, celekoksibs) un aspirīns.
COX ietekmē no arahidonskābes veidojas tromboksāni, prostaglandīni un prostaciklīni. Ir divi COX izoenzīmi — COX–1 un COX–2. COX–1 enzīma aktivitāte ietekmē trombocītu agregāciju un nieru aferentās arteriolas dilatāciju, kam ir nozīme kuņģa gļotādas aizsardzībā. COX–2 enzīma aktivitāte pieaug iekaisuma laikā. [15; 16]
Pārsvarā medikamentus lieto perorāli, bet ir arī lokāli lietojami (piemēram, geli) un injicējami medikamenti. Pacientiem ar hronisku nieru slimību NSPL lietošana nav rekomendējama, jo var provocēt akūtu nieru mazspēju un/vai hroniskas nieru slimības progresēšanu, inhibējot aferentās arteriolas vazodilatāciju (inhibējot prostaciklīna E2 un I1 veidošanos).
Protams, tas ir no devas un medikamenta lietošanas ilguma atkarīgs lēmums. Bieži šis process ir atgriezenisks, medikāciju pārtraucot, tomēr ne vienmēr un var radīt paliekošas sekas. Medikamenti var veicināt arī akūta intersticiāla nefrīta attīstību, kura ārstēšanā ir jālieto glikokortikoīdi, tomēr bojājums var palikt, radot hronisku nieru slimību. Var veicināt arī hiperkaliēmiju, īpaši kombinācijā ar citiem medikamentiem, kas paaugstina kālija līmeni. [16] Ja pacientam tomēr tiek izvēlēti NSPL, vienmēr jācenšas tos dot iespējami īsāku laiku un nepārsniegt maksimālo diennakts devu.
Drošāk lietojami medikamenti
Pacientiem ar hronisku nieru slimību drošāk lietojami ir, piemēram, paracetamols, kam ir pretsāpju un antipirētisks efekts. Ja efekts nav pietiekams, paracetamolu var lietot kombinācijā ar vājāku opioīdu, piemēram, kodeīnu.
Šādas kombinācijas ir arī vienas tabletes veidā, bieži veiksmīgi kupē sāpes. Ja tas nav pietiekami, terapijā var pievienot spēcīgāku opioīdu, piemēram, tramadolu. Galējie līdzekļi ir opioīdi, piemēram, fentanils, morfijs, oksikodons, tomēr to lietošanā jābūt piesardzīgiem, jo iespējams elpošanas nomākums; deva jāizvēlas mazākā iespējamā ar pietiekamu efektu un titrējama uz augšu pēc nepieciešamības.
Jāatceras, ka svarīga ir sāpju kupēšana, tomēr tikpat būtiska ir medikamentu pareiza lietošana, lai neradītu atkarību.
Pacientiem ar neiropātiskām sāpēm aktuāli medikamenti sāpju kupēšanā ir antikonvulsanti (gabapentīns un karbamazepīns), arī tricikliskie antidepresanti (amitriptilīns). Gabapentīna deva pielāgojama nieru funkcijai, piemēram, sasniedzot GFĀ < 50 ml/min./1,73 m2, diennakts deva reducējama par 50 %, bet ar GFĀ < 15 ml/min./1,73 m2 — jau par 90 %. Gabapentīnu sāk lietot mazās devās un pakāpeniski titrē, sekojot pacienta pašsajūtai. Reti, bet karbamazepīna lietošana var veicināt hiponatrēmijas attīstību saistībā ar pastiprinātu antidiurētiskā hormona izdales stimulāciju. [17]