Lielākā daļa reimatisko slimību saistītas ar izmaiņām imunoloģiskajā profilā, sevišķi sistēmas saistaudu slimības. Taču ir situācijas, kad saskaramies ar reimatisko slimību bez raksturīgām izmaiņām imunoloģiskajās analīzēs.
Situācija ir, piemēram, seronegatīvs reimatoīdais artrīts. Tā ir biežākā situācija reimatoloģijā. Šoreiz analizēsim klīniskajā praksē un zinātniskajās publikācijās ļoti retu stāvokli — antinukleāro antivielu (ANA) negatīvu sistēmisku sklerodermiju (SS) (diagnozes formulējums pēc Starptautiskā slimību klasifikatora (SSK)).
Klīniskais gadījums
2016. gada jūlija vidū uz konsultāciju pie reimatologa ieradās 65 gadus vecs vīrietis ar sūdzībām par difūzām sāpēm visā ķermenī, t.i., muskuļos un ādā, izteiktu nespēku, novājēšanu (pēdējā mēnesī zaudēti 10 kg), periodisku caureju (bez asinīm), elpas trūkumu mērenas fiziskas slodzes laikā (bez klepus).
Anamnēze
Kopumā pakāpeniska stāvokļa pasliktināšanās kopš 2016. gada pavasara, ir grūti strādāt un veikt sadzīves darbus. Ievācot vispārējo anamnēzi, uzzinājām, ka pacientam ir Reino fenomens — aukstumā roku pirksti paliek zilgani balti (siltumā šīs izmaiņas izzūd). Šī parādība ir pēdējos 2—3 gadus. Līdz 2016. gada pavasarim ārsta apmeklējumi un zāļu lietošana nav bijusi nepieciešama (anamnēzē pneimonija pirms vairākiem gadiem; smēķēšana: 10 cigaretes dienā 30 gadus (15 paciņgadi, pašlaik 6 mēnešus nesmēķē)). Ģimenes anamnēzē — mātei plaušu ļaundabīgs audzējs, taisnās zarnas audzējs.
Izmeklējumi
Fizikālajā izmeklēšanā: difūzi sabiezēta āda, t.i., apgrūtināta kroku veidošana, teleangiektāzijas uz sejas, perifēras tūskas uz apakšstilbiem; pārējās orgānu sistēmas bez būtiskām novirzēm no normas.
Darba diagnoze
Izvērtējot anamnēzes un fizikālās izmeklēšanas datus, darba diagnoze ir sistēmiska sklerodermija. Kāds ir šīs darba diagnozes pamatojums? Difūza ādas sabiezēšanās (subjektīvi un objektīvi), Reino fenomens, teleangiektāzijas, elpas trūkums, norādot par iespējamu plaušu iesaisti un/vai sirds mazspēju, kuņģa—zarnu trakta funkcijas traucējumi (caureja), perifēras tūskas (sirds un/vai nieru mazspējas iespējas).
Diagnostiskie kritēriji
Reimatoloģijā izmanto klasifikācijas kritērijus, lai noteiktu, vai sūdzības atbilst konkrētas slimības izpausmēm. 2013. gadā izstrādāti jauni SS klasifikācijas kritēriji (1. tabula). [1] Šos kritērijus nepiemēro pacientiem, kam nav iesaistīti roku pirksti, kā arī gadījumos, ja ādas izmaiņas labāk izskaidrojamas ar citu stāvokli, piemēram, nefrogēno sklerozējošo fibrozi, porfīriju, skleromiksedēmu, cukura diabēta izraisītām ādas izmaiņām, eozinofilo fascītu utt.
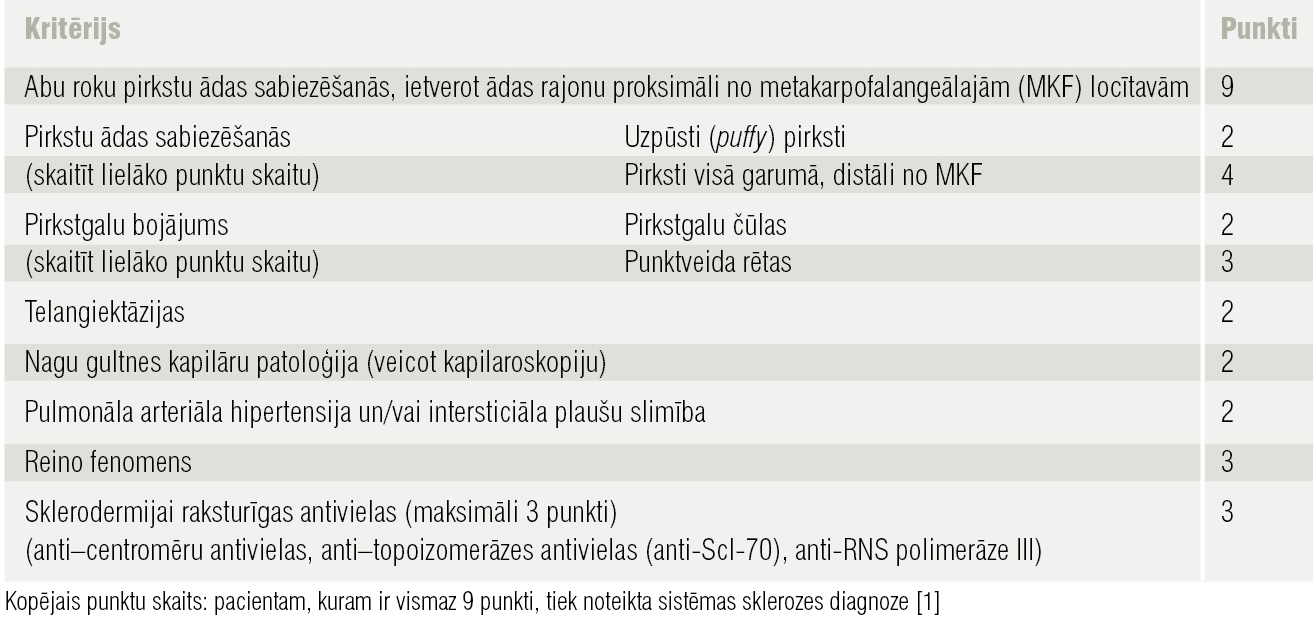

1. tabula
SS klasifikācijas kritēriji
Izvērtējot kritērijus klīniski (bez histoloģijas, imunoloģisko un radioloģisko izmeklējumu rezultātiem), pacientam ir 14 punkti (2. tabula). Tālāk būtiski novērtēt iekšējo orgānu iesaisti un izslēgt paraneoplastisko sindromu, kura gadījumā sistēmas skleroze var būt kā maska.


2. tabula
Pacienta klīniskās sūdzības
Veicot analīzes un radioloģiskos testus, katru izmeklējumu var izmantot četros veidos: lai noteiktu diagnozi, lai izslēgtu citas diagnozes, lai novērtētu terapijas drošumu un efektivitāti (3. tabula).


3. tabula
Pacientam veiktie izmeklējumi
Slēdziens
Ņemot vērā klīniku un veiktos izmeklējumus, pacientam ir ANA negatīva difūza sistēmiska sklerodermija ar plaušu un nieru bojājumu, kuņģa—zarnu trakta iesaisti (klīniski), Reino fenomenu.
Stacionārā pacientam sākta terapija ar ciklofosfamīdu (i/v deva 800 mg mēnesī) un perorāla terapija ar prednizolonu (sākuma deva 30 mg dienā, ko pakāpeniski mazina), saskaņota ar kardiologu un progresējošas slodzes stenokardijas dēļ koriģēta kardiālā terapija.
Klīniskā gadījuma kopsavilkums
- Vīrietis, kaut arī slimību biežāk novēro sievietēm, kad ANA negatīvas SS gadījumā prognoze ir labāka, šajā gadījumā risku palielina vīriešu dzimums.
- Tipiski difūza ādas sabiezēšanās, kas raksturīga vīriešiem un ANA negatīvai SS.
- Novēroja kuņģa—zarnu trakta iesaisti, malabsorbciju kā ANA negatīvas SS gadījumā.
- Pacientam netika konstatēta pulmonālā hipertensija (mērot ar TTEHO kardiogrāfiju), tomēr, progresējot slimībai, progresē arī stenokardiska rakstura sūdzības.
- Pacientu izmeklēja paraneoplastiskā procesa virzienā, lai izslēgtu sekundāru sistēmas sklerozi, — malignitāte netika pierādīta.
Pārskats par sistēmisku sklerodermiju
SS ir hroniska sistēmiska saistaudu slimība, kam raksturīgi vazomotoriski traucējumi, fibroze, atrofija — ādas, zemādas audu, muskuļu, iekšējo orgānu (gastrointestinālais trakts, plaušas, sirds, nieres, CNS) bojājums un imunoloģiskās pārmaiņas. Sklerodermiju iedala lokālā un sistēmiskā (4. tabula).


4. tabula
Sklerodermijas klasifikācija
Sklerodermijas pamatā ir imūnās sistēmas aktivācija, endotēlija disfunkcija, palielināta fibro-blastu aktivitāte. Audos notiek monocītu un limfocītu ekstravazācija, aktivējas fibroblasti, kas pastiprināti producē ekstracelulāro matrici, traucēta asinsvadu gludās muskulatūras šūnu kontrakcijas—relaksācijas regulācija. Rezultātā pastiprināti notiek vazospazmas un veidojas gludās muskulatūras hipertrofija.
Vaskulārā bojājuma pamatā ir palielināta endotēlija permeabilitāte, samazināta vazoreaktivitāte, traucēta adhēzijas molekulu sintēze un izjaukts balanss starp hemostatiskiem un fibrinolītiskiem faktoriem, trombocītu aktivācija. Gan ādā, gan iekšējo orgānu mazajās artērijas un kapilāros notiek vazokonstrikcija, pakāpeniski attīstoties asinsvadu lūmena obliterācijai un išēmijai. [17; 18] Slimību raksturo vispārēja ādas sabiezēšanās pastiprināta kolagēna un matrices proteīnu uzkrāšanās dēļ.
Kopumā dati liecina, ka SS sastopama 2,3—10 cilvēkiem no miljona. [6] Prognoze, kas korelē ar iekšējo orgānu iesaisti, pēdējās desmitgadēs kopumā uzlabojusies, jo ir jauni medikamenti un pilnveidoti terapijas algoritmi. Desmit gadu izdzīvošanas rādītājs 70—80 %. Galvenie nāves iemesli: progresējoša plaušu fibroze, pulmonāla hipertensija, smaga gastrointestinālā trakta iesaiste, sirds bojājums. [7]
SS atšķirības vīriešiem un sievietēm
Ar SS sievietes slimo biežāk nekā vīrieši, attiecīgi 6—12:1, slimība izpaužas 35—65 gadu vecumā. [3] Difūza SS vienlīdz bieži abiem dzimumiem sastopama agrīnāk, t.i., 30—40 gadu vecumā, ar tendenci vīriešiem parādīties lielākā vecumā. Lai gan SS biežāk ir sievietēm, smagāka SS gaita novērojama vīriešiem — viņiem ir lielāks tādu kardiovaskulāro notikumu kā sirds mazspēja, pulmonālā hipertensija risks. Vīriešiem biežāk novēro difūzu ādas iesaisti, pirkstgalu čūlas; izdzīvošanas rādītāji ir sliktāki. [33]
ANA negatīva SS
Vēsturiski vairāki pētījumi liecina, ka 2—10 % pacientu ar SS pārliecinošiem kritērijiem ir negatīvi ANA izmeklējumu rezultāti. Lielākajā daļā pētījumu ietvertas mazas pacientu grupas. 2015. gadā publicēts pētījums (Salazar, 2015), kurā analizēti 3249 sistēmiskas sklerodermijas pacientu (Scleroderma Family Registry) demogrāfiskie un klīniskie dati.
Pētījuma ietvaros atklāja, ka ANA negatīviem pacientiem, kas lielākoties bija vīrieši (p < 0,008), raksturīga ģeneralizēta ādas iesaiste, biežāka apakšējā kuņģa—zarnu trakta iesaiste un malabsorbcija, retāk novērotas telangiektāzijas, pirkstu galu čūlas, vaskulopātijas. Starp abām grupām nebija būtiskas atšķirības SS renālās krīzes, pulmonālās fibrozes vai izdzīvošanas datu analīzē. [8; 22]
Imunoloģiski negatīvas SS gadījumā paredzama labāka prognoze. [22; 33] Ir klīnisko gadījumu apraksti par seronegatīvu SS asociāciju ar malignitātēm, bet šiem pacientiem nenovēroja Reino fenomenu. [34] ANA negatīva sistēmiska sklerodermija kā paraneoplastiska procesa izpausme novērojama multiplas mielomas un krūts dziedzera karcinomas gadījumā. EUSTAR (The European Scleroderma Trials and Research group) dati par septiņiem pacientiem: krūts ļaundabīgs audzējs diviem pacientiem, mielomas slimība vienam pacientam, urīnpūšļa karcinoma vienam pacientam. [35]
Simptomātika
Sistēmas skleroze var skart jebkuru orgānu sistēmu. Slimības gaitā var novērot tādus vispārējus simptomus kā nogurums, svara zudums. Izmaiņas, kas skar ādu, var būt dažādas: sākotnēji novēro plaukstu un pēdu tūsku, difūzu vai lokālu ādas sabiezēšanos, izmaiņas ādas pigmentācijā, vēlākās stadijās pirkstu galu kalcinozi išēmijas dēļ, čūlas, fleksijas kontraktūras ādas sabiezēšanās dēļ.
Ādas izmaiņas sākas agrīnā fāzē kā ādas tūska — pietūkuši roku pirksti, tad sabiezējas ekstremitāšu, sejas un rumpja āda. Pacientam, kam šīs izpausmes attīstās strauji, tuvākajos 3—5 gados ir lielāks iekšējo orgānu bojājuma risks. [12] Reino fenomens bieži asociēts ar SS un ir agrīna slimības izpausme. Novēro nagu gultnes kapilāru izmaiņas (tipiskas izmaiņas kapilaroskopijā), teleangiektāzijas. Novēro izmaiņas arī balsta—kustību aprātā: artralģijas, saišu bojājumu, miopātiju, artrītu.
Plaušu bojājuma dēļ var progresēt elpas trūkums, sauss klepus. Daži pacienti var būt asimptomātiski, bet plaušu bojājuma pazīmes (piemēram, bazālus trokšņus) var atklāt fizikālā izmeklēšanā un radioloģiskās izmaiņās. Pacientiem ar SS var attīstīties intersticiāla plaušu slimība, 20—30 % pacientu var rasties pulmonāla hipertensija bez intersticiālas plaušu slimības. [12] Plaušās radioloģiski novēro intersticiālas izmaiņas, alveolītu, intersticiālu fibrozi. Pulmonāla hipertensija var būt neatkarīgi no plaušu izmaiņām.
Ja bojāts barības vads, parādās sūdzības par rīšanas grūtībām pastāvīgas aspirācijas dēļ, kas ir barības vada motilitātes traucējumu gadījumā, var veidoties aspirācijas pneimonīts. Novēro GERS barības vada dismotilitātes izmaiņas, tādus gastrointestinālā trakta motilitātes traucējumus kā aizcietējumi, malabsorbcija. Difūzi izmainītu asinsvadu sieniņu izmaiņu dēļ var būt nieru bojājums, nieru mazspēja, arteriāla hipertensija, sklerodermijas nieru krīze. [9]
SS diagnostika
Sistēmiskas sklerodermijas diagnozi pamato ar klasifikācijas kritērijiem, klīniski svarīgākā ir ādas sabiezēšanās, raksturīgas ādas izmaiņas asociācijā ar Reino fenomenu, kā arī iekšējo orgānu iesaiste (1. attēls).
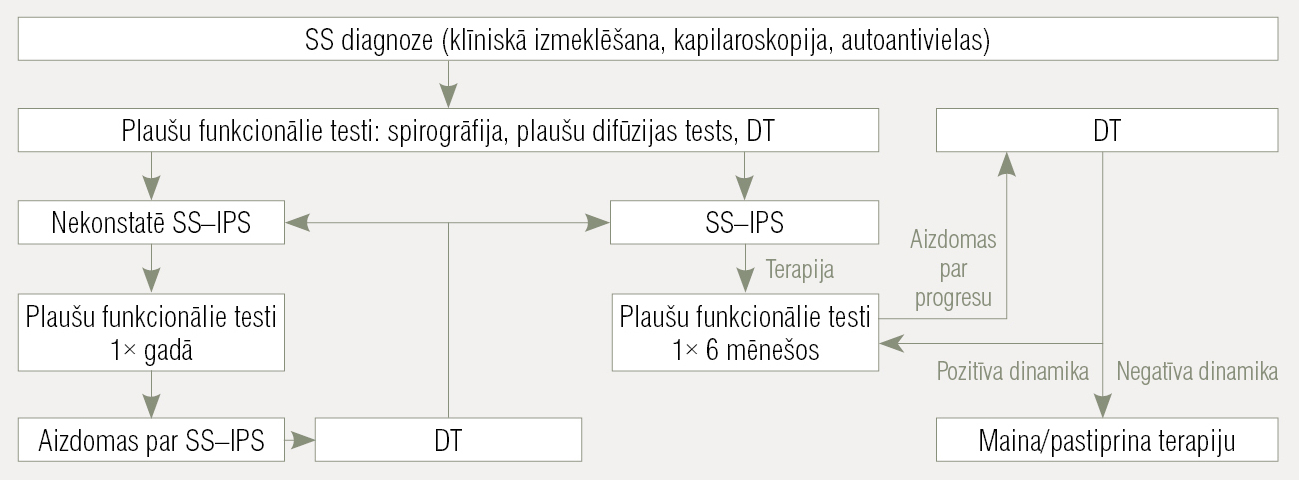

1. attēls
Intersticiālas plaušu slimības diagnostika un terapija SS gadījumā
Lai primāru Reino slimību atšķirtu no Reino fenomena sistēmiskas autoimūnas slimības gadījumā, izmanto nagu gultnes kapilaroskopiju. SS gadījumā nepieciešamie izmeklējumi: pilna asinsaina, asins bioķīmija, iekļaujot aknu, nieru, iekaisuma rādītājus, muskuļu enzīmus, vairogdziedzera funkcionālos testus, urīna analīzi. Seroloģiskā antivielu izmeklēšana nepieciešama, lai diagnosticētu un klasificētu SS. [1; 2]
- Disfāgijas, GERS simptomu, sliktas dūšas un vemšanas gadījumā jāveic fibrogastroskopija un barības vada manometrija.
- Jānovērtē plaušu iesaiste, veicot rentgenogrāfiju vai datortomogrāfiju (DT). Visiem pacientiem ar plaušu bojājumu būtu jānovērtē plaušu funkcija (jāveic spirometrija ar forsēto vitālo kapacitāti un difūzijas kapacitātes tests). DT ļaus diferencēt pulmonālu fibrozi no aktīva alveolīta. Alveolīta gadījumā būtu indicēta bronhoskopija ar bronhoalveolāro lavāžu (BAL) (> 3 % neitrofili, > 2 % eozinofili vai abi BAL šķidrumā).
- Ehokardiogrāfija un sirds labās puses katetrizācija būtu nepieciešama, lai agrīni atklātu pulmonālu hipertensiju. Tāpat vispārējā stāvokļa novērtēšanai neieciešams slodzes tests.
- Lai novērtētu renālas krīzes iespējamību, jākontrolē arteriālais asinsspiediens, nieru funkcijas un bojājuma rādītāji. [9]
- SS asociēta ar vairākām antivielām, no kurām katra ir lietderīga šīs slimības diagnostikai, nosakot iespējamo prognozi (5. tabula). Visraksturīgākās antivielas, kas ļauj atpazīt SS pacientus, ir anti–centromēru (ACA) un anti–scl–70. ACA parasti prognozē limitētu ādas iesaisti, bet anti–scl–70 gadījumā palielinās difūza ādas un plaušu iesaiste. Anti–fibrillarīnās antivielas (anti–U3–RNP) un anti—RNS–PM antivielas sastopamas retāk, bet arī prognozē difūzu ādas iesaisti un sistēmisku slimības gaitu. Anti–Th/To un PM–Scl antivielas asociētas ar limitētu ādas iesaisti, bet anti–Th/To antivielas var būt predisponējošs marķieris pulmonālai hipertensijai. [9]


5. tabula
Ar antivielām asociētas SS prognoze
- Antinukleārās antivielas (ANA) atrod 95—75 % SS pacientu, diagnostiskā jutība 85 %, specifiskums 54 %. [10]
- Anticentromēru antivielas (ACA) atrod 20—30 % SS gadījumu, bet to biežums variē pēc rases, reti atrod veseliem cilvēkiem. Ja tās ir atklātas pacientam ar Reino fenomenu, ir predispozīcija SS attīstībai. [11] ACA biežāk asociētas ar CREST sindromu. [9]
- Anti–Scl–70 antivielas atrod 15—20 % SS pacientu, to klātbūtne pacientiem ar Reino fenomenu var liecināt par SS attīstību nākotnē. [11]
- ENA antivielas — anti–Sm, anti–U1–RNP antivielas — specifiskas sistēmas sarkanai vilkēdei, bet atrod arī SS gadījumā, biežāk SS pacientiem, ja ir pārklāšanās sindromi, norādot uz sliktāku prognozi un vairāku orgānu bojājumu. [9]
Nemedikamentozā terapija
- Dzīvesveids: fiziskās aktivitātes uzlabo vispārējo stāvokli, palīdz saglabāt locītavu kustīgumu un uzlabot cirkulāciju.
- Ādas aizsardzība: pacientam jāģērbjas piemēroti gadalaikam, aukstākā laikā jāvalkā siltākas drēbes, lai neprovocētu vazospazmas Reino fenomena dēļ. Reino fenomena gadījumā redzamo vazospazmu laikā ekstremitāšu pirkstu galos notiek asinsvadu sašaurināšanās, iekšējos orgānos — plaušās.
- Diēta: nepieciešamas pilnvērtīgas maltītes, kas nekairina kuņģa—zarnu traktu un barības vada dismotilitātes gadījumā neveicina GERS. Pacientiem būtu jāatturas no alkohola, smēķēšanas. [17]
Medikamentozā terapija
Ir dažādas medikamentozās stratēģijas, lai mazinātu slimības progresu, uzlabotu vaskulāro funkciju, samazinātu mirstību un nodrošinātu uzturošu simptomātisko terapiju (2. attēls). [17] Vairākas zāles samazina vazospazmu. Dihidropiridīna kalcija kanālu blokatori (amlodipīns, nifedipīns) ir pirmās izvēles zāles Reino fenomena ārstēšanai. [13] Antiagregantu un antikoagulantu lietošanas nozīme ir neskaidra; ja nav kontrindikāciju to lietošanai un ir Reino fenomens, rekomendē terapijā pievienot aspirīnu mazā devā. Lai mazinātu pirkstu išēmiju un čūlas, rekomendē arī fosfodiesterāzes–5 (FDE5) inhibitorus (sildenafilu, tadalafilu vai vardenafilu) vai endotelīna receptora antagonistus (bosentānu). [13; 16]


2. attēls
Intersticiālas plaušu slimības terapijas taktika
Renālās krīzes gadījumā jālieto angiotensīnu konvertējošā enzīma inhibitori. [16] Gastroezofageālā refluksa gadījumā nozīme ir protonsūkņu inhibitoriem, kā arī dismolitātes mazināšanai svarīgi ir prokinētiķi (metoklopramīds vai domperidons). Tievās zarnas malabsorbcijas un baktēriju savairošanās dēļ izraisītas diarejas gadījumā apsverama antibakteriālā terapija. [16] Metotreksātam ir ierobežots efekts ādas sabiezēšanās mazināšanā. [15] Nozīmīgas plaušu slimības, pulmonālas hipertensijas gadījumā nepieciešama skābekļa terapija. [16]
Ciklofosfamīds (CYC)
- Intersticiālas plaušu slimības (SS–IPS) gadījumā nozīmīga ir ciklofosfamīda pievienošana terapijā. [7] Tas ir visbiežāk lietotais un efektīvākais medikaments, kas pētījumos ievērojami uzlabo FVC. To lietojot, sasniedz remisiju, pēc tam nepieciešama uzturošā terapija. Ja CYC pārstāj lietot bez uzturošās terapijas, sešos mēnešos novēro negatīvu dinamiku. [23] CYC uzlabo plaušu funkciju, samazina elpas trūkumu, uzlabo ādas stāvokli, dzīves kvalitāti. [14; 16]
- CYC, īslaicīgi lietojot, var izraisīt leikopēniju, infekcijas, bet ilgtermiņā — neauglību, kaulu smadzeņu bojājumu, pieaug karcinoģenēzes risks. Intermitējoša pulsa terapija mazina tā toksicitāti. [24]
- Joprojām nav konkretizēts CYC pulsa terapijas lietošanas ilgums, biežums, deva. Rekomendē ikmēneša pulsa terapiju devā 1 g/m2 6—12 mēnešus. [25]
Mikofenolāta mofetils (MMF)
- MMF ir zāles, kas SS–IPS gadījumā stabilizē plaušu funkcionālos rādītājus. Perspektīvā pētījumā, lietojot MMF:CYC 1:1, rezultāti rādīja, ka SS–IPS pasliktinās (CT) MMF grupā, bet ne CYC grupā, lai gan ar CYC ārstētajā grupā sākumā bija izteiktāka IPS. [26]
- MMF izmanto kā uzturošās terapijas līdzekli, retāk kā indukcijas medikamentu. [27]
Azatioprīns (AZA)
- Pētījumā, kur CYC un AZA salīdzināja kā pirmās rindas izvēles medikamentus, pēc 10 mēnešiem novēroja plaušu funkcionālo testu rezultātu pasliktināšanos AZA grupā. Rekomendē izvēlēties AZA kā uzturošās terapijas medikamentu, bet ne kā pirmās izvēles medikamentu, tas stabilizē plaušu funkcijas rādītājus pēc inducējošās terapijas. [28]
Kortikosteroīdi (KS)
- Ordinē miozīta un alveolīta gadījumā, bet jāņem vērā, ka steroīdi lielās devās var veicināt renālu krīzi. [16]
- KS bieži tiek izmantoti SS pacientu terapijā kombinācijā ar citu imūnsupresīvu medikamentu, jo monoterapija ar KS nav efektīva. KS pulsa terapijai kopā ar CYC labi rezultāti SS–IPS terapijā. [29]
- Svarīgi, ka hroniska KS lietošana lielās devās (> 15 mg/dienā) asociēta ar lielāku sklerodermijas nieru krīzes risku, īpaši agrīnas nieru slimības gadījumā. [30]
Bioloģiskie medikamenti
- Divu ciklu terapija — rituksimaba (RTX) iknedēļas infūzija (375 mg/m2 1 × nedēļā) četras nedēļas un atkārtota infūzija pēc 24 nedēļām — pēc gada kontroles apskates dinamikā pierādīja izteikti pozitīvu dinamiku plaušu funkcionālo testu, ādas skalas rādītājos.
- RTX jāizvēlas, ja pacients nepanes CYC vai ja ir kontrindikācijas. CYC terapijas neefektivitātes gadījumā MMF vai AZA vietā. [32]