Eiropas sāpju apvienība (Pain Alliance Europe) ziņo, ka apmēram 100 miljoni cilvēku Eiropā cieš hroniskas sāpes — tās izteikti negatīvi iespaido gan cilvēka emocionālo, gan funkcionālo un arī ekonomisko sfēru. Tās ir sāpes, kas ilgst vairāk nekā sešus mēnešus un ārstēšanai padodas grūtāk nekā akūtas sāpes, tāpēc ir grūti risināms uzdevums ikdienas ārsta praksē.
Hroniskas sāpes mugurā un to saistība ar dzīves kvalitāti
AVOTS: Husky MM, et al. Chronic back pain and its association with quality of life in a large French population survey. Health And Quality Of Life Outcomes, 2018; 16(1): 195.
Dzīves laikā apmēram 40 % vispārējās populācijas ziņo par hroniskām sāpēm mugurā. Šīs sāpes turpinās pēc normālā paredzētā dzīšanas perioda, parasti ilgst vairāk par 3—6 mēnešiem. Hroniskas muguras sāpes ir viens no galvenajiem iemesliem darbnespējai — netiešās izmaksās šīs problēmas dēļ pasaulē katru gadu tērē miljardiem dolāru.
Pētījuma ietvaros aptaujā noskaidroja hronisku muguras sāpju izplatību vispārējā populācijā, saikni starp muguras sāpēm un pacientu sociāli demogrāfisko raksturojumu vai klīniskajiem riska faktoriem, novērtēja dzīves kvalitāti cilvēkiem ar hroniskām muguras sāpēm.
Metodes
Pētījums notika Francijā, tajā 17 249 respondenti uz jautājumiem atbildēja telefonintervijā. Aptaujāto vecums 18—89 gadi (vid. 46,39 gadi; SN = 17,44), 56,7 % sieviešu. Medicīniskā stāvokļa novērtēšanai izmantoja CIDI (Composite International Diagnostic Interview) rīku, dzīves kvalitāti novērtēja pēc fiziskā un mentālā komponenta rādījumiem SF–36 aptaujā.
Rezultāti
No hroniskām muguras sāpēm cieš 38,3 % no visiem aptaujātajiem. Sāpju attīstību ietekmē vairāki faktori: sieviešu dzimums, lielāks vecums, zemāks izglītības līmenis, fizisks darbs ikdienā. Hronisku muguras sāpju gadījumā rezultāti SF–36 bija zemāki nekā cilvēkiem bez hroniskām sāpēm, tātad dzīves kvalitāti ievērojami pasliktina sāpju pāreja hroniskā formā.
Lielākā daļa (66,6 %) atzīmē, ka viņiem ir arī cita veida hroniskas sāpes, un 43,6 % piemin ne tikai muguras sāpes, bet arī citas veselības problēmas (piemēram, insults vai miokarda infarkts anamnēzē, hipertensija, cukura diabēts).
Secinājumi
Pētījums izgaismo hronisku muguras sāpju nozīmīgumu vispārējā populācijā un īpaši izceļ to korelāciju ar dzīves kvalitāti. Lai mazinātu paliekošas sekas un novērstu sāpju pāreju hroniskās, svarīga profilakse, agrīna diagnostika, piemērota terapija un rehabilitācija.
Dr. D. Jēgere: “Latvijā daudz pretrunu un atšķirīgu viedokļu par muguras sāpju ārstēšanu. Dažādu specialitāšu ārsti izmanto dažādas vadlīnijas un iesaka dažādas terapijas taktikas. Nereti tiek uzspiesta operatīva terapija, jo pārsvarā, izvērtējot klīnisko sindromu, vadās pēc izmeklējumos konstatētām morfoloģiskām izmaiņām. No pieredzes zināms, ka, izmeklējot mugurkaulu, reizēm atrod minimālas izmaiņas, bet sūdzības ir ilgstošas, izteiktas. Mēdz būt arī pretēji — izmaiņas ir izteiktas, bet sāpju nav vai tās ir niecīgas. Jāatceras, ka sāpes ir biopsihosociāls fenomens neatkarīgi no to cēloņa. Muguras sāpes var būt arī somatoformu traucējumu izpausme. Un, ja radioloģiskos izmeklējumos ir atrastas izmaiņas diskos un skriemeļos, šī atrade tikai baro slimnieka izmainīto sāpju uztveri un priekšstatu par neārstējamu un invalidējošu slimību. Tomēr pacienti ar muguras sāpēm vienmēr jānovērtē, lai specifiskas muguras sāpes atšķirtu no nespecifiskām un konstatētu slimības, kad iespējami drīz jāiejaucas ķirurģiski. Muguras sāpju ārstēšanas plānā, ja nav nepieciešama steidzama ķirurģiska iejaukšanās, noteikti nevar aprobežoties tikai ar analgētiķiem. Muguras sāpju gadījumā iesaistītas dažādas struktūras — kauli, diski, locītavas, muskuļi, saites, fascijas, asinsvadi, tātad medikamentozā terapija piemērojama individuāli, terapijas plānā noteikti jāietver fizikālās metodes un fizioterapija. Neinvazīvo terapijas metožu (fizioterapijas, fizikālās terapijas, bioloģiskās atgriezeniskās saites, kognitīvi biheiviorālās psihoterapijas) pieejamība Latvijā ir ierobežota. Reizēm pacients izmanto kādu vienu metodi, nevis rehabilitologa vadībā ilgstoši darbojas pēc racionāli izveidota metožu plāna. Ārstēšanās sanatorijā divas nedēļas nav pietiekami efektīva, ja ilgstoši neturpina uzturošu ārstēšanu ārsta rehabilitologa vadībā.”
Primārās veselības aprūpes speciālistu rīcība hronisku sāpju gadījumā
AVOTS: Provenzano DA, Kamal KM, Giannetti V. Evaluation of Primary Care Physician Chronic Pain Management Practice Patterns. Pain Physician, 2018; 21(6): E593–E602.
Primārās veselības aprūpes ārsti parasti ir pirmie, kam jāizvēlas pretsāpju terapija pacientiem. No hroniskām sāpēm cieš apmēram 100 miljoni ASV iedzīvotāju, 2003. gada aptaujas dati liecina, ka apmēram 63 % pēc palīdzības vispirms dodas pie ģimenes ārsta. Ģimenes ārsta zināšanas par atsāpināšanas metodēm ir ļoti svarīgas, turklāt pirms kāda medikamenta izrakstīšanas jāņem vērā individuālie klīniskie, cilvēciskie un ekonomiskie faktori.
Ģimenes ārsti ASV kopš 2007. gada opioīdus daudz biežāk izrakstījuši arī gadījumos, kad jākupē ne–onkoloģiska spektra sāpes, tāpēc 2016. gada martā izdotas klīniskās vadlīnijas, kur teikts, ka:
- pirmā izvēle hronisku sāpju pārvaldībā ir ne–opioīdi,
- rūpīgi jāizvērtē gan nepieciešamība opioīdus lietot, gan ārstēšanas mērķi, ja opioīdi tiek izvēlēti,
- jāizvairās no vairāku opioīdu kombinācijām vai kombinācijām ar benzodiazepīniem.
Pētījuma mērķis bija noskaidrot ģimenes ārstu zināšanas un ikdienas praksi darbā ar hronisku sāpju pacientiem.
Metodes
Aptaujā noskaidroja ģimenes ārsta taktiku hronisku sāpju pacientu ārstēšanā, veiktās darbības, pieņemtos lēmumus un zināšanas par sāpju pārvaldību ar piecām medikamentu pamatklasēm.
Rezultāti
Atsaucība bijusi diezgan slikta, par izvērtēšanai derīgām atzītas 48 anketas jeb 16 % no visām nosūtītajām. Vidējais aptaujāto vecums 48,98 gadi, praksē nostrādāti vidēji 19,17 gadi.
Ģimenes ārsts mēnesī strādā ar vidēji 30 pacientiem, kam ir kāda veida hroniskas sāpes: onkoloģiskas, migrēna, neiropātiskas sāpes, nociceptīvas sāpes, osteoartrīts, multiplā skleroze, radikulāras sāpes, jaukta tipa sāpes, fibromialģija, muguras sāpes, viscerālas sāpes.
Medikamenta izvēli visbiežāk nosaka zāļvielas efektivitāte, drošums, izmaksas, pacienta medicīniskā vēsture, zāļu mijiedarbības un atkarību rašanās risks.
Ārstu zināšanas par piecām medikamentu pamatklasēm (antidepresanti, antikonvulsanti, opioīdi, acetaminofēns un NSPL, topiskās zāļvielas) noskaidrotas pēc speciālistu atbildēm uz apgalvojumiem par katru zāļvielu (piekrītu, nepiekrītu, neesmu pārliecināts/nezinu). Daži piemēri tabulā.
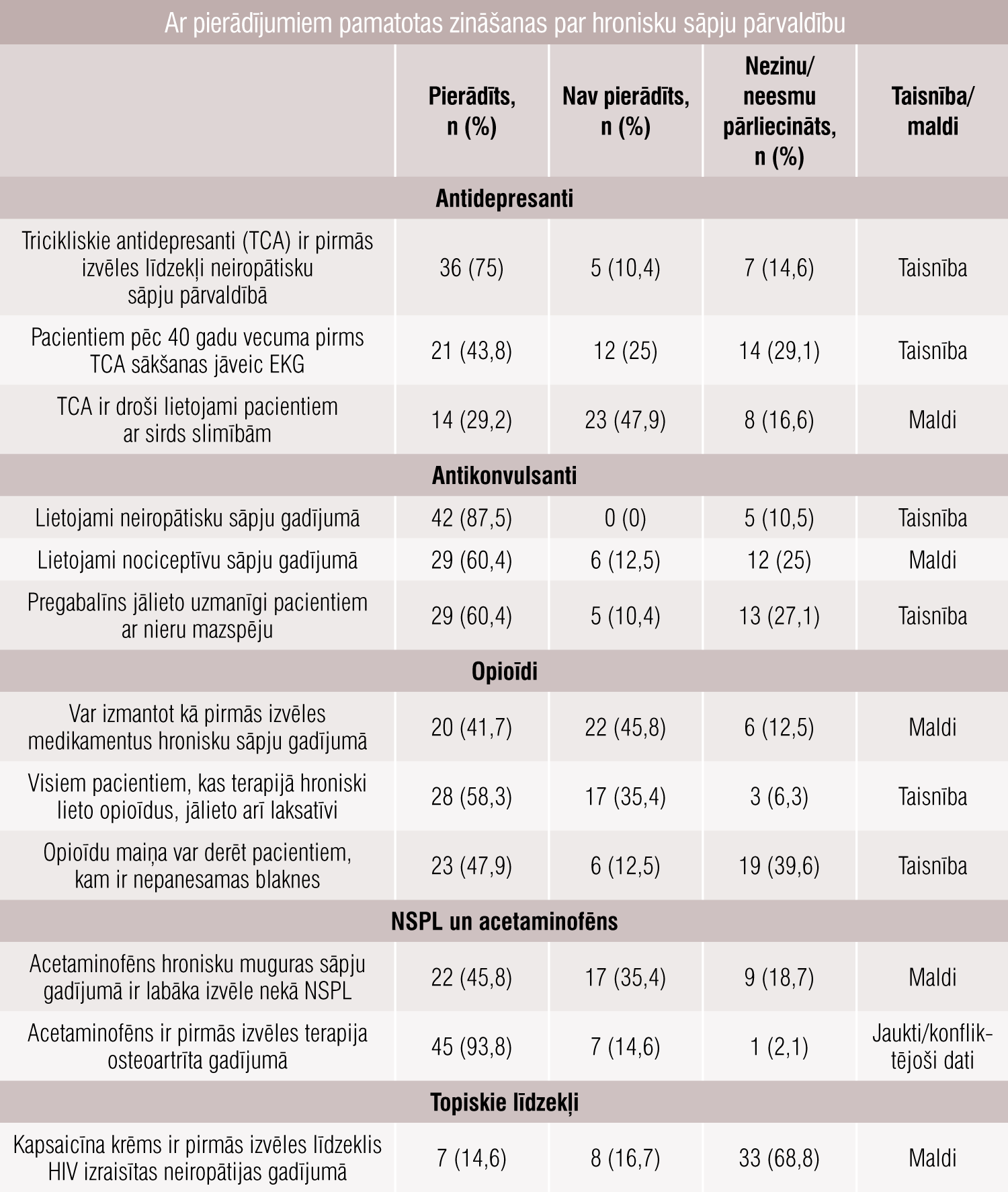

Tabula
Ar pierādījumiem pamatotas zināšanas par hronisku sāpju pārvaldību
Dr. D. Jēgere: “Hronisku sāpju terapijas pamatprincipi — izmantot dažādas medikamentu grupas, tās kombinējot, lai mazinātu iespējamās blaknes un lai tie cits citu pastiprinātu.
Terapiju ordinē pēc noteiktām shēmām noteiktos laikos, nevis pretsāpju medikamentu pacients lieto tad, kad sāpes nevar izturēt! Sākot terapiju, novērtē sāpju raksturu, jo neiropātisku sāpju terapijā vairāk izmantojami ir pretepilepsijas līdzekļi un tricikliskie antidepresanti, bet nociceptīvām sāpēm — NSPL un acetaminofēns.
Īss pārskats par medikamentu grupām, kas lietojamas hronisku sāpju terapijā.
- Neopioīdu analgēzija ietver acetaminofēnu, neselektīvos nesteroīdos pretiekaisuma līdzekļus (NSPL) un ciklooksigenāzes–2 (COX–2) inhibitorus. NSPL un COX–2 inhibitoriem piemīt pretiekaisuma iedarbība.
- Acetaminofēna jeb paracetamola analgētiskais darbības mehānisms nav skaidrs, un tam nav pretiekaisuma iedarbības. Acetaminofēnu parasti kombinē ar opioīdiem, lai samazinātu to devu. Tomēr, ja ordinē šādus kombinētus preparātus, jārēķinās ar maksimāli pieļaujamo paracetamola devu dienā (pieaugušajiem 4 g). Acet-aminofēna pārdozēšana var izsaukt nopietnu aknu bojājumu. Pat pieļaujamās devās tas var būt bīstams pacientiem ar aknu slimībām vai alkoholismu. Līdz ar to acetaminofēna lietošanas risks ir diskutabls. Piemēram, ASV maksimālais acetaminofēna saturs vienā tabletē ierobežots līdz 325 mg un pacientiem ar alkoholismu vai aknu bojājumu neiesaka pārsniegt 2 g dienā. Paracetamola lietošanas iespējamās blaknes jānovērtē arī pacientiem ar hronisku nieru slimību, peptiskas čūlas slimību un paaugstinātu asinsspiedienu.
- NSPL primāri tika ieteikti vieglām un vidējām nociceptīvām sāpēm, bet jaunākos ieteikumos arī izteiktu sāpju gadījumā sakarā ar somatisku bojājumu. Visbiežāk iesaka mīksto audu ievainojumiem, sastiepumiem, galvassāpēm, artrītam, muguras sāpēm. NSPL ir sinerģija kombinācijā ar opioīdiem. NSPL pretsāpju efekts nav lielāks kā acetaminofēnam. Amerikas Geriatru asociācija ilgstošai osteoartrīta sāpju ārstēšanai iesaka izvairīties no NSPL lietošanas, ja tas iespējams. Lokalizētu sāpju gadījumā labāk iesaka topiskus līdzekļus. No NSPL grupas mazāk izteiktas blaknes ir COX–2 inhibitoriem. Tomēr pacientiem šīs grupas medikamentu iedarbība var individuāli atšķirties.
- Lietojot NSPL grupas medikamentus, jārēķinās ar to iedarbību uz kuņģa—zarnu traktu, aknām, nierēm, alerģisku reakciju iespējamību, piesardzīgu lietošanu astmas slimniekiem, kā arī pacientiem ar paaugstinātu asinsspiedienu un asiņošanas risku. NSPL ir relatīvi kontrindicēti pacientiem ar pārciestu vēnu trombozi. Jāpārskata pacienta medikamentu saraksts, vai pacienti lieto antiagregantus un kortikosteroīdus.
- Antikonvulsanti. Neiropātisku sāpju terapijā lieto gabapentīnu, pregabalīnu un karbamazepīnu. Gabapentīns un pregabalīns ir efektīvi diabētiskai polineiropātijai, postherpētiskai neiralģijai. Pregabalīna efekts ir ātrāks nekā gabapentīnam. Medikamenti var radīt reiboni, miegainību, tāpēc nozīmējami lēni pieaugošās devās lietošanai vakarā. Pregabalīnam piemīt viegla eiforizējoša iedarbība, var būt iedarbība uz elpošanas sistēmu. Karbamazepīnam un okskarbamazepīnam vairāk izteikta iedarbība uz trigeminālu neiralģiju.
- Antidepresanti. Gan tricikliskajiem antidepresantiem, gan serotonīna, noradrenalīna atpakaļsaistīšanās inhibitoriem piemīt laba pretsāpju darbība. Duloksetīns labi mazina fibromialģijas sāpes. Analgētiskais efekts tiem parādās ātrāk nekā antidepresantu efekts. Tomēr jārēķinās ar triciklisko antidepresantu blaknēm — miegainību, aizcietējumiem, ķermeņa masas pieaugumu, kā arī neiesaka lietot pacientiem ar glaukomu un prostatītu. Veciem cilvēkiem labāk lietot nortriptilīnu vai dezipramīnu.
- Adjuvanti jeb ko–analgētiskie līdzekļi — dažādu grupu analgētiķi, kas paši nav pretsāpju medikamenti, bet kas ietekmē kādu noteiktu sāpju veidošanās mehānismu. Pie adjuvantiem var pieskaitīt antidepresantus, pretepilepsijas līdzekļus, topiskos anestēzijas līdzekļus, miorelaksantus, kā arī kortikosteroīdus. Dažus adjuvantus lieto, lai potencētu analgēziju, bet citus — pretsāpju līdzekļu izraisīto blakņu mazināšanai. Lokālu sāpju mazināšanā izmanto topiskus līdzekļus, lai mazinātu medikamenta ietekmi uz visu ķermeni.
- Topiski lietojams lidokaīns dažiem pacientiem ir efektīvs neiropātiskām sāpēm, sevišķi alodīnijai pēcherpētiskas neiralģijas gadījumā.
- Kapsaicīna krēms 0,025—0,075 % vai 8 % plāksteris pēcherpētiskai neiralģijai. Kapsaicīnam ir vidēja vai vāja iedarbība uz hroniskām balsta—kustību aparāta un neiropātiskām sāpēm, bet dažiem pacientiem var būt efektīvs. Biežāk to lieto nevis monoterapijā, bet kā adjuvantu. Dažreiz to lieto HIV neiropātijai, diabētiskai neiropātijai.
- Gelu, aerosolu, krēmu un plāksteru veidā topiski lietojami arī NSPL, biežāk diklofenaku saturošie.
- Spazmolītiķi. Tizanidīns, baklofēns palīdz hroniskām sāpēm, ja ir muskuļus spazmējošs komponents. Labi šos medikamentus lietot vakarā, jo tiem piemīt atslābinošs un miega efekts.
- Hroniskām pēcherpētsikām neiralģijām ir vērts mēģināt injekciju veidā lokāli lietot botulīna toksīnu.”
Opioīdi hronisku ne–onkoloģisku sāpju pārvaldībai: sistemātisks pārskats un meta–analīze
AVOTS: Busse JW, et al. Opioids for Chronic Noncancer Pain: A Systematic Review and Meta-analysis. JAMA, 2018; 320(23): 2448–2460.
2016. gadā apmēram 50 miljoni pieaugušo ASV sadzīvo ar hroniskām ne–onkoloģiskām sāpēm, daudziem tiek izrakstīti opioīdi. Aprēķini rāda, ka 2013.—2016. gadā amerikāņi izcēlušies ar to, ka lietojuši visvairāk opioīdu “uz galviņu” pasaulē!
Nesenos sistemātiskos pārskatos par opioīdu lietošanu ne–onkoloģisku sāpju pārvaldībā iekļauti tikai pētījumi par to efektivitāti vismaz gadu ilgā apsekošanas periodā, bet ne nejaušināti klīniski pētījumi. Šajā sistemātiskajā pārskatā un nejaušinātu klīnisko pētījumu meta–analīzē iekļauti paši svaigākie pētījumu dati un uzsvērti iepriekšējo pārskatu ierobežojumi.
Metodes
Datus līdz 2018. gada aprīlim ievāca datubāzēs CENTRAL, CINAHL, EMBASE, MEDLINE, AMED un PsycINFO, iekļāva pētījumus, kuros aprakstīti hronisku ne–onkoloģisku sāpju pacienti, kas pēc nejaušības principa saņēmuši kādu no opioīdu zāļu formām versus citai zāļvielai vai placebo, un kuros apsekošanas periods bijis vismaz četras nedēļas.
Rezultāti
Meta–analīzē iekļāva 96 pētījumus (pacientu kopskaits 26 169 — 61 % sieviešu, vidējais vecums 58 gadi): 25 pētījumus par neiropātiskām sāpēm, 32 par nociceptīvām sāpēm, 33 par centrālu sensibilizāciju (sāpes bez audu bojājuma) un sešus par jaukta tipa sāpēm.
Salīdzinot ar placebo, opioīdu lietošana tika asociēta ar sāpju samazināšanos (svērtā vidējā atšķirība (WMD) ‑0,69 cm [95 % TI, no ‑0,82 līdz ‑0,56 cm] uz 10 cm vizuālo analogo sāpju skalā; modelētā riska atšķirība, sasniedzot minimāli svarīgo atšķirību (MID) 11,9 % [95 % TI, no 9,7 % līdz 14,1 %]), uzlabotu fizisko funkciju (WMD, 2,04 punkti [95 % TI, no 1,41 līdz 2,68 punktiem] 100 punktu SF–36 PCS skalā; modelētā riska atšķirība, sasniedzot MID 8,5 % [95 % TI, no 5,9 % līdz 11,2 %]), bet veicināja vemšanu (5,9 % opioīdu gadījumā, 2,3 % placebo gadījumā).
Zemas līdz vidējas kvalitātes pierādījumi rāda, ka opioīdu efekts sāpju mazināšanā un fizisko funkciju uzlabošanā ir līdzīgs NSPL (sāpes: WMD ‑0,60 cm [95 % TI, no ‑1,54 līdz 0,34 cm]; fiziskās funkcijas: WMD ‑0,90 punktu [95 % TI, no ‑2,69 līdz 0,89 punktiem]) vai tricikliskie antidepresanti (sāpes: WMD ‑0,13 [95 % TI, no ‑0,99 līdz 0,74 cm]; fiziskās funkcijas: WMD ‑5,31 punkts [95 % TI, no ‑13,77 līdz 3,14 punktiem]), vai antikonvulsanti (sāpes: WMD ‑0,90 cm [95 % TI, no ‑1,65 līdz ‑0,14 cm]; fiziskā funkcija: WMD 0,45 punkti [95 % TI, no ‑5,77 līdz 6,66 punktiem]).
Secinājumi
Meta–analīzē secināts, ka pacientiem ar hroniskām ne–onkoloģiskām sāpēm opioīdi sniedz statistiski ticamu, taču mazu uzlabojumu sāpju mazināšanā un fizisko funkciju uzlabošanā, bet veicina vemšanu, ja salīdzina ar placebo.
Lai gan pētījumi, kur salīdzināti opioīdi un ne–opioīdi, norāda uz opioīdu noderīgo efektu, jāpatur prātā, ka pētījumos iegūtie rezultāti vērtējami kā zemas vai vidējas kvalitātes.
Dr. D. Jēgere: “No minēto pētījumu datiem izriet, ka opioīdu lietošanas efekts salīdzināms ar NSPL efektu, tāpēc, apsverot opioīdu lietošanu, jāņem vērā iespējamās blaknes no opioīdu lietošanas, salīdzinot ar pretsāpju efektu. Vidēji stipru un stipru neonkoloģisku sāpju ārstēšanai biežāk izmantojami vājas iedarbības opioīdi: kodeīns (reizes devā 30—60 mg ik 4—6 stundas), dihidrokodeīns jeb DHC, pussintētisks pagarinātas darbības kodeīna atvasinājums (60, 90, 120 mg tabletēs, darbojas 8—12 h, titrējams, maksimālā diennakts deva 360 mg), tramadols, vājas darbības sintētisks opioīds, kas ietekmē sāpju centrālos un perifēros ceļus, piemīt mērena serotonīna un noradrenalīna atpakaļsaistīšanās inhibēšana. Tramadols tiek fasēts tabletēs, svecītēs, injekcijās, tā iedarbības ilgums 4—6 stundas, prolongētām formām 12 stundas, maksimālā diennakts deva 400 mg. Pie stipriem opioīdiem pieder morfīns, oksikdons, trimepiridīns (promedols) un fentanils. Šīs grupas medikamenti lietojami, ja ir ilgstošas, nepanesami stipras sāpes. Hronisku neonkoloģisku sāpju terapijā vislabākais rezultāts ir kombinētai terapijai, kur ietverti NSPL, antidepresanti ar pretsāpju iedarbību, pretepilepsijas līdzekļi gabapebtīns, pregabalīns, karbamazepīns, adjuvanti, miorelaksanti, topiskie līdzekļi lokālu sāpju ārstēšanai. Katra veida sāpēm var būt kādi specifiski medikamenti, piemēram, trigeminālai neiralģijai efektīvāks karbamazepīns, hroniskai migrēnai var izmantot bēta blokatorus vai flunarizīnu, vai topiramātu. Izmantojot medikamentu kombinācijas, var iegūt labāku pretsāpju efektu nekā ar vienu pretsāpju līdzekli lielā devā. Ievērojamu sāpes mazinošu efektu iegūst, izmantojot fizikālo terapiju, fizioterapiju, psihoterapiju vai mainot ieradumus ilgā periodā. Kombinētā terapija parasti pacientam dod iespēju kļūt sociāli aktīvākam, mainīt ieradumus. Tas notiek lēni, ilgākā periodā. Tomēr sāpes mēdz saasināties arī tad, ja izmanto kombinēto terapiju, vai arī ir atsevišķas akūtu sāpju epizodes. Šajos gadījumos uz noteiktu laiku var papildus pievienot opioīdus. Tomēr jāizvairās opioīdus ordinēt ilgstoši, lai “opioīdu epidēmija” nesāktos arī Latvijā. Baltijas valstīs, salīdzinot ar citām Eiropas valstīm un ASV, opioīdi tiek lietoti maz un mums ir salīdzinoši neliels no opioīdiem atkarīgo pacientu skaits. Domāju, ka hronisku sāpju saasinājumu gadījumos, īslaicīgi izrakstot opioīdus kā papildinājumu pastāvīgai pretsāpju terapijai, var uzlabot pacientu dzīves kvalitāti. Tomēr, nozīmējot opioīdus, pacients jāinformē par iespējamo atkarību, rekomendācijās būtu jānorāda konkrēts laiks, kad opioīda lietošana sākta un cik ilgi tas lietojams. Nereti ar speciālista rekomendācijām, kur nav norādīts medikamenta lietošanas ilgums, pacients var doties pie ģimenes ārsta un lūgt ilgstoši izrakstīt opioīdu. Kombinētā pretsāpju terapija ir efektīva, ja katru dienu tiek lietoti vairāki medikamenti dažādos laikos, un tas pacientam var likties apgrūtinoši. Tā vietā šķiet labāk trīsreiz dienā lietot tableti vai divas tabletes viena paša opioīda, nerēķinoties ar atkarības rašanās risku ilgākā periodā. Opioīdu lietošanas radītās blaknes ir aizcietējumi, slikta dūša, vemšana, urīna aizture, nieze, sedācija, elpošanas nomākums un atkarības veidošanās. Lietojot ilgāku laiku, iepriekšējā deva nenodrošina atsāpināšanu un tā jāpalielina. Psihiskā atkarība rodas, ja opioīdus lieto apreibināšanās nolūkā devās, kas pārsniedz atsāpināšanai nepieciešamās. Strauji atceļot opioīdus, parādās fiziskas atkarības simptomi: aizkaitināmība, bezmiegs, svīšana. Tāpēc opioīdu lietošana pārtraucama, devu samazinot pakāpeniski.”
Miega traucējumi un hronisks nogurums — hronisku sāpju vēstneši 5 un 18 gadu perspektīvā
AVOTS: Aili K, et al. Sleep problems and fatigue as predictors for the onset of chronic widespread pain over a 5- and 18-year perspective. BMC Musculoskeletal Disorders, 2018; 19(1): 390.
Pacientiem ar balsta—kustību aparāta sāpēm nereti ir ar miegu saistītas problēmas. Iepriekšējie pētījumi liecina, ka miega kvalitāte norāda uz sāpju prognozi: pacienti ziņo par grūtībām iemigt, uzturēt miegu un par neizgulēšanās sajūtu.
Šā populācijas pētījuma mērķis bija noskaidrot, vai miega traucējumi un nogurums prognozē hronisku plaši izplatītu sāpju (HPIS) sākumu piecu un 18 gadu perspektīvā kohortā, kurā nav ziņots par HPIS trīs gadus pirms pētījuma sākuma.
Metodes
Pētījumā izmantoja tikai to cilvēku datus, kas nav ziņojuši par hroniskām izplatītām sāpēm 1998. gadā un trīs gadus pirms (1995. gadā). Piecus gadus apsekoja 1249 dalībniekus no visiem iekļautajiem, 18 gadus novēroja 791 pacientu. Tādi miega traucējumi kā grūtības aizmigt, uzturēt miegu, priekšlaicīga celšanās, nogurums pēc miega tika pētīti kā hronisku izplatītu sāpju prognozes rādītāji.
Rezultāti
Pētījumā izdevās secināt, ka grūtības aizmigt, uzturēt miegu, priekšlaicīga celšanās no rītiem un nogurums pēc miega tiek apstiprināti kā hronisku izplatītu sāpju prognozes rādītāji gan piecu gadu (OR 1,85 pret OR 2,27), gan 18 gadu (OR 1,54 pret OR 2,25) perspektīvā neatkarīgi no mentālās veselības stāvokļa (novērtēts ar SF–36) pētījuma sākumā.
Kopumā miega traucējumu un noguruma efekts uz hroniskām sāpēm (piecu gadu perspektīvā) bija mazliet zemāks, kad pielāgoja sāpes no pētījuma sākumpunkta, bet statistiski ticams efekts saglabājas tādu miega traucējumu gadījumā kā priekšlaicīga pamošanās, neatjaunošanās pēc miega un nogurums.
Problēmas ar miega uzturēšanu paredz hronisku izplatītu sāpju attīstību 18 gadus vēlāk neatkarīgi no mentālās veselības stāvokļa un sāpju izplatības reģionu daudzuma (OR 1,72). Rezultātus statistiski ticami neietekmēja ne pacienta vecums un dzimums, ne sociāli ekonomiskais un mentālās veselības stāvoklis, sākot no pētījuma sākuma.
Secinājumi
Miega traucējumi un hronisks nogurums ir nozīmīgi faktori, kas var būt iemesls hronisku izplatītu sāpju attīstībai piecu gadu perspektīvā. Izteiktāks negatīvais efekts pēc ilgāka laikposma izpaudās tieši miega problēmām. Šie rezultāti norāda uz miega traucējumu un hroniska noguruma ārstēšanas klīnisko nozīmīgumu, lai novērstu citas pacienta veselības problēmas nākotnē.
Dr. D. Jēgere: “Terminu “hronisks noguruma sindroms” lieto, lai aprakstītu grūtības vai nespēju aktīvi darboties, subjektīvu vājuma sajūtu, apātiju, grūtības koncentrēties, atcerēties. Tiek aprakstīta slimība “hroniska noguruma sindroms”, bet aprakstītie simptomi var izpausties dažādu slimību, piemēram, fibromialģijas, depresijas, somatoformu traucējumu, gadījumā, kā arī būt dažādu medikamentu blaknes. Par hronisku nogurumu sūdzas slimnieki ar reimatiskām slimībām, izkaisīto sklerozi, kardiopulmonālām, endokrīnām slimībām, infekcijas slimībām, osteoartrītu. Subakūts un hronisks nogurums visbiežāk saistīts ar kādu hronisku slimību vai arī ar ilgstošu pārstrādāšanos bez atpūtas. Daļa no uzskaitītajām slimībām (reimatiskās slimības, fibromialģija, osteoartrīts) saistītas ar dažādi izteiktām sāpēm. Šīs slimības var attīstīties ilgstošā periodā un saistās arī ar miega traucējumiem, grūtībām iemigt, miegainību dienā, koncentrēšanās traucējumiem, kas var parādīties slimības sākuma fāzē, kad sāpju simptomi vēl maz izteikti. Somatoformi traucējumi ar miega traucējumiem var turpināties vairākus gadus, līdz kādu apstākļu dēļ tie sāk izpausties smagāk un pacients meklē palīdzību pie ārsta. Domāju, ka nevar novilkt asu robežu, kad ir miega traucējumi un kad parādās kādas citas slimības simptomi. Minētajā pētījumā bija izmantoti pacientu aptaujas dati un nebija ņemtas vērā objektīvi novērtētas agrīnas kādas slimības izpausmes. Pacienti ar hronisku nogurumu un ar miega traucējumiem izmeklējami vispusīgi, lai konstatētu šo traucējumu iemeslu. Apmēram 75 % pieaugušo ar depresiju atzīmē miega traucējumus. Bieži miega traucējumi ir cilvēkiem ar posttraumatiskā stresa sindromu. Šajos gadījumos miega traucējumi saistīti ar autonomās nervu sistēmas funkciju traucējumiem, serotonīna, melatonīna izdales traucējumiem centrālajā nervu sistēmā. Šīs vielas ir nozīmīgas sāpju impulsu pārvadē, tāpēc cilvēkiem ar miega traucējumiem ir pazemināts sāpju slieksnis.”