Akromegālijas izplatība ir 40—125 gadījumi uz miljonu iedzīvotāju, bet sastopamība ir 3—4 gadījumi uz miljonu iedzīvotāju gadā. Datu par akromegālijas izplatību un sastopamību Latvijā nav.
Lai uzlabotu akromegālijas agrīnu diagnostiku un savlaicīgu, pamatotu ārstēšanu Latvijā, publikācijai žurnālā Doctus sagatavotas Endokrinoloģijas biedrības (ASV) jaunākās, 2014. gadā izdotās klīniskās vadlīnijas. Aprūpējot akromegālijas pacientus pēc jaunākajām klīniskajām vadlīnijām, iespējams uzlabot šo pacientu dzīves kvalitāti un samazināt agrīnas mirstības risku. Klīniskās vadlīnijas sagatavotas, izmantojot GRADE sistēmu (Grading of Recommendations, Assessment, Development, and Evaluation System), kas raksturo rekomendāciju ticamības pakāpi un pierādījumu kvalitāti. [1; 2] Katrs vadlīniju ieteikums tālāk tekstā ir numurēts. Pārliecinošs ieteikums tiek apzīmēts ar vārdu “rekomendē”, vājš ieteikums — ar vārdu “iesaka”. Ar “Q” apzīmē pierādījuma kvalitāti: QEEE — ļoti zemas kvalitātes, QQEE — zemas kvalitātes, QQQE — vidējas kvalitātes un QQQQ — augstas kvalitātes apgalvojums. Ieguvēji būs pacienti, kas aprūpēti pēc pārliecinošiem pierādījumiem.
Definīcija
Akromegālija ir hroniska un progresējoša slimība, ko izraisa somatotropā hormona (STH) hipersekrēcija. STH stimulē IGF–1 sintēzi aknās un citos audos, šā hormona hipersekrēcijas rezultātā konstatē paaugstinātu IGF–1 līmeni asinīs. Slimībai raksturīga iekšējo orgānu palielināšanās, vairākas blakusslimības, invaliditāte un agrīna mirstība. [3; 4]
Patofizioloģija
Vairāk nekā 95 % pacientu ar akromegāliju ir STH sekretējoša hipofīzes adenoma, kas attīstās no somatotropām šūnām. Adenomas šūnas pastiprināti sekretē STH un IGF–1. [5] STH sekretējošas adenomas biežāk ir blīvi vai reti granulēti somatotropie audzēji. Reti granulētie somatotropie audzēji biežāk ir gados jauniem cilvēkiem, un tie ir agresīvāki, bet blīvi granulēti audzēji ir izmēros mazāki un bioķīmiski aktīvāki. [8; 9]
Mazāk kā 5 % gadījumu somatotropas hiperplāzijas un akromegālijas iemesls ir pastiprināta STH atbrīvotājhormona sekrēcija no hipotalāma vai citas izcelsmes audzēja (piemēram, plaušās, aizkuņģa dziedzerī), kā arī ektopiska STH sekrēcija. [10] Akromegālija var būt saistīta arī ar iedzimtību, piemēram, multiplo endokrīno neoplāziju, Carney sindromu un McCune—Albright sindromu. Iespējama arī ģimenes akromegālija, kad slimības norise ir agresīvāka. [13]
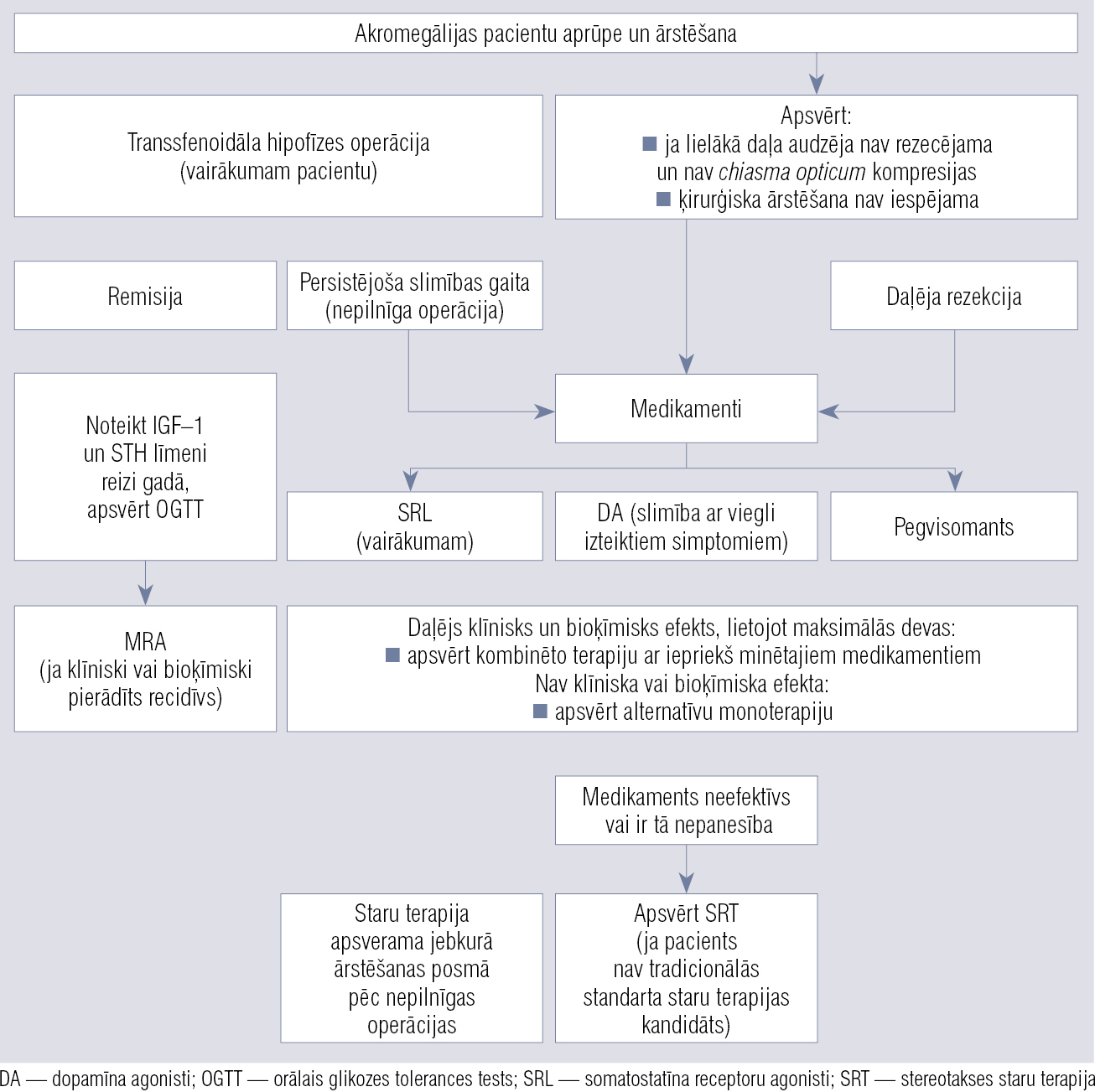

Attēls
Ārstēšanas taktikas apsvērumi pacientiem ar akromegāliju Taktika attiecināma uz pacientiem ar hipofīzes adenomu
Diagnostika
1. Rekomendē noteikt IGF–1 līmeni serumā pacientiem ar tipisku akromegālijas klīniku, it īpaši ar akromegālijai raksturīgajām pazīmēm ekstremitātēs un sejā. (1/QQQE)
2. Pacientiem bez tipiskas akromegālijas iesaka noteikt IGF–1 līmeni, ja ir vairākas no šādām blakusslimībām: miega apnojas sindroms, 2. tipa cukura diabēts (CD), invalidizējoša rakstura artrīts, karpālā kanāla sindroms, hiperhidroze un arteriālā hipertensija. (2/QQEE)
Pierādījumi
Kā sākotnējo sijājošo diagnostiku pacientiem, kam ir akromegālijas klīniskās pazīmes, rekomendē IGF–1 līmeņa noteikšanu. [14–17]Cirkulējošā IGF–1 pusizvades laiks vidēji ir 15 stundas, un serumā tas ir relatīvi stabils. [19] Normāls IGF–1 līmenis izslēdz akromegālijas diagnozi. Viltus pozitīvi rezultāti var būt grūtniecības gadījumā un vēlīnā pusaudžu vecumā. Viltus pozitīvus rezultātus, normālu vai zemu IGF–1 līmeni var konstatēt hronisku aknu un nieru slimību, hipotireozes un malnutrīcijas gadījumā, pacientiem ar smagi noritošām infekciju slimībām, nepietiekamu CD kompensāciju un perorālo estrogēnu lietošanas rezultātā. [20–22]
Paaugstināta IGF–1 līmeņa gadījumā ar vienlaikus normālu STH līmeni akromegālijas diagnozi pamato klīniskā aina. [23]
Ārstiem jāzina par akromegāliju pavadošajām slimībām (piemēram, 2. tipa CD, karpālā kanāla sindromu, invalidizējošu artrītu, arteriālo hipertensiju, miega apnojas sindromu) un jāapsver bioķīmisko un hormonālo rādītāju noteikšana, lai akromegāliju diagnosticētu agrīni. [24]
IGF–1 līmenis jāizvērtē pēc vecumam pieņemtajām normām. [25; 26] (Latvijā dažādās laboratorijās noteikšanas metodes, references intervāli un rādītāju mērvienības atšķiras!)
3. Pacientiem ar veidojumu hipofīzē, lai izslēgtu vai apstiprinātu akromegālijas diagnozi, rekomendē noteikt IGF–1. (1/QQQE)
Pierādījumi
Hipofīzes incidentalomas var sekretēt jebkuru no adenohipofīzes hormoniem. Sākotnēji STH hipersekrēcija var būt bez klīniskām pazīmēm. [28] Daļai pacientu ar maz izteiktiem slimības simptomiem var vēl nebūt diagnostiski pierādāma adenoma ar paaugstinātu IGF–1 un STH līmeni serumā. [29]
4. Rekomendē nepaļauties uz STH noteikšanu, lai diagnosticētu akromegāliju. (1/QQQE)
5. Rekomendē veikt STH supresijas testu, izmantojot orālo glikozes tolerances testu jeb OGTT pacientiem ar paaugstinātu vai šaubīgu IGF–1 līmeni. (1/QQQE)
Pierādījumi
Lai gan STH noteikšana serumā ir starptautiski standartizēta [30; 31], imūnķīmisko testu rezultātus no vienas laboratorijas nedrīkst salīdzināt ar rezultātiem no citas laboratorijas, jo tie var būtiski atšķirties. [32; 33]
Vienreiz noteikts STH līmenis serumā virs references intervāla akromegālijas diagnozi neapstiprina, bet arī neizslēdz. STH raksturīga epizodiska izdalīšanās, kas var būt virs references intervāla arī neizmainītas hipofīzes gadījumā, tāpēc diagnozes apstiprināšanai tikai STH noteikšanu neiesaka. [34] Seruma STH līmenis < 1 µg/l pēc OGTT galvenokārt izslēdz akromegālijas diagnozi. [14; 35] Pusmūžā, pacientiem ar palielinātu ķermeņa masas indeksu, sievietēm var būt saistīta ar izmainītu STH supresiju OGTT laikā. [32; 36]
Piezīmes
Seruma STH līmenis < 0,4 µg/l pēc OGTT palīdz izvērtēt akromegālijas diagnozi. [37] Lai gan pašreizējās STH noteikšanas metodes ir ar pietiekamu jutību [14; 38; 39], daudziem testiem diagnozes noteikšanā nav pietiekamas precizitātes, ja STH līmenis < 1 µg/l. STH līmenis < 1 µg/l pēc OGTT izslēdz akromegālijas diagnozi.
6. Rekomendē radioloģiskos attēldiagnostikas izmeklējumus, lai vizualizētu hipofīzes adenomas izmēru un struktūru (1/QQQQ) pēc hormonālo rādītāju analīzes. Datortomogrāfiju (DT) iesaka, ja ir kontrindikācijas vai magnētiskās rezonanses attēlveidošanas (MRA) izmeklējums nav iespējams. (2/QQEE)
Pierādījumi
Makroadenomas konstatē 77 % pacientu. [44] Lai diagnosticētu mikroadenomas, iesaka MRA ar 2 mm lieliem izmeklēšanas griezieniem jeb izmeklēšanas soli.
Piezīmes
Retākos gadījumos ar MRA izmeklējumu var diagnosticēt pacientus ar hormonāli apstiprinātu akromegāliju un neizmainītu hipofīzi. Audzējs var būt nevizualizējams ar MRA [47], tad nepieciešami citi izmeklējumi, piemēram, somatostatīna receptoru scintigrāfija (octreoscan), krūškurvja un vēdera dobuma orgānu vizualizācija, lai izvērtētu ektopiskas slimības atradi. [48]
7. Iesaka redzes lauku noteikšanu, ja radioloģiskos izmeklējumos pierādīts, ka hipofīzes adenoma ietekmē chiasma opticum. (2/QQQE)
Pierādījumi
Redzes izmaiņas redzes nerva kompresijas dēļ nosaka ārstēšanas veida izvēli un steidzamību. Retāk audzējs var iesaistīt sinus cavernosus vai izraisīt citu kraniālo nervu funkciju izmaiņas, piemēram, redzes dubultošanos, miglošanos un jušanas traucējumus sejā. [49]
Blakusslimību izpausmes un aprūpe, ar tām saistītais nāves risks
8. Visiem akromegālijas pacientiem iesaka izvērtēt saistīto blakusslimību (piemēram, tādu kardiovaskulāro slimību (KVS) kā arteriālā hipertensija, kā arī CD, osteoartrīta, miega apnojas sindroma) risku. (2/QQEE)
9. Kolonoskopiju iesaka kā zarnu jaunveidojumu sijājošo diagnostiku. (2/QQEE)
10. Ja ir palpējami vairogdziedzera mezgli, iesaka ultrasonoskopiju (USS) vairogdziedzerim. (2/QQEE)
Pierādījumi
Saslimstība un mirstība akromegālijas rezultātā ir sekas blakus struktūru kompresijai, STH un IGF–1 pārmērīgai sekrēcijai un blaknēm, kas saistītas ar ārstēšanu. [35; 50] Pacientiem ar akromegāliju mirstība ir divreiz lielāka nekā CD, arteriālās hipertensijas un citu KVS, cerebrovaskulāro, respiratoro slimību un malignitātes rezultātā. [38; 51–53]
STH hipersekrēcija palielina insulīna rezistenci, 15—38 % pacientu izraisot hiperglikēmiju un cukura diabētu. [44; 55–57]
Arteriālā hipertensija ir 33—46 % gadījumu, biežāk konstatē diastoliskā spiediena paaugstināšanos. [44; 55; 56; 58]
Lipīdu spektra analīzēs konstatē paaugstinātu triglicerīdu, lipoproteīna A un zema blīvuma lipoproteīnu holesterīna līmeni. [58; 59]
Biežāk diagnosticē sirds vārstuļu slimības, īpaši aortas un mitrālā vārstuļa regurgitāciju, kā arī aritmijas un vadīšanas traucējumus. Sirds funkcionālā stāvokļa izvērtēšana ar ehokardiogrāfiju būtu indicēta. KVS un cerebrovaskulāras slimības ir biežākais nāves cēlonis akromegālijas pacientiem.
Miega apnoju diagnosticē 69 % pacientu ar hormonāli aktīvu akromegāliju. Biežāk tā ir obstrukcija mīksto audu (piemēram, mēles, aukslēju) hipertrofijas un tūskas dēļ. [60] Normalizējoties STH un IGF–1 līmenim, uzlabojas miega apnojas sindroma klīnika, tomēr vairāk nekā 40 % pacientu ar kontrolētu akromegāliju miega apnoja ir persistējoša. [60–63]
Meta–analīzēs konstatēts, ka akromegālijas pacientiem ir palielināts resnās zarnas polipu attīstības risks. [65] Akromegālijas pacientiem iesaka veikt kolonoskopiju. Diagnosticējot akromegāliju, sākotnēji iesaka kolonoskopiju, jo vairāk nekā 19 % pacientu, kas jaunāki par 40 gadiem, salīdzinot ar kontroles grupu (4,4 % gadījumu), tika diagnosticēta resnās zarnas neoplāzija. [66]
Pēc akromegālijas ārstēšanas sākšanas pacientiem, kam konstatēti polipi un pastāvīgi paaugstināts IGF–1 līmenis, kolonoskopija ieteicama reizi piecos gados, bet tiem, kam polipi netika konstatēti un IGF–1 līmenis ir normāls, kolonoskopija jāveic ik desmit gadus. [67]
Akromegālija saistīta ar vairogdziedzera apjoma un mezglu palielināšanos. [68] Vairogdziedzera vēzis ir viens no biežākajiem audzēja veidiem pacientiem ar akromegāliju. [69]
Galvassāpes konstatē 55 % pacientu, ja audzējs ieaug galvas smadzeņu apvalkos, sinus cavernosus un ir trijzaru nerva kairinājums vai pastāvīga STH hipersekrēcija.
Pārmērīga svīšana un seboreja ir 80 % akromegālijas pacientu. [72]
Izmaiņas balsta—kustību aparātā un artropātijas konstatē bieži. Tās saistītas ar skrimšļa hipertrofiju, cīpslu vājumu un osteofītu attīstību, kam seko locītavu destrukcija. Par spīti slimības ilglaicīgai kontrolei sūdzības par locītavām saglabājas 77 % pacientu un negatīvi ietekmē viņu dzīves kvalitāti. [75] Agrīna ārstēšanas sākšana ar STH un IGF–1 kontroli nodrošina labāku rezultātu artropātiju progresijas apturēšanā, bet vēlākās slimības stadijās nepieciešama fizikāla ārstēšana, atsāpināšana un endoprotezēšana.
Akromegālijas pacientiem ir palielināts mugurkaula kompresijas lūzumu risks, lai gan kaulu minerālais blīvums atbilst pieņemtajai normai. Lūzumu risku palielina arī hipogonādisms. [76] Nepieciešama dzimumhormonu aizstājterapija. [77; 78]
Prognatisms var radīt sāpes žoklī un nepieciešamību veikt sejas un augšžokļa rekonstrukciju.
Bieži pacientiem ir perifērās neiropātijas ar jušanas traucējumiem rokās un kājās. Karpālā kanāla sindromu diagnosticē 20—40 % pacientu. [79; 80]
Zema pašnovērtējuma un ķermeņa izmaiņu dēļ pacientiem attīstās psiholoģiskas personības izmaiņas, trauksme un depresija, mainās sociālās dzīves paradumi. [81; 82]
Galvenie ārstēšanas mērķi
11. Iesaka noteikt IGF–1 līmeni, piemērojot vecumam atbilstīgo references intervālu, kas atspoguļo akromegālijas norises kontroli. (2/QQEE)
12. Ārstēšanas mērķis ir STH līmenis < 1 µg/l, jo tas korelē ar slimības aktivitāti. (2/QEEE)
13. Iesaka visas ārstēšanas laikā izmantot vienu un to pašu STH un IGF–1 noteikšanas metodi katram pacientam individuāli. (2/QQEE)
Pierādījumi
Tā kā slimības gaita ir mainīga, ārstēšanas stratēģijai jābūt individualizētai. Ārstēšanas mērķi ir sasniegt hormonālo rādītāju normu, mazināt mirstības risku un simptomu izteiktību, audzēja lieluma/masas kontrole un hipofīzes normālas funkcijas uzturēšana.
IGF–1 ir labāks blakusslimību prognozes marķieris nekā STH OGTT laikā. [88; 89] Mērķa STH ir < 1 µg/l un normāls IGF–1 līmenis. Abi korelē ar nāves riska samazināšanos. [90; 92]. Katram pacientam visā ārstēšanās laikā jāsasniedz mērķa STH (< 1 µg/l) un normālas IGF–1 rādītāju vērtības slimības gaitā. [32; 33; 93]
Ķirurģiska ārstēšana
Indikācijas
14. Kā pirmo izvēles metodi vairākumam pacientu rekomendē transsfenoidālu pieeju. (1/QQQE)
Pierādījums
Izvēles ķirurģiskā pieeja ir transsfenoidāla, izmantojot operācijas mikroskopu vai endoskopu kopā ar mikroķirurģijas tehniku. [94; 95]
Pēc operācijās strauji pazeminās STH līmenis, audus iespējams izvērtēt histoloģiski un imūnohistoķīmiski. [98; 99] Tāpēc ķirurģisku operāciju rekomendē kā pirmās izvēles terapiju vairākumam pacientu. [100; 101]
Histoloģiska audu izmeklēšana dod iespēju audzēju iedalīt kategorijās, ņemot vērā proliferācijas marķieri (Ki–67 indekss), cietā smadzeņu apvalka invāziju, granulācijas pakāpi, atipisku šūnu esību. [105–107]
Ķirurģiskas ārstēšanas rezultāti
Pēc mikroskopiskas vai endoskopiskas transsfenoidālas hipofīzes operācijas, ko veicis pieredzējis neiroķirurgs, sākotnēja remisija konstatēta > 85 % pacientu ar mikroadenomu un 40—50 % pacientu ar makroadenomu. [94; 95; 108]
15. Intrasellāras adenomas atlieku audu gadījumā pēc sākotnējās operācijas iesaka atkārtotu ķirurģisku iejaukšanos. (2/QQEE)
Pierādījumi
Neefektīvas ķirurģiskas ārstēšanas gadījumā atkārtota operācija var būt lietderīga, ja audzējs ir rezecējams (piemēram, nav audzēja invāzijas kavernozajos sinusos).
Medikācija pirms operācijas
16. Pirmsoperācijas periodā pacientiem ar izteiktu rīkles mīksto audu hipertrofiju, miega apnojas sindromu vai sirds mazspēju ar saglabātu kreisā kambara funkciju iesaka terapiju ar SRL. (2/QEEE)
Pierādījumi
Ir palielināts anestēzijas komplikāciju risks, piemēram, intubācijas grūtības un aizkavēta ekstubācija balsenes un rīkles mīksto audu un balssaišu tūskas dēļ. [115; 116] Ārstēšana ar SRL var strauji mazināt mīksto audu tūsku, samazinot ar intubāciju saistīto komplikāciju risku. [117] Diagnosticējot pacientam akromegāliju, sākotnēji sirds mazspēju konstatē reti, bet ir lielāks ventrikulāro aritmiju risks. [118; 119] SRL lietošana uzlabo sirds funkciju un var uzlabot anestēzijas drošumu. [119; 120]
Daļēja adenomas ķirurģiska rezekcija
17. Pacientiem ar parasellāru adenomas izplatības veidu, lai uzlabotu medikamentozās ārstēšanas efektivitāti, iesaka daļēju adenomas rezekciju. (2/QQEE)
Pierādījumi
Ķirurģiska adenomas masas samazināšana pacientiem, kam ir makroadenoma bez lokāliem kompresijas simptomiem un kam ķirurģiska izārstēšanās ekstrasellāra veidojuma dēļ nav iespējama, var veicināt turpmākās medikamentozās terapijas, piemēram, SRL, efektu. [31; 109; 121; 122]
Medikamentoza terapija
18. Medikamentozu ārstēšanu rekomendē pacientiem, kam ķirurģiska iejaukšanās bijusi neefektīva. (1/QQQQ)
19. Adjuvantu ārstēšanu ar SRL vai pegvisomantu iesaka pacientiem ar vidēji izteiktiem vai izteiktiem simptomiem STH hipersekrēcijas rezultātā un bez lokālas simptomātikas. (2/QQEE).
20. Kā adjuvanto terapiju sākumā iesaka dopamīna agonistu (biežāk — kabergolīna) lietošanu pacientiem ar nedaudz paaugstinātu IGF–1 līmeni un maz izteiktu STH hipersekrēcijas simptomātiku. (2/QQEE)
Pierādījums
Adjuvanta medikācija nepieciešama, ja pēc operācijas saglabājas izmaiņas hormonālajos rādītājos un klīniskajā ainā. Medikamentozo terapiju lieto hormonālai kontrolei.
Somatostatīna receptoru ligandi
Ir divi vienlīdz efektīvi ilgstošas darbības SRL medikamenti: intramuskulāri (i/m) ievadāms ilgstošas darbības okteotrīds LAR (long acting releaser) un subkutāni (s/c) lietojamais lanreotīds. [128–131]
Sākuma okteotrīda LAR deva ir 20 mg/mēnesī ar devas kontroli katrus 3—6 mēnešus, devu samazinot par 10 mg/mēnesī vai palielinot līdz 40 mg/mēnesī.
Lanreotīda sākotnējā deva ir 90 mg/mēnesī ar kontroli katru mēnesi, devu samazinot līdz 60 mg/mēnesī vai palielinot līdz 120 mg/mēnesī. Lanreotīda devu var ievadīt ar 8 nedēļu intervālu samērīgi hormonālajai atbildreakcijai. [132]
Terapijas efektivitāti izvērtē pēc IGF–1 un STH serumā rādītājiem, ko nosaka 12 nedēļas pēc ārstēšanas sākšanas.
SRL atbildes noteicēji
Audu SSRT2 (Somatostatin receptor type 2) ekspresija korelē ar SRL atbildi. [133] Mazākam audzēja izmēram un zemākam STH un IGF–1 līmenim ir lielāka prognozes nozīme atbildreakcijā uz medikāciju. [134; 135] Pēc histoloģiskas izmeklēšanas datiem blīvi granulēta adenoma labāk reaģēs uz ārstēšanu ar SRL nekā irdeni granulēta adenoma. [8; 9]
Hipointensīvas T2 lieluma adenomas MRA attēlos, kas korelē ar blīvi granulētu audzēju, pierāda labāku SRL efektivitāti. [46]
SRL ietekme
Ārstējoties ar SRL, bieži mazinās artralģijas, hiperhidroze, mīksto audu tūska un galvassāpes [137]. SRL 59 % pacientu audzēja masu samazina par 50 % un vairāk. [143] Tas korelē ar hormonālo aktivitāti. [143] Terapijas efektivitāti var uzlabot ārstēšana ar lielākām devām (piemēram, okteotrīds LAR > 60 mg/mēnesī un lanreotīds autogels > 180 mg/mēnesī). [144]
Blaknes
Zarnu kolikas, vēdera pūšanās un caureja ir raksturīgas blaknes ārstēšanas sākumā. Turpinot SRL lietošanu, šo medikamentu izraisītas blaknes mazinās. Injekcijas vietā iespējams ādas kairinājums un sāpes. Retāk konstatē matu izkrišanu un alopēciju. Tā kā SRL nomāc insulīna, glikagona un STH sekrēciju, glikozes kontrole parasti uzlabojas, tomēr retākos gadījumos var arī pasliktināties. [146]
21. USS vēdera dobuma orgāniem ikdienas praksē neiesaka pacientiem, kuri lieto SRL, lai kontrolētu žultsakmeņu slimību. (2/QQEE)
Pierādījums
Žultsakmeņus un nogulsnes žultspūslī konstatē aptuveni 25 % pacientu, bet lielākajā daļā gadījumu slimība norit asimptomātiski. Tikai 4 % pacientu ar žultsakmeņu slimību holestāze tiek apstiprināta bioķīmiski. [147] Tā kā simptomātiskas žultsakmeņu slimības gadījumi ir reti, veikt kontroles USS nav nepieciešams. Žultsakmeņu obstrukcija var attīstīties arī pēc SRL lietošanas pārtraukšanas. [148]
Pegvisomants
Pegvisomants ir STH receptoru antagonists, kas nomāc IGF–1 produkciju. [150–152] Pegvisomantu ievada s/c injekciju veidā 10—15—20 mg devā. Pētījumos pierādīts, ka IGF–1 normalizējas 95 % pacientu, kam ievada vismaz 40 mg pegvisomanta dienā. [156] Pegvisomantu lietojot līdztekus SRL, efektu iespējams sa-sniegt, to ievadot 1—2 reizes nedēļā. [157] Pegvisomanta iedarbības kontrolei izmanto IGF–1 rādītāja noteikšanu, nevis STH noteikšanu, jo hormona hipersekrēcija, lietojot medikamentu, turpinās. Lietderīga ir pegvisomanta lietošana pacientiem ar CD, jo medikaments nodrošina glikēmijas kontroli. [158]
Blaknes
Injekcijas vietā lokālu reakciju konstatēja 2,2 % pacientu, un tās bija saistītas ar lokālu diskomfortu, atgriezenisku lipohipertrofiju vai lipoatrofiju. [163]
22. Aknu transamināžu līmeni iesaka kontrolēt reizi mēnesī pirmo pusgadu, pēc tam ik 6 mēnešus pacientiem, kam ievada pegvisomantu. Iesaka apsvērt ārstēšanas pārtraukšanu, ja aknu transamināžu līmenis vairāk nekā trīs reizes pārsniedz references intervāla augšējo robežu. (2/QQEE)
Pierādījumi
Dopamīna agonisti
Meta–analīzēs pierādīts, ka, lietojot kabergolīnu, aptuveni 30 % pacientu sasniedz hormonālo kontroli. [167] Kabergolīns ir piemērots pacientiem ar nedaudz paaugstinātu STH un IGF–1 līmeni un ar vienlaicīgu hiperprolaktinēmiju vai bez tās. [168] Lai gan kabergolīns sākotnēji ir efektīvs, ar laiku efektivitāte mazinās. Pētījumā 2004. gadā pierādīts, ka pēc 18 mēnešiem tikai 21 % pacientu sasniedz slimības kontroli. [169]
Konstatētās blaknes bija šādas: gastrointestināli traucējumi, deguna gļotādas tūska, nogurums, ortostāze un galvassāpes. [170]
Kombinēta ārstēšana
Kombinējot medikamentus, iespējams uzlabot terapijas efektu, samazināt blaknes, kas saistītas ar konkrēto medikamentu. Lietojot vairākus medikamentus, injekcijas veicamas retāk un medikamentu deva ir mazāka.
23. Ja ārstēšana ar SRL nav efektīva, iesaka pievienot pegvisomantu vai kabergolīnu. (2/QQEE)
Pierādījumi
SRL kopā ar pegvisomantu
Pētījumos par pacientiem, kam slimība bija daļēji kontrolēta, lai gan viņi lietoja lielas SRL devas, pegvisomanta pievienošana [157; 173; 174] ar vidējo devu 60 mg vienu reizi nedēļā (20—200 mg/ned., 1—2 inj./ned.) IGF–1 līmeni normalizēja 95 % pacientu. Uzlabojās arī adenomas izmēra kontrole. Aknu enzīmu līmeņa paaugstināšanos konstatēja 27 % pacientu, kam pegvisomantu ievadīja līdztekus SRL lietošanai. [172]
SRL kopā ar kabergolīnu
Kombinējot šos medikamentus, IGF–1 līmenis normalizējās 42—60 % pacientu. Pacientiem, kas SRL lietoja monoterapijā un kam netika sasniegts STH līmenis < 2,5 µg/l, pēc kabergolīna pievienošanas 21—71 % gadījumu tika sasniegta remisija. [167; 175]
Pegvisomants kopā ar kabergolīnu
Pētījumā par 24 akromegālijas pacientiem kabergolīns, lietojot 0,5 mg katru dienu, normalizēja IGF–1 līmeni 11 % pacientu, bet, pievienojot pegvisomantu 10 mg/dienā, IGF–1 līmenis normalizējās 68 %. Pārtraucot lietot kabergolīnu, IGF–1 kontrole saglabājās tikai 26 % pacientu. [176]
24. Iesaka ārstēšanu ar SRL, ja ķirurģiska iejaukšanās nav iespējama vai ja ir plaša sinus cavernosus invāzija, nav chiasma opticum kompresijas, vai ja pacientiem operācija kontrindicēta blakusslimību dēļ. (2/QQQE)
Pierādījumi
Papildu medikācija pēc ķirurģiskas iejaukšanās bieži nepieciešama pacientiem ar makroadenomu un ekstrasellāru veidojumu bez kompresijas simptomiem. Kā pirmās izvēles medikamentus lietojot SRL, hormonālā kontrole tiek panākta > 70 % pacientu. [146] Adenomas masas samazināšanās par 50 % tika konstatēta 59 % pacientu pēc terapijas ar SRL sākšanas. [178] Primāra medikamentoza ārstēšana ar SRL piemērota pacientiem, kam ir ekstrasellāra adenoma, kas invadē sinus cavernosus un ko nevar evakuēt ķirurģiski.
Staru terapija un stereotakses staru terapija
25. Ja medikamentoza ārstēšana nav iespējama vai ir neveiksmīga, iesaka staru terapiju (RT — radiation therapy). (2/QQEE)
26. Ja ir atbilstīga tehnika, atlikušā audzēja izmērs ir neliels vai lokalizējas pārāk tuvu chiasma opticum, iesaka stereotakses staru terapiju (SRT — stereotactic radiation therapy), nevis RT. (2/QQEE)
27. Pēc medikamentu atcelšanas, lai izvērtētu RT efektivitāti, STH un IGF–1 līmeni rekomendē noteikt reizi gadā. (1/QQQE)
Pierādījums
RT parasti ir adjuvanta terapija pacientiem, kam slimības gaita pēc ķirurģiskas un medikamentozas ārstēšanas ir nekontrolējama, bet nav ieteicama kā primārā ārstēšanas metode. [3; 5; 179] Pēc staru terapijas var sasniegt hormonālo kontroli, tādējādi mazinot nepieciešamību pēc medikamentozas terapijas. [5; 180] Pēc RT rekomendē periodisku medikamentozās terapijas atcelšanu 1—3 mēnešos (tas atkarīgs no konkrēta medikamenta), lai izvērtētu STH un IGF–1 līmeni. Pēc SRT pacientiem, ko apsekoja vairāk nekā 15 gadus, remisiju konstatēja 10—60 % gadījumu. [183–186]
28. Lai izslēgtu hipopituitārismu vai citas ar RT saistītas sekas, hormonu līmeni rekomendē noteikt reizi gadā pēc RT. (1/QQQQ)
Pierādījumi
Hipopituitārismu 5—10 gadu laikā konstatē > 50 % pacientu, un pacientu skaits ar hipopituitārismu ar laiku palielinās. [182; 188–190] Hipopituitārismu vienādi bieži diagnosticē pēc SRT un pēc RT. [190–192]
Pēc RT palielinās cerebrovaskulāro slimību risks. [44] Komplikācijas pēc RT pacientiem ar hipofīzes audzēju ir radiācijas izraisīts kraniālo nervu bojājums, sekundārs audzējs, radionekroze un kognitīvas izmaiņas. [193–197] Radionekroze ir reta SRT komplikācija. [198] Pētījumos nav konstatēts pamatojums atcelt SRL lietošanu staru terapijas laikā. [183; 199; 200]
PILNS VADLĪNIJU APRAKSTS PIEEJAMS ŠEIT: http://ejuz.lv/683