Pasaules Veselības organizācijas dati liecina, ka cukura diabēts kopā ar onkoloģiskām, kardiovaskulārām un hroniskam elpceļu slimībām pieder četru “nekomunicējamo” jeb hronisko slimību grupai, kuru pieaugošā izplatība un ar tām saistītās komplikācijas ir aktuāls jautājums 21. gadsimta sabiedrības veselības aprūpē, jo šīs slimības ir iemesls 65 % nāves cēloņu.
Raksturojums
Epidemioloģija
Pēc Starptautiskās Diabēta asociācijas pētījuma datiem, kurš norisinājās 1990.—2016. gadā, 20—79 gadu vecumgrupā diagnosticētā cukura diabēta gadījumu skaits bija 425 miljoni, kas ir par 281 % lielāks, nekā prognozēja 2000. gadā; publicēts IDF Diabetes Atlas ziņojums.
2045. gadā cukura diabēta sastopamība pieaugs līdz 629 miljoniem gadījumu. Šie skaitļi atspoguļo tikai daļu problēmas — lai gan veselības aprūpe attīstās un uzlabojas, gandrīz pusei (49,7 %) pieaugušo (18—99 gadu vecumā), kuri dzīvo ar cukura diabētu, 2017. gadā šī slimība nebija diagnosticēta, t.i., vairāk nekā 224 miljoniem! Turpinās pieaugt arī glikozes panesības traucējumu un gestācijas cukura diabēta gadījumu skaits.
Definīcija
Diabētiska nefropātija ir hroniska nieru slimība (HNS), kas attīstās cukura diabēta izraisīto mikrovaskulāro komplikāciju dēļ, tā ir viens no biežākajiem terminālas nieru mazspējas izraisītājiem kā attīstītajās, tā attīstības valstīs.
Ieskats patofizioloģijā
Vienam indivīdam diabētiskas nefropātijas attīstības ātrumu un secīgi HNS progresu nosaka vairāku faktoru mijiedarbība: cukura diabēta slimības ilgums, nepietiekama glikēmijas kontrole, dislipidēmijas stāvoklis, paaugstināts asinsspiediens, smēķēšana, pārmērīga nesteroīdo pretiekaisuma līdzekļu lietošana. Lielāko daļu no šiem faktoriem cilvēks var ietekmēt, mainot savus paradumus un dzīvesveidu.
Diabētiskas nefropātijas patoģenēze ir sarežģīts process, kas veidojas metabolisko un hemodinamisko faktoru mijiedarbībā. Ilgstoša hiperglikēmijas stāvokļa ietekmē notiek strukturālas un funkcionālas izmaiņas nierēs. Ilgstoša hiperglikēmija samazina nātrija koncentrāciju pie macula densa → tiek bloķēta atgriezeniskā tubuloglomerulārā saite → palielinās pievadošās arteriolas vazodilatācija un glomerulu filtrācijas apjoms. Hiperglikēmijas rezultātā uzkrājās glikolīzes galaprodukti, piemērām, sorbīts, kas tieši toksiski iedarbojas pret šūnām, bet osmotiskais efekts ir iemesls audu tūskai. Tā kā nierēs nav pietiekami daudz sorbīta dehidrogenāzes enzīma, tas akumulējas un izraisa audu bojājumu. Attīstās augšanas faktoru ekspresijas novirze, palielinās reaktīvā skābekļa molekulu daudzums un veidojas brīvie radikāļi, izraisot oksidatīvu stresu un secīgi epitēlija bojājumu.
Zināmi dati par to, ka dislipidēmija (paaugstināts kopējā holesterīna, triglicerīdu, ZBLH līmenis) ir asociēta ar cukura diabēta makrovaskulārām komplikācijām. Diētas kļūdas, lietojot produktus ar augstu tauku saturu, agravē dislipidēmijas stāvokli un ir riska faktors renālai lipīdu intracelulārai akumulācijai. Diēta ar augstu olbaltumvielu saturu pasliktina nieru funkciju, palielinot intrakapilāro spiedienu glomerulos, tādējādi negatīvi ietekmējot hiperfiltrāciju, kas, savukārt, pastiprina albuminūriju. D vitamīnam ir nieru audus aizsargājošas īpašības, tā trūkuma dēļ nieru bojājums var progresēt.
Patohistoloģiskās atrades
Vēsturiski diabētiska nefropātija zināma kā Kimmelstiel—Wilson sindroms pēc vācu patologanatoma Paula Kimmelštīla un angļu terapeita Kloforda Vilsona aprakstītajām patognomiskām izmaiņām nierēs, t.i., hialīna mezgliņiem kapilāru kamoliņos. Veselam indivīdam katrā nierē ir 750 000—1,5 miljoni nefronu. Slimībai ritot dabisko gaitu, nieru izmērs un svars pieaug vidēji par 15 % no izejas rādītājiem, tādiem paliekot brīdī, kad neatgriezeniski pasliktinās nieru funkcija. Izmaiņas vēro diabētiskas nefropātijas pirmajā attīstības stadijā, kad nieru darbība pastiprinās. Paralēli par 10—15 % palielinās filtrācijas apjoms. Šīs izmaiņas konstatē, atklājot cukura diabētu.
Nefropātijas stadijas
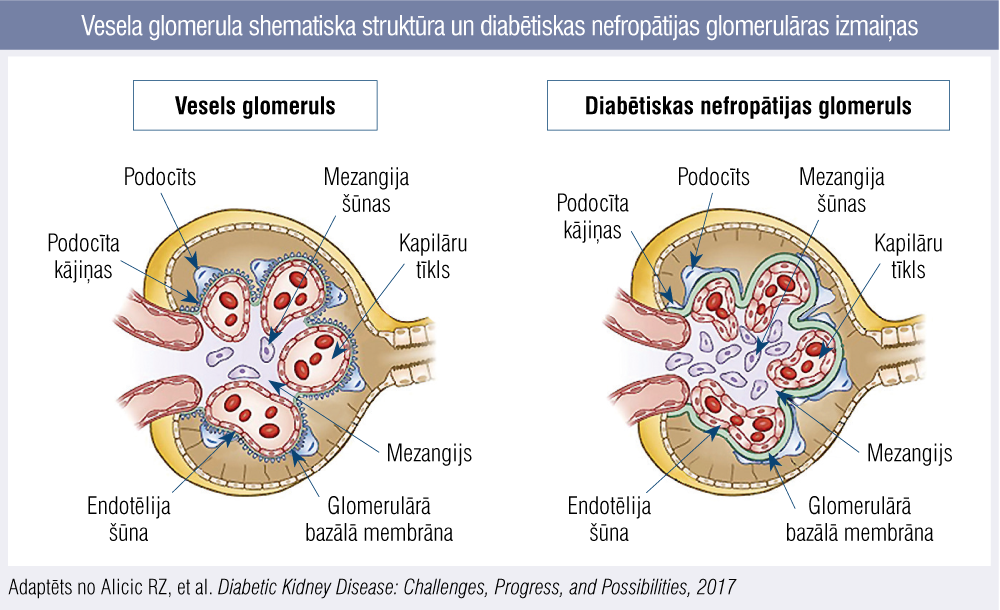

Attēls
Vesela glomerula shematiska struktūra un diabētiskas nefropātijas glomerulāras izmaiņas
Glomerulārās filtrācijas barjera sastāv no fenestrēta endotēlija, glomerulāras bazālas membrānas un podocītu kājiņām, kopā strādājot kā vienots bioloģiskais siets (attēls). Otrai diabētiskas nefropātijas attīstības stadijai raksturīga bazālās membrānas sabiezēšanās un mezangija proliferācija. Paaugstinātais intraglomerulārās filtrācijas spiediens kā barotrauma izraisa podocītu bojājumu. Otrā diabētiskas nefropātijas stadija attīstās pirmajos piecos slimības gados. Abas stadijas (pirmā un otrā) norit asimptomātiski, dažiem indivīdiem tādas strukturālas izmaiņas var saglabāties ilgāku laiku, jo nieru strukturālās izmaiņas nekorelē ar klīnisko ainu. Atsevišķos gadījumos var pievienoties paaugstināts asinsspiediens. Gan pirmajā, gan otrajā diabētiskas nefropātijas stadijā albumīns urīnā izdalās niecīgā daudzumā, ko nevar noteikt ar rutīnā veiktu teststrēmeles (strip) testu. Sākumā GFĀ mazinās par 0,5—1 ml/min./1,73 m2 ik gadu, bet, slimībai progresējot, GFĀ krītas par 5—10 ml/min./1,73 m2. Trešajai stadijai raksturīga mikroalbuminūrija, kas laika gaitā progresē līdz ceturtajai diabētiskas nefropātijas stadijai, t.i., smagai albuminūrijai, ir neatgriezeniski samazināts GFĀ un izteikta arteriālā hipertensija. Trešā diabētiskas nefropātijas stadija attīstās 6.—15. slimības gadā. Stāvoklis, kad cukura diabēta slimniekam nepieciešama nieru aizstājterapija, ir diabētiskas nefropātijas piektā attīstības stadija. HNS V jeb terminālu nieru mazspēju diagnosticē 50 % cukura diabēta slimnieku un 25.—30. slimības gadā (1. tabula).
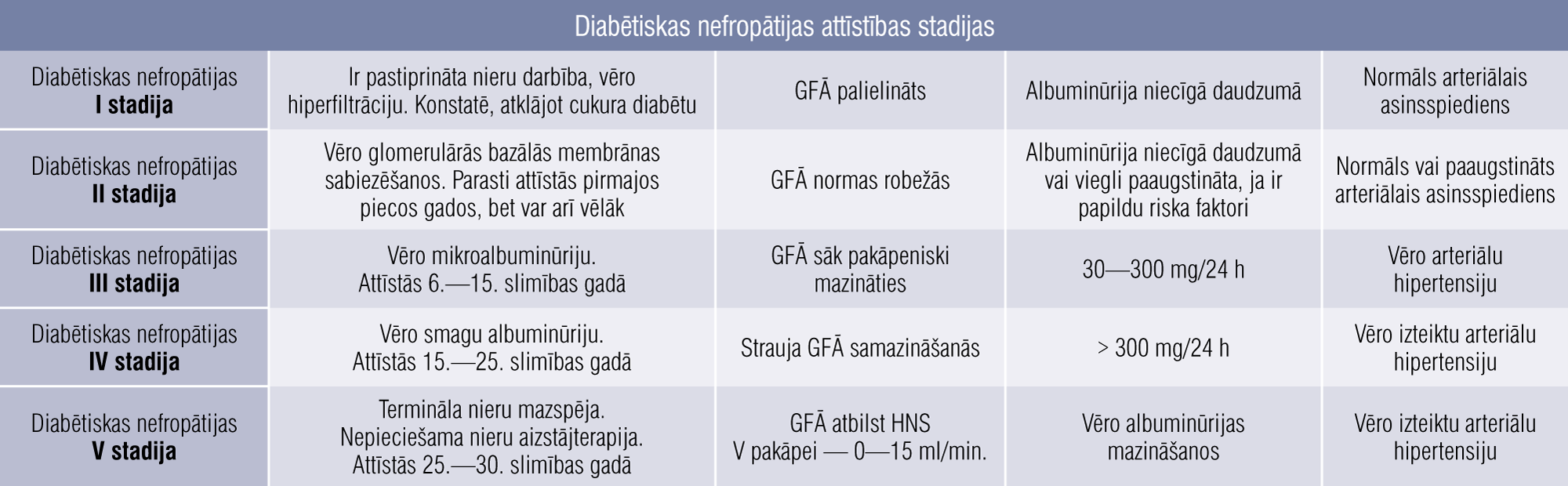

1. tabula
Diabētiskas nefropātijas attīstības stadijas
Svarīgi zināt!
Jāatceras, ka nieru bojājumu var izraisīt savstarpēji nesaistītas slimības. Gadījumos, kad nieru funkcija pasliktinās negaidīti strauji, klīniski persistē smagas norises nefrotisks sindroms un parādās nefrītiskam sindromam raksturīgs urīna sediments un medikamentozi slikti kontrolējama arteriālā hipertensija, nieru bojājums jādiferencē no, piemēram, multiplās mielomas, saistaudu sistēmiskām slimībām, ātri progresējošiem glomerulonefrītiem.
Diagnostika
Diabētiska nefropātija definēta kā persistējoša albuminūrija (albumīna/kreatinīna attiecība urīnā > 30 mg/g, kas atbilst > 30 mg/24 h) un/vai glomerulu filtrācijas ātruma (GFĀ) kritums zem 60 ml/min./1,73 m2.
Diabētiskas nefropātijas sijājošā diagnostika reizi gadā jānodrošina pacientiem ar 2. tipa cukura diabētu uzreiz pēc diagnozes apstiprināšanas, bet pacientiem ar 1. tipa cukura diabētu reizi gadā pēc 5 gadiem kopš diabēta diagnosticēšanas. Izvēles tests albuminūrijas noteikšanai ir albumīna/kreatinīna attiecība vienā urīna paraugā, vēlams rīta porcijā. Jāņem vērā, ka albuminūrija pacientam ar cukura diabētu var attīstīties arī citu iemeslu dēļ. Potenciāli ar cukura diabētu nesaistīti albuminūrijas iemesli ir liela fiziska slodze, urīnceļu infekcija, mens-truācijas, febrilitāte, dekompensēta sastrēguma sirds mazspēja, akūta smaga hiperglikēmija, hipertensīvā krīze. GFĀ iesaka aprēķināt ar speciālām pētījumos pamatotām formulām (MDRD, CKD—EPI), kurās parasti iekļauts kreatinīna līmenis serumā, pacienta vecums, dzimums un rase. Lai apstiprinātu diabētiskas nefropātijas diagnozi, albuminūrija vai pazemināts GFĀ ir jāpierāda vismaz divos mērījumos ar trīs mēnešu intervālu.
Kad GFĀ pazeminās zem 60 ml/min./1,73 m2, pacientam var pievienoties arī hroniskas nieru slimības (HNS) izraisītas komplikācijas. Anēmija ir gandrīz visiem pacientiem ar GFĀ zem 30 ml/min., taču diabētiskas nefropātijas gadījumā tā var attīstīties agrāk. Turklāt, progresējot hroniskai nieru slimībai, pacientiem attīstās kaulu un minerālu vielmaiņas traucējumi, metaboliska acidoze, elektrolītu izmaiņas, var pasliktināties arteriālās hipertensijas kontrole un pievienoties šķidruma pārslodzes simptomi. Lai šos sarežģījumus diagnosticētu laikus, asinsspiedienu un hidratācijas stāvokli iesaka izvērtēt katrā vizītē, bet laboratorijas testus veikt reizi 6—12 mēnešos pacientiem ar GFĀ 60—30 ml/min./1,73 m2 (HNS III), reizi 3—5 mēnešos pacientiem ar GFĀ 30—15 ml/min./1,73 m2 (HNS IV) un reizi 1—3 mēnešos, ja ir HNS V ar GFĀ zem 15 ml/min./1,73 m2.
Kad jādodas pie nefrologa?
Nefrologa konsultācija nepieciešama pacientiem ar HNS IV (GFĀ < 30 ml/min./1,73 m2), lai pacientu laikus gatavotu nieru aizstājterapijai, pacientiem ar pierādītiem HNS izraisītiem sarežģījumiem vai gadījumos, kad ir aizdomas par alternatīvas etioloģijas (2. tabula) nieru mazspēju pacientam ar cukura diabētu.


2. tabula
Pacients ar cukura diabētu un nieru mazspēju. Kad jādomā par alternatīvu diagnozi?
Ārstēšana
Diabētiskas nefropātijas ārstēšanas pamatmērķis ir terminālas nieru mazspējas attīstības novēršana un kardiovaskulāro risku mazināšana. Terapijas pamatā ir savlaicīga cukura diabēta komplikāciju atpazīšana un šādi principi: dzīvesveida korekcija, glikēmijas un asinsspiediena kontrole, albuminūrijas/proteinūrijas mazināšana. Ārstēšana efektīvāka, ja tiek sākta agrīni slimības gaitā.
Dzīvesveida un diētas korekcija
- Sāls uzņemšanu uzturā samazināt līdz 2—3 gramiem diennaktī.
- Ja ir hiperkaliēmijas risks, piemēram, lietojot RAS blokatorus, tad uzturā jāierobežo ar kāliju bagātu produktu lietošana.
- Olbaltumvielu uzņemšanu uzturā samazināt līdz 0,8 g/kg/diennaktī (ne–dialīzes pacientiem).
- Smēķēšanas atmešana, jo ir pierādīts, ka smēķēšana saistīta ar lielāku risku diabētiskas nefropātijas attīstībai un ātrāku tās progresu.
- Ķermeņa masas mazināšana pacientiem ar lieko svaru.
Glikēmijas kontrole
ASV cukura diabēta asociācijas rekomendācijās un KDOQI vadlīnijās teikts, ka glikozētā hemoglobīna (HbA1c) mērķis jāpielāgo katram pacientam individuāli. Pētījumu dati rāda, ka lielākajai daļai pieaugušo pacientu HBA1c mērķis ir < 7 %. Striktāka glikēmijas kontrole ar HbA1c mērķi < 6,5 % var būt attaisnota jaunākiem pacientiem ar īsāku cukura diabēta ilgumu anamnēzē, pacientiem bez cukura diabētam raksturīgajām komplikācijām un pacientiem ar ilgāku paredzēto dzīvildzi. Savukārt HbA1c mērķis < 8 % var būt piemērots pacientiem ar ilgāku cukura diabēta gaitu, pacientiem ar smagām hipoglikēmijām anamnēzē, pacientiem ar īsāku paredzēto dzīvildzi un pacientiem ar nozīmīgām mikrovaskulārām vai makrovaskulārām komplikācijām. Jāņem vērā, ka HbA1c līmenis var būt viltus zemāks pacientiem ar hroniskas nieru slimības izraisītu anēmiju, īpaši tiem, kam intravenozi ievada dzelzs preparātus un eritropoetīnu.
Medikamentozās terapijas iespējas
Pacientiem ar GFĀ zem 60 ml/min./1,73 m2 var būt nepieciešama medikamentu devas korekcija atbilstīgi nieru funkcijai. Jāņem vērā, ka 30—45 % insulīna metabolizējas un izvadās caur nierēm, tāpēc, pasliktinoties nieru funkcijai, insulīna iedarbība ir ilgāka un pacientiem ir lielāks hipoglikēmijas risks. Pacientiem ar 2. tipa cukura diabētu jāapsver SGLT–2 inhibitoru vai GLP–1 receptoru agonistu lietošana, jo šīm medikamentu grupām ir pierādīta pozitīva ietekme uz HNS progresēšanu un kardiovaskulāriem notikumiem. Metformīna lietošanas principi apkopoti 3. tabulā.


3. tabula
Metformīna lietošana pacientiem ar HNS
Asinsspiediena kontrole un RAS blokāde
Adekvāta antihipertensīvā terapija mazina kardiovaskulāro mirstību un aizkavē HNS progresēšanu. Eiropas Kardioloģijas asociācijas vadlīnijās norādīts, ka mērķa sistoliskais asinsspiediens pacientiem ar cukura diabētu un HNS ir zem 130—139 mmHg, bet ASV Diabēta asociācija pacientiem ar diabētisku nefropātiju rekomendē sasniegt mērķa asinsspiedienu zem 140/90 mmHg. Renīna—angiotensīna sistēmas (RAS) blokatora kombināciju ar kalcija kanālu blokatoriem vai tiazīdu grupas diurētiķiem var izmantot kā sākuma terapiju pacientam ar cukura diabēta izraisītu HNS un arteriālu hipertensiju.
RAS blokatori (angiotensīnu konvertējošā enzīma inhibitori (AKEI jeb “prili”) vai angiotensīna receptoru blokatori (ARB jeb “sartāni”)) ir visefektīvākie albuminūrijas mazināšanā, salīdzinot ar citiem antihipertensīvajiem līdzekļiem, tāpēc tiek rekomendēti pacientiem ar arteriālu hipertensiju un albuminūriju.
Vairākos pētījumos pierādīta šīs medikamentu grupas kardioprotektīvā, renoprotektīvā iedarbība, kā arī pozitīva ietekme uz kardiovaskulāriem notikumiem, tāpēc RAS blokatoru lietošana indicēta arī normotensīviem cukura diabēta pacientiem ar albuminūriju. Taču RAS blokatoru profilaktisku lietošanu cukura diabēta pacientiem bez arteriālas hipertensijas un bez albuminūrijas neiesaka, jo pētījumos pierādīts, ka diabētiskas nefropātijas attīstības risku tādiem pacientiem tie nemazina.
AKEI un ARB kombinācija pacientiem ar HNS nav rekomendēta tāpēc, ka ir liels risks hiperkaliēmijas, akūtas nieru mazspējas un kardiovaskulāru notikumu attīstībai, turklāt pētījumu dati rāda, ka tāda kombinācija nemazina terminālas nieru mazspējas attīstības biežumu.
Dislipidēmijas kontrole
Dislipidēmijas korekcija rekomendēta ar statīniem vai statīna/ezetimiba kombināciju. Statīnu lietošanas sākšana ir pamatota ne–dialīzes pacientiem ar HNS, taču pēc dialīzes sākšanas statīnu lietošanu sākt nav rekomendēts, jo nav pierādīta efekta uz kardiovaskulāru notikumu mazināšanu.