Hiperglikēmija ir biežs stāvoklis sievietēm grūtniecības laikā. IDF dati liecina, ka viena no sešu dzīvi dzimušu (16,8 %) bērnu mātei grūtniecības laikā bijusi hiperglikēmija. Retāk (16 %) hiperglikēmija saistīta ar cukura diabētu (CD) grūtniecības laikā, bet biežāk (84 %) — ar gestācijas cukura diabētu (GCD).
Saīsinājumi
ACOG — The American Congress of Obstetricians and Gynecologists ADA — American Diabetes Association CD — cukura diabēts FIGO — International Federation of Gynecology and Obstetrics g — grams GCD — gestācijas cukura diabēts GD — glikozes 1–dehidrogenāze GI — glikēmiskais indekss GK — glikokināze GO — glikozes oksidāze GTT — glikozes tolerances tests HbA1c — glikētais hemoglobīns HK — heksokināze IADPSG — International Association of the Diabetes and Pregnancy Study Groups IDF — International Diabetes Federation i/u — intrauterīni KVS — kardiovaskulārās slimības ĶMI — ķermeņa masas indekss LGV — liels gestācijas vecumam ned. — nedēļa OR — odds ratio OGTT — perorālais glikozes tolerances tests PCOS — policistisko olnīcu sindroms PVO — Pasaules Veselības organizācija RKP — randomizēts, kontrolēts pētījums st. — stundas
Gestācijas cukura diabēta izplatība korelē ar glikozes tolerances pārmaiņu, aptaukošanās un 2. tipa CD izplatību populācijā, tāpēc palielinās ar veselības aprūpi saistītais slogs. Pirmreizēji CD vai prediabētu diagnosticē gados arvien jaunākām pacientēm, vienlaikus sieviešu reproduktīvais vecums palielinās. Pieaug sieviešu skaits reproduktīvajā vecumā ar virssvaru vai aptaukošanos, arvien vairāk sievietēm jau pirms grūtniecības ir hiperglikēmijas riska faktori. GCD saistīts ar biežāku mātes saslimstību, piemēram, dzemdību traumām, hipertensīviem stāvokļiem grūtniecības laikā, palielinātu 2. tipa CD, KVS risku. Palielinās arī perinatālā un neonatālā saslimstība. Bērniem, kuru mātei bijusi hiperglikēmija grūtniecības laikā, ir lielāks aptaukošanās un CD risks vēlāk dzīvē. Lielākajā daļā zemu un vidēju ienākumu līmeņa valstu, kur ik gadu notiek 85 % no dzemdībām pasaulē kopumā, vairākumam sieviešu grūtniecības laikā netiek veikta vai tiek veikta nepilnīga CD sijājošā diagnostika.
Grūtnieces hiperglikēmijas profilaksei, diagnostikai un aprūpei jāvelta lielāka uzmanība. Lai gan nav šaubu par GCD nelabvēlīgu ietekmi uz mātes un bērna veselību, speciālisti joprojām diskutē, kāds ir labākais šīs problēmas risinājums.
FIGO izstrādājusi vadlīnijas ar mērķi:
- pievērst uzmanību hiperglikēmijas saistībai ar nelabvēlīgiem grūtniecības iznākumiem mātei un auglim, kā arī mātes un bērna veselības riskiem nākotnē un izveidot plānu šo jautājumu risināšanai,
- izveidot vienotas vadlīnijas, kas palīdzēs GCD diagnostikā, ārstēšanā un aprūpē, un veicināt to izmantojumu klīniskajā praksē.
Lai gan kvalitatīvu pierādījumu pieejamība ir ierobežota, vadlīnijas sniedz viegli īstenojamas rekomendācijas. Lai risinātu jautājumus par GCD, FIGO kā svarīgākos izvirza vairākus faktorus.
- Sabiedrības veselības uzmanība.Ilgtspējīgu attīstības mērķu programmājāvelta lielāka uzmanība GCD, tā saistībai ar mātes un bērna veselību. Par prioritāti jāizvirza sabiedrības veselību veicinoši pasākumi, lai palielinātu reproduktīvā vecuma sieviešu informētību un pieejamību konsultācijām pirms ieņemšanas, prenatālai un postnatālai aprūpei.
- Universāla diagnostika.Hiperglikēmijas sijājošā diagnostika, izmantojot viena soļa pieeju, jāveic visām grūtniecēm. Veselības aprūpes organizācijām jāveicina šīs stratēģijas ieviešana.
- Diagnostiskie kritēriji. Jāizmanto PVO diagnostiskie kritēriji 1. tipa un 2. tipa CD noteikšanai grūtniecības laikā, PVO un IADPSG GCD diagnostiskie kritēriji.
- GCD diagnostika. Diagnozi pamato ar pareizi paņemta, transportēta un pārbaudīta venozā seruma vai plazmas parauga testēšanas rezultātiem. Lai gan ar plazmas kalibrētu glikometru iegūtie rezultāti ir mazāk precīzi kā laboratoriski iegūtie, glikometru izmantošana GCD noteikšanai ir pieļaujama, ja testēšana laboratorijā nav iespējama. [1; 2]
- GCD aprūpe. Aprūpei jābūt atkarīgai no resursiem un infrastruktūras valstī. Jelkāda aprūpe uzskatāma par labāku pieeju nekā aprūpes neesība.
- Dzīvesveida pārmaiņas. Pirmās izvēles līdzekļi GCD aprūpē ir uztura terapija un fiziskās aktivitātes. Sievietēm ar GCD jāsaņem konsultācijas par veselīgu dzīvesveidu, uzsverot tā nozīmi ne tikai grūtniecībā, bet arī pēc tās ar mērķi mazināt aptaukošanās, 2. tipa CD un KVS risku.
- Farmakoloģiskā terapija. Ja ar uztura terapijas un fizisko aktivitāšu palīdzību nav iespējams sasniegt mērķa glikēmijas rādītājus, metformīns, glibenklamīds vai insulīns ir apsverams kā drošs un efektīvs GCD farmakoterapijas līdzeklis.
- Aprūpe pēc dzemdībām. Apsekojot GCD pacientes grūtniecības laikā un pēcdzemdību periodā, nodrošināma mātes un bērna atbilstīga veselības aprūpe. Ginekologiem un dzemdību speciālistiem jāsadarbojas ar ģimenes ārstiem, internistiem, pediatriem un citiem veselības aprūpes speciālistiem, lai veicinātu pēcdzemdību aprūpes programmu.
- Turpmākie pētījumi. Nepieciešami ar pierādījumiem pamatoti atklājumi un starptautiska sadarbība pētniecības jomā, lai nodrošinātu labākas diagnostikas un aprūpes iespējas grūtniecēm ar GCD.
Pierādījumu kvalitāte un rekomendāciju ticamības pakāpe
Pierādījumu kvalitāte un rekomendāciju ticamības pakāpe vadlīnijās novērtēta pēc Grading of Recommendations, Assessment, Development and Evaluation terminoloģijas. Ar “1” apzīmēts pārliecinošs ieteikums (“rekomendējam”), ar “2” — vājš ieteikums (“iesakām”). Ar “Q” apzīmē pierādījuma kvalitāti: QEEE — ļoti zemas kvalitātes, QQEE — zemas kvalitātes, QQQE — vidējas kvalitātes un QQQQ — augstas kvalitātes apgalvojums.
Katram ieteikumam norādīta ticamības pakāpe (pārliecinošs vai vājš), ņemot vērā pierādījumu kvalitāti, izmantotos resursus, līdzsvaru starp riskiem un ieguvumiem, izmaksu un resursu sadali.
Gestācijas cukura diabēts: definīcija, epidemioloģija, patofizioloģija
Lai gan ilgtermiņa pētījumu, publikāciju un starptautisku konferenču bijis daudz, hiperglikēmijas grūtniecības laikā un GCD klasifikācija un diagnostiskie kritēriji joprojām ir diskutējami. [3]
Hiperglikēmijas klasifikācija grūtniecības laikā un GCD definīcija
Iepriekš pieņemtā hiperglikēmijas un GCD definīcija bija “jebkuras pakāpes glikozes tolerances traucējumi, kas pirmo reizi izpaužas vai tiek noteikti grūtniecības laikā”. Šī definīcija ietvēra arī pacientes ar neidentificētu CD pirms grūtniecības un neizcēla robežu starp slimībām, kas saistās ar CD grūtniecības laikā un GCD. GCD definīcija vēl aizvien tiek pilnveidota. Hiperglikēmija, kas pirmo reizi noteikta jebkurā grūtniecības periodā, klasificējama kā CD grūtniecības laikā vai GCD.
Tā kā GCD izpaužas vēlākā grūtniecības laikā un tam raksturīga mazāk izteikta hiperglikēmija, tā ir relatīvi vieglāka hiperglikēmijas forma, salīdzinot ar CD grūtniecības laikā. Tomēr jāņem vērā, ka GCD ciešāk korelē ar palielinātu risku nelabvēlīgiem grūtniecības iznākumiem, CD un KVS nākotnē, tāpēc nepieciešama atbilstīga aprūpe. [4; 5; 6; 7; 8]
CD grūtniecības laikā
CD grūtniecības laikā ir 1. tipa vai 2. tipa CD, kas diagnosticēts pirms grūtniecības vai pirmo reizi diagnosticēts grūtniecības laikā (1. attēls).
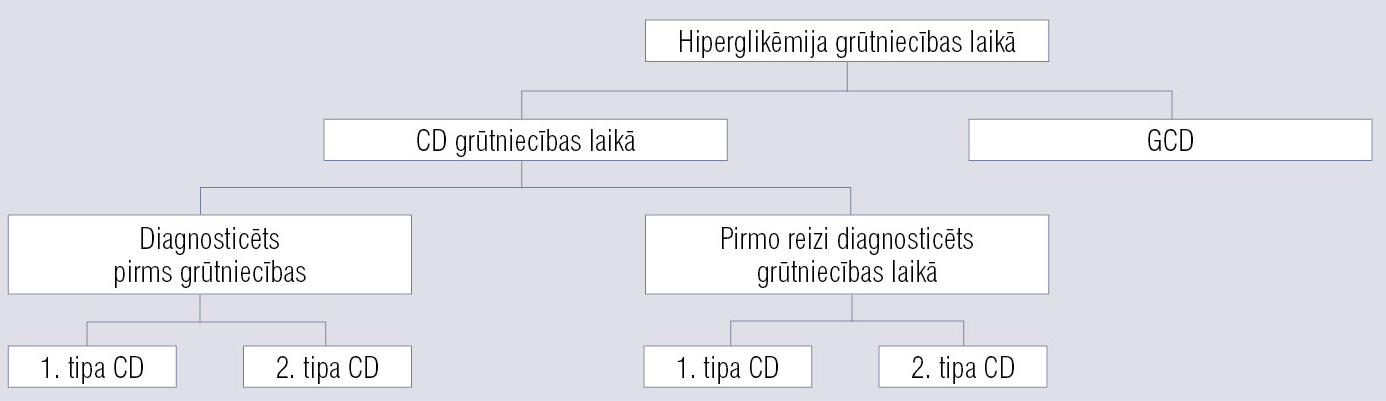

1. attēls
Hiperglikēmijas veidi grūtniecības laikā
Neatkarīgi no hiperglikēmijas izteiktības, ja tā ir jau ieņemšanas brīdī un embrioģenēzes periodā, palielinās grūtniecības komplikāciju risks. Grūtniecei ar nediagnosticētu CD var būt līdz tam vēl nenoteiktas CD komplikācijas, piemēram, diabētiska retinopātija, diabētiska nefropātija, kas ievērojami palielina ar grūtniecību saistītos riskus. Hiperglikēmija organoģenēzes periodā palielina spontāna aborta un iedzimtu augļa anomāliju risku. CD var būt cēlonis augļa augšanas izmaiņām un makrosomijai, kas, savukārt, attīstās līdz tādām komplikācijām kā plecu distocija, neonatāla hipoglikēmija vai neiroloģiski bojājumi. Iespējama mikrovaskulāru komplikāciju (piemēram, diabētiskās retinopātijas, diabētiskās nefropātijas) attīstība grūtniecības laikā. Šo iemeslu dēļ nepieciešama precīza glikēmijas kontrole pirms plānotās grūtniecības un tās laikā.
2. tipa CD diagnosticē arvien jaunākām sievietēm, daudzām pacientēm ar iepriekš diagnosticētu 2. tipa CD iestājas grūtniecība, bieži vien 2. tipa CD pirmo reizi nosaka tikai grūtnieču sijājošās diagnostikas laikā. Sievietēm, kam ir nozīmīgs CD risks, metaboliskais stress grūtniecības laikā veicina CD attīstību (2. attēls).


2. attēls
CD grūtniecības laikā un GCD salīdzinājums
Glikēmijas līmenis, kas pirmo reizi noteikts jebkurā grūtniecības periodā un atbilst CD diagnostiskajiem kritērijiem (glikozes līmenis plazmā tukšā dūšā ≥ 7,0 mmol/l un/vai 2 st. pēc 75 g OGTT vērtība ≥ 11,1 mmol/l, un/vai nejauši konstatēts glikozes līmenis plazmā ≥ 11,1 mmol/l un vienlaicīgi CD simptomi), tiek definēts kā CD grūtniecības laikā. Biežāk grūtniecības laikā diagnosticē 2. tipa CD, retāk — 1. tipa CD. CD grūtniecības laikā pretstatā GCD atbilstīgas sijājošās diagnostikas programmas gadījumā iespējams diagnosticēt jau pirmajā trimestrī. [6]
GCD
Hiperglikēmija grūtniecības laikā (visbiežāk noteikta 24.—28. gestācijas nedēļā), kas neatbilst CD grūtniecības laikā kritērijiem, tiek definēta kā GCD. GCD diagnostiskie kritēriji aprakstīti vadlīniju turpinājumā.
GCD epidemioloģija
Hiperglikēmija ir biežs stāvoklis sievietēm grūtniecības laikā. GCD izplatība korelē ar glikozes tolerances pārmaiņu, aptaukošanās un 2. tipa CD izplatību populācijā, tādējādi palielinās ar veselības aprūpi saistītais slogs. Jāņem vērā, ka pirmreizēji CD vai prediabētu (pēc PVO — robežhiperglikēmiju) diagnosticē gados arvien jaunākām pacientēm, sieviešu reproduktīvais vecums palielinās, pieaug sieviešu skaits reproduktīvajā vecumā ar virssvaru vai aptaukošanos. Arvien vairāk sievietēm jau pirms grūtniecības ir riska faktori, kas nosaka lielāku hiperglikēmijas risku grūtniecības laikā.
Pasaules GCD izplatības rādītāji liecina par plašām etniskām variācijām un heterogenitāti dažādās populācijās. GCD izplatība variē no 1 % līdz 28 %. IDF dati — vienai no sešu dzīvi dzimušu (16,8 %) bērnu mātei grūtniecības laikā bija kādas pakāpes hiperglikēmija. Retāk (16 %) hiperglikēmija saistīta ar CD grūtniecības laikā, biežāk (84 %) — ar GCD. [7; 8; 9; 10; 11; 12]
GCD riska faktori
GCD riska faktori ir etniskā piederība un mātes vecums, multiparitāte, virssvars un aptaukošanās, pārmērīgs ķermeņa masas pieaugums iepriekšējā grūtniecībā, īss augums, PCOS, CD pirmās pakāpes radiniekiem, nelabvēlīgs grūtniecības iznākums anamnēzē (aborts, priekšlaicīgas dzemdības), makrosomija iepriekšējā un/vai šajā grūtniecībā, GCD iepriekšējā grūtniecībā, preeklampsija un daudzaugļu grūtniecība. Klīniskajā praksē vairāk nekā pusei sieviešu ar GCD ir viens vai vairāki riska faktori, kas pamato GCD sijājošās diagnostikas nepieciešamību visām grūtniecēm. [13; 14; 15; 16; 17]
Ar GCD saistītās mātes un augļa slimības un stāvokļi
GCD ir saistīts ar biežāku mātes saslimstību, piemēram, dzemdību traumām, hipertensīviem stāvokļiem grūtniecības laikā (preeklampsiju), un palielinātu 2. tipa CD risku. Palielinās arī perinatālā un neonatālā saslimstība (makrosomija, plecu distocija, dzemdību traumas, neonatāla hipoglikēmija, policitēmija un hiperbilirubinēmija). Bērnam, kas i/u pakļauts mātes hiperglikēmijai, ir lielāks aptaukošanās un CD risks. [18; 19; 20; 21; 22; 23; 24; 25; 26] Apkopojums par GCD ietekmi uz māti un augli parādīts 1. tabulā.


1. tabula
Ar GCD saistītās mātes un augļa slimības un stāvokļi
Patofizioloģija
Grūtniecība saistīta ar daudzām izmaiņām mātes metaboliskajā sistēmā. Šo izmaiņu uzdevums ir nodrošināt pilnvērtīgu augļa augšanu un attīstību no ieņemšanas brīža līdz dzemdībām. Grūtniecības laikā, lai nodrošinātu adekvātu barības vielu piegādi auglim, mijiedarbojas hormoni un metaboliskie mediatori, kas ietekmē mātes ogļhidrātu, lipīdu un aminoskābju vielmaiņu, veicina insulīna rezistenci.
Pieaugošas insulīna rezistences rezultātā mātes insulīna sekrēcija palielinās un asinīs tiek nodrošināts normāls glikozes līmenis. Grūtniecībai progresējot, insulīna rezistence palielinās un stabilizējas līdz 24. gestācijas nedēļai. Insulīna rezistencei pārsniedzot aizkuņģa dziedzera insulīna sekrēcijas kapacitāti, attīstās hiperglikēmija. Tādējādi, ja sievietei pirms grūtniecības ir insulīna rezistences riska faktori (virssvars, aptaukošanās, pārmērīgs ķermeņa masas pieaugums grūtniecības laikā, PCOS, glikozes tolerances pārmaiņas, metaboliskais sindroms) vai samazināta spēja producēt insulīnu (īss augums), ir lielāks risks GCD attīstībai.
Ietekme uz augli
I/u vides pārmaiņas rada izmaiņas auglī epiģenētiskā līmenī, kas rada sekas tālāk dzīvē. Šo fenomenu sauc par attīstības programmēšanu. Arvien palielinās pierādījumu skaits, kas atbalsta hipotēzi, ka GCD ietekmē dažādu augļa audu, orgānu un orgānu sistēmu attīstību, radot nepilnvērtīgu organisma funkcionēšanu pieaugušo vecumā. Visjutīgākās ir augļa nervu šūnas, adipocīti, muskuļšūnas un aizkuņģa dziedzera bēta šūnas. Mātes hiperglikēmija rada augļa hiperglikēmiju, kas rezultējas augļa hiperinsulinēmijā.
Saskaņā ar Freinkel hipotēzi, izmainīti mātes metabolīti i/u modificē jauni veidojušos šūnu fenotipu, kas nosaka pastāvīgu īstermiņa vai ilgtermiņa ietekmi uz bērnu. Izmainīto metabolītu ekspozīcijas laika (embrija vai augļa periods) ietekmē attīstās dažādas sekas. Pirmajā trimestrī var attīstīties i/u augšanas traucējumi un orgānu malformācijas. Otrā trimestra laikā, kad notiek centrālās nervu sistēmas attīstība un diferencēšanās, var attīstīties uzvedības, intelektuālas un psiholoģiskas izmaiņas. Trešajā trimestrī izmainīta augļa adipocītu un muskuļšūnu proliferācija, aizkuņģa dziedzera bēta šūnu un neiroendokrīno šūnu hiperplāzija var radīt virssvaru, arteriālu hipertensiju un 2. tipa CD. [27; 28; 29; 30] Patofizioloģiskie augļa komplikāciju attīstības mehānismi hiperglikēmijas rezultātā atainoti 3. attēlā.
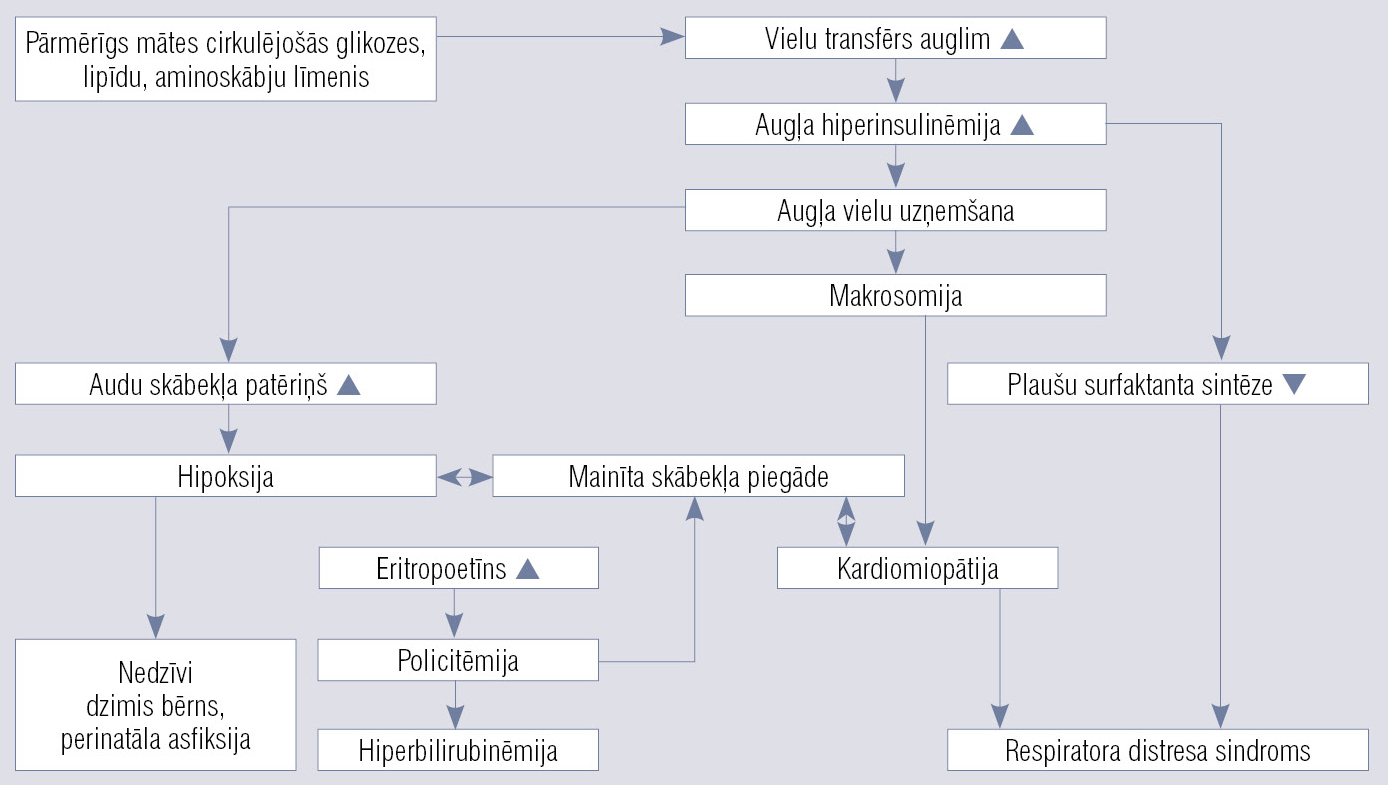

3. attēls
Patofizioloģiskie augļa komplikāciju attīstības mehānismi hiperglikēmijas rezultātā
Ietekme uz māti
Līdz 1921. gadam, kad Banting un Best atklāja insulīnu, tikai nelielam skaitam pacienšu ar CD iestājās grūtniecība, vēl mazākai daļai grūtniecība noritēja veiksmīgi. Tobrīd aptuveni 50 % no šīm sievietēm mira grūtniecības laikā dažādu CD komplikāciju (galvenokārt ketoacidozes) rezultātā, aptuveni 50 % gadījumu bija traucēta augļu attīstība. Pacientēm ar GCD ievērojami biežāk grūtniecības iznākums bija neveiksmīgs. CD komplikācijas un palielināts vaskulāras disfunkcijas risks bija pamats ievērojami lielākiem mātes saslimstības un mirstības rādītājiem. Turklāt hiperglikēmija, kas pirmo reizi atklāta grūtniecības laikā, tika saistīta ar palielinātu risku CD un KVS attīstībai nākotnē.
Mūsdienās ir daudzas metodes (augļa sirdsdarbības kontrole, ultrasonogrāfija, glikozes līmeņa paškontrole, insulīna pumpji), ar kuru palīdzību uzlabojusies CD diagnostika, ārstēšana un aprūpe.
Klīnicisti atzīst, ka agrīnai diagnostikai, adekvātai ārstēšanai un ciešai pacientu pārraudzībai ir liela nozīme, lai mazinātu GCD komplikāciju biežumu un grūtniecības iznākums būtu veiksmīgs.
Lielākajā daļā zemu un vidēju ienākumu līmeņa valstu, kur ik gadu notiek 85 % no dzemdībām pasaulē kopumā, vairākumam sieviešu grūtniecības laikā netiek veikta vai tiek veikta nepilnīga CD sijājošā diagnostika. Jāņem vērā, ka šīs valstis ir atbildīgas par 80 % no pasaules CD sloga, kā arī 90 % no visiem mātes un perinatālās mirstības un nelabvēlīgu grūtniecības iznākumu gadījumiem. [27; 28; 29; 30; 31; 32; 33; 34; 35]
Ilgtspējīgu attīstības mērķu programmā lielāka uzmanība jāvelta mātes veselības saistībai ar neinfekciju slimībām.
Gestācijas cukura diabēta diagnostika
Problēma — atšķirīgi kritēriji
Veselības aprūpes organizācijas pasaulē iesaka atšķirīgus GCD sijājošās diagnostikas un diagnostikas algoritmus. Diemžēl speciālisti pat vienas valsts robežās izmanto dažādus protokolus un robežvērtības GCD sijājošajā diagnostikā un diagnostikā. Lai atrisinātu šo problēmu, GCD diagnostisko kritēriju ieviešanai nepieciešama vienota pieeja, līdzsvarojot riskus un ieguvumus sociālajā, ekonomiskajā un klīniskajā kontekstā.
IADPSG eksperti 2010. gadā vienprātīgi noteica glikēmijas slieksni tukšā dūšā, kā arī 1 st. un 2 st. pēc 75 g OGTT. Izvēloties izredžu koeficientu (jeb odds ratio) 1,75 trim būtiskākajām GCD radītajām komplikācijām — auglis LGV, augļa adipozitāte un augļa hiperinsulinēmija, tika noteikti jauni GCD diagnostiskie kritēriji samērīgi glikēmijai pēc 75 g OGTT. Šie kritēriji ir pasaulē atzīti un apstiprināti PVO un ADA.
Tomēr tādi rādītāji kā auglis LGV un augļa adipozitāte nav atkarīgi tikai no mātes glikēmijas līmeņa. Piemēram, izmantojot 2 st. OGTT robežvērtību 8,5 mmol/l, kas noteikta pēc IADPSG, lai identificētu sievietes, kuru auglim ir risks būt LGV, ir mazāk efektīva, salīdzinot ar 2 st. OGTT robežvērtība, kam OR samazināts līdz 1,5 (atbilst iepriekš pieņemtajam PVO 2 st. testa kritērijam ar robežvērtību 7,8 mmol/l).
Lai gan sliekšņa vērtības atšķiras, dažādu profesionālo organizāciju vienota viedokļa trūkums ir lielākā problēma GCD sijājošās diagnostikas un diagnostikas algoritma izveidei. Joprojām tiek diskutēts par pilnvērtīgu GCD sijājošās diagnostikas un diagnostikas protokolu. [36; 37; 38; 39; 40; 41; 42; 43; 44]
Universāla vai selektīva sijājošā diagnostika
Selektīvu sijājošo diagnostiku, ko pamato sievietes GCD riska faktori, izmanto populācijās ar zemu GCD riska līmeni, uzskatot, ka visu grūtnieču testēšana nav izmaksu efektīva. GCD diagnostiku pēc GCD riska faktoriem biežāk izmanto Eiropā. Riska faktori: vecums, ĶMI, etniskā piederība, daudzūdeņainība, makrosomija (iepriekšējā vai šajā grūtniecībā), GCD anamnēzē, iepriekšējā grūtniecībā nedzīvi dzimis bērns, 2. tipa CD pirmās pakāpes radiniekiem, PCOS. Lai arī algoritmos izmanto dažādas riska faktoru variācijas, to diagnostiskais jutīgums un specifiskums saglabājas niecīgs. Pamatproblēma sijājošās diagnostikas programmā, ko pamato riska faktori, ir nepieciešamība pēc sarežģītiem testēšanas protokoliem, tāpēc pasliktinās pacienšu un veselības aprūpes darbinieku līdzestība.
Ņemot vērā selektīvās sijājošās GCD diagnostikas mazo specifiskumu un faktu, ka hiperglikēmija grūtniecēm ir bieži, universālai sijājošās diagnostikas programmai ir priekšrocības.
Universālo diagnostikas modeli FIGO stingri rekomendē attīstības valstīs, kur diagnosticē 90 % no visiem GCD gadījumiem un kur GCD riska faktoru identificēšana ir apgrūtināta.
2010. gadā IADPSG ierosināja un 2014. gadā ADA un IDF atbalstīja universālo GCD sijājošo diagnostiku, izmantojot viena soļa algoritmu ar 75 g OGTT. Lai arī ir pieņemts vienots universāls algoritms GCD diagnostikai, tomēr joprojām testa protokoli dažādās valstīs atšķiras.
Izmantojot universālo GCD sijājošo diagnostiku un veicot glikozes tolerances testu visām grūtniecēm, kopējās izmaksas var samazināt, ja tukšas dūšas GTT rezultātus izmanto, lai lemtu par pilna GTT nepieciešamību. Situācijās, kad nav iespējams tukšas dūšas GTT, var izmantot viena soļa testu ar 75 g 2 st. OGTT. [45; 46; 47; 48; 49; 50; 51; 52]
FIGO vadlīnijas izveidotas ar mērķi dažādām organizācijām pieņemt un veicināt vienotu pieeju GCD sijājošai diagnostikai un diagnostikai.
FIGO pieņem un atbalsta IADPSG/PVO/IDF nostāju, ka visām grūtniecēm piemērojama hiperglikēmijas viena soļa sijājošās diagnostikas stratēģija.
FIGO vadlīnijas mudina visas valstis pieņemt un veicināt vienotu pieeju universālas GCD sijājošās diagnostikas īstenošanai.
Diagnostiskie kritēriji
Cukura diabēts grūtniecības laikā
Diagnozi “CD grūtniecības laikā”, kā definēts PVO kritērijos, pamato vismaz viens no šiem rezultātiem rutīnas testēšanas laikā jebkurā grūtniecības periodā:
- glikozes līmenis plazmā tukšā dūšā ≥ 7,0 mmol/l;
- glikozes līmenis plazmā 2 st. pēc 75 g OGTT ≥ 11,1 mmol/l;
- nejauši noteikts plazmas glikozes līmenis ≥ 11,1 mmol/l vienlaikus ar CD simptomiem.
Kā vēl vienu svarīgu diagnostisko kritēriju ADA rekomendē HbA1c (≥ 6,5 %), kas apstiprināts atkārtotā noteikšanā. [43]
Gestācijas cukura diabēts
Pēc IADPSG (2010.) un PVO (2013.) ieteikumiem GCD diagnozes apstiprināšanai izmantojama viena soļa stratēģija ar 75 g OGTT, kad tiek fiksēts vismaz viens no šiem rezultātiem rutīnas testā (to rekomendē 24.—28. gestācijas nedēļā vai jebkurā grūtniecības periodā):
- glikozes līmenis plazmā tukšā dūšā 5,1—6,9 mmol/l,
- glikozes līmenis plazmā 1 st. pēc 75 g OGTT ≥ 10 mmol/l,
- glikozes līmenis plazmā 2 st. pēc 75 g OGTT 8,5—11,0 mmol/l.
FIGO atbalsta PVO (2013.) CD grūtniecības laikā diagnostiskos kritērijus, PVO (2013.) un IADPSG (2010.) GCD diagnostiskos kritērijus.
Glikozes līmeņa noteikšana
Tehniski apsvērumi laboratorijā un mājas apstākļos
Glikozes līmeni nosaka asins serumā vai plazmā, vai pilnasinīs. Mūsdienās glikozes mērījumus biežāk veic no asins seruma vai plazmas parauga. Glikozes koncentrācija pilnasinīs ir vidēji par 15 % mazāka nekā serumā vai plazmā. Serumam un plazmai jābūt atdzesētai un atdalītai no šūnām pietiekami ātri, lai novērstu šūnu frakcijas ietekmi uz glikozes metabolismu. Seruma paraugam pirms analizēšanas jāsarec, bet tas ievērojami paildzina testa veikšanu. Tā kā plazmas testēšanai nepieciešams īsāks laiks, glikozes noteikšana plazmā kļuvusi par “zelta standartu”. Analizējot plazmu, eritrocītus no plazmas ātri atdala centrifugējot. Ja paraugu neapstrādā centrifūgā, glikozes līmenis plazmā pazeminās par apmēram 0,56 mmol/l st. glikozes patēriņa dēļ sarkano asins šūnu glikolītiskajā ceļā.
Nātrija fluorīdu agrāk bieži izmantoja kā asiņu antikoagulantu un konservantu, īpaši gadījumos, kad analīžu veikšanu atlika. Nesenā pētījumā pierādīts, ka citrāta buferšķīdums efektīvāk par fluorīdu nomāc glikolīzi in vitro. Pēdējā laikā citrāta buferšķīdumu uzskata par efektīvu glikolīzes inhibitoru. Vidējā glikozes koncentrācija paraugos samazinās tikai par 0,3 % 2 stundās un par 1,2 % pēc 24 st., kad asinis glabātas 37 °C temperatūrā stobriņos, kas satur citrāta buferšķīdumu, nātrija fluorīdu un etilēndiamīntetraetiķskābi. Plazma, kas iegūta no fluorīda stobriņos glabātām asinīm, bija nederīga citu parametru laboratoriskai diagnostikai.
Arteriālajās, kapilārajās un venozajās asinīs glikozes līmenis atšķiras. Koncentrācijas atšķirības nosaka glikozes izdalīšanās audos, perfūzija, oksigenācija, pH un temperatūra. Vidēji arteriālo asiņu glikozes koncentrācija pie normāla parciālā skābekļa spiediena ir par 0,28 mmol/l lielāka nekā kapilārā koncentrācija un par 0,56 mmol/l lielāka nekā venozā koncentrācija. Glikozes mērījumā ar glikometru mājas apstākļos testē kapilārās asinis, bet mērījumos laboratorijā izmanto venozo asiņu plazmu.
Glikozes līmeni nosaka pēc enzimātiskām reakcijām ar vienu no četriem fermentiem: GO, GD, GK vai HK. GK vai HK metodes tiek uzskatītas par precīzākām, salīdzinot ar GO noteikšanu. GO vai GD biežāk izmanto mājās lietotajos glikometros, bet GK un HK ir pamatmetodes laboratorijās.
Atšķirības glikozes mērījumos ietekmē reaģentu kvalitāte, materiālu savākšanas un uzglabāšanas metode, izmantotais tests. [68; 69; 71; 72]
Laboratoriskā testēšana
Tā kā glikēmijas rezultātiem ir liela nozīme, pieņemot medicīniskus lēmumus, tikai akreditētās laboratorijās var noteikt šos rezultātus. Par kvalitātes specifikāciju liecina dokumenti no akreditācijas struktūrām, piemēram, College of American Pathologists vai International Organization for Standards 15189.
Katrai laboratorijai rūpīgi jādokumentē:
- reproducējamība, ik dienu sekojot kvalitātes kontrolei un ik mēnesi aprēķinot variācijas koeficientu (coefficient of variation %),
- precizitāte, veicot kvalifikācijas pārbaudes vai salīdzinot rezultātus ar akreditētu laboratoriju. Kad minimālās reproducējamības prasības ir nodrošinātas ar optimālu laboratorijas darbību, iespējams uzlabot precizitāti. [70]
FIGO ieteikums: katrai laboratorijai jādokumentē sākotnējais kvalitātes līmenis un tas jāuzlabo neatkarīgi no resursiem.
Hiperglikēmijas kontrole grūtniecības laikā
Mātes un augļa komplikācijas korelē ar grūtnieces hiperglikēmijas kontroles pakāpi. GCD terapijas primārais mērķis ir sasniegt mātes un bērna iznākumu iespējami tuvāku normāli noritošas grūtniecības iznākumam, optimāli kontrolējot mātes hiperglikēmiju.
FIGO rekomendācijās teikts, ka CD pārvaldībai grūtniecības laikā jānotiek saskaņā ar resursiem un infrastruktūru valstī. Aprūpe pat bez pierādījumiem par izcilu kvalitāti uzskatāma par labāku alternatīvu vājai aprūpei vai tās trūkumam.
Pirmsdzemdību pārraudzība
Šobrīd nav pieņemts vienots prenatālās aprūpes protokols pacientēm ar CD. ACOG ieteikumi apkopoti 2. tabulā.


2. tabula
Rekomendācijas pirmsdzemdību pārraudzībai pacientei ar GCD
Augļa ultrasonogrāfisks novērtējums
Ultrasonogrāfiski kontrolējot augļa augšanu i/u, kļūdu iespējamība ir ± 15 %. Augļa makrosomija ir biežākā CD komplikācija, tāpēc īpaša uzmanība jāvelta savlaicīgai makrosomijas diagnostikai. Rekomendācijas augļa augšanas novērtējumam apkopotas 3. tabulā.


3. tabula
Rekomendācijas augļa augšanas novērtējumam pacientēm ar GCD
Augļa labsajūtas novērtējums
Lai novērtētu augļa labsajūtu, var izmantot augļa kustību skaitīšanu, biofizikālo profilu un nestresa testu. Trūkst kvalitatīvu pierādījumu, kas atbalstītu kādu konkrētu algoritmu, tomēr uzskata, ka, regulāri novērtējot augļa labsajūtu, biežāk iespējama grūtniecības pilna laika saglabāšana. [73] Rekomendācijas augļa labsajūtas novērtējumam apkopotas 4. tabulā.


4. tabula
Rekomendācijas augļa labsajūtas novērtēšanai sievietei ar GCD
Dzemdību termiņš un veids
Mātes hiperglikēmija un augļa makrosomija saistīta ar palielinātu risku augļa i/u nāvei un citiem nelabvēlīgiem grūtniecības iznākumiem. Jāapsver dzemdību indukcija 38.—39. grūtniecības nedēļā, tomēr šim ieteikumam trūkst kvalitatīvu pierādījumu. Dažas vadlīnijas rekomendē grūtniecību turpināt līdz 40.—41. nedēļai, ja vien glikēmijas kontrole grūtniecības laikā bijusi laba un aprēķinātais augļa svars to pieļauj. Ņemot vērā ievērojami palielināto risku plecu distocijai, ja paredzamais augļa svars ir lielāks par 3750 g, pacientei ar CD apsverama plānveida ķeizargrieziena operācija. Ja aprēķinātais augļa svars ir virs 4000 g, rekomendē plānveida ķeizargrieziena operāciju (4. attēls). [74; 75; 76; 77; 78; 79; 80; 81; 82] Ieteikumi dzemdību laika un veida plānošanai pacientei ar GCD apkopoti 5. tabulā.
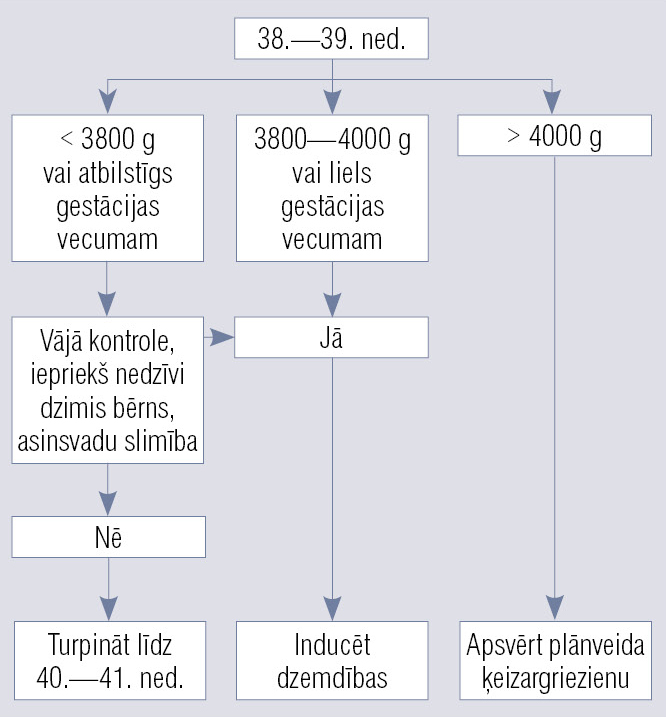

4. attēls
Algoritms dzemdību laika un veida plānošanā pacientei ar GCD un CD grūtniecības laikā


5. tabula
Rekomendācijas dzemdību laika un veida plānošanai pacientei ar GCD
Glikozes līmeņa noteikšana
Asiņu glikozes līmeņa kontroli var novērtēt pēc viena no trim parametriem: HbA1C noteikšana, asiņu glikozes paškontrole vai nepārtraukta glikozes līmeņa kontrole.
HbA1C
HbA1C atspoguļo vidējo glikozes līmeni asinīs iepriekšējos trīs mēnešos pirms mērījuma. Rādītājs korelē ar iedzimtu malformāciju risku, bet ne ar citiem nelabvēlīgiem grūtniecības iznākumiem. To vislabāk izmantot grūtniecības plānošanas periodā un prenatālā pārraudzībā pacientei ar CD grūtniecības laikā. HbA1C neaizstāj OGTT GCD diagnostikā. Pacientēm ar GCD šo rādītāju var izmantot, lai apstiprinātu glikozes paškontroles mērījumu ticamību. [83; 84]
Glikozes līmeņa asinīs paškontrole
Glikozes līmeni kapilārajās asinīs kontrolē, rezultātu ik dienas nosakot ar glikometru. Glikozes līmeni tādējādi nosaka tikai mērījuma brīdī, neatspoguļojot hiper– un hipoglikēmiskos periodus pārējā laikā. Pētījumi pierāda glikometru lietderību stingrā glikēmiskā kontrolē, tādējādi mazinot grūtniecības komplikāciju biežumu. [85; 86; 87; 88]
Nepārtraukta glikozes līmeņa noteikšana
Ierīci nepārtrauktai glikozes līmeņa noteikšanai veido enzimātisks zemādas sensors, kas pievienots raidītājam. Tas rezultātus sūta uz uztvērēju: daudzi automatizēti nolasījumi rāda intersticiālo audu glikozes līmeni. Ierīce kalibrēta, lai atspoguļotu glikozes līmeni plazmā. Nepārtrauktie mērījumi ļauj noteikt gandrīz visas glikozes līmeņa svārstības un palīdz pielāgot pretdiabēta terapiju. Mērījumi var noteikt palielinātu postprandiālo glikozes līmeni asinīs un hipoglikēmijas nakts laikā. Tomēr nav skaidru pierādījumu par mātes vai bērna ieguvumiem, izmantojot šādu glikozes noteikšanas modeli. [89; 90; 91; 92; 93; 94; 95; 96; 97; 98]
Rekomendācijas glikozes līmeņa noteikšanai pacientēm ar GCD
Jautājums par optimālu ikdienas glikozes līmeņa mērījumu biežumu un laiku attiecībā pret maltītēm pacientēm ar GCD ir diskutējams. Trūkst RKP pierādījumu, kas atbalstītu kādu noteiktu algoritmu GCD aprūpē. Landon un kolēģu ieteikums: pacientēm glikozes līmenis jānosaka tukšā dūšā un divas st. pēc ēšanas, nenorādot, cik reizes dienā pārbaude veicama. ACHOIS pētījums rosina grūtniecēm glikozes līmeni sākotnēji noteikt četras reizes dienā, vēlāk to darīt no vienas līdz četrām reizēm ik dienas. Novērojumu pētījumos Langer ar kolēģiem noteicis, ka pacientēm glikozes līmenis jāmēra septiņas reizes dienā. National Institute for Health and Care Excellence apgalvo, ka veselības aprūpes speciālistiem vajadzētu mudināt grūtnieci biežāk noteikt glikozes līmeni: gan tukšā dūšā, gan pre– un postprandiāli. ACOG ziņo, ka “vispārējais ieteikums ir glikozes līmeņa asinīs noteikšana četras reizes dienā, to veicot tukšā dūšā, vienu vai divas st. pēc katras ēdienreizes. Līdzko ar uztura terapijas palīdzību pacientes glikozes līmenis vērtējams kā labi kontrolēts, mērījumu biežumu var samazināt.” 2015. gada pamatnostādnēs ADA rosina pre– un postprandiālu glikozes līmeņa asinīs kontroli, nenosakot konkrētu testēšanas regularitāti. [99; 100; 101] Rekomendācijas glikozes līmeņa noteikšanai sievietei ar GCD apkopotas 6. tabulā.


6. tabula
Rekomendācijas glikozes līmeņa noteikšanai sievietēm ar GCD
Raksta turpinājumu par gestācijas cukura diabēta terapiju, aprūpi pēcdzemdību periodā un konsultācijām pirms ieņemšanas lasiet Doctus 2016. gada jūnija numurā.