Latvijas Iedzīvotāju veselību ietekmējošo paradumu jaunākā pētījuma dati rāda, ka 45 % respondentu pēdējā mēneša laikā kaut reizi sūdzējušies par galvassāpēm. Biežākā galvassāpju slimība, kas saistīta ar īslaicīgu darbnespēju, ir migrēna. Tā ir neiroloģiska slimība, kuru tās biežās sastopamības dēļ plaši pēta un kuras ārstēšanai mūsdienās ir radītas speciālas zāles.
Līdz šim nav veikti specifiski pētījumi, kas precizētu migrēnas sastopamību Latvijā, taču pasaulē migrēnas sastopamības rādītājs ir 12—15 %, bet 2017. gadā Rastenyte et al publicētajā populācijas pētījumā Lietuvā migrēna bija 18 % aptaujāto. Drīzumā ceram arī Latvijā apzināt migrēnas izplatību un radīto sociālo slogu.
Migrēnas etioloģija un patoģenēze
Migrēna ir daudzfaktoru slimība — nav iespējams pateikt vienu iemeslu, kas to izraisa. Patofizioloģiskie mehānismi migrēnas lēkmes un starplēkmju periodā saistīti ar dažādām perifērās nervu sistēmas un CNS daļām gan garozā, gan smadzeņu stumbrā, trīszaru nerva ganglijā un tā sensoriskajās nervu šķiedrās, kas iesniedzas smadzeņu apvalkā un veido ciešu sistēmu ar meningeālajiem asinsvadiem, t.s. trigeminovaskulāro sistēmu. Migrēnas lēkmes gadījumā izdalās dažādi neirotransmiteri un aktīvas vielas, nozīmīgākā no tām ir ar kalcitonīna gēnu saistītais peptīds (CGRP, calcitonine gene related peptide), kas pēdējos gadus kalpo par migrēnas terapijas mērķi. Kopš 2018. gada profilaktiskā migrēnas terapijā iespējams lietot monoklonālas anti–CGRP antivielas, bet akūtu lēkmju terapijā CGRP receptoru agonistus jeb gepantus.
Noskaidrots, ka migrēnai ir ģenētiska predispozīcija. Visa genoma asociācijas pētījumos (GWA, Genome-wide association) identificēti vismaz 38 lokusi ar 44 viena nukleotīda polimorfismiem, kuriem ir asociācija ar migrēnas risku. Sievietes dzimums per se tiek uzskatīts par riska faktoru migrēnai. Bet tas, kas konkrētam indivīdam papildus nosaka slimības izpausmes, izriet no epiģenētikas — gēnu un vides faktoru mijiedarbības.
Migrēnas riska faktoriem pieskaita zemu sociāli ekonomisko stāvokli, stresu, pārlieku biežu medikamentu lietošanu, aptaukošanos u.c. Apstiprināta arī cieša migrēnas saistība ar depresiju un trauksmi.
Ilgus gadus migrēnu centās izskaidrot ar t.s. vaskulāro teoriju jeb cerebrālo asinsvadu vazokonstrikciju un tai sekojošu vazodilatāciju, kas izraisa galvassāpes. Tieša trīszaru nerva aferento šķiedru kairināšana galvas smadzeņu apvalkā izsauc galvassāpes — šo eksperimentu pirmais veica Harolds Volfs 1940. gadā, stimulējot smadzeņu apvalka vaskulāros nervus ķirurģiskā operācijā. Kopš tā laika izvirzīta migrēnas vaskulārā teorija, kas migrēnas galvassāpes skaidroja ar intrakraniālo asinsvadu dilatāciju. Tomēr šī teorija ir apstrīdēta. Radioloģiskie pētījumi pierādījuši, ka cerebrālie asinsvadi migrēnas lēkmes laikā nav dilatēti. Joprojām nav pilnībā skaidra migrēnas izcelsme, tāpat nav zināms, kam piešķirama galvenā loma — perifērajiem vai centrālajiem mehānismiem.
Migrēnas centrālie mehānismi
Galvenie migrēnas patoģenēzes centrālie mehānismi saistīti ar garozas, smadzeņu stumbra, thalamus un hypothalamus aktivitāti. Tā, piemēram, migrēnas auru skaidro ar t.s. garozas kavējuma izplatības vilni (CSD, cortical spreading depression) — elektrofizioloģisku fenomenu, kas sākas no viena punkta garozā un izplatās kā lēni pieaugošs depolarizācijas vilnis pāri smadzeņu garozai ar ātrumu 2—3 mm minūtē.
PET un funkcionālos magnētiskās rezonanses pētījumos jau sen pierādīta smadzeņu stumbra iesaiste migrēnas patoģenēzē. Tas tiek uzskatīts par migrēnas ģeneratoru, kas nosaka smadzeņu garozas aktivitātes izmaiņas migrēnas gadījumā. Ir precīzi noteikti kodoli, kuri modulē trigeminovaskulāro sāpju pārvadi un autonomās nervu sistēmas atbildi. Savukārt thalamus ir labi zināma ienākošo sāpju impulsu apstrādes un integrācijas centrālā struktūra, jo tam ir plašs savienojumu tīkls smadzeņu garozā (somatosensorajos, motoriskajos, redzes, dzirdes un ožas apgabalos), un arī ar limbisko sistēmu, kas varētu izskaidrot kompleksos migrēnas klīniskos simptomus. Thalamus ir galvenais, kas atbild par fotojutīgumu un mehānisku alodīniju, ko novēro migrēnas pacientiem.
Par hipotalāma nozīmi grupālo galvassāpju un citu trigeminālo autonomo galvassāpju gadījumā zināms sen, bet pēdējā laikā iegūti pierādījumi par tā lomu arī migrēnas gadījumā un tieši ļoti agrīnā migrēnas lēkmes stadijā, premotoriskajā fāzē. Hipotalāms, lai arī ļoti niecīgs izmēra ziņā, pilda vitāli svarīgu lomu un netiešā veidā piedalās homeostāzes uzturēšanā, jo ir augstākais veģetatīvās nervu sistēmas centrs, kas kontrolē neiroendokrīno sistēmu, organisma adaptāciju, atbildreakciju uz stresu, regulē cirkadiānos ritmus. Kopā ar limbisko sistēmu hipotalāms piedalās emociju un uzvedības regulācijā.
Migrēnas perifērie mehānismi
Noskaidrots, ka migrēnas lēkmju laikā aktivējas trigeminovaskulārā sistēma, kuras raidītos impulsus smadzenes interpretē kā sāpes. Trigeminovaskulārā sistēma sastāv no trīszaru nerva smalkajām C un A delta nervu šķiedrām, kas inervē galvas smadzeņu apvalkus un to asinsvadus. Trigeminovaskulārās sistēmas aktivācijas rezultātā izdalās virkne vazoaktīvu peptīdu: CGRP, P viela u.c.
Tieši CGRP kopš tā atklāšanas 1982. gadā ir visvairāk pētītais migrēnas marķieris.
CGRP ir neiropeptīds, kas sastāv no 37 aminoskābēm un tiek sintezēts perifērajos jušanas neironos, kā arī citviet CNS, tas darbojas kā vazodilatators un vienlaicīgi veicina iekaisīgo citokīnu, slāpekļa oksīda izdalīšanos no ganglija glijas šūnām. Antivielas pret pašu CGRP molekulu vai tā receptoru spēj efektīvi panākt migrēnas lēkmju atvieglojumu, pierādot, ka CGRP ir būtiska loma migrēnas patoģenēzē.
Tomēr tiek uzskatīts, ka tas ir migrēnas lēkmes modulētājs, nevis iniciators. Trīszaru nerva gangliju un smadzeņu apvalkus nesargā hematoencefāliskā barjera. Tā kā anti–CGRP antivielas ir izmērā samērā lielas un nešķērso hematoencefālisko barjeru, tas pierāda migrēnas sāpju veidošanās perifēros mehānismus.
Apkopojot iepriekš izklāstītos aspektus, šodienas migrēnas izpratne to skaidro kā neirovaskulāru slimību ar traucētu zemgarozas un garozas modulējošo mehānismu spēju analizēt normālo sensorisko aferento informāciju, kas tiek saņemta no trigeminovaskulārās sistēmas, kodoliem smadzeņu stumbrā un muguras smadzenēs. Trigeminovaskulārās sistēmas aktivācija ir atbildīga par sāpju veidošanos migrēnas gadījumā.
Praktiska migrēnas diagnostika un diagnostiskie kritēriji
Migrēna ir klīniska diagnoze, tas nozīmē, ka nav specifisku izmeklējumu vai analīžu, ar ko šo slimību pierādīt, apstiprināt vai izslēgt. Lai diagnosticētu migrēnu, jāpārzina diagnozei raksturīgās sūdzības un vispārēji jānovērtē slimnieka veselības stāvoklis. Jāņem vērā, ka jebkuras blakusslimības pasliktināšanās vai nepietiekama ārstēšana var izraisīt migrēnas saasināšanos.


1. tabula
Migrēnas bez auras diagnostiskie kritēriji pēc ICHD–3
Ar migrēnu biežāk saistītās blakusslimības ir miega un garastāvokļa traucējumi. Migrēnas diagnozi var noteikt jebkuras specialitātes ārsts ar interesi pacienta veselības stāvokļa uzlabošanā — ģimenes ārsts, rehabilitologs, neirologs, oftalmologs, otorinolaringologs, alergologs, psihiatrs utt.
Migrēna ir epizodiska slimība, pacientu galvenā sūdzība ir vidēji stipru līdz ļoti stipru galvassāpju epizodes, kuras ilgst 4—72 h un starp kurām pacients ir pilnīgi vesels. Migrēna nav tikai galvassāpes — tas ir daudzu pavadošu simptomu kopums, kas cilvēku īslaicīgi padara nespējīgu veikt plānotās aktivitātes, darba pienākumus.
Pastiprināta jutība pret skaņu, gaismu, smaržām, slikta dūša, vemšana, kuņģa—zarnu trakta darbības traucējumi, izteikta miegainība, nogurums, grūtības koncentrēties ir biežākie ar migrēnu saistītie simptomi.
Migrēnas diagnostiskie kritēriji atbilstīgi Starptautiskās galvassāpju klasifikācijas 3. izdevumam aprakstīti 1. tabulā.
Parasti migrēnas lēkmes laikā arī minimālas fiziskas aktivitātes pastiprina galvassāpes, piemēram, piecelšanās no gultas vai kāpšana pa kāpnēm. Ar laiku migrēnas lēkmes var kļūt arvien biežākas un pacients var sūdzēties par pastāvīgām galvassāpēm, kas var būt dabiska migrēnas slimības gaita.
Hronisku ikdienas galvassāpju gadījumā svarīgi iztaujāt pacientu par galvassāpju slimības sākumu, pat ja tas ir pirms gadu desmitiem. Jāņem vērā, ka pārlieku bieži lietoti atsāpinošie medikamenti var pasliktināt sāpes un pat mainīt galvassāpju raksturu.


2. tabula
Migrēnas ar auru diagnostiskie kritēriji pēc ICHD–3
Aptuveni trešdaļa migrēnas slimnieku saistībā ar galvassāpēm novēro migrēnas auru, t.i., galvassāpju lēkmi pavadošus, pilnībā atgriezeniskus neiroloģiskas dabas simptomus — redzes, jušanas, kustību vai runas traucējumus. Tipiski migrēnas aura parādās pirms galvassāpēm, bet to var novērot arī galvassāpju laikā, turklāt iespējams, ka vienam pacientam parādās vairāki secīgi migrēnas auras simptomi. Parasti viena auras simptoma ilgums ir no piecām minūtēm līdz stundai, tomēr vienas auras laikā var parādīties arī vairāki auras simptomi, kas nozīmē, ka migrēnas aura var būt arī ilgāka. Migrēnas ar auru diagnostiskie kritēriji aprakstīti 2. tabulā.
Šie pilnībā atgriezeniskie pavadošie neiroloģiskie traucējumi bieži vien ārstos izraisa pārdomas par iespējamiem asinsrites traucējumiem vai pat epilepsiju. Katrai no šīm slimībām ir savas īpatnības, tāpēc pacienta vispārēja apskate un rūpīga iztaujāšana palīdz šos stāvokļus atšķirt pat bez specifisku papildu izmeklējumu veikšanas. 3. tabulā un 4. tabulā salīdzinātas pārejošiem asinsrites traucējumiem/insultam, epilepsijai un migrēnas aurai raksturīgās īpatnības.
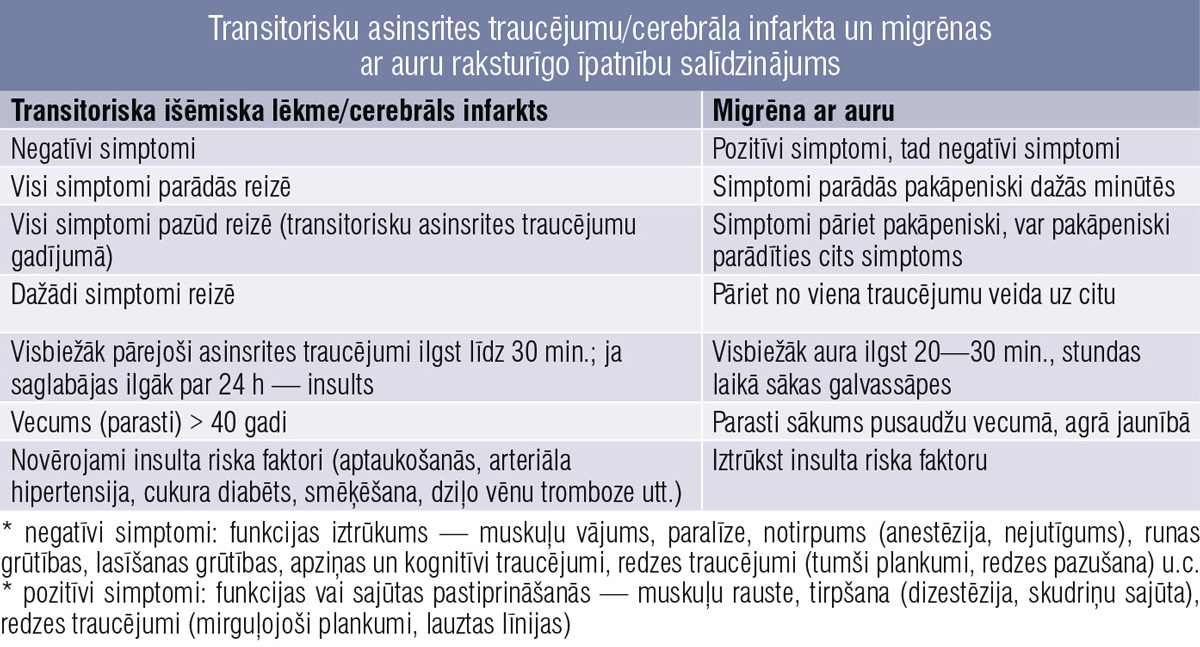

3. tabula
Transitorisku asinsrites traucējumu/cerebrāla infarkta un migrēnas ar auru raksturīgo īpatnību salīdzinājums
Papildu izmeklējumi migrēnas pacientiem plānojami tad, ja galvassāpes saistītas ar kādām bīstamām pazīmēm jeb sarkanā karoga simptomiem.
- Galvassāpes (GS), kas ir jaunas un konkrētajam pacientam nepazīstamas.
- Zibensveida galvassāpes (pēkšņas visstiprākās GS dzīvē varētu liecināt par subarahnoidālu asinsizplūdumu).
- Žokļa locītavas klaudikācijas (GS žokļa kustību laikā varētu liecināt par temporālu arterītu).
- GS, ko pavada atipiski neiroloģiski simptomi (atipiska aura). Ilgums > 1 h, arī ieildzis notirpums, muskuļu vājums rokā/kājā.
- GS, kas mainās līdz ar ķermeņa pozu (pieaug klepus laikā, pieliecoties, iespējams, saistītas ar paaugstinātu intrakraniālo spiedienu).
- Spēcīgas sāpes acs rajonā, acs apsārtums (acs patoloģija — slēgta kakta glaukoma?).
- Saindēšanās ar oglekļa monoksīdu (tvana gāzi) + letarģija, vemšana.
- Jauns neiroloģisks deficīts: jušanas traucējumi, kustību traucējumi sejā, ķermenī, ekstremitātēs, kustību koordinācijas traucējumi.*
- Apziņas traucējumi, personības pārmaiņas, uzvedības izmaiņas bez redzama iemesla.*
- Jaunas GS pacientam vecumā < 18 gadiem vai > 50 gadiem; ar imūnsupresiju, HIV, nesenām dzemdībām, grūtniecības periodā, pacientam ar onkoloģisku anamnēzi, nesena galvas trauma, antikoagulantu lietošana.*
- Galvassāpes, kas pacientu pamodina nakts laikā.*
- Progresējošs galvassāpju pieaugums pēdējā nedēļā.*
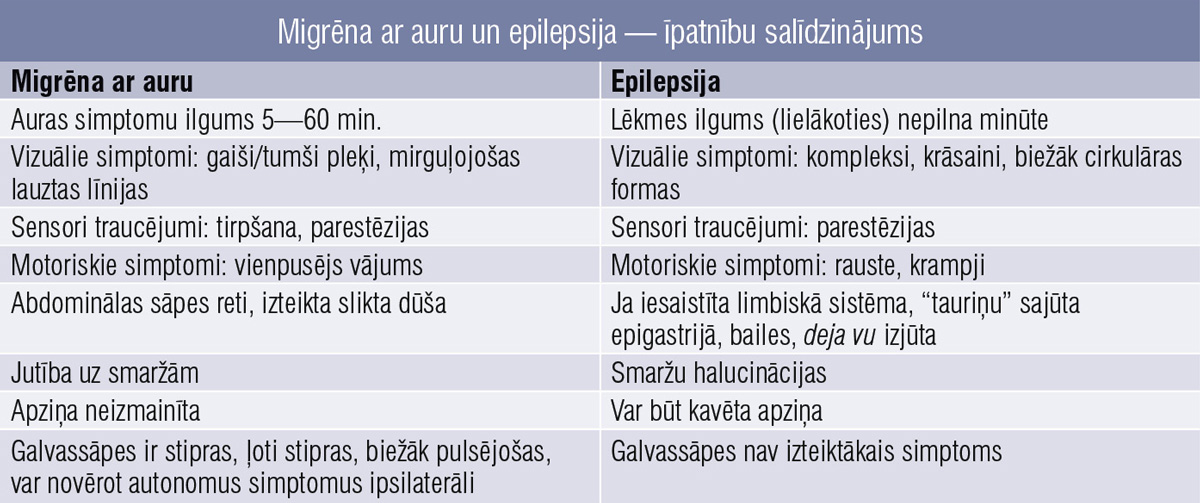

4. tabula
Migrēna ar auru un epilepsija — īpatnību salīdzinājums
Sarkanā karoga simptomu gadījumā jāapsver neatliekama stacionēšana un papildu izmeklējumi. Iepriekšminētajiem simptomiem ar atzīmi “*” veicama neatliekama MR vai cits piemērots izmeklējums (DT, DT angiogrāfija, lumbālpunkcija, okulista konsultācija).
Migrēnas terapija
Akūtas lēkmes kupēšana
Akūtas migrēnas lēkmes ārstēšanai izmantojamas dažādas nemedikamentozas un medikamentozas terapijas iespējas. Ārstēšanas mērķis ir nomākt sāpes, pavadošos simptomus un atjaunot pacienta funkcionalitāti. Katram pacientam ir individuāla medikamentozās un nemedikamentozās terapijas kombinācija, kas vislabāk ārstē akūtu migrēnas lēkmi.
Ir iespējami vairāki nemedikamentozi akūtas lēkmes ārstēšanas pasākumi, kuriem nav zinātnisku pierādījumu, bet, apkopojot pacientu pieredzi, varam secināt, ka daži pasākumi palīdz atvieglot migrēnas lēkmi:
- atpūta un miegs, vislabāk klusā un tumšā telpā,
- aukstums (ledus maisiņi, aukstas kompreses),
- karstums (karsta vanna, duša),
- elpošanas/relaksācijas vingrinājumi.
Zinātniski pierādīta dažādu neiromodulācijas metožu lietderība akūtas lēkmes kupēšanai. Tās ir speciālas ierīces, kas ar elektrisku vai magnētisku stimulāciju var nomākt migrēnas lēkmi, piemēram, gammaCORE, CEFALY.
Literatūrā piedāvātas vairākas stratēģijas medikamentu izvēlei akūtas lēkmes ārstēšanā. Garākas vai ieilgušas migrēnas lēkmes ārstēšanā visefektīvākā stratēģija ir lēkmes ārstēšana soli pa solim.
1. solis: simptomātiska terapija ar vienkāršiem analgētiķiem, ko pēc nepieciešamības var kombinēt ar antiemētiķiem. Kā analgētiķus var izmantot ibuprofenum 400—800 mg, acidum acetylsalicylicum 900—1000 mg, diclofenacum natricum 50—100 mg, naproxenum natricum 500—1000 mg, ketoprofenum 100 mg vai paracetamolum 1000 mg. Ir diezgan maz pierādījumu par paracetamola efektivitāti lēkmes kupēšanā, tāpēc tas nav pirmais izvēles medikaments. Svarīgi atcerēties, ka medikaments jālieto savlaicīgi un adekvātā devā.
Pacienti, kuriem lēkmes laikā ir slikta dūša, papildus var lietot domperidonum 20 mg vai metoclopramidum 10 mg, tas veicina pretsāpju medikamentu uzsūkšanos un mazina gastrointestinālās sūdzības. Pacienti, kuriem lēkmes laikā ir vemšana, var izmantot medikamentu šķīstošās formas vai rektāli ievadāmas medikamentu formas. Svarīgi atcerēties, ka vienkāršos analgētiķus nevajadzētu lietot vairāk kā desmit dienas mēnesī, lai neattīstītos no medikamentiem atkarīgas galvassāpes. Pacientiem, kuriem nepalīdz vienkārši analgētiķi, jāpāriet uz 2. soli.
2. solis: specifiska terapija, lietojot triptānus (5-hydroxytryptamina receptoru agonistus). Tie ir efektīvi, jo iesaistās migrēnas lēkmes patoģenētiskos mehānismos, ierosinot vazokonstrikciju, kavē neiropeptīdu izdalīšanos un iesaistās trigeminovaskulārās sistēmas regulācijas mehānismos. Latvijā nopērkamie triptāni migrēnas lēkmes ārstēšanai:
- sumatriptanum (Cinie) — 50 mg vai 100 mg tabletes (pasaulē pieejamas un dažās aptiekās Latvijā ir pasūtināmas arī deguna aerosola un s/c injekcijas formas),
- rizatriptanum (Calvinia) — 10 mg mutē disperģējama tablete,
- frovatriptanum (Migard) — 2,5 mg tablete,
- eletriptanum (Relpax) — 40 mg tablete.
Svarīgi atcerēties, ka arī triptāni jālieto iespējami ātrāk un atbilstošā devā. Uzskaitītie triptāni nedaudz atšķiras, tāpēc pacienta individuālā atbildreakcija uz terapiju var atšķirties. Triptāns tiek uzskatīts par efektīvu, ja mazina sāpes trijās no četrām migrēnas lēkmēm. Lietojot triptānus, pacienti var just dažādas blakusparādības — ādas reakciju, spiedienu un žņaudzošu sajūtu krūtīs, tirpšanu, miegainību, reiboni, vājumu, sausumu mutē.
Arī triptānu lietošanai ir kontrindikācijas: nekontrolēta hipertensija, koronāra sirds slimība, insults, perifēras vaskulāras slimības, MAO inhibitoru un SSAI antidepresantu lietošana.
Triptānus var lietot pacienti, kuriem ir migrēna ar auru un bez auras, bet stingri iesaka nelietot hemiplēģiskas migrēnas un migrēnas ar stumbra auru gadījumā. Triptānus nevajadzētu lietot regulāri, ne vairāk kā 2 × nedēļā, lai neattīstītos no medikamentiem atkarīgas galvassāpes. Ja divās stundās lēkme nav atkāpusies vai sāpes atjaunojas, var ieņemt otru devu. Diennaktī maksimālā pieļaujamā deva ir divas tabletes. Pacienti, kuriem ir slikta dūša, papildus var lietot kādu no augstāk minētajiem antiemētiķiem.
Cita stratēģija akūtas migrēnas lēkmes ārstēšanā piedāvā iedalīt lēkmes pēc smaguma pakāpes. Vieglas lēkmes gadījumā pirmās izvēles medikamenti ir NSPL, bet vidēji smagas un smagas lēkmes gadījumā pirmā izvēle ir triptāni. Izvēloties šādu lēkmes ārstēšanas stratēģiju, ir labāki rezultāti sāpju mazināšanai pirmajās divās stundās, taču biežāk attīstās medikamentu izraisītas blaknes.
Galvenais priekšnoteikums efektīvai akūtas migrēnas lēkmes ārstēšanai ir iemācīties atpazīt lēkmi un lietot atbilstošu medikamentu iespējami drīz un adekvātā devā.
Lai šo priekšnoteikumu izpildītu, ļoti svarīga ir ārsta un pacienta sadarbība.
Profilaktiska migrēnas terapija
Profilaktiska terapija ir nozīmīga sadaļa migrēnas pacientu aprūpē. Praksē sastopam pacientus ar dažādiem dzīves uzskatiem, un mūsu mērķis ir atrast pacientam pieņemamu profilaktisku terapiju, jo tas ir pamats veiksmīgai sadarbībai.
Profilaktiskās terapijas sākšanas mērķi: mazināt lēkmju biežumu, intensitāti un ilgumu, tādējādi samazinot vajadzību pēc akūtas migrēnas lēkmes kupēšanas, uzlabot dzīves kvalitāti, akūtās terapijas efektivitāti, novērst migrēnas attīstību līdz hroniskai.
Pētījumos pierādītā efektīvākā profilaktiskā terapija ir medikamentozā terapija, ko sāk pēc noteiktiem kritērijiem.
Medikamentozu profilaktisku terapiju rekomendē sākt:
- ja novēro trīs un vairāk migrēnas lēkmes mēnesī, kas negatīvi ietekmē dzīves kvalitāti,
- ja migrēnas lēkmes ir ilgstošas un parasti ilgst vairāk par 72 h,
- komplicētas migrēnas lēkmes (hemiplēģiskā migrēna, ilgstošas auras) gadījumā,
- ja ir migrēnas lēkmes, kurām akūtā terapija ir neefektīva,
- gadījumos, ja akūtā terapija nav iespējama blakņu dēļ,
- iespējamas medikamentu pārlieku lietošanas dēļ.
- pacienta vēlmes gadījumā.
|
Profilaktiskā terapijā plaši tiek lietoti medikamenti, kas sākotnēji radīti citu slimību ārstēšanai, proti, pretepilepsijas līdzekļi, antihipertensīvie medikamenti, kā arī antidepresantu grupas līdzekļi. Nozīmīgākie sarežģījumi šo līdzekļu lietošanā saistāmi ar zemo to efektivitāti, sagaidāmajām blakusparādībām, kā arī pacientu bailēm no atkarības veidošanās. Šobrīd jauni pētījumi, kas saistīti ar populārākajiem “vecajiem” profilaktiskajiem medikamentiem, nav gaidāmi, jo ir izstrādāti jauni specifiski pretmigrēnas līdzekļi, ar kalcitonīna gēnu saistītā peptīda un tā receptora antivielas. Tomēr augsto izmaksu dēļ šo jauno migrēnas zāļu pieejamība Latvijas migrēnas pacientiem ir ierobežota.
“Veco” profilaktisko terapiju sāk ar mazām medikamenta devām, pakāpeniski palielinot, apstājoties pie mazākās efektīvās profilaktiskās devas, lai maksimāli izvairītos no blaknēm. Efektivitāti novērtē divus trīs mēnešus pēc tam, kad sasniegta rekomendējamā deva vai maksimālā panesamā medikamenta deva. Ja lietotais profilaktiskais līdzeklis nozīmīgi atvieglo galvassāpes, tad šādu profilaktisku terapiju rekomendēts turpināt 12 mēnešus.
Ja šajā periodā nenovēro zīmīgu galvassāpju mazināšanos, jāsāk citas grupas profilaktisks medikaments, turklāt pierādījumi rāda, ka šādā gadījumā nākamā medikamenta iespējamā efektivitāte ir augstāka. Ar pacientu jāpārrunā dzīvesveida izmaiņas: regulārs miegs, ēdienreizes, fiziskās aktivitātes. Tāpat medikamentozā terapija jākombinē ar psihoterapiju, relaksācijas vingrojumiem, biofeedback, kognitīvi biheiviorālo terapiju.
Antihipertensīvie medikamenti
Nejaušināti pētījumi norāda uz bēta blokatoru un angiotensīna II receptoru blokatoru efektivitāti. Savukārt pētījumi par kalcija kanālu blokatoriem un angiotensīnu konvertējošā enzīma inhibitoru efektivitāti nav pietiekami pārliecinoši, bet nereti tiek izmantoti arī šie medikamenti.
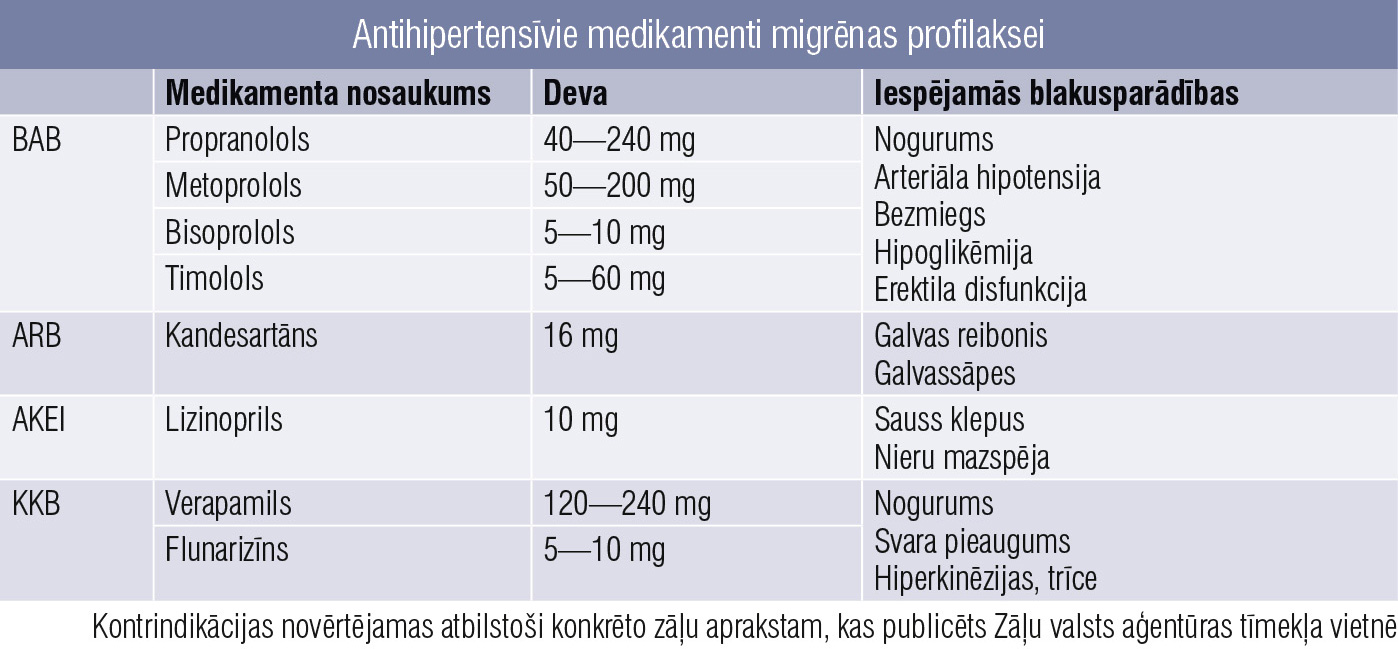

5. tabula
Antihipertensīvie medikamenti migrēnas profilaksei
No bēta blokatoriem vairāk pētījumu ir par propranololu, metoprololu, timololu (5. tabula). Šīs grupas medikamentus kā sākotnēju izvēli nerekomendē > 60 gadus veciem pacientiem, smēķētājiem, jo saista ar paaugstinātu kardiovaskulāru notikumu risku. Tāpat rūpīgi jāapsver medikamentu lietošana pacientiem ar erektilu disfunkciju, perifēro asinsvadu slimībām, pacientiem ar hipotensiju un bradikardiju. Nereti propranololu un metoprololu rekomendē arī migrēnas profilaksei grūtniecības laikā.
Divos maskētos pētījumos angiotensīna II receptoru blokatora kandesartāna efektivitāte tika pierādīta 40 %. AKE inhibitora lizinoprila efektivitāte izvērtēta vienā pētījumā. Pētījumu nepietiekamais skaits un mazais izmērs neļauj pārliecinoši izteikties par šo grupu medikamentu efektivitāti, tomēr Dānijā kandesartāns tika izmantots kā viens no pirmās izvēles medikamentiem.
Kalcija kanālu blokatoru efektivitāte ir apšaubāma mazo un pretrunīgo pētījumu dēļ, turklāt uzrādīts, ka, lietojot šīs grupas medikamentus flunarizīnu vai verapamilu, veidojas tolerance, kuru var pārvarēt, palielinot medikamenta devu.
Antidepresanti un antikonvulsanti
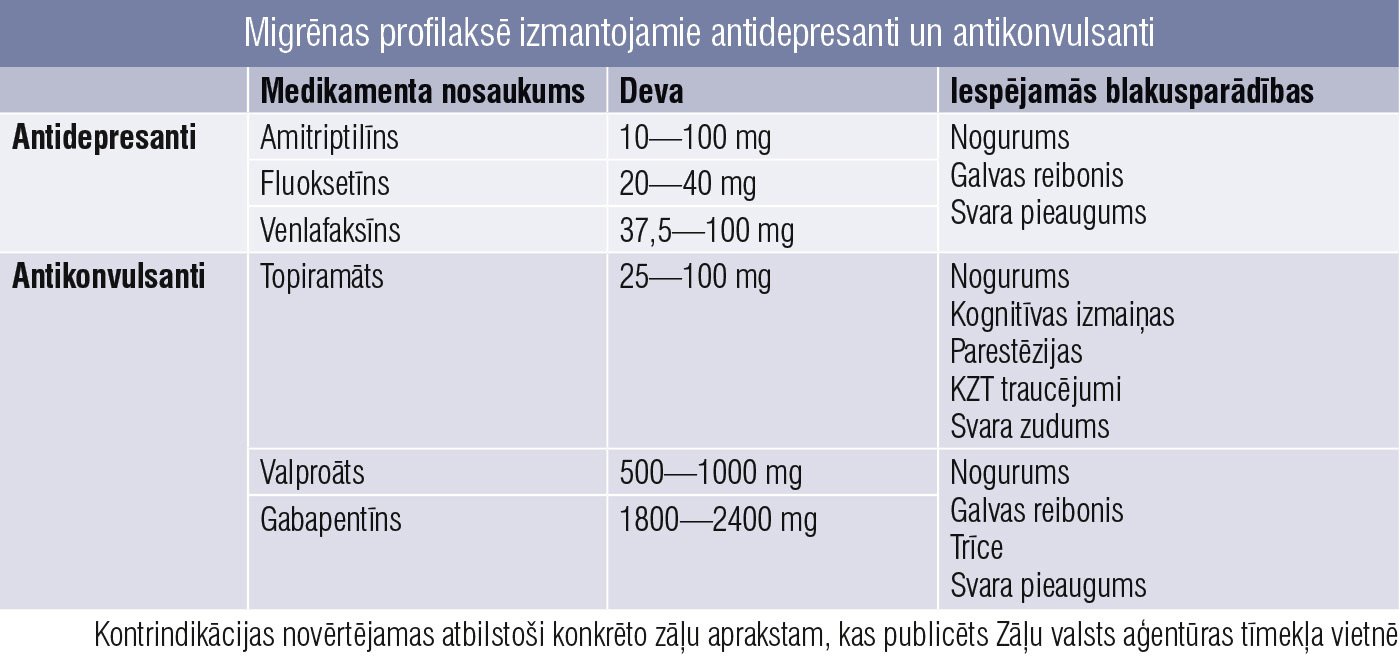

6. tabula
Migrēnas profilaksē izmantojamie antidepresanti un antikonvulsanti
No antidepresantiem biežāk izmantotie ir amitriptilīns un fluoksetīns (6. tabula). Amitriptilīnu rekomendē kā izvēles medikamentu, ja migrēna kombinējas ar saspringuma tipa galvassāpēm vai citām hroniskām sāpēm un miega traucējumiem, bet fluoksetīnu, venlafaksīnu — ja migrēna kombinējas ar panikas un citām trauksmes epizodēm.
Antikonvulsanti ir efektīvi pretmigrēnas līdzekļi, un topiramāts tiek uzskatīts par efektīvāko šīs grupas pārstāvi, bet tā lietošana bieži vien saistās ar blakusparādībām, kuru dēļ medikācija nereti jāpārtrauc. Šo medikamentu rekomendē hroniskas migrēnas un no medikamentiem atkarīgu galvassāpju gadījumā. Īpaši nozīmīga ir pakāpeniska šā medikamenta titrēšana līdz mazākajai efektīvajai devai. Migrēnas medikamentozai profilaktiskai terapijai rekomendē monoterapiju, bet aprakstīti efektīvi gadījumi nortriptilīna un topiramāta kombinācijai.
Pētījumos atklāts, ka nātrija valproāts samazina migrēnas lēkmju biežumu, bet ne intensitāti. Ņemot vērā medikamenta teratogenitāti, nav rekomendējams fertilā vecumā, tāpat nav pierādījumu tā lietošanas efektivitātei bērniem un pusaudžiem.
Lamotrigīns un levetiracetāms arī lietojami migrēnas profilakses terapijā, jo samazina lēkmju biežumu. Lamotrigīns jāizvēlas pacientiem, kam ir migrēna ar auru. Pacientiem ar migrēnu bez auras medikaments tiek uzskatīts par profilaktiski neefektīvu.
Pētījumi par gabapentīna efektivitāti nav pietiekami, turklāt, lai samazinātu migrēnas lēkmju biežumu, nepieciešama salīdzinoši liela medikamenta deva.
CGRP antagonisti
Šobrīd Eiropas galvassāpju centros kā pirmās izvēles medikamenti tiek rekomendēti CGRP antagonisti jeb “mabi”, kas ir specifiski pretmigrēnas līdzekļi ar augstu profilaktisku efektivitāti.
Erenumabum (Aimovig) efektīvās devas ir 70 mg un 140 mg reizi mēnesī, abās devu grupās migrēnas dienas samazinājās par vismaz 50 %. Biežākās aprakstītās blaknes ir reakcija injekcijas vietā, aizcietējumi, kā arī hipertensijas epizodes. Fremanezumab (Ajovy) 225 mg ik mēnesi vai 675 mg ik trīs mēnešus; biežākā blakusparādība — reakcija injekcijas vietā. Līdzīga efektivitāte > 50 % kā injekcijai 1 × mēnesī, tā arī 1 × trīs mēnešos lielākajai devai.
Galkanezumabum (Emgality) jāsāk ar piesātinošo devu 240 mg, pēc tam ik mēnesi ievada 120 mg devu. Eptinezumabum (Vitepti) atšķirībā no citiem šīs grupas pārstāvjiem paredz intravenozu ievadi, rekomendējamā deva 100 mg, atšķiras arī aprakstītās biežākās blaknes: augšējo elpceļu infekcijas, nogurums un hipersensitivitāte.
Mazmolekulārie CGRP antagonisti jeb “gepanti” šobrīd nav apstiprināti lietošanai Eiropā. Rimegepantum (Vydura) 75 mg lietošana p/o katru otro dienu 12 mēnešus. Atogepantum (Qulipta) pētīta efektivitāte dažādām devām (10 mg, 30 mg, 60 mg), bet lielākas devas saistāmas ar biežākām blaknēm, savukārt efektivitāte līdzīga visām devām.
Citi iespējamie profilaktiskās terapijas veidi
- Botulīna toksīna A injekcijas: netiek rekomendētas epizodiskas migrēnas gadījumā, bet hroniskas migrēnas gadījumā atzītas par efektīvu terapiju.
- Pārtikas piedevas apsveramas migrēnas pacientiem, kas nav gatavi farmakoloģiskai terapijai. Koenzīms Q10 pētījumos pazemina CGRP līmeni. Rekomendējamā deva 100 mg 3 × dienā. Riboflavīns 400 mg — pētījumos efektivitāte parādījās pēc lietošanas trīs mēnešus. B6, folskābe, B12 vitamīns pētījumos iezīmējas kā efektīva profilaktiska terapija migrēnas ar auru gadījumā. Nelieli pētījumi ir par E vitamīna efektivitāti menstruālās migrēnas gadījumā. Melatonīna 3 mg efektivitāte kādā pētījumā tika norādīta kā līdzvērtīga amitriptilīnam.
- Neiromodulācija. Transkutāna supraorbitāla nerva stimulācija — pēc trīs ārstēšanas mēnešiem migrēnas dienu skaits samazinājās par > 50 %, nebija atzīmējamu blakusparādību. Transkraniāla magnētiskā stimulācija — apstiprināta kā efektīva terapija, pierādījās medikamentu lietošanas mazināšana, bet netika konstatēts samazinājums migrēnas lēkmju biežumā vai intensitātē. N. vagus stimulācija — epizodiskas migrēnas laikā, novēro dzīves kvalitātes uzlabošanos.