Pirmo reizi primāru iedzimtu glaukomu aprakstījis Hipokrats, novērojot patoloģiski palielinātus acu ābolus zīdaiņiem. Izpratne par slimību izveidojās tikai 18. gadsimta sākumā, kad Bergers aprakstīja saistību starp paaugstinātu intraokulāro spiedienus (IOS) un acs lieluma izmaiņām bērniem. [4]
Terminoloģija
Glaukoma ir hroniska progresējoša optiska neiropātija, kam raksturīgas redzes nerva diska izmaiņas un asociēts redzes lauka defekts. [5] Bērnu glaukomas ir reta, heterogēna slimību grupa, ko vieno paaugstināts IOS un sekojošs redzes nerva bojājums. [6]
Bērnu vecumā var attīstīties dažādi primāras un sekundāras glaukomas veidi (1. tabula). [6]
![Glaukomas klasifikācija pēc etioloģijas bērniem [6]](https://cdn.doctus.lv/media/2020/02/2/original/b120b93df7aa.jpg)
![Glaukomas klasifikācija pēc etioloģijas bērniem [6]](https://cdn.doctus.lv/media/2020/02/2/original/b120b93df7aa.jpg)
1. tabula
Glaukomas klasifikācija pēc etioloģijas bērniem [6]
Primāra iedzimta glaukoma
Raksturīga acs priekšējā kakta disģenēze, kas traucē intraokulārā šķidruma (IOŠ) atteci un veicina glaukomas attīstību, šo konkrēto glaukomas veidu diferencējot no citiem, kas iespējami bērniem. [7] Primāru iedzimtu glaukomu klasificē pēc 2014. gada Eiropas glaukomas asociācijas vadlīnijām, ņemot vērā diagnosticēšanas brīdi [5]:
- neonatāla (no dzimšanas brīža līdz viena mēneša vecumam),
- zīdaiņu (1—24 mēneši),
- vēlīnas izpausmes vai vēlīni diagnosticēta (> 24 mēneši),
- spontāni neprogresējoša ar normālu IOS, bet ar tipiskām primāras iedzimtas glaukomas pazīmēm.
Juvenīla glaukoma
Juvenīla glaukoma ir autosomāli dominanta glaukomas forma. No divu gadu vecuma līdz pubertātei attīstās agrīna juvenīla glaukoma. Slimībai raksturīgi tas, ka nav vērojama acs struktūru izplešanās, citas iedzimtas anomālijas/sindromi un acs priekšējais kakts ir atvērts.
Vēlīnas juvenīlas glaukomas gadījumā izpildās visi iepriekšminētie kritēriji kā agrīnas formas gadījumā. Vecuma kritērijs slimības attīstībai ir no pusaudžu gadiem līdz 40 gadu vecumam. [7]
Sekundāra bērnu glaukoma
To ierosina plašs klāsts slimību, kuru pamatā nav primāra acs priekšējā kakta attīstības anomālija, bet, piemēram, uveīts, trauma, steroīdu lietošana, intraokulāri audzēji, anamnēzē iedzimtas kataraktas operācija, lēcas ierosināta glaukoma, rubosis iridis un process sekundāri intraokulāram iekaisumam.
Šis glaukomas veids var attīstīties jebkurā bērnu vecumposmā. [6]
Vairāk par primāru iedzimtu glaukomu
Diagnostikas un ārstēšana taktika šajā rakstā atspoguļota atbilstīgi rekomendācijām primāras iedzimtas glaukomas gadījumā.
Riska faktori un patoģenēze
Primāras iedzimtas glaukomas sastopamība dzīvi dzimušiem bērniem atkarīga no etniskās piederības (no 1 : 1250 slovāku romiem līdz 1 : 18 500 Lielbritānijā), vidēji Eiropā 1 : 27 800. [8] Pirmajā dzīves gadā attīstās > 75 % no visiem gadījumiem. Zēniem patoloģija ir statistiski biežāk nekā meitenēm. [6] Līdz šim nav zināmi saslimšanas riska faktori. Visbiežāk slimība attīstās sporādiski, pozitīva ģimenes anamnēze 10—40 % gadījumu, parasti AR ar nepilnīgu penetranci. Iespējams arī AD pārmantošanas tips. Šobrīd ir identificēti četri ģenētiskie lokusi (GLC3A, GLC3B, GLC3C, GLC3D), kas saistāmi ar iedzimtu glaukomu. Mutācijas CYP1B1 (2p22.2), LTBP2 (2p21) un MYOC (1q23—q24) gēnā tiek saistītas tieši ar glaukomas attīstību. [8; 9]
Arī patoģenēze līdz šim nav pilnīgi skaidra. Pētījumu dati liecina, ka pamatā varētu būt kavēta priekšējās kameras kakta audu attīstība no nervu kores šūnām. Rezultātā veidojas kakta disģenēze un augstāk, priekšēji novietota varavīksnenes sakne, kas veicina trabekulu saplakšanu un paaugstina IOŠ atteces rezistenci. [4]
Diagnostika
Sūdzības
Klasiskā simptomu triāde zīdaiņu vecumā: epifora (acu asarošana), fotofobija (nepatika pret spilgtu gaismu), blefarospazma. Nereti glaukomu diagnosticē novēloti arī pēc oftalmologa apmeklējuma, ja netiek noteikts IOS. Sākotnējie simptomi var būt maldinoši, bet, kad sāk parādīties radzenes diametra izmaiņas un vizuāli redzami palielināta acs (buphthalmus), tie liecina, ka IOS bijis paaugstināts jau ilgstoši (1. attēls). Svarīgi no bērna vecākiem uzzināt anamnēzi arī par ēšanas paradumiem, svara zudumu, ikdienas vispārējo uzvedību. [6; 8]
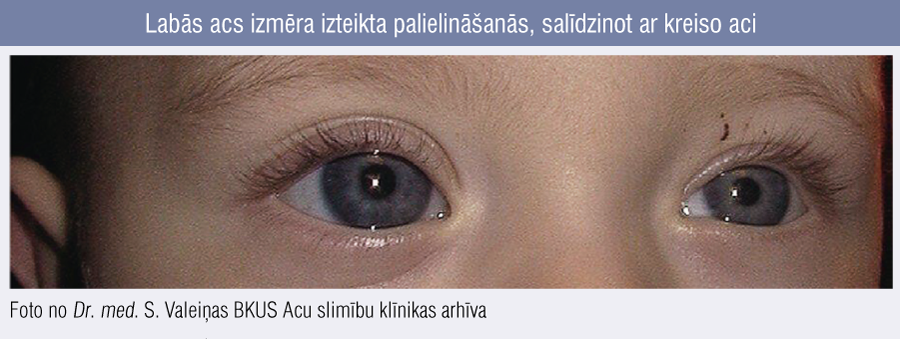

1. attēls
Labās acs izmēra izteikta palielināšanās, salīdzinot ar kreiso aci
Redzes asums
Bērna izmeklēšana vienmēr sākas ar redzes asuma izvērtēšanu. Redzes asuma precīza noteikšana jaundzimušajiem, zīdaiņiem un bērniem līdz trīs gadu vecumam ir apgrūtināta un ļoti subjektīva, tāpēc katrā vecumposmā to nosaka atšķirīgi. Spēja reaģēt uz gaismu, kustīgiem objektiem, fiksēt skatienu uz attēliem (Cardiff kartes) un atpazīt simbolus (Lea simboli, E burti, Landolta C burti) sākotnēji palīdz iegūt priekštatu par redzes funkciju, nosakot bērna vecumam piemērotāko metodi. Vecākiem bērniem izmanto pieaugušo redzes asuma noteikšanas skalas, ar kurām precīzāk izvērtējamas redzas asuma izmaiņas katrā nākamajā vizītē (piemēram, Snellena tabula). [6]
Tonometrija
Ambulatori noteikt IOS maziem bērniem visnotaļ var būt grūti, jo raudāšana var mākslīgi paaugstināt IOS vērtību. “Zelta standarts” IOS noteikšanai ir Goldmana aplanācijas tonometrija, ko veiksmīgi var lietot bērniem, kuri ir pietiekami līdzestīgi un var mierīgi nosēdēt pie spraugas lampas. Gados jaunākiem bērniem par pamatmetodi ir atzīta Perkina tonometrija.
Abi aprakstītie tonometrijas veidi ir kontaktmetodes, tāpēc jālieto lokālā anestēzija un galva jānotur nekustīgā pozīcijā. Maziem bērniem izmeklēšana notiek vispārējā anestēzijā, jo tas ir vienīgais veids, lai iegūtu nepieciešamos datus par IOS un acs struktūru izmaiņām. Tomēr jāatzīmē, ka arī vispārējās anestēzijas medikamenti var būtiski ietekmēt IOS vērtību. Šobrīd bērniem IOS īpaši palīdz noteikt arī iCare tonometrija, kas darbojas pēc atsitiena principa, veicot vieglu pieskārienu radzenei. Mērījumu veikšanai nav nepieciešama anestēzija un metode ir daudz vieglāk realizējama jaundzimušajiem un zīdaiņiem. Latvijā šo metodi plaši izmanto nolūkā sākotnēji izvērtēt IOS, lai nepieciešamības gadījumā padziļināti izmeklētu vispārējā anestēzijā.
Normā jaundzimušajiem IOS ir nedaudz virs 10 mmHg un, bērnam pieaugot, tas pakāpeniski paaugstinās. Par patoloģisku tiek uzskatīts IOS virs 21 mmHg jebkurā bērna vecumā, kā arī izteikta spiediena asimetrija starp abām acīm (> 5 mmHg). Tomēr jāņem vērā, ka ar dažādām metodēm noteikts IOS var būtiski atšķirties un IOS pakāpeniski paaugstinās fizioloģiskos apstākļos, bērnam pieaugot. Paaugstināts IOS vienmēr ir iemesls padziļinātai acu izmeklēšanai. [8; 10]
Acs priekšējo daļu biomikroskopija
Radzenes tūska un apduļķojumi, plīsumi Descementa membrānā (Haab strijas, 2. attēls) var būt signāli, kas liecina par paaugstinātu IOS. Svarīgi apskates laikā ir noteikt radzenes horizontālo un vertikālo diametru, kas bērniem pieaug kā atbilde paaugstinātam IOS. Normāli rādītāji jaundzimušajiem ir 9,5—10,5 mm, gada vecumā 11—12 mm (patoloģiski jaundzimušajiem > 11,5 mm, zīdaiņiem un bērniem pēc divu gadu vecuma > 12,5—13 mm). Būtiski ir izslēgt acs priekšējā segmenta anomālijas, kas var būt par pamatu traucētai IOŠ attecei. Radzenes izplešanos var novērot līdz 2—3 gadiem, atbildot uz paaugstinātu IOS. [6]
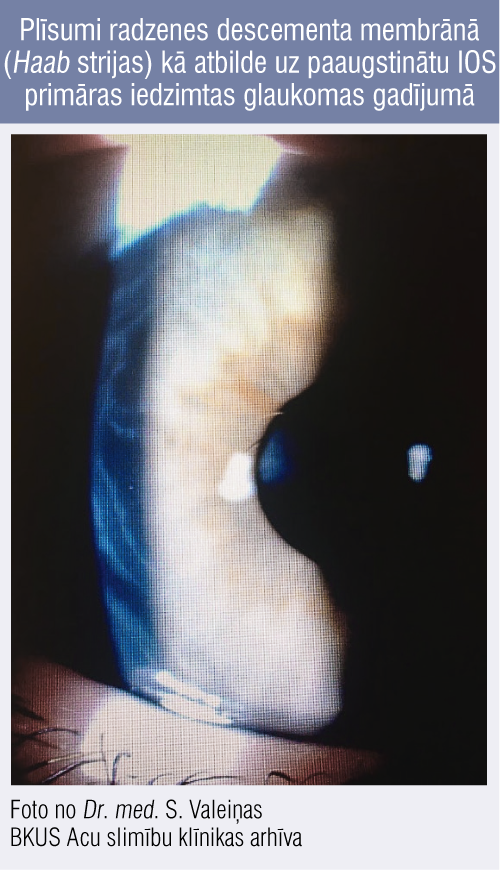

2. attēls
Plīsumi radzenes descementa membrānā (Haab strijas) kā atbilde uz paaugstinātu IOS primāras iedzimtas glaukomas gadījumā
Gonioskopija
Izmeklējums ir īpaši svarīgs, lai spriestu par tālāko ķirurģiskās ārstēšanas taktiku. Iedzimtas glaukomas pamatā ir acs priekšējā kakta disģenēze, kas traucē IOŠ atteci un veicina IOS paaugstināšanos. Acs kakta vizualizēšana ļauj spriest par struktūru izmaiņu apjomu.
Gonioskopiski novēro augstu novietotu varavīksnenes sakni un salīdzinoši nediferencējamas, puscaurspīdīgas pārējās struktūras (ciliārā ķermeņa josliņu, sklēras piesi un trabekulāro tīklu). [7]
Ultrasonogrāfija
Metode īpaši noder, izvērtējot glaukomas iespējamību bērnam līdz trīs gadu vecumam, jo šajā posmā, atbildot uz paaugstinātu IOS, izteikti palielinās acs aksiālais garums. Pēc trīs gadu vecuma acs struktūras nostiprinās un acs aksiālais garums stabilizējas, atbildot uz paaugstinātu IOS.
Dzimšanas brīdī acs aksiālais garums ir 16—17 mm, gada vecumā 20—21 mm, bet apmēram sešu gadu vecumā tas sasniedz pieaugušā acs ābola garumu 23 mm. Novirzes no normām liecina par IOS radītajām acs struktūru izmaiņām, kā arī ļauj izsekot glaukomas kontrolei dinamikā. Tāpat metode ir svarīga, lai izvērtētu slimības norisi dinamikā un izvairītos no atkārtotas izmeklēšanas vispārējā anestēzijā. [11]
Fundoskopija
Bērniem bez glaukomatozām izmaiņām redzes nerva diska ekskavācijai vajadzētu būt < 0,3 (redzes nerva ekskavācija — redzes nerva padziļinājuma vertikālais diametrs attiecībā pret redzes nerva diska kopējo vertikālo diametru). Tomēr bērniem ar glaukomu šī ekskavācija ir > 0,3 un unilaterālos gadījumos novēro savstarpējo disku padziļinājumu asimetriju. Bērniem raksturīgs, ka, sākot glaukomas ārstēšanu un veiksmīgi pazeminot IOS, redzes nerva diska ekskavācija un lamina cribrosa izliekums uz mugurpusi samazinās. Mērķtiecīgi ir fotogrāfiski dokumentēt redzes nerva disku novērošanai dinamikā. [7]
Retinoskopija
Refrakcijas noteikšana cikloplēģijā palīdz izvērtēt un sekot līdzi glaukomas attīstībai. Bērna vecumā raksturīga hipermetropija, kas parasti acs augšanas procesā līdz skolas vecumam izzūd. Glaukomas gadījumā paaugstinātais IOS veicina acs aksiālā garuma palielināšanos un miopijas attīstību. Tuvredzības izvērtēšana var palīdzēt sekot līdzi glaukomas kontrolei. Svarīgi arī atzīmēt, ka pēc antiglaukomatozas operācijas var attīstīties astigmatisms: svarīgi to koriģēt, lai neattīstītos refrakcijas ambliopija. [7; 11]
Papildu izmeklējumi
Redzes lauka, radzenes biezuma noteikšana (pahimetrija) un optiskā koherences tomogrāfija (OCT) ir glaukomas diagnostikas stūrakmeņi pieaugušajiem. Redzes lauka noteikšanas iespējamība atkarīga no individuālā gadījuma, bet parasti tikai pēc 7—8 gadu vecuma. Redzes lauka noteikšana sniedz informāciju par acs funkciju reālās dzīves apstākļos. Kad bērns ir paaudzies, var mierīgi nosēdēt un ir pietiekami līdzestīgs, radzenes biezuma noteikšana ir iespējama. Arī OCT izmeklējums tīklenes nervu šķiedru biezuma noteikšanai (RNFL) un ganglionārajām šūnām kalpo kā papildu izmeklējums, kas precīzi ļauj izsekot stāvoklim dinamikā. [12]
Pēc Childhood Glaucoma Research Network datiem iedzimtu glaukomu diagnosticē, ja ir vismaz divi no šiem kritērijiem: [13]
- IOP > 21 mmHg,
- redzes nerva disks — progresējošs ekskavācijas palielinājums, asimetrija ≥ 0,2, fokāls neiroretinālās apmales sašaurinājums,
- radzene — Haab strijas vai diametrs > 11 mm jaundzimušajiem, > 12 mm < 1 gadā vai > 13 mm jebkurā vecumā,
- miopijas attīstība, progresējoša miopija vai acs aksiālā garuma pieaugums vairāk nekā noteiktā vecuma norma,
- redzes nerva defektam atbilstošs redzes lauks.
Primāras iedzimtas glaukomas iespējamās diferenciāldiagnozes uzskaitītas 2. tabulā, atsaucoties uz tipisko simptomu kopu un agrīnajām slimības izpausmēm. Iedzimtas glaukomas pacienti nereti sākotnēji tiek ārstēti kā ar aizdomām par iedzimtu ductus nasolacrimalis obstrukciju. [6]
![Primāras iedzimtas glaukomas diferenciāldiagnostika [6]](https://cdn.doctus.lv/media/2020/02/2/original/623d8253eb21.jpg)
![Primāras iedzimtas glaukomas diferenciāldiagnostika [6]](https://cdn.doctus.lv/media/2020/02/2/original/623d8253eb21.jpg)
2. tabula
Primāras iedzimtas glaukomas diferenciāldiagnostika [6]
Ārstēšana
Primāras iedzimtas glaukomas ārstēšana pamatā ir ķirurģiska, lai pazeminātu IOS. Gan pirms, gan pēc operācijas var lietot lokālos antiglaukomatozos acu pilienus. Šobrīd nav kontrolētu klīnisko pētījumu par glaukomas medikamentu drošumu un efektivitāti tieši bērniem.
Par pirmās izvēles medikamentiem atzīti bēta blokatori un karboanhidrāzes inhibitori, tomēr jāņem vērā arī iespējamās blaknes. Alfa agonistu lietošana ir aizliegta jaundzimušajiem un zīdaiņiem, jo tie var šķērsot asins—smadzeņu barjeru un ierosināt iegareno smadzeņu funkciju depresiju. Veiksmīga efektivitāte prostaglandīnu analogu lietošanai pēc pētījumu datiem ir apmēram ~30 % gadījumu, kad ilgtermiņā lietots latanoprosts. [6; 16]
Pirmās rindas izvēles metode ir goniotomija — operācijā gonioskopijas kontrolē atver acs priekšējo kaktu no iekšpuses. Dažkārt šo manipulāciju nav iespējams veikt, jo paaugstinātā IOS ietekmē ir radušās izmaiņas radzenē un tā ir kļuvusi necaurspīdīga, apgrūtinot acs priekšējā kakta struktūru vizualizāciju. Secīgi šādiem gadījumiem nākamā izvēles metode ir trabekulotomija. Operācijas laikā trabekulārais tīkls tiek atvērts ar trabekulotoma, mikrokatetra vai polipropilēna diega palīdzību, piekļūstot Šlemma kanālam no ārpuses. Pētījumu dati liecina, ka trabekulotomija kā pirmā operācijas metode ir efektīvāka nekā goniotomija (79 % pret 21 %). [14]
Ja iepriekš uzskaitītās metodes nav bijušas efektīvas IOS pazemināšanai (apmēram 20 % pacientu), rezistentiem iedzimtas glaukomas gadījumiem izmanto trabekulektomiju ar mitomicīnu C vai bez tā, kas ir “zelta standarta” operācija glaukomas ķirurģiskai ārstēšanai pieaugušajiem.
Pateicoties tehnoloģiskajiem jauninājumiem, rezistentiem iedzimtas glaukomas variantiem ir arī speciāli glaukomas implanti, ko ievieto subkonjunktivāli (Ahmed valve, Baerveldt valve). [15]
Paaugstināta IOS pazemināšanai kā pēdējā iespēja rezervēta ciklodestrukcija gadījumos, kad ar ķirurģiskām manipulācijām un lokāli lietotiem antiglaukomatoziem medikamentiem neizdodas normalizēt IOS.
Ciklodestrukcijas metodes: ciklokrioterapija, transsklerāla ciklofotokoagulācija un endoskopiska ciklofotokoagulācija. Manipulācijas laikā tiek iznīcināts ciliārais ķermenis un šādā veidā samazināta IOŠ veidošanās. [7]
Prognoze
Paplašinoties ķirurģiskas ārstēšanas iespējām, iedzimtas glaukomas prognoze ievērojami uzlabojusies, tomēr pat visizcilākajos glaukomas centros veiktā aprūpe nereti nespēj šos bērnus pasargāt no vājredzības attīstības. [15]
Vislabākā prognoze ir 3—12 mēnešus veciem bērniem, kam slimība attīstījusies šajā posmā un kam veikta savlaicīga operācija. [6] Agrīna forma (jaundzimušajiem) un vēlīni diagnosticēta (pēc viena gada vecuma) patoloģija pasliktina vispārējo prognozi par tālāko redzes funkciju. Zem trīs mēnešu vecuma prognoze par redzes funkciju ir vissliktākā neatkarīgi no veiksmīgi veiktas glaukomas operācijas. [14] Vairāk nekā 50 % iedzimtas glaukomas gadījumu ar jaundzimušo formu attīstītās vājredzība.
Jāņem vērā, ka arī veiksmīga pēcoperācijas iznākuma gadījumā iespējama ambliopijas, anisometropijas, kataraktas, lēcas subluksācijas un šķielēšanas attīstība, kas var būtiski ietekmēt redzes funkciju. Šiem bērniem ir nepieciešamas regulāras vizītes pie oftalmologa, lai kontrolētu IOS kompensāciju, diagnosticētu potenciālo komplikāciju rašanos un novērotu acu attīstību dinamikā. Tāpat svarīgi uzsvērt vecāku izglītošanu, lai sadarbība bērna ārstēšanā būtu veiksmīga. [6; 7]
FOTO: Pixabay.com