Pēdējos gados tiek veikti jauni pētījumi par OH klasifikāciju, patoģenēzi, diagnostiku un jo īpaši ārstēšanu. Šie pētījumi visbiežāk atbilst trešajam līmenim - tas ir, kā atsevišķi apraksti un ekspertu viedokļi - un vēl joprojām trūkst randomizētu multicentru pētījumu. Pēdējās vadlīnijas par OH di agnostiku un ārstēšanu ir publicētas 2006. gadā (EFNS guidelines on the diagnosis and managment of orthostatic hypotension [2]). Vadlīnijās ievērojami akcentēti diagnostikas un mūsdienīgas ārstēšanas metožu pētījumi, kas arī pamatojas tikai uz trešā līmeņa pētījumiem.
Ortostatiskas hipotensijas iedalījums un atsevišķu formu sastopamības biežums
Ortostatiskas hipotensijas visbiežāk tiek klasificētas divās grupās: tā dēvētajās neirogēnās un neneirogēnās OH. [3]
Lielākā daļa jaunāko pētījumu veltīti neirogēno OH patoģenēzes, morfoloģijas un diagnostikas jautājumiem, sevišķi pamatojoties uz mūsdienu augsti informatīvo nervu sistēmas radioloģisko diagnostikas metožu rezultātiem.


1. tabula
Biežākās neneirogēnās ortostatiskās hipotensijas formas
- Pēc Graba (Grubb B. P.) [3] datiem starp neirogēnām OH vislielākā sastopamība ir pierādīta autonomām neiropātijām (10-50 uz 100 000 iedzīvotāju), īpaši izdalot diabētisko autonomo neiropātiju.
- Otra biežākā neirogēnā OH, ir idiopātiska posturāla hipotensija (pašlaik to apzīmē kā tīro autonomo disfunkciju), kuras prevalence svārstās līdz 30 uz 100 000 iedzīvotāju.
- Trešajā neirogēnās OH grupā iekļautas slimības, kas apzīmētas ar kopīgu nosaukumu - multiplās sistēmas atrofijas (MSA) - un to sastopamība ir 5-10 uz 100 000 iedzīvotāju.
Runājot par vecuma īpatnībām, jāatzīmē, ka neirogēna OH visbiežāk izpaužas pēc 50 gadu vecuma, un tās sastopamība strauji pieaug pēc 75 gadu vecuma. Dzimumu atšķirības tika izvērtētas tikai atsevišķām neirogēnās OH formām, nosakot šādas attiecības: vīrieši : sievietes = 2:1.
Neneirogēnās OH iekļauj šādas apakšgrupas: sakarā ar sirds patoloģiju, intravaskulārā tilpuma samazinājumu, metaboliem traucējumiem un medikamentiem (1. tabula). Neneirogēno OH sindromu sastopamības biežumam jeb prevalencei nav pārliecinošas vecuma un dzimuma atšķirības. [4]
Ortostatiskās hipotensijas patofizioloģija un patoģenēze
Posturālas normotensijas uzturēšan bez pārmērīga sirds ritma pieauguma atkarīga no adekvāta asins tilpuma, dažādu reflektoro un humorālo sistēmu līdzsvara un no smadzeņu, šķērssvītrotās muskulatūras un vēdera dobuma orgānu asinsapgādes stāvokļa. [2]
![Asinsspiediena un asins cirkulācijas reflektorā kontrole: barorefleksi [10]](https://cdn.doctus.lv/media/2011/09/2/original/12ede1b7f60d.jpg)
![Asinsspiediena un asins cirkulācijas reflektorā kontrole: barorefleksi [10]](https://cdn.doctus.lv/media/2011/09/2/original/12ede1b7f60d.jpg)
1. attēls
Asinsspiediena un asins cirkulācijas reflektorā kontrole: barorefleksi [10]
Hipovolēmija izraisa OH pat tad, ja vaskulārie refleksi nav bojāti, un tā var būt saistīta ar denervāciju, samazinātu vaskulāro tonusu un palielinātu vaskulāro kapacitāti. Pacientiem saistībā ar norepinefrīna (NE) un tā mediēto signālu bojājumu var attīstīties hipovolēmija arī gadījumos, kad plazmas tilpums ir normāls vai palielināts. Tomēr jāuzmanās arī no plazmas tilpuma paaugstināšanās OH pacientiem. Samazināta eritrocitārā masa un hroniska autonoma nepietiekamība var izraisīt OH simptomus, un anēmijas korekcija ar eritropoetīnu samazina ortostatisko intoleranci. [5; 6]
Asinsspiediena un asins cirkulācijas reflektoro kontroli nosaka divu barorefleksu grupas: arteriāla (augsta spiediena) un venoza (zema spiediena) (1. attēls). Kad krītas sistēmiskais pulsa spiediens un vidējais arteriālais spiediens, tad karotīdā sinusa un aortas loka barorefleksi zaudē aktivitāti. Aferentā informācija no karotīdā sinusa tiek novadīta pa n. glossopharyngeus, bet no aortas loka pa n. vagus uz nucl. tracti solitarii, no kura polisimpātiskie kardiovagālie impulsi tiek novadīti uz nucl. ambiguus un nucl. dorsalis nervi vagi un tālāk uz sinuatriālo mezglu. Orālā ventrolaterālā iegareno smadzeņu daļa regulē simpātisko fun-kciju, no tās savukārt atzarojas ceļi uz muguras smadzeņu torakālo intramediolaterālo daļu, no kurienes impulsi tiek novadīti uz sirdi, perifērām artērijām un vēnām. [7]
Reducējoties centrālajam venozajam spiedienam, aktivizējas zema spiediena baroreceptori. No kardiopulmonāliem receptoriem atzarojas nemielinizētas vagālas šķiedras uz nucleus tracti solitarii, un aferentie ceļi ir tādi paši kā arteriāliem baroreceptoriem. Baroreceptoru disfunkcija, īpaši gadījumos, kad ir bojātas eferentās simpātiskās šķiedras, klīniski izpaužas ar guļus stāvokļa hipertensiju, homeostatisku asinsspiediena pielāgošanas spēju zudumu un naktī aug-stāku asisspiedienu nekā dienā. Vēdera dobuma asinsvadu kapacitāte ir ar lielu tilpumu, tāpēc attece no šī asinsvadu baseina ir nozīmīga posturālas normotensijas uzturēšanā. Mezenteriālās asinsrites baseina kapacitāti nosaka gan arteriālie, gan venozie baroreceptori, bet splanchus vēnu konstrikciju nosaka a adrenoreceptori. [8; 9] Splanchus autonomās inervācijas anomālijas ir arī pacientiem ar autonomo neiropātiju, kā arī pacientiem ar demielinizāciju un aksonu zudumu preganglionārā un postganglionārā autonomās nervu sistēmas daļā.
Lai nodrošinātu stabilu un adekvātu asinsplūsmu, neatkarīgi no sistēmiskā asinspiediena svārstībām, svarīga nozīme ir centrālai vazoregulācijai. Vidējā asinsspiediena svārstības no 50-150 mmHg cerebrālo asinsplūsmu parasti nozīmīgi neietekmē. Pētot OH pacientus, konstatē, ka cerebrāla vaskulāra autoregulācija tiek traucēta, ja sistēmiskais asinsspiediens ir pazemināts vai paaugstināts: cerebrāla perfūzija saglabājas konstanta pacientam guļus stāvoklī, bet nozīmīgi samazinās, pieceļoties stāvus. [10] Neirogēnas OH pamatā ir neadekvātas centrālās nervu sistēmas (CNS) reflektorās atbildes uz kardiovaskulāro adrenerģisko funkciju.
Autonomās nervu sistēmas (ANS) bojājums var izpausties sakarā ar postganglionārās daļas (kā, piemēram, to novēro pacientiem ar tīru autonomu disfunkciju) vai postganglionārās daļas bojājumu (kā tas ir pacientiem ar MSA). Parkinsona slimības gadījumā bojājums var būt gan pre-, gan postganglionārajā ANS daļā. OH pazīmes var izpausties gan sakarā ar aferentās inervācijas bojājumu locekļos un CNS struktūrās, gan eferentās daļas bojājuma gadījumā, ja ir pārtraukta tā refleksa loka daļa, kas nosaka autonomo atbildi. [3]
Preganglionārai ANS (parasimpātiskajai un simpātiskajai) daļai un postganglionārās sistēmas parasimpātiskajai daļai galvenais neirotransmiters ir acetilholīns, bet postganglionārajai simpātiskajai daļai - norepinefrīns, izņemot tiem holīnerģiskajiem neironiem, kas inervē sviedru dziedzerus. [4]
![Neirogēnas OH pacientiem sastopamo simptomu biežums [4]](https://cdn.doctus.lv/media/2011/09/2/original/662933b3582e.jpg)
![Neirogēnas OH pacientiem sastopamo simptomu biežums [4]](https://cdn.doctus.lv/media/2011/09/2/original/662933b3582e.jpg)
2. tabula
Neirogēnas OH pacientiem sastopamo simptomu biežums [4]
Neirogēnās un neneirogēnās ortostatiskās hipotensijas klīnisko simptomu biežums
Pamatojoties uz statistikas datiem, Lovs (Low Ph. A.) ar līdzautoriem [10] demonstrē datus par klīnisko simptomu biežumu, kas kopsummā ir ar lielām svārstībām - no 18 līdz 88%. Visbiežākā sajūta, ko atzīmē pacienti, ir noreibums, vispārējs vājums, nogurums, ievērojami retāk ir slikta dūša un vēsuma sajūta (2. tabula).
Ortostatiskās hipotensijas (intolerances) sindroma pakāpes
Lovs un Singers (Ph. A. Low; W. Singer) [10] publicēja un ikdienas klīniskajā praksē ieteica pielietot četras OH smaguma pakāpes, kam ir sevišķa nozīme diagnostikā un adekvātas terapijas indikāciju noteikšanā.
- 1. pakāpe - ortostatiski simptomi ir reti, nepastāvīgi, attīstās tikai tad, ja ir augsts ortostatisks stress. Nostāvēšanas laiks ir ≥ 15 minūtes, un ikdienas dzīves kvalitāte nav ierobežota.
- 2. pakāpe - ortostatiskie simptomi attīstās vismaz reizi nedēļā un parasti ir saistīti ar ortostatisku stresu. Nostāvēšanas laiks ≥ 5 minūtes. Daži ikdienas dzīves kvalitātes ierobežojumi.
- 3. pakāpe - ortostatiskie simptomi attīstās bieži un katrā gadījumā ir saistīti ar ortostatisko stresu. Nostāvēšanas laiks ≥ 1 minūte. Nozīmīgi ierobežota ikdienas dzīves kvalitāte. Atsevišķās dienās OH ir ≥ 50% no dienas laika.
- 4. pakāpe - ortostatiskie simptomi ir pastāvīgi, nostāvēšanas laiks daudzos gadījumos ir mazāk kā viena minūte. Sakarā ar ortostatisku intoleranci, pacientam ir jāguļ vai jālieto invalīdu ratiņi. Ja pacients pieceļas stāvus, ir presinkope vai sinkope. OH vērojama pastāvīgi.
Neirogēno ortostatisko hipotensiju biežākās klīniskās formas
Tīra autonomā disfunkcija (PAF)
Viena no biežākajām neirogēnajām OH formām literatūrā apzīmēta ar dažādiem nosaukumiem: idiopātiska posturāla hipotensija, pandisautonomija, primāra ortostatiska hipotensija jeb Bradberija-Egelstona (Bradburry-Egelston) sindroms, sporādiska idiopātiska patoloģija, kuru raksturo ģeneralizēta autonoma postganglionāra disfunkcija. [1; 11] Ņemot vērā, ka šī konkrētā ANS bojājuma aprakstīšanai lietoti dažādi nosaukumi, tika nolemts unificēt šo sindromu ar apzīmējumu - tīrā autonomā disfunkcija (Pure autonomic failure - PAF) [4].
Tīrās autonomās disfunkcijas etioloģija nav zināma, bet dažos gadījumos pierādīta saistība ar autoimūnu autonomu patoloģiju. [11] Primāri ir bojāti postganglionārie simpātiskie neironi; tas izpaužas kā samazināts neironu skaits simpātiskajos ganglijos, kas nosaka zemu noradrenalīna līmeni. [3] Atsevišķos gadījumos konstatē A3 acetilholīna receptoru antivielas. [11] Daži autori uzskata, ka 10-15% gadījumu PAF iekļaujams MSA grupā. [3]
OH pazīmes visbiežāk aizsākas vidējā vecumā (50-70 gadu vecumā) [12], un šos traucējumus biežāk konstatē vīriešiem nekā sievietēm - 2:1. [13] Slimības sākuma fāzē simptomi attīstās lēni, bieži ir slēpti, tiek uzskatīti par nespecifiskiem un var palikt neprecizēti gadiem ilgi.
PAF gadījumā raksturīga spilgta OH, kas sākumā var nebūt izteiktas pakāpes, bet parasti pacienti tās dēļ meklē medicīnisku palīdzību. Bieži pārsvarā izpaužas vagāli simptomi, ortostatisks vājums, reibonis un presinkopiāls stāvoklis galvenokārt no rīta pēc maltītes, fiziskas slodzes, karstas vannas, karstajā laikā (tā dēvētā autonomā stresa stāvoklī). Atšķirībā no kardiogēnas (vazovagālas) sinkopes - pacientiem ar progresējošu PAF OH nav saistīta ar vemšanu, sliktu dūšu un bālumu. [14] Pacienti sinkopi apraksta kā pakāpenisku apziņas un/vai samaņas zudumu. Nereti ir dažādu veidu amnēzija par notikumiem pirms un pēc sinkopes. Citas ortostatiskas sūdzības var ieilgt un izpausties kā vājums, ātra nogurdināmība, gaitas traucējumi, neskaidra redze, aizcietējumi, abdominālas sāpes, ko izraisa samazināta zarnu motilitāte, temperatūras intolerance. Raksturīga urīna retence, mutes sausums un impotence. [15] Slimībai raksturīga arī guļus stāvokļa hipertensija. Vīriešiem kā pirmais simptoms bieži ir impotence un samazināts libido, bet sievietēm pirmie simptomi ir urīna retence vai inkontinence. PAF var izraisīt dažādus funkcionālus traucējumus, bet reti izraisa nāvi. [4] PAF norise dinamikā 10-15% gadījumu var būt nelabvēlīga, tai pievienojas CNS bojājums, kā tas raksturīgi multisistēmas atrofijai.
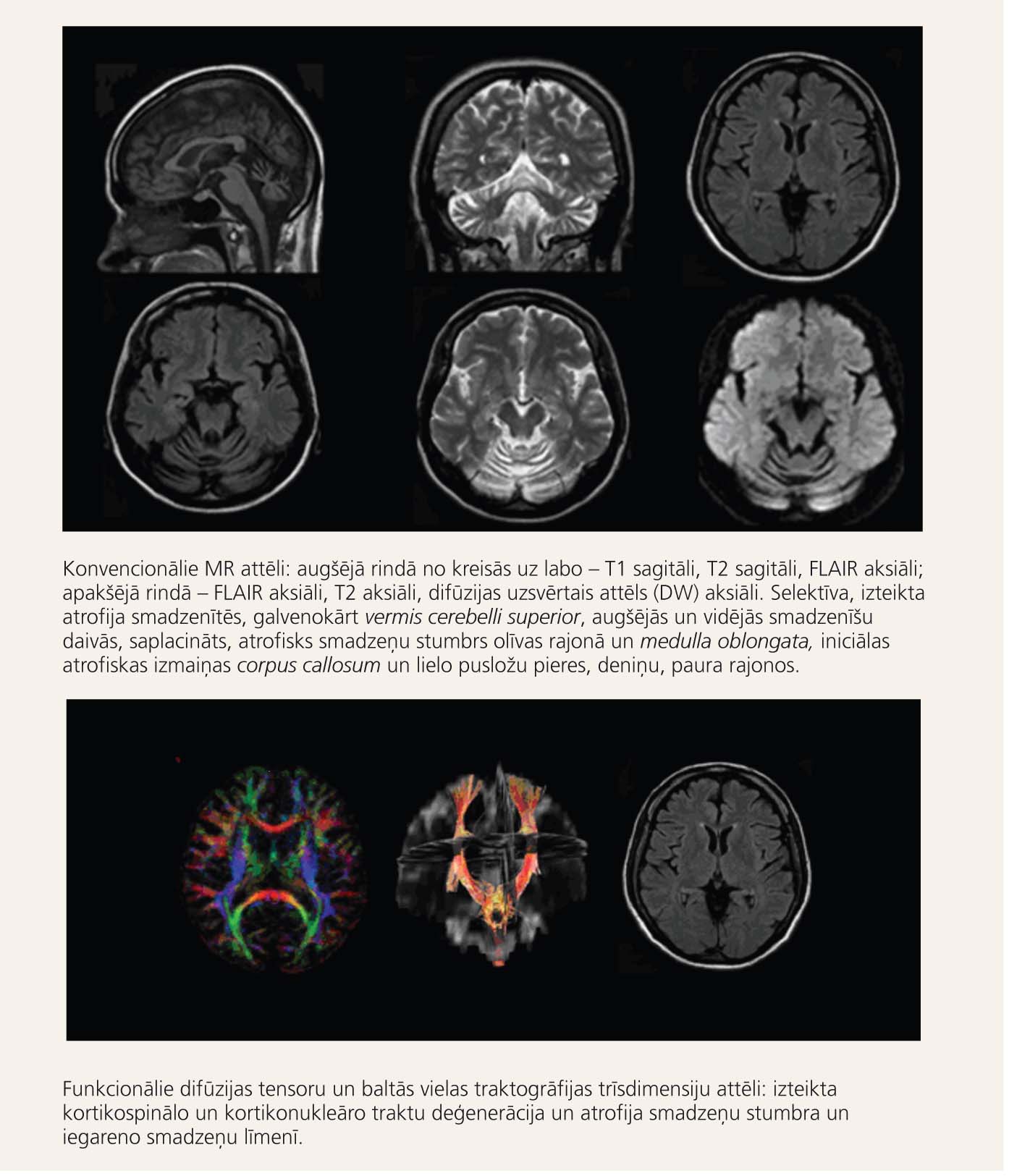

2. attēls
Attēldiagnostikas metodes neirogēniem OH sindromiem (paciente ar olivopontocerebellāru atrofiju – 38 gadi, grūti staigāt un koordinēt kustības)
Multisistēmas atrofija
Multisistēmas atrofijas (MSA) grupā iekļautas vairākas slimības formas, kas ir kā sporādiska progresējoša CNS slimība, kurai raksturīga autonomā disfunkcija, sevišķi OH, kā arī parkinsonisma un ataksijas klīniskās izpausmes. [1]
MSA vīriešiem sastopama divreiz biežāk nekā sievietēm. [13] Slimības simptomi visbiežāk sāk izpausties pēc 50 gadu vecuma un noris ar vidējo dzīvildzi seši līdz deviņi gadi. MSA pacientiem visos gadījumos CNS ir atrodami a sinukleīna pozitīvie ieslēgumi (Levī ķermenīši) dažādos smadzeņu reģionos, biežāk substantia nigra, putamen, oliva inferior, striatum, pons kodolos un citos smadzeņu stumbra kodolos, smadzenītēs un torakolumbālās daļas muguras smadzeņu kodolos. Bojājums izpaužas kā primāra neironāla deģenerācija ar neironu zudumu un gliozi. [3]
MSA klīniskās pazīmes visbiežāk sākas ar simptomiem, kas raksturīgi PAF pacientiem, vēlāk pievienojas somatiskās NS traucējumi. Līdzīgi kā PAF gadījumā attīstās presinkope un sinkope - arī MSA pacienti meklē medicīnisku palīdzību sakarā ar šiem simptomiem.
Atkarībā no strukturālā CNS bojājuma lokalizācijas MSA izdala trīs galvenās subgrupas. [4]
MSA-P
Pirmajā MSA slimību grupā iekļauti pacienti, kuriem bez autonomas disfunkcijas attīstās Parkinsona slimības simptomi. Sakarā ar strukturāla bojājuma izpausmi tie tiek apzīmēti kā striatonigrāla deģenerācija (SND) un iekļauti MSA-P slimību grupā [4].
SND gadījumā konstatē izteiktas un precīzi lokalizētas izmaiņas putamen un substantia nigra rajonā, mazāk iesaistītas ir arī citas bazālo gangliju daļas. Nereti grūti diferencēt SND no Parkinsona slimības. SND klīniskajā ainā bieži pievienojas cerebellāra ataksija, bet, atšķirībā no PD, SND gadījumā dominē rigiditāte bez izteikta tremora, novērojama progresējoša amīmija un locekļu akinēzija. [12] MSA-P slimniekiem nav raksturīgs zobrata fenomens, kas ir tipisks Parkinsona slimības pacientiem. Turklāt pacientiem ar SND nenovēro efektu no pretparkinsonisma terapijas. Pacientiem ar SND bez OH lēkmjveidīgām un permanentām pazīmēm raksturīgi vēl citi ANS bojājuma simptomi, bieži vērojama urīna nesaturēšana vai retence, impotence. Demence šajos gadījumos ir mazāk izteikta un nav tik bieži sastopama kā Parkinsona slimības gadījumā. [3]
Slimības diagnostikā ļoti liela nozīme ir magnētiskās rezonanses attēldiagnostikai, kas bieži ticami apstiprina diagnozi.
MSA-C
Otrajā MSA grupā ir iekļauti pacienti ar cerebellāru bojājumu, kas var kombinēties ar piramidālu bojājumu. Pateicoties tipiskai procesa lokalizācijai, slimībai tiek pielietots apzīmējums olivopontocerebellāra atrofija (OPCA) un tā tiek apzīmēta kā MSA-C forma. [15]
Pacientiem ar OPCA klīniskajā ainā dominē statiska ataksija ar gaitas traucējumiem, var būt kustību ierobežojums locekļos. Runas traucējumi parasti izpaužas kā progresējoša dizartrija, dikcijas zudums, var būt mērķa trīce locekļos. [10] Klīniskajā ainā raksturīgi dažādu variāciju simptomu kompleksi - ataksija, dizartrija, kinētisks tremors, horeja, distonija, spastika, kā arī neiropātija un tīklenes deģenerācija.
Slimības diagnozē svarīga nozīme ir magnētiskās rezonanses attēldiagnostikai; deģeneratīvo slimību diagnostikā izmantojami arī difūzijas tensoru attēli un traktogrāfija, kas ataino smadzeņu baltās vielas saistības (2. attēls 8. lpp.).
MSA-A
Trešajā MSA grupā ir pacienti ar jauktu MSA formu (MSA-A) jeb Šaja-Dragera (Shy-Drager) sindromu, kuriem dominē autonomā nepietiekamība. [1; 4] Klīnika līdzīga kā Parkinsona slimības gadījumā, taču ANS bojājums ir izteiktāks un OH ir prominentākais simptoms.
Autonomās nervu sistēmas bojājuma raksturojums un OH Parkinsona slimības pacientiem
Parkinsona slimība (PD) ir idiopātiska neirodeģeneratīva slimība, kas raksturojas ar dopamīnerģisko pigmentēto šūnu zudumu substantia nigra, putamen un nucleus caudatus rajonā. Ar PD slimo vidēji 1% no populācijas pēc 65 gadu vecuma. Līdz nesenu pētījumu rezultātiem uzskatīja, ka OH sindromu PD pacientiem izraisa medikamenti un aktivitātes trūkums. Lielākā daļa no dopamīnerģiskajiem medikamentiem PD terapijā tik tiešām var izraisīt OH, bet arī PD pati par sevi var izraisīt OH un citus autonomās mazspējas simptomus. Dominējošie PD simptomi ir ekstrapiramidāli motori traucējumi, īpaši tremors, kas var būt asimetrisks, akinēzija un rigiditāte. Vēlākos slimības posmos pacientiem bieži attīstās autonoma mazspēja, kas apgrūtina diferenciāldiagnozi starp MSA un PD. Diferencēt MSA parkinsonismu no PD ir apgrūtināti un nesenos pētījumos pierādīts, ka 7-22% PD pacientu autopsijās pierādīta MSA. MSA progresējot, 90% pacientu novēro parkinsonisma pazīmes, 80% - autonomo mazspēju un augšējo motoro neironu bojājumu pazīmes. [4; 10]
MSA pacientiem bieži novēro tremoru, kas atšķirībā no PD tremora ir simetrisks. MSA pacientiem parasti dopamīnerģiskā terapija nav efektīva. Atšķirīgi ir arī MS-AP un PD pacientu magnētiskās rezonanses dati. [7]
Perifērās autonomās neiropātijas
Autonomo neiropātiju iemesli var būt dažādi - autoimūna patoloģija, metaboli traucējumi, intoksikācija u. c.
Atsevišķi no citām autonomām neiropātijām tiek izdalīta diabētiskā autonomā neiropātija. Diabētiskas neiropātijas pacientiem ir perifērās nervu sistēmas (PNS) bojājums un sīko mielinizēto un nemielinizēto nervu šķiedru zudums splanchus sistēmā, karotīdajā sinusā un vagus nervos.
![Standarta diagnostiskie testi autonomās nervu sistēmas izvērtēšanai [4]](https://cdn.doctus.lv/media/2011/09/2/original/7a49cc20f65b.jpg)
![Standarta diagnostiskie testi autonomās nervu sistēmas izvērtēšanai [4]](https://cdn.doctus.lv/media/2011/09/2/original/7a49cc20f65b.jpg)
3. tabula
Standarta diagnostiskie testi autonomās nervu sistēmas izvērtēšanai [4]
Sākotnēji autonoma neiropātija ir asimptomātiska, bet turpmāk sāk izpausties vagāli traucējumi, tādi kā palēnināts sirds ritms dziļas ieelpas laikā, attīstās sudomotorās funkcijas zudums, ko izvērtē, izmantojot QSART testu (2. tabula).
Autonomas neiropātijas pacientiem raksturīga OH, kas bieži kombinējas ar impotenci, urīna inkontinenci, zīlīšu anomālijām, gastroparēzi, sliktu dūšu, vemšanu, fekāliju inkontinenci. Var būt hipoglikēmijai raksturīgie simptomi, ja ir samazināta epinefrīna izdale virsnieru dziedzera simpātiskās inervācijas bojājuma dēļ. Paaugstināts insulīna līmenis var saasināt OH simptomus. Autonomas disfunkcijas pacientiem dažreiz EKG novēro pagarinātu QT intervālu, rodas aritmija un var iestāties pat pēkšņa kardiāla nāve.
Hiperglikēmija diabēta pacientiem ir tiešs autonomo traucējumu riska faktors [4; 10].
Ortostatiskas hipotensijas sindroma diagnostika
Funkcionālie diagnostiskie testi
OH diagnostiskā liela nozīme ir anamnēzei, uzmanīgai pacienta subjektīvo izjūtu iepazīšanai, detalizētai vispārējai un neiroloģiskai izmeklēšanai. Jāizvērtē 12 novadījumu EKG un rutīnas laboratorisko izmeklējumu dati. Jāveic asinsspiediena mērījumi guļus un stāvus pozīcijās. Neirogēnās OH pacientiem bieži nepieciešams veikt neiroradioloģiskos, elektrofizioloģiskos un ultrasonoloģiskos izmeklējumus. [2]
Kardiovaskulārā reakcija uz piecelšanos stāvus jānovērtē, reģistrējot asinsspiedienu un sirds ritmu guļus stāvoklī un trīs minūšu laikā pēc piecelšanās. Gadījumā, ja aktīvais piecelšanās tests ir negatīvs, pacientiem, kuriem ir aizdomas par OH, un pacietiem ar progresējošiem motoriem traucējumiem, īpaši ar parkinsonismu, ataksiju, un ANS bojājuma simptomiem, rekomendē slīpā galda ar kāju balstu pielietošanu. Horizontālā stāvoklī pacientam nosaka sirdsdarbības biežumu un asinsspiedienu. Pēc tam slīpajam galdam paceļ galvas daļu par 60˚ un mēra asinsspiedienu un sirds ritmu trīs minūšu laikā. [16; 17] Vērtē asinsspiediena un sirds ritma izmaiņu adrenerģisko un kardiovaskulāro atbildi uz galvas pacelšanas testu (HUT). Tests jāvērtē kā pozitīvs, ja sistoliskais spiediens krītas vairāk par 20 mmHg un diastoliskais par 10 mmHg no asinsspiediena guļus stāvoklī. Ja parādās OH simptomi, pacients nekavējoties jānogulda horizontāli.
Retāk izmantojami testi, ar kuru palīdzību vērtē ANS atsevišķu funkciju traucējumus, redzami 3. tabulā.
Farmakoloģiskie diagnostiskie testi
Farmakoloģiskie testi galvenokārt palīdz diferencēt ANS traucējumus sakarā ar centrālās un perifērās nervu sistēmas bojājumu. OH farmakoloģiskais diagnostiskais tests ar plazmas norepinefrīna (NE) mērījumu guļus un pēc piecām minūtēm stāvus pozīcijā: postganglionāras patoloģijas gadījumā guļus stāvoklī NE līmenis ir samazināts, to bieži novēro autonomās neiropātijas un PAF pacientiem. Lai novērtētu postganglionāro adrenerģisko funkciju, izmanto arī tiramīna (atbrīvo NE postganglionārajās terminālēs) un fenilepinefrīna (kas darbojas kā tiešais a-2 agonists) līmeņu noteikšanu. Postganglionāra bojājuma gadījumā atbilde uz tiramīnu ir reducēta, bet ir paaugstināta reakcija uz fenilepinefrīnu. Var veikt gangliju blokādes ar trimetafānu, un preganglionāra bojājuma gadījumā novēro krietnu asinsspiediena krišanos blokādes rezultātā. Ar arginīna vazopresīna noteikšanu izvērtē ANS aferentos centrālos ceļus. [3]
Attēldiagnostikas metodes neirogēniem OH sindromiem
Svarīga klīniskās diagnozes nozīme ir magnētiskās rezonanses (MR) izmeklējumiem. MSA-P pacientiem dominē šķidruma zudums un T2 sekvences attēlos redzama hiperintensitāte putamen, globus pallidus un smadzeņu baltajā vielā. [3] MSA-C gadījumā MR izmaiņas novēro pārsvarā cerebellum, pons, oliva inferior atrofijas veidā.
Goldšteins ar līdzautoriem apraksta [18], ka arī ar fotonu emisijas tomogrāfiju (PET) iespējams diferencēt dažādas autonomās mazspējas formas. Sirds simpātiskie nervi absorbē 123 I metaiodobezilguanidīnu (123 I- MIBG) un 6- (18F) fluordopamīnu, kuri veido radioaktīvus pūslīšus simpātisko nervu terminālēs. Tādējādi var vizualizēt sirds simpātisko inervāciju. Vizualizācija nav atkarīga no adrenoreceptoru saistīšanās, jo to nosaka galvenokārt indikatorvielu aktīvais transports. [4]
Ģenētiskie testi
Pašreiz šietesti ir pieejami tikai atsevišķām CNS slimībām, kas raksturojas ar neirogēnu OH sindromu. [10]
Ortostatiskās hipotensijas sindroma ārstēšanas principi
Režīma ieteikumi
Nervu sistēmas slimībai, kura raksturojas ar OH, paralēli etioloģiskai un patoģenētiskai ārstēšanai nozīmīgi pielietot adekvātu posturālās hipotensijas kontroli un ārstēšanu.
Svarīgi ir zināt, ka:
- OH simptomus var mazināt, guļot gultā ar 20-30 cm paceltu galvgali;
- jābūt piesardzīgam, atrodoties vidē ar paaugstinātu temperatūru, karstā vannā, dušā vai pirtī, kas ir autonomā stresa stāvokļi;
- jāizvairās no ilgstošas gulēšanas dienas laikā, straujas galvas pozas maiņas [19], straujas piecelšanās no guļus stāvokļa stāvus;
- jāierobežo lielas ēdiena porcijas, īpaši ar ogļhidrātiem bagātas, un arī alkohols.
Izjūtot presinkopiālus simptomus, rekomendē veikt fiziskus vingrinājumus. OH simptomus mazina individuāli pieskaņotas fiziskās aktivitātes, vingrojumu programmas, kā, piemēram, kāju krustošana ar augšstilbu stiepšanu, ikru un muguras muskuļu aktivācija, liekšanās uz priekšu, pietupieni.
Vēnu dilatācijas mazināšanai OH pacientiem ieteicama elastīgo zeķu un abdominālo saišu pielietošana. [20; 21]
Lai kompensētu renālu sāls zudumu, ar uzturu iesaka uzņemt vismaz 8 g (150 mmol) sāls un 2-2,5 l ūdens dienas laikā. [22]
Pirms farmakoloģiskās terapijas uzsākšanas nepieciešams 24 stundu laikā veikt asinsspiediena un pulsa mērījumus; vēlams pacientiem pašiem mērīt asinspiedienu katru dienu vienā laikā un OH sūdzību rašanās laikā. Jāierobežo hipotensīvo medikamentu uzņemšana pēc sešiem pēcpusdienā.
Farmakoloģiskā terapija
Ja pacienti ar OH ievēro iepriekš noteiktos ierobežojumus dzīves režīmā un pielieto atbilstošus vingrinājumus, bet vēlamo rezultātu nesasniedz, un sevišķi, ja pacientam ir trešā vai ceturtā OH pakāpe, nepieciešams rekomendēt farmakoloģisko terapiju.
- Kā pirmās izvēles medikaments rekomendējams fludrokortizona acetāts, kas ir sintētisks minerālkortikoīds ar minimāliem glikokortikoīdu efektiem. Tas palielina nātrija absorbciju nierēs un plazmas tilpumu. Veicina a-adrenoreceptoru sensibilizāciju un var pastiprināt noradrenalīna darbību. Pēc orālas fludrokortizona uzņemšanas tas viegli absorbējas, un 45 minūšu laikā tiek sasniegts tā pīķis plazmā. Eliminācijas pusperiods ir septiņas stundas. Kā terapijas blakusefekts iespējama tūska. Pacientiem ar zemu plazmas albumīnu līmeni fludrokortizons būtu lietojams piesardzīgi. Lielas preparāta devas var izraisīt palielinātu šķidruma daudzumu organismā un sastrēguma sirds mazspēju, guļus stāvokļa hipertensiju un hipokaliēmiju. [23] Lai to novērstu, ieteicams lietot ar kāliju bagātu uzturu - augļus, dārzeņus, putnu gaļu, zivis. Diēta ar lielu sāls daudzumu, pacelts gultas pagalvis (20-30 cm) un mazas devas fludrokortizona (0,1-0,2 mg) efektīvi novērš OH simptomus. [2]
Citu grupu medikamenti OH korekcijai uzskatāmi par otrās izvēles preparātiem.
- Viens no biežāk pielietojamajiem medikamentiem ar simpatomimētisku ietekmi ir midodrīns; tas ir a-adrenoreceptoru ag onists, kura efektivitāte ir novērota PAF un MSA pacientiem OH ārstēšanai. Midodrīna sākumdeva ir 2,5 mg perorāli divas trīs reizes dienā, turpmāk devu palielinot līdz 10mg dienā. Midodrīns ir rekomendēts monoterapijā vai kombinācijā ar fludrokortizonu. Midodrīns jālieto piesardzīgi pacientiem ar aknu disfunkciju, tas ir kontrindicēts pacientiem ar smagām sirds slimībām, nieru mazspēju, urīna retenci un tireotoksikozi. [24]
- Pacientiem ar PAF un MSA simptomātiskai OH kontrolei efektīvi pielietojams ir dihidroksifenilserīns (L-DOPS), kas 200- 400mg devā dienā paaugstina AS un ortostatisko toleranci, un to uzskata par vienīgo efektīvo terapijas metodi pacientiem ar dopamīna b-hidroksilāzes nepietiekamību. [25]
- Somatostatīna analogs okreotīds PAF pacientiem efektīvi reducē OH postprandiālo un ekskrēcijas izraisītu hipotensiju, neizsaucot nakts hipertensiju. Akūti un ilgstoši lietojot šo preparātu, reducējās OH simptomi arī MSA pacientiem. Sevišķi kombinācijā ar midodrīnu. [26] Okreotīds pielietojams subkutāni sākumā 25 μg, turpmāk devu palielinot līdz 50 μg.
- Atsevišķi pētījumi apstiprina iespēju OH korekcijai lietot dihidroergotamīnu, kas ir a-adrenoreceptoru agonists un stimulē venozās sistēmas konstrikciju, samazinot vēnu kapacitāti. Preparātu pielieto perorāli 3-5 mg dienā. [2]
- Pacientiem ar terapijas rezistentu OH dažos trešā līmeņa pētījumos apstiprināta johimbīna (26 mg dienā) efektivitāte. [2]
Visu minēto OH koriģējošo medikamentu pielietošanu jāveic, individuāli apsverot devas, veicot testēšanu un uzmanīgi izvērtējot zāļu panesamību, efektivitāti un iespējamās blaknes.