Galvas smadzeņu bojājuma patoģenēze
Nepieciešamība uzlabot GST profilaksi un ārstēšanu ir aktuāla. Lai to paveiktu, jāizprot GST izraisītu smadzeņu bojājumu patoģenēze. Tas ļaus izvēlēties gan piemērotāko GST klasifikācijas sistēmu, gan arī pierādījumos balstītas izmeklēšanas, ārstēšanas un profilakses metodes.
Primārs bojājums
Primāru bojājumu rada traumējoša spēka iedarbība. Parasti vairāk cieš smadzeņu daiva, kas ir tuvāk spēka pielikšanas vietai, tomēr iespējama arī t.s. pretsitiena jeb contre coup trauma, jo trieciena rezultātā smadzenes var pārvietoties un atsisties pret galvaskausa daļu pretējā galvas pusē, kas ir ceļā kustības vektoram. Piemēram, sitiens pa pakausi tādā veidā var radīt gan pakauša, gan arī pieres daivu sasitumu (kontūziju). Ja GST ir penetrējoša, smadzeņu bojājumu rada trieciens pa galvu, pats svešķermenis un kaula fragmenti. Biežāk tas notiek šautu ievainojumu rezultātā. Nopietnākie primārā bojājuma veidi GST gadījumā var būt: difūzs aksonāls bojājums (DAB), smadzeņu sasitums vai plīsums, dažādi asinsvadu bojājumi.
Difūzs aksonāls bojājums (DAB)
Agrāk bija pieņemts uzskatīt, ka DAB raksturīgs tikai smagai GST, bet jaunākie pētījumi šo priekšstatu ir mainījuši. Pat la ban pierādīts, ka DAB ir visu GST pavadonis, un tieši DAB veids un lokalizācija nosaka GST smaguma pakāpi un prognozi. [4] Piemēram, vieglas GST gadījumā aksonu bojājumi ir nenozīmīgi (biežāk - intracelulāri) un pārsvarā lokalizēti pusložu baltajā vielā [5]; šūnu un sinapšu bojājumi ir atgriezeniski. Toties smagas GST gadījumā aksonu bojājumi ir izteikti, lielā daudzumā un lokalizēti arī smadzeņu stumbrā; bojāto šūnu reģenerācija ir apgrūtināta vai neiespējama. Pacientus pēc vidēji smagas un smagas GST izmeklējot ar magnētisko rezonansi (MR), DAB tiek konstatēts 65% gadījumu. [6]
Smadzeņu sasitums vai plīsums
Īpaši spēcīgs traumējošs spēks rada smadzeņu kontūzijas zonu, kur ir daudz mehāniski bojātu smadzeņu šūnu un var būt asins izplūdumi no bojātajiem asinsvadiem. Vissmagākajā formā tas izpaužas kā galvas smadzeņu plīsums vai sašķaidījums, kas parasti nav savienojams ar dzīvību.
Dažādi asinsvadu bojājumi
Nosacīti vieglākais asinsvadu bojājuma veids ir asiņu-smadzeņu barjeras (ASB) bojājums. ASB veidojas no asinsvadu endotēlija šūnām, ko apņem astrocītu izaugumi. Signāli no astrocītiem regulē endotēlija caurlaidību. [7] ASB var tikt mehāniski bojāta gan astrocītu, gan endotēlija bojājumu dēļ. Ekstravazālajā telpā bez fizioloģiskas nepieciešamības nokļūst liela izmēra molekulas, kā arī papildu šķidrums, radot priekšnoteikumus ekstracelulāras tūskas attīstībai. Ja ASB bojājums ir lokāls, tā radītā perivazālā tūska apgrūtina mikrocirkulāciju un paaugstina lokālas išēmijas risku. Plašs ASB bojājums var nopietni apdraudēt intrakraniālo homeostāzi kopumā.
Ja GST rezultātā ir plīsusi artērija vai vēna, sākas intrakraniāla asiņošana, kas var izraisīt subarahnoidālu asinsizplūdumu vai hematomu. Hematomas veidošanās ir viena no bīstamākajām GST sekām, jo bieži apdraud cietušā dzīvību straujas intrakraniālā spiediena (IKS) paaugstināšanās un smadzeņu dislokācijas dēļ. Atbilstīgi lokalizācijai hematomas iedala:
- intracerebrālās (smadzeņu parenhīmā),
- intraventrikulārās (smadzeņu vēderiņos jeb likvora dobumos),
- subdurālās (starp smadzeņu virsmu un cieto apvalku),
- epidurālās (starp cieto apvalku un galvaskausu).
Sekundārs bojājums
Sekundārs bojājums attīstās citotoksisku procesu, išēmijas, hipoksijas, IKS paaugstināšanās, smadzeņu dislokācijas un iekaisuma rezultātā.
Citotoksisks process
Smadzeņu šūnu bojāeja mehānisku bojājumu vai/un išēmijas un hipoksijas dēļ ļauj izplūst ekstracelulārajā telpā aminoskābēm, ko sauc par neirotransmiteriem. Nelielā koncentrācijā tie nodrošina signālu pārvadi starp šūnām, bet lielā koncentrācijā darbojas citotoksiski, traucējot normālu šūnu darbību [8] un veicinot mikrocirkulācijas traucējumus.
Išēmija
Sekundāra cerebrāla išēmija ir konstatēta 90% nāves gadījumu pēc smagas GST. [9] Lokālas išēmijas attīstību veicina ASB bojājuma radīta ekstracelulāra tūska, kā arī tromboze artēriju sieniņas iekšējo slāņu traumatiska bojājuma dēļ. [10] Vispārēju cerebrālu išēmiju izraisa arteriālā spiediena mazināšanās un/vai IKS paaugstināšanās. Kā lokālu, tā vispārēju cerebrālu išēmiju bīstamāku padara hipoksija, ko var izraisīt gan nepilnvērtīga elpošana, gan arī anēmija.
Lai raksturotu galvas smadzeņu asinsriti, mēdz izmantot tādus rādītājus kā cerebrālās perfūzijas spiediens (CPP) un asins plūsma (ml) uz 100 g smadzeņu vielas minūtē. CPP ieteicams uzturēt ap 60 mmHg [11], jo tālākas pazemināšanās gadījumā cerebrālā asins plūsma tuvojas 20 ml/100 g/min., kas liecina par cerebrālu išēmiju [14; 15] un tās izraisītu kaitīgu bioķīmisku procesu kaskādi. Būtiska nozīme kaskādē ir pārmērīgai ūdens ieplūdei šūnās: veidojas intracelulāra (citotoksiska) tūska, kas vēl vairāk apgrūtina mikrocirkulāciju, kā arī paaugstina IKS.
Gan lokālu, gan vispārēju išēmiju var izraisīt traumatisks subarahnoidāls asinsizplūdums. Kā vadošais patoģenētiskais mehānisms šajā gadījumā darbojas artēriju spazma, kas īpaši bīstama, ja anatomisku īpatnību dēļ ir samazināta kolaterālas asinsrites iespējamība.
IKS paaugstināšanās
IKS paaugstināšanos izraisa šķidruma uzkrāšanās galvaskausa dobumā. GST gadījumā tas notiek, kombinējoties ekstracelulārai un intracelulārai smadzeņu tūskai. Papildu iemesli var būt hematomas veidošanās vai likvora uzkrāšanās ventrikuļos tā atplūdes ceļu nosprostojuma dēļ (okluzīva hidrocefālija). Kā biežāko okluzīvas hidrocefālijas iemeslu pēc GST var nosaukt intraventrikulāru asinsizplūdumu. Nav vēlams, ka IKS pārsniedz 20 mmHg. [11; 13]
Smadzeņu dislokācija
Ja IKS nozīmīgi paaugstinās vienā galvas smadzeņu puslodē (tūska, hematoma), tas var dislocēt smadzenes vispirms horizontālā plaknē, radot smadzeņu viduslīnijas nobīdi un smadzeņu daļu saspiedumu pret falx cerberi un/vai tentorium cerebelli. Tālāka IKS paaugstināšanās var radīt arī smadzeņu stumbra vertikālu dislokāciju kaudālā virzienā. Tas ir īpaši bīstami, jo smadzeņu stumbra ieķīlēšanās lielajā pakauša kaula atverē izraisa dzīvībai svarīgu struktūru bojājumu un nāvi.
Retāk iespējama kaudāla galvas smadzeņu dislokācija pārāk zema IKS dēļ. Jāatceras, ka galvas smadzenes nosacīti peld likvorā. Ja pēc traumatiska galvaskausa bojājuma vai operācijas ir radušies lieli likvora zudumi, atlikušais šķidruma daudzums vairs nespēj nodrošināt pietiekamu hidrostatisko spēku un smadzenes noslīd uz galvaskausa pamatnes. [16]
Aseptisks smadzeņu iekaisums
Aseptisks smadzeņu iekaisums pēc GST attīstās kontūzijas zonā un tās apkārtnē kā organisma reakcija uz bojātu un bojā gājušu šūnu klātbūtni. [9; 17; 18] Tas veicina tūsku. Vaļējas vai penetrējošas GST gadījumā var pievienoties iekaisums.
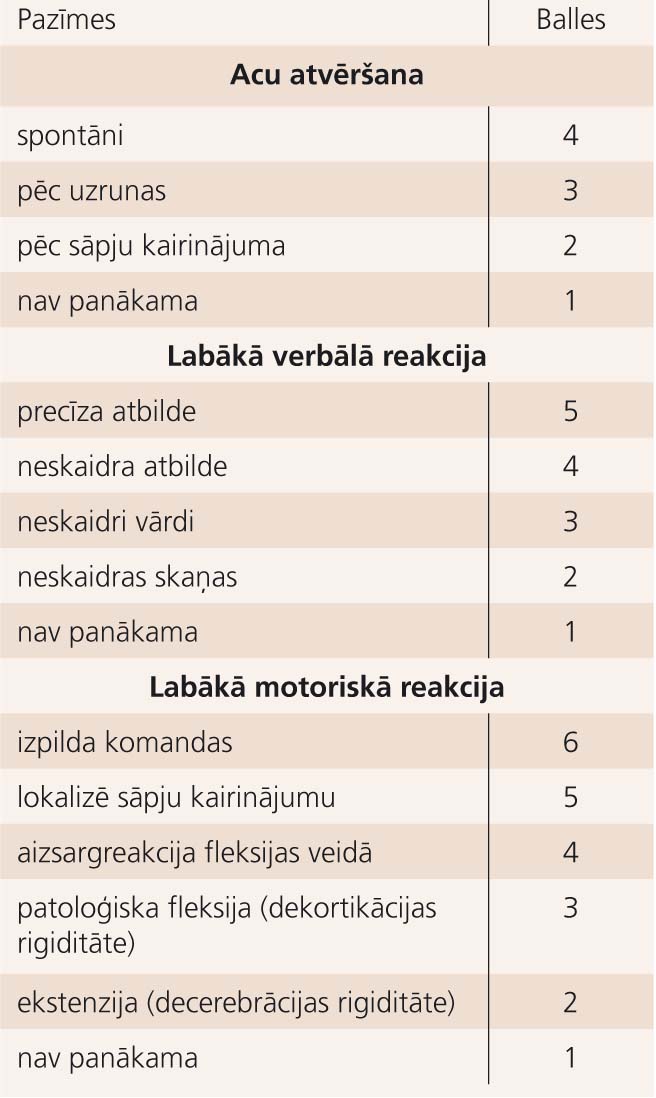

1. tabula
Glāzgovas komas skala
Klasifikācija
GST klasifikācijas galvenais mērķis ir iespējami precīzi noteikt smadzeņu bojājuma smaguma pakāpi, lai izvēlētos piemērotāko ārstēšanu, prognozētu klīnisko gaitu un ekspertīzes gadījumā sniegtu funkcionālā bojājuma raksturojumu. Lai gan priekšstati par GST radīto smadzeņu bojājumu patoģenēzi ir samērā vienoti, viena vispāratzīta GST klasifikācija pagaidām nav ieviesta, kamēr divas populārākās ir saistītas vai nu ar Pasaules Veselības organizācijas pieņemto Starptautiskās statistiskās slimību un veselības problēmu klasifikācijas (SSK), vai Glāzgovas komas skalas [19] (skat.1. tabulu) kritēriju piemērošanu. [20] Abas šīs klasifikācijas salīdzinātas 2. tabulā.
Arī Eiropas Neirologu biedrību federācija (EFNS) ir piedāvājusi savu klasifikācijas modeli, kas daļēji balstīts Glāzgovas komas skalas (GKS) piemērošanā. [21] Tomēr dažādu iemeslu dēļ tas pagaidām nav guvis plašāku atzinību.
GST klasificēšana ne vienmēr ir viegla. Viens no grūtākajiem ir jautājums, kā atšķirt galvas sasitumu bez GST no vieglas GST (smadzeņu satricinājums jeb commotio cerebri). Te varētu palīdzēt definīcija [22]: galvas smadzeņu satricinājums ir GST, kas izraisījusi īslaicīgu samaņas vai apziņas zudumu un tādus sim ptomus kā galvassāpes, slikta dūša, kustību koordinācijas, orientācijas, uztveres un atmiņas traucējumi (amnēzija).


2. tabula
GST smaguma pakāpes aptuvens salīdzinājums biežāk lietotajās klasifikācijās
Nolūkā vērtēt bakteriālas infekcijas risku GST mēdz klasificēt arī pēc galvas audu slāņu bojājuma:
- slēgta (nav bojāts galvaskausa velves muskuļu apvalks jeb aponeiroze),
- vaļēja bez likvorejas (aponeirozes vai aponeirozes un galvaskausa bojājums),
- vaļēja ar likvoreju (galvaskausa un cietā smadzeņu apvalka bojājums),
- penetrējoša (ar smadzeņu parenhīmas tiešu primāru bojājumu).
Diagnostika
Klīniskā izmeklēšana
Klīniskajā izmeklēšanā pēc GST svarīgi novērtēt samaņas traucējumu pakāpi un mērķtiecīgi ievākt anamnēzes datus par samaņas zudumu un atmiņas traucējumiem. Īpaši svarīgi laikus konstatēt pieaugošu miegainību, galvassāpes un vemšanu, jo šie simptomi norāda uz IKS paaugstināšanos. Bez šaubām, jānovērtē galvas audu traumatiskais bojājums, jāpievērš uzmanība iespējamajiem pavadošajiem bojājumiem un vispārējam veselības stāvoklim. Saskaņā ar EFNS ieteikumiem katrs GST slimnieks būtu jāizmeklē gan ķirurģiski, gan neiroloģiski. [21]
Lai objektīvāk vērtētu sākotnējos samaņas traucējumus un līdz ar to GST smaguma pakāpi, Eiropā jau vairākus gadus par standarta instrumentu pieņemta GKS. [2] GKS palīdz precīzāk vērtēt arī samaņas stāvokļa izmaiņas. Latvijā GKS lieto arvien biežāk: piemēram, RA KUS klīnikā "Gaiļezers", izmeklējot slimniekus pēc GST, 2004. gadā GKS tika lietota 65% gadījumu. [23] Tiesa, GKS bez modificēšanas nav piemērota, izmeklējot mazus bērnus. Zināmas grūtības tās lietošanā var izrādīties arī saskarsmē ar cilvēkiem, kam jau pirms traumas bijuši dzirdes, valodas, uztveres un/vai kustību traucējumi.
Papildizmeklējumi
Papildizmeklējumu vidū par visinformatīvāko GST gadījumā var uzskatīt radioloģisko izmeklēšanu. No radioloģiskajām metodēm GST diagnostikā plašāk lieto datortomogrāfiju (DT). Ar DT iespējams precīzi vizualizēt galvaskausa lūzumu, kontūzijas zonu, intrakraniālu asiņošanu, hidrocefāliju, smadzeņu dislokāciju un lielāko daļu svešķermeņu. Lai gan MR ļauj diagnosticēt smadzeņu bojājumu precīzāk nekā DT, pagaidām nav pietiekami ticamu datu, ka papildu precizitāte būtiski mainītu ārstēšanas plānu un iznākumu.
Indikācijas neatliekamai galvas DT atbilstīgi Latvijas Neiroķirurgu asociācijas, Latvijas Neatliekamās medicīniskās palīdzības un katastrofu medicīnas asociācijas un Latvijas Rehabilitologu asociācijas ieteikumiem par GST medicīnisko aprūpi [24]:
- galvaskausa lūzums, ja ir kaut viena no šādām pazīmēm: samaņas traucējumi, epileptiska lēkme, neiroloģiski simptomi,
- vaļēja galvas trauma ar lūzumu vai penetrējošu ievainojumu,
- pieaugoši samaņas traucējumi un/vai progresējoši neiroloģiski simptomi,
- koma un neskaidra diagnoze.
Ja, veicot galvas DT pacientam ar 15 ballēm pēc GKS (GKS 15), intrakraniāli bojājumi netika konstatēti, tad arī vēlāk netika konstatētas nekādas komplikācijas. [25] Ja tūlīt pēc traumas ar DT palīdzību konstatēts traumatisks subarahnoidāls asinsizplūdums vai neliela asimptomātiska epidurāla hematoma, ir nepieciešama vismaz viena atkārtota izmeklēšana. Šādos gadījumos DT, kas veikta pēc 36-48 stundām, parasti uzrāda galīgo bojājuma apjomu. [26; 27]
Ārstēšana, prognoze un profilakse
Prehospitāla ārstēšana
Vidēji smagas un smagas GST ārstēšanu svarīgi sākt jau ceļā uz slimnīcu, veicot ārstnieciskās darbības atbilstīgi ABCDE algoritmam. Prehospitālās palīdzības galvenie uzdevumi GST gadījumā: hipoksijas, hipovolēmijas, hipotensijas novēršana. [24]
To izpildei lietojot albumīnu vai fizioloģisko šķīdumu, ticami labāks rezultāts iegūts fizioloģiskā šķīduma lietošanas gadījumos. [29] Joprojām nav pārliecinošu pierādījumu, ka prehospitāla mannitola lietošana uzlabotu GST ārstēšanas rezultātus. [30]
Hospitāla ārstēšana
Ārstēšanas papildu uzdevumi slimnīcā - atjaunot audu integritāti (brūces gadījumā) un nepieļaut IKS pārlieku paaugstināšanos un smadzeņu dislokāciju, kas apdraud dzīvību. Lai to īstenotu, var būt nepieciešama neatliekama neiroķirurģiska operācija. Ja smadzeņu tūska izraisa IKS paaugstināšanos virs 30 mmHg, kas nepakļaujas korekcijai, ir iespējama t.s. dekompresijas trepanācija. Tā var glābt dzīvību 75% gadījumu, bet 50% gadījumu rodas nopietnas blaknes un aptuveni 25% slimnieku jāsamierinās ar smagu invaliditāti. [31; 32]
Pagājušajā desmitgadē konstatēts, ka vaļējas GST (ar likvoreju) gadījumā profilaktiska antibiotiku nozīmēšana nedod ticamu labumu. Tā vietā tika ieteikts monitorēt slimnieka veselības stāvokli un nozīmēt antibiotikas tikai tad, ja tiek konstatētas meningīta pazīmes. [33] Pagaidām nav gadījies iepazīties ar salīdzinošu nejaušinātu pētījumu rezultātiem, kas pierādītu citas taktikas priekšrocības.
Prognoze
Prognoze par GST iznākumu ļauj aptuveni paredzēt slimnieka izredzes izdzīvot, kā arī novērtēt tādu vai citādu seku parādību iespējamību. Veidojot prognozi, jāņem vērā vairāki riska faktori.
Viens no nelabvēlīga iznākuma riska faktoriem ir vecums - cilvēkiem, kas vecāki par 65 gadiem, nāves risks smagas GST gadījumā ir 10 reizes augstāks nekā 15-25 gadu vecumā. [34] Vecumam jāpieskaita arī uzņemšanas nodaļā konstatēts paaugstināts seruma glikozes līmenis, zems hemoglobīns un neliels GKS ballu skaits. [35]
RAKUS klīnikā "Gaiļezers" 2004. gadā letalitāte slimniekiem ar vieglu (GKS 15-13), vidēji smagu (GKS 12-9) un smagu GST (GKS 8-3) bija attiecīgi 1,2%, 14,3% un 52,9%. [23] Eiropā vidējā letalitāte stacionētiem GST slimniekiem ir aptuveni 3%. [2] Latvijā šis rādītājs tika samazināts no 3,69% (1998.-2000. gadā) uz 2,64% (2002.-2004. gadā), statistiski ticami (p=0,03) apliecinot 2001. gadā ieviesto ieteikumu lietderību GST ārstēšanai. Slimniekiem ar vidēji smagu un smagu GST hospitālā letalitāte attiecīgajos laikposmos bija 19,1% un 13,1% (p=0,04). [3]
Riska faktori tādām GST seku parādībām kā atmiņas, uztveres un kustību traucējumi varētu būt līdzīgi iepriekš minētajiem. Tomēr t.s. pēctraumas stresa sindroma (PTSS) gadījumā situācija ir atšķirīga. Vienu gadu pēc fiziskas traumas 22% pacientu tika konstatēti psihiska rakstura traucējumi. Slimniekiem, kas bija cietuši no vieglas GST, biežākās seku parādības bija panikas lēkmes, sociāla fobija un agorafobija. Ciešāka saistība ar psihiska rakstura traucējumu rašanos starp visiem cietušajiem bija nevis vieglai GST, bet gan traumas radītiem funkcionāliem traucējumiem. [36] Līdzīga rakstura pētījums liecina, ka jebkura nozīmīga fiziska trauma - bet nevis tieši viegla GST - ir ticams riska faktors t.s. "pēcsatricinājuma sindromam", tāpēc no šāda termina vajadzētu atturēties. [37] Ārstējot PTSS, nopietnākos gadījumos būtu lietderīgi sadarboties ar psihiatru. [38]
Diemžēl pagaidām nav pierādījumu, kas ar augstu ticamības līmeni liecinātu par kāda medikamenta spēju GST gadījumā darboties neiroprotektīvi, samazinot seku parādību risku. Tāpēc iespējami daudz uzmanības jāpievērš profilaksei.
Profilakse
GST profilakse - līdzīgi citu traumu profilaksei - ir saistīta ar riska apzināšanos, prasmi novērtēt riskantu situāciju, drošības pasākumu ievērošanu un iespējami drošas vides veidošanu. [39] Izvēloties riskantu situāciju apzināti (piemēram, kalnu slēpošana, riteņbraukšana), būtu jālieto nepieciešamie aizsarglīdzekļi galvai. Arī drošības spilvenu un drošības jostu lietošana automobilī ticami mazina GST risku un smaguma pakāpi. [40]