C vīrushepatīts izplatības un klīniskās norises dēļ kļuvis par vienu no aktuālākajām infekcijas slimībām pasaulē. C hepatīta vīruss izplatās galvenokārt ar asinīm. Patlaban inficēto skaits pasaulē ir aptuveni 170 miljoni, bet Eiropā pārsniedz 9 miljonus. Pēc 2008. gada epidemioloģiskā pētījuma datiem Latvijā ir ap 40 tūkstošiem hroniska C hepatīta pacientu, HCV–RNS (C hepatīta vīrusa RNS) sastopamība Latvijā ir 1,7 procenti.
Ar C hepatīta vīrusu inficēto ir 3-4 reizes vairāk nekā ar HIV (cilvēka imūndeficīta vīrusu) inficēto. Vakcīnas, kas pasargātu no iespējas saslimt ar C hepatītu, nav. C hepatīta vīrusa infekcija var izpausties kā akūts vai hronisks hepatīts. Akūta infekcija visbiežāk (50-90% gadījumu) norit asimptomātiski; ja tomēr ir klīniskie simptomi, tie izzūd pēc dažām dienām vai nedēļām. Akūts C hepatīts reti izraisa aknu mazspēju.
Akūts C hepatīts līdz 80% gadījumu pāriet hroniskā formā. Arī hronisks C vīrushepatīts (VHC) bieži ir asimptomātiska, lēni progresējoša slimība. Ar laiku daļai pacientu attīstās ciroze. Hronisks VHC ir viens no biežākajiem aknu cirozes, hepatocelulāras karcinomas izraisītājiem un aknu transplantācijas nepieciešamības iemesliem.
C hepatīta vīruss
1960. gadu beigās un 1970. gadu sākumā kļuva skaidrs, ka daļu vīrushepatītu izraisa vēl kāds vīruss bez A un B hepatīta vīrusiem. To sauca par ne-A, ne-B vīrushepatītu. Ierosinātājs tika atklāts 1989. gadā, kad izdevās noteikt vīrusa genomu. To nosauca par C hepatīta vīrusu (HCV). Jaunais vīruss uzbūves dēļ tika iedalīts Flaviviridae dzimtā, lai gan izteiktās mainības dēļ šo vīrusu varētu izdalīt arī atsevišķā klasē. HCV nav līdzīgs nevienam no iepriekš zināmajiem hepatītu vīrusiem, bet vēlāk atklātais G hepatīta vīruss ir kaut kādā mērā līdzīgs HCV. C hepatīta vīrusa genomā ir RNS molekula, kas satur aptuveni 9500 nukleotīdu. Tajā ir stabili, nemainīgi 5' un 3' netranslējamie reģioni ar 9000 nukleotīdiem, kas kodē poli-proteīnu ar 3000 aminoskābēm. Šis proteīns pakļauts saimnieka un vīrusa enzīmu posttranslācijas procesiem un veido jaunus vīrusa strukturālos un nestrukturālos proteīnus un fermentus. Vīrusa RNS 5' netranslējamais reģions (untranslated region) ir svarīgs replikācijas procesā, tas satur nepieciešamos elementus, kas koordinē vīrusa olbaltumu sintēzi. Šis reģions ir ļoti stabils un nemainīgs, tāpēc to izmanto vīrusa RNS diagnostikai ar amplifikācijas metodi.
Daudzu RNS vīrusu, arī HCV RNS polimerāze nespēj precīzi nolasīt informāciju, tāpēc tā nevar koriģēt kļūdas, kas radušās vīrusa replikācijas laikā. Šādos nukleotīdu izmaiņu gadījumos veidojas nefunkcionējošs genoms, kas vēlāk iet bojā, jo nespēj replicēties (letāls mutants). Tomēr ne visi kļūdainie aiziet bojā, citi persistē. Tie arī nosaka vīrusa daudzveidību, kas raksturīga C hepatīta vīrusam. Šī heterogenitāte (daudzveidība, mainība) īpaši svarīga HCV infekcijas diagnostikā, patoģenēzē un terapijas efektivitātē. Tā nosaka nespēju sintezēt vakcīnu un ļauj vīrusam pretoties organisma imūnsistēmai un pretvīrusu terapijai - interferonam.
Vīrusa heterogenitāti var iedalīt pēc daudzveidības pakāpes:
- kvazitipi (quasispecies) - atšķirīgas vīrusa pasugas, kas attīstās saimnieka organismā, bet to nukleotīdu secība vismaz par 95% līdzīga sākotnējam vīrusam. Kvazitipu klīniskā nozīme nav pilnībā noskaidrota, taču ir ziņojumi par to nozīmi vīrusa persistencē, infekcijas attīstībā un atbildes reakcijā uz terapiju. Ir pētījuma dati, ka terapija ir neefektīvāka, ja nukleotīdu secības izmaiņas ir lielākas, salīdzinot ar grupu, kam tās ir mazākas;
- gadu desmitos (iespējams, gadsimtos) vīrusa mainības rezultātā radušies jauni genotipi. Nukleotīdu secības līdzība dažādiem genotipiem ir nepilni 80%. Izšķir 6 HCV genotipus un vairāk nekā 50 apakštipus.
Latvijā biežākie ir 1. un 3. genotips. Genotipu veidošanos, visticamāk, nosaka dažādi faktori (piemēram, saimnieka imunitāte, vīrusa īpašības, replikācijas efektivitāte un populācijas migrācija), tāpēc vērojama diezgan izteikta genotipu ģeogrāfiskā izplatība:
- 1. genotips biežāk konstatēts ASV un Eiropā (60-70%);
- 2. un 3. genotips ASV un Eiropā konstatēts retāk, bet 4., 5. un 6. genotips šajos rajonos praktiski nav konstatēts;
- 3. genotips biežāk konstatēts Indijā, Tālajos Austrumos, Austrālijā, retāk Eiropā;
- 4. genotips biežāk konstatēts Āfrikā un Vidējos Austrumos;
- 5. genotips biežāk konstatēts Dienvidāfrikā;
- 6. genotips biežāk konstatēts Honkongā, Vjetnamā un Austrālijā.
Arī genotipu klīniskā nozīme vēl nav pilnībā noskaidrota, tomēr skaidri zināms, ka dažādu genotipu gadījumā terapijas efekts atšķiras.
Akūts C vīrushepatīts
Epidemiologu dati liecina, ka pēdējos gados Latvijā ik gadu tiek reģistrēti apmēram 100 akūta C hepatīta gadījumi. Inkubācijas periods 14-180 dienas, vidēji 50 dienas. Diagnozes noteikšanā svarīga ir pozitīva epidemioloģiskā anamnēze: narkotiku lietošana, tetovējumi, pīrsings, manikīrs, parenterālas medicīniskas manipulācijas (medicīniski izmeklējumi, zobārsta, higiēnista pakalpojumi inkubācijas perioda ietvaros). Inficēšanās seksuālā ceļā arī iespējama, taču risks nav pārāk liels - ap 3%.
Klīniskajā ainā līdzīgi kā citu hepatītu gadījumos vēro nespecifiskas sūdzības: nogurumu, sliktu dūšu, sāpes vai diskomfortu labajā paribē, bet dzelte vizuāli vērojama ne vairāk kā 25% gadījumu.
Analīzēs paaugstināts AlAT (alanīnaminotransferāzes) līmenis, parasti virs 1000 V/l, taču dažkārt nesasniedz 1000 V/l un ir ap 800 V/l, AlAT aktivitāte pastiprinās vidēji 6-12 nedēļas (1-26 nedēļas) pēc inficēšanās, bilirubīns - normas robežās vai paaugstināts, galvenokārt uz saistītās frakcijas rēķina, pozitīvs HCV-RNS. HCV-RNS parādās dažas dienas, bet ne vēlāk kā 8 nedēļas pēc inficēšanās, tas atkarīgs no inficējošās devas, pozitīvas antivielas pret hepatīta C vīrusu (anti-HCV), taču līdz 50% gadījumu antivielas var būt negatīvas - akūtajā fāzē nav vēl izstrādājušās pietiekamā daudzumā. Tāpēc, ja ir aizdomas par akūtu C hepatītu, bet anti-HCV negatīvs, jāveic HCV-RNS analīze.
Pēc ārstēšanas ar alfa interferonu (kursa ilgums 24 nedēļas) rezultāti ir ļoti labi - virs 90%. Latvijā terapija tiek sākta uzreiz pēc diagnozes noteikšanas. Ir valstis, kur terapiju 3 vai 6 mēnešus atliek, izvērtējot, vai nenotiek spontāna atveseļošanās un HCV-RNS izzušana. Pēc atbrīvošanās no vīrusa (HCV-RNS negatīvs) antivielas saglabājas ilgstoši, iespējams, visu mūžu, tomēr pilnīgu aizsardzību šīs antivielas nenodrošina. Ir iespējama atkārtota inficēšanās.
Hronisks C vīrushepatīts
Pēc akūtā C hepatīta, kas vairāk nekā 50% gadījumu (pat līdz 90% gadījumu) norit asimptomātiski (subklīniski), līdz 80% gadījumu slimība pāriet hroniskā formā. Spontāna vīrusa izzušana hroniska VHC gadījumā ir ārkārtīgi reta. Atbrīvošanos no vīrusa nosaka dažādi faktori: vīrusa faktori (mainība, mutācijas, genotips, vīrusu slodze), slimības stadija (fibrozes pakāpe, ciroze), saimnieka faktori - vecums, dzimums, rase, smēķēšana, alkohola lietošana, blakusslimības (insulīna rezistence, aptaukošanās, HIV infekcija, autoimūnas slimības u.c.), pēdējos gados par vienu no svarīgākajiem faktoriem, kas nosaka atbrīvošanos no C hepatīta vīrusa gan spontāni, gan pēc terapijas, tiek uzskatīts IL28B kodējošā gēna polimorfisms. C/C tipa alēle ir labvēlīgāka, salīdzinot ar C/T un T/T tipa alēlēm. Pētījumu dati liecina, ka C/C tipa alēle biežāk konstatēta Eiropas iedzīvotājiem, salīdzinot ar Āfrikas iedzīvotājiem. Tomēr Latvijā veiktā pētījumā hroniska C hepatīta pacientiem C/C tipa alēle konstatēta tikai nedaudz virs 30%. Ir vēl citi faktori, kas jāņem vērā: HLA-DRB1 un DQB1 alēļu klātbūtne, neitralizējošo antivielu veidošanās pret HCV strukturālajiem proteīniem, HCV specifiska CD4 T šūnu reakcija. Interesants ir fakts, ka sievietes, kas narkotikas lieto intravenozi, biežāk spontāni atbrīvojas no C hepatīta vīrusa, salīdzinot ar vīriešiem. Ir dažas pacientu grupas, kam hronisks VHC attīstās retāk, piemēram, bērniem pēc inficētu asiņu transfūzijas parādās anti-HCV, bet HCV-RNS pozitīvs konstatēts tikai 55% gadījumu. Savukārt, inficējoties pēc 40-55 gadu vecuma, slimība ir aktīvāka un progresē straujāk.
Klīniskā aina
Visbiežāk slimība norit asimptomātiski. Biežākās sūdzības ir nespecifiskas: slikta dūša, sliktāka apetīte, mialģijas, artralģijas, nespēks, svara zudums, diskomforts labajā paribē. Tomēr klīniskie simptomi neparāda slimības aktivitāti. Ja attīstījusies aknu ciroze, parādās cirozei raksturīgie klīniskie simptomi.
HCV infekcijai var būt arī ārpus aknu izpausmes, kas bieži ir tieši saistītas ar hepatīta C vīrusa infekciju un attīstās ap 38% gadījumu:
- hematoloģiskās slimības (krioglobulinēmija, limfoma);
- autoimūnās slimības (tireoidīts, autoantivielu klātbūtne);
- nieru slimības - membrānproliferatīvs glomerulonefrīts;
- ādas izpausmes (Lichen planus, Porphyria cutanea tarda);
- cukura diabēts u.c.
Diagnostika
- Anamnēzes dati - īpaši svarīga ir epidemioloģiskā anamnēze par iespējamo inficēšanās ceļu.
- AlAT līmenis - pārsvarā nedaudz paaugstināts, reti - līdz 10 reizēm virs normas, aptuveni trešdaļai pacientu AlAT aktivitāte ir normas robežās. AlAT aktivitāte nekorelē ar slimības aktivitāti vai fibrozes pakāpi. Ja pēc terapijas morfoloģiskā aina uzlabojas, AlAT aktivitāte ne vienmēr pavājinās.
- Anti-HCV - primārā diagnostika ar ELISA metodi, tomēr līdz 30% gadījumu šis tests var dot viltus pozitīvus rezultātus, jo dažādās laboratorijās to veic ar dažādu paaudžu testsistēmām, kuru specifiskums atšķiras; apstiprinošo antivielu testu teorētiski var veikt ar Imunoblot metodi, tomēr praksē pozitīva anti-HCV rezultāta gadījumā parasti izvēlas HCV-RNS testu ar polimerāzes ķēdes reakciju (PĶR). Latvijas Infektoloģijas centrā vispirms tiek veikts anti-HCV tests ar jaunākās paaudzes ELISA metodi (dažkārt pat ar vairākām testsistēmām) un pozitīva rezultāta gadījumā tiek noteikts HCV-RNS.
- HCV-RNS - vīrusa RNS noteikšana asinīs ar PĶR. Terapijas shēmas izvēlei un ārstēšanas rezultāta izvērtēšanai nosaka vīrusa RNS genotipu un vīrusu slodzi kvantitatīvi ar PĶR.
- Slimības aktivitātes izvērtēšanai un fibrozes pakāpes noteikšanai jāveic aknu punkcijas biopsija un audu morfoloģiskā izmeklēšana. Latvijā pēdējos gados aknu audu stāvokļa izvērtēšanai pārsvarā izmanto Ishak vai Knodell skalu, pēc kuras izvērtē hepatīta aktivitātes indeksu (HAI). Tiek noteikta iekaisuma šūnu infiltrācija periportālajos laukos, portālajos traktos, kā arī intralobulārajā rajonā. Jo lielāks šis indekss, jo iekaisums aktīvāks. Fibrozes pakāpi iedala vairākās stadijās, pēdējā ir ciroze. Vēl izvērtē arī tauku ieslēgumu pakāpi un hemosiderīna klātbūtni aknu audos.
- Fibrozes noteikšanai var izmantot elastogrāfiju, kas ir ultrasonogrāfijas metode aknu audu blīvuma mērīšanai. Šo metodi Latvijā pagaidām neizmanto.
Dabiskā norise
Definēt hroniska C hepatīta dabisko norisi ir grūti, jo slimība progresē ļoti lēni, turklāt lielākajā daļā gadījumu nav datu par inficēšanās laiku, ir zināms tikai diagnostikas laiks (skat. attēlu). Dažādu pētījumu dati liecina, ka ciroze ap 20% hroniska C hepatīta pacientu vidēji attīstās 15-20 gados, tomēr ir ziņojumi, ka, ja vīruss organismā ir ilgāk nekā 30 gadus, cirozes attīstības biežums jau pārsniedz 40%. Mirstība hroniska C hepatīta pacientiem ne vienmēr saistāma ar C hepatīta vīrusu. Jauni cilvēki, kas turpina lietot narkotikas, biežāk mirst no narkotiku izraisītām komplikācijām.
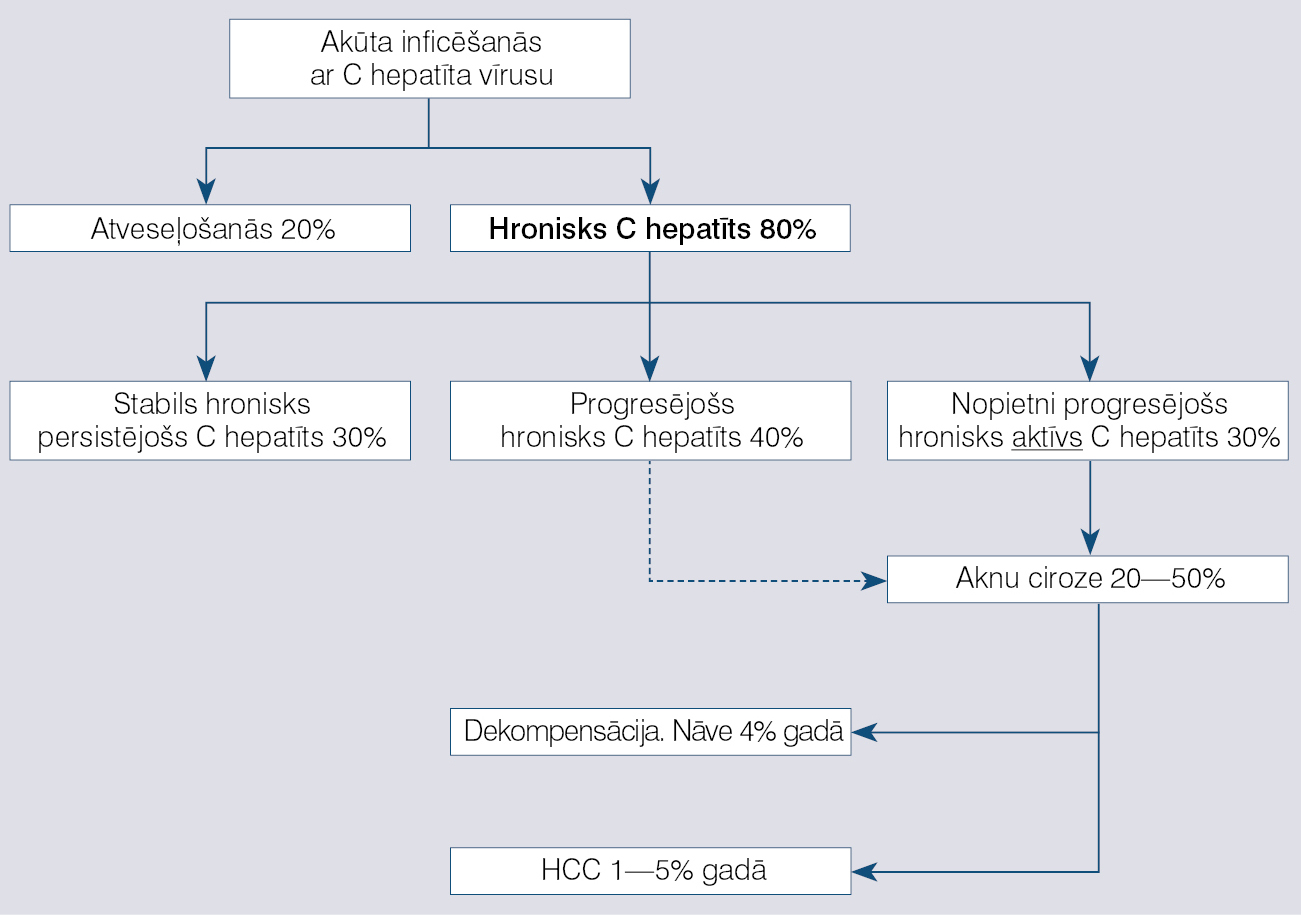

Attēls
Hroniska C hepatīta dabiskā norise
Aknu ciroze
Aknu ciroze bieži attīstās nemanāmi, sūdzības pacients sāk just tikai līdz ar cirozes dekompensāciju, iepriekš pat nezinot, ka bijis inficēts ar C hepatīta vīrusu.
Biežākās aknu cirozes komplikācijas:
- portālā hipertensija (ascīts, spontāns bakteriāls peritonīts, tūskas, barības vada vēnu varikoze ar vai bez asiņošanas, splenomegālija, hipersplenisms);
- hepatorenāls sindroms;
- aknu šūnu mazspēja - aknu encefalopātija, hipokoagulācija, disproteinēmija;
- trombohemorāģisks sindroms;
- hepatopulmonāls sindroms;
- portopulmonāls sindroms;
- hepatokardiāls sindroms.
Dzelte praktiski vienmēr liecina par tālu progresējušu slimību. Dekompensētas aknu cirozes gadījumā patoloģiskas izmaiņas var būt jebkurā orgānā vai orgānu sistēmā. Katras komplikācijas progresēšana var beigties letāli. Tomēr, protams, ne visiem pacientiem attīstās šīs komplikācijas, dažkārt dekompensācijas pazīmes parādās portālajā sistēmā, kamēr aknu šūnu funkcija vēl ir relatīvi laba, vai otrādi. Pirmās laboratorās pazīmes, kas varētu liecināt par cirozes attīstību: hipoalbuminēmija, hipergamma globulinēmija, hipokoagulācija, trombocitopēnija.
Ultrasonoskopiskās (US) izmaiņas, kas varētu liecināt par aknu cirozi: splenomegālija, nelīdzena aknu virsma, rupjgraudaina struktūra, paplašinātas portālās sistēmas vēnas, papildu vēnu anastomozes, ascīts, augšējā endoskopijā - barības vada vēnu varikoze. Tomēr pilnīgi precīzi cirozes diagnoze apstiprināma morfoloģiski.
Hepatocelulāra karcinoma
Hepatocelulāra karcinoma (HCC) attīstās 1-5% pacientu gadā. ASV HCV infekcija ir iemesls trešdaļai aknu vēža gadījumu. Augstāks riska līmenis ir 1.b genotipa pacientiem. Pārsvarā tiek uzskatīts, ka C hepatīta gadījumā (atšķirībā no B hepatīta) HCC attīstās jau aknu cirozes fonā, līdz ar to galvenais predisponējošais faktors ir ciroze. Lai agrīni diagnosticētu HCC, svarīgi regulāri (reizi gadā) noteikt alfa fetoproteīna (AFP) līmeni un veikt US, lai izvērtētu perēkļainu izmaiņu parādīšanos. AFP līdz 100 ng/ml var būt cirozes attīstības rādītājs (reģenerācija) hroniska VHC pacientiem, tomēr stabili pieaugošs AFP līmenis vai virs 200 ng/ml jau ir ar lielu HCC varbūtību. Ja HCC ir pierādīta, letalitāte pirmā gada laikā sasniedz 33%.
Dzīvildze pacientiem ar hronisku VHC un īpaši ar jau noformējušos cirozi ir saīsināta. Pacientiem ar dekompensētu cirozi 5 gadu dzīvildze ir 50%. Arī krioglobulinēmija varētu saīsināt dzīvildzi.
Ārstēšana
Galvenais ārstēšanas mērķis - C hepatīta vīrusa izskaušana, sasniedzot noturīgu virusoloģisko atbildi (sustained virologic response - SVR): HCV-RNS negatīvu uzreiz un 6 mēnešus pēc terapijas. Sasniedzot SVR, 99% gadījumu ir iespēja ilgstoši noturēt HCV-RNS negatīvu, šādā situācijā samazinās kopējā mirstība, aknu slimību izraisīta mirstība, HCC un citu komplikāciju attīstības biežums, nepieciešamība pēc aknu transplantācijas, salīdzinot ar pacientiem, kas nesasniedz SVR. Tomēr ar mūsdienu terapijas veidiem SVR var sasniegt 54-63% gadījumu.
Speciāla diēta nav nepieciešama, rekomendē ēst veselīgu pārtiku. Alkohola lietošana paātrina C hepatīta progresēšanu, jo veicina fibrozes attīstību.
Citu medikamentu lietošana C hepatīta ār-stēšanas laikā:
- ja aknu funkcija ir apmierinoša, citu medikamentu lietošana parasti netiek ierobežota;
- nesteroīdie pretiekaisuma līdzekļi ir hepatotoksiski un progresējošas aknu slimības gadījumā netiek rekomendēti;
- paracetamolu drīkst lietot, bet tā deva diennaktī nedrīkst pārsniegt 2 g un to nerekomendē lietot regulāri;
- statīnu lietošana nepasliktina aknu funkciju, ja aknu slimība ir kompensēta.
C hepatīta pacientiem rekomendē vakcināciju pret A un B vīrushepatītu, difteriju, stinguma krampjiem, garo klepu, pneimokoku infekciju, sezonālo gripu. Pacientiem pēc splenektomijas rekomendēta arī vakcinācija pret hemofilo nūjiņu un meningokoku infekciju.
Pirms ārstēšanas:
- novērtēt aknu slimību un aknu funkciju - noteikt AlAT, AsAT, gamma glutamiltranspeptidāzes (GGT), sārmainās fosfatāzes aktivitāti, bilirubīnu, protrombīna laiku vai INR, albumīnu, gamma globulīnu, pilnu asinsainu;
- ultrasonoskopijas izmeklējums;
- citu aknu slimību izslēgšana - autoimūns hepatīts, Vilsona slimība, HIV, hronisks B hepatīts, ne-alkohola steatohepatīts, alkohola steatohepatīts, vairogdziedzera slimības;
- ķermeņa masas indekss - ja tas ir augsts, pirms terapijas vēlama svara samazināšana;
- alkohola lietotājiem vispirms jāārstē alkohola atkarība un tikai pēc tam sākama C hepatīta ārstēšana;
- pārrunas ar pacientu nepieciešamas vairāku iemeslu dēļ:
- lielākajai daļai pacientu nav sūdzību, viņi jūtas veseli, tomēr slimība nemanot var progresēt līdz nopietnām, dzīvībai bīstamām komplikācijām,
- ārstēšana ir ilgstoša, iespējamas blakusparādības, arī izmaksas ir salīdzinoši lielas,
- svarīga ir pacienta līdzestība un sadarbība, jo, izlaižot medikamentu devas, ārstēšanas efektivitāte mazinās.
Pēc skaidrojuma par terapijas nepieciešamību, sarežģījumiem, blakusparādībām kopīgi jāpieņem lēmums par terapijas sākšanu. Latvijā ārstēšana tiek sākta pēc hepatologu konsilija lēmuma, ņemot vērā ārstējošā ārsta ieteikumus.
Indikācijas ārstēšanai
Indikācijas ārstēšanas sākšanai.
- Vecums vismaz 18 gadi (dažkārt ārstēt sāk arī bērnus, kas jaunāki par 18 gadiem).
- HCV-RNS pozitīvs serumā.
- Aknu biopsijā - hronisks aktīvs hepatīts, aknu fibroze. Ja izmaiņas aknu biopsijā ir nelielas, terapijas sākšanu izvērtē katrā gadījumā individuāli.
- Aknu slimība ir kompensēta. Dekompensētas aknu cirozes gadījumā specializētos centros, kur ir pieredzējuši hepatologi, pieļaujama ārstēšana pacientiem ar Child-Pugh B pakāpi, individuāli izvērtējot pacienta stāvokli un iespējamos sarežģījumus. Pacientiem ar Child-Pugh C pakāpes cirozi C hepatīta ārstēšanu nerekomendē nozīmīgā dzīvībai bīstamu komplikāciju riska dēļ.
- Pieņemami hematoloģiskie rādītāji - leikocītu, trombocītu, eritrocītu skaits.
- Pacients spēj ārstēties un piekrīt terapijas un uzraudzības režīmam.
- Nav kontrindikāciju, skat. tabulu.
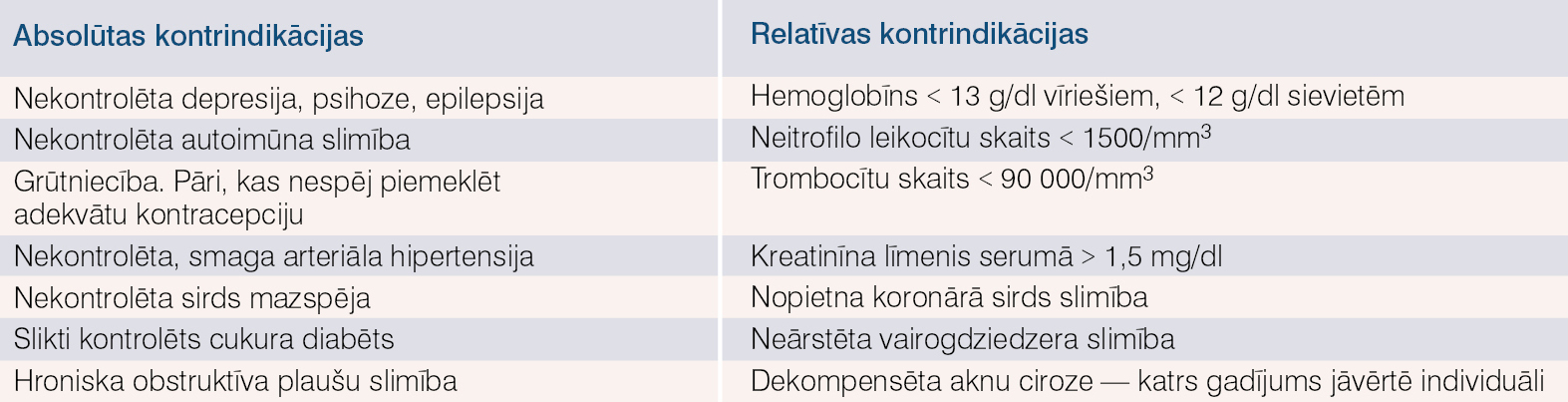

Tabula
Kontrindikācijas C hepatīta terapijai
Ārstēšanas shēma
Pašreiz praksē izmanto divas ārstēšanas shēmas - standarta terapija:
- pegilētais interferons alfa 2a - 180 µg/nedēļā kombinācijā ar ribavirīnu 800-1200 mg/dienā;
- pegilētais interferons alfa 2b - 1,5 µg/kg/nedēļā kombinācijā ar ribavirīnu 800-1200 mg/dienā.
Klīniskos pētījumos abu ārstēšanas shēmu efektivitāte pierādīta kā līdzvērtīga. Devas un ārstēšanas ilgums atkarīgs no vīrusa genotipa.
- 1. genotipa gadījumā nosaka vīrusu slodzi, ordinē zāles un pēc 12 nedēļām atkārto vīrusu slodzi. Ja tā samazinājusies vismaz 100 reižu, terapiju turpina līdz 48 nedēļām. Ja nepieciešamā samazinājuma nav, terapiju pārtrauc, jo izārstēšanās iespēja ir ļoti neliela.
- 3. genotipa gadījumā ārstēšana ilgst 24 nedēļas neatkarīgi no vīrusu slodzes.
- Katram individuālam pacientam var atšķirties gan vīrusu slodzes noteikšanas biežums, gan terapijas ilgums, to pielāgo individuāli un pēc dažādu pētījumu datiem. Saskaņā ar Eiropas aknu slimību pētnieku asociācijas (EASL) vadlīnijām vīrusu slodze jānosaka terapijas 4., 12. un daļai pacientu arī 24. nedēļā. Pēc to rezultātiem atšķiras ārstēšanas ilgums, kas svārstās no 24 līdz 72 nedēļām.
- Biežākās blaknes:
- interferonam - gripai līdzīgi simptomi, nespēks, leikopēnija, trombocitopēnija, miega un garastāvokļa traucējumi, depresija u.c.;
- ribavirīnam - hemolīze, anēmija, slikta dūša, sauss klepus, sausa āda, vairogdziedzera disfunkcija u.c.
- Šobrīd reģistrēti divi proteāžu inhibitori, kas pētījumos pierādījuši efektivitāti kombinācijā ar jau zināmo standarta terapiju, - telaprevirs un boceprevirs, tie indicēti tikai pacientiem ar 1. genotipu. Pētījumos iepriekš neārstētiem pacientiem SVR iespējams sasniegt 63-75% gadījumu, iepriekš ārstētiem pacientiem efekts atkarīgs no pirmās ārstēšanas rezultāta, un tas svārstās no 33% līdz 88%. Šo preparātu problēma ir rezistences attīstība, mijiedarbība ar citiem medikamentiem un blaknes, tomēr tā ir iespēja pacientiem, kas nav reaģējuši uz standarta terapiju. Latvijā telaprevirs un boceprevirs nav iekļauti kompensējamo zāļu sarakstā. Izpētes stadijās ir vēl arī citu grupu medikamenti ar ievērojami augstāku efektivitāti un paredzamo lietošanu bez alfa interferona.
Visiem pacientiem, kas nesasniedz SVR un neatbrīvojas no C hepatīta vīrusa, regulāri jāveic aknu funkcionālie testi, cirozes pacientiem regulāri jāpārbauda AFP, jāveic US, augšējā endoskopija (barības vada vēnu izvērtēšana), lai iespējamo komplikāciju attīstību - cirozes dekompensāciju un HCC - diagnosticētu laikus.