Pasaulē aizvien biežāk sarunās par populācijas novecošanos tiek skarta tēma par kognitīviem traucējumiem, kas ir arī loģiski izskaidrojams, — jo vairāk cilvēku nodzīvo ilgāk par 80 gadiem, jo lielāka iespēja, ka viņiem var attīstīties kognitīvie traucējumi. Latvijā visbiežāk tiek diagnosticētas kombinētas ģenēzes demences, kas ietver gan vaskulāru demenci, gan Alcheimera demenci, gan novērojamas toksiskas, dismetaboliskas encefalopātijas ar demenci.
Demence ir stāvoklis, kad atmiņa un citas kognitīvās funkcionēšanas prasmes pasliktinās līdz tādam stāvoklim, ka tas ietekmē cilvēka spēju būt patstāvīgam ikdienas aktivitātēs. Starptautiskās publikācijās tiek norādīts, ka visā pasaulē dzīvo aptuveni 50 miljoni cilvēku ar demenci, un tiek prognozēts, ka līdz 2030. gadam to skaits sasniegs 75 miljonus un līdz 2050. gadam — 131 miljonu. [1]
Visizplatītākā demences forma ir Alcheimera slimība, kas veido līdz pat 70 % demences gadījumu, kam seko vaskulārā demence. [1] Citi demences veidi ir demence ar Levi ķermenīšiem, frontotemporālā demence un Parkinsona slimības demence. Agrīnākā vecumā parasti novērojama viena no formām, taču līdz ar vecumu biežāk ir novērojamas tieši jauktas demences formas. Arī Latvijā visbiežāk tiek minēta jaukta tipa demence, kas bieži ietver gan vaskulāro demenci, gan arī Alcheimera slimību.
Kognitīvās funkcijas skrīnings, neiropsiholoģiskā novērtēšana joprojām ir svarīga daļa gadījumos, ja pacientam iespējama demence. Šī neiropsiholoģiskā novērtēšana jau agrīni, līdz saņemti dati no attēldiagnostikas un veikta biomarķieru noteikšana, var norādīt, ar kāda veida demenci pacients, iespējams, slimo.
Konsultējot pacientu, mums, ārstiem, ir priekšrocības pamanīt izmaiņas pacienta uzvedībā, uztvert pacienta neprasmi sakārtot kādas lietas, izpildīt kādas pavēles, kaut ko neatpazīt.
Arī nepieciešamība pacientam vairākas reizes izskaidrot aprūpes plānu var norādīt uz pacienta samazinātām spējām uztvert informāciju un koncentrēties darbam, atcerēties uzdevumus.
Ja ir radušās aizdomas par kognitīvu deficītu, ir lietderīgi nozīmēt pacientam papildu vizīti, kuras laikā veicams Latvijā adaptētais MoCA tests vai Mini Mental tests. Abi testi ir starptautiski atzīti kognitīvo funkciju izvērtēšanai, tiek lietoti arī pētījumos un ir arī izmantojami dinamiskajai izvērtēšanai. Man kā raksta autorei tīkamāks ir MoCA tests, tas atspoguļo plašāku iespējamo kognitīvo deficītu.
Atšķirīgais kognitīvajos procesos [2]
Nedaudz ieskatam, kas raksturīgāks tieši Alcheimera demencei un kas — vaskulārajai demencei. Alcheimera demences gadījumā pacientam jau agrīni parādās orientēšanās traucējumi — pēkšņa apmaldīšanās pazīstamā pilsētas rajonā ceļā no punkta A uz mājām. Esošie traucējumi saistīti ar tādiem pamata redzes traucējumiem kā kontrasta jutība, krāsu atšķiršana un dziļuma uztvere. Traucējumi ietekmē vizuāli telpisko funkciju arī augstākā līmenī, samazinot stimulu izcelsmi, kustību uztveri, telpisko izpēti un vizuālo meklēšanu. Alcheimera slimības pacientiem agrīni arī samazinās sarunvalodas vārdu krājums, pacients slikti atceras tieši pēdējos notikumus. Veicot MoCA testu, Alcheimera pacientam būs sliktāki rezultāti telpisko uzdevumu izpildīšanā un piecu vārdu testā. Izvērtējot laika nogrieznī, Alcheimera demence progresē vienmērīgi, bez lēcienveidīgiem paasinājumiem, taču izmaiņas notiek salīdzinoši strauji.
Vaskulārās demences gadījumā mazāk novērojami tieši atmiņas traucējumi, bet pacientam ir grūtāka darbu plānošana, organizēšana, novērojama lēnāka darbošanās, ar kavējumu atbild uz uzdotajiem jautājumiem. Vaskulārās demences pacienti labāk atceras vārdus, skaitļus, bet lēnāk veic rēķināšanas darbības. Dinamikā izvērtējot, vaskulārās demences gadījumā kognitīvās spējas var saglabāties nemainīgas ilgāku laiku, bet tad kāda vaskulāra notikuma gadījumā, piemēram, piedzīvojot hipertonisko krīzi, kognitīvās spējas pasliktinās. Pēc tam stāvoklis kādu laika posmu paliek nemainīgs līdz nākamajam vaskulārajam notikumam.
Ārsta praksēs visbiežāk tiek izmantots Mini mentālā stāvokļa pārbaudes (MMSE) tests vai Monreālas Kognitīvā novērtēšanas (MoCA) skala.
Ir pieejami arī citi, laika ziņā īsāki testi, piemēram, pulksteņa zīmēšanas tests, Mini Cog tests, kas ietver pulksteņa zīmēšanas testu kopā ar trīs vārdu atcerēšanās testu. Pulksteņa zīmēšanas tests palīdz novērtēt izpildfunkcijas un vizuāli telpiskās spējas.
Padziļināts Alcheimera slimības gadījumā izmantojamais tests ir ADAS — Cog tests, kas sastāv no 11 pamata apakštestiem:
- Vārdu atcerēšanās (īsa un aizkavēta atmiņa).
- Vārdu atpazīšana.
- Valodas uzdevumi — priekšmetu
- nosaukšana, priekšmetu aprakstīšana.
- Konstrukcijas prakse — ģeometrisku figūru kopēšana.
- Komandu izpilde — spēja saprast un izpildīt vienkāršus verbālus norādījumus.
- Lasīšana, rakstīšana.
- Valodas izteiksmes spējas — spēja
- izteikties saprotami.
- Valodas plūdums (piemēram, nosauc pēc iespējas vairāk dzīvnieku).
- Orientācija laikā un vietā.
- Runas saprotamība.
- Atmiņas atsaukšana (uzdotie vārdi).
ADAS — Cog tests ir specifiski orientēts uz Alcheimera slimību. Tas ir jutīgāks nekā MMSE vidēji smagās un smagās stadijās, un to parasti izmanto starptautiskajos klīniskajos pētījumos, jo ir viegli dinamikā salīdzināt datus. Šis tests, salīdzinot ar MoCA testu, ir mazāk jutīgs agrīnās stadijās un nav optimāls citu demenču izvērtēšanai.
Attēldiagnostika [2]
Izvērtējot pacientu ar kognitīviem traucējumiem, vismaz vienu reizi ir jāveic attēldiagnostiskie izmeklējumi. Latvijā visbiežāk lietotā metode ir magnētiskā rezonanse, kas gan palīdz izslēgt cita veida galvas smadzeņu bojājumus, piemēram, cerebrovaskulāras slimības (infarktus, sīko asinsvadu slimības radītus bojājumus), intrakraniālu hipertensiju, reģionālu smadzeņu atrofiju, iekaisumus un citas neirodeģeneratīvas slimības, kā arī potenciāli ķirurģiski ārstējamas patoloģijas — audzējus, intracerebrālu vai subdurālu hematomu.
Ar šo metodi var atšķirt procesus, kas ir raksturīgi normālam smadzeņu novecošanas procesam, no kognitīvo traucējumu procesiem. Latvijā visbiežāk tiek izmantota Fazekas skala. Magnētiskajā rezonansē ir specifiska radioloģiska atrade, raksturīga Alcheimera demencei, proti, jau agrīni ir raksturīga temporālo un parietālo daivu atrofija un abpusēja hipokampa atrofija. Ļoti būtiski ir hipokampa volumetriskie rādītāji. Agrīnās Alcheimera slimības gadījumos arī var novērot mugurējo smadzeņu rajonu precuneus un cingulārās garozas atrofiju.
Pēc starptautiskajām vadlīnijām būtu vērtīgi CNS struktūru izvērtēt dinamikā pēc pāris gadiem, jo MRI palīdz monitorēt izmaiņas galvas smadzenēs dinamikā, sekojot volumetrisko rādītāju izmaiņām laika gaitā. Ir izvirzīta hipotēze, ka šo izmaiņu novērtēšana var prognozēt slimības gaitu, norises straujumu.
Ja tomēr magnētisko rezonansi pacients kādu iemeslu dēļ nespēj veikt, tad ir veicama kaut datortomogrāfija ar mērķi izslēgt plašus strukturālus bojājumus, hidrocefāliju, citus ķirurģiski ārstējamus bojājumus. Arī jaunākās paaudzes DT var konstatēt hipokampa atrofiju.
SPECT un PET ir funkcionāla attēldiagnostika, kas vizualizē smadzeņu metabolisko aktivitāti. Jau pirms izveidojas atrofija, šajos izmeklējumos potenciālā atrofijas zona kļūst metaboliski mazaktīva. Tieši tas šo izmeklēšanas metodi padara daudz jutīgāku un agrīnāk lietojamu. Rutīnā pacientam ar atmiņas traucējumiem, kam anamnēze, fizikālā izmeklēšana, kognitīvo funkciju testi un DT vai MRI liecina par Alcheimera slimību vai citas etioloģijas demenci, funkcionālās attēldiagnostikas izmeklējumi nav nepieciešami. Šie dārgie izmeklējumi tiek lietoti vien gadījumos, ja vairāki kompleksās izvērtēšanas kritēriji liek domāt par atipisku neirodeģeneratīvu slimību. SPECT un PET ir izmantojami kā papildu metode šaubu gadījumā diagnozes uzstādīšanas procesā. Tādi var būt gadījumi, kad ir kognitīvi traucējumi ar izteiktām neiropsihiatriskām izpausmēm. Ja klīniski pastāv aizdomas par demenci, bet 18FDG PET atrade ir normāla, neirodeģeneratīva patoloģija ir maz iespējama. Klīniskajos pētījumos bieži tiek izmantota amiloīda pozitrona emisijas tomogrāfija (PET) — mērot amiloīda daudzumu galvas smadzenēs. Izmeklējums tiek veikts, lai mērķtiecīgi konstatētu Alcheimera slimību.
Kaut ultrasonogrāfijas metode nav standarta metode demenču izvērtēšanai, tomēr, strādājot ar šo metodi, esmu novērojusi, ka pacienti, kam ir lēna plūsma intrakraniālajās artērijās, pat bez stenotiskām izmaiņām ekstrakraniālajā daļā pēc gadiem vēršas pie ārsta atkārtoti kognitīva deficīta dēļ. Izmeklējuma laikā ir svarīgi noteikt pulsatilitātes indeksu, kas ir stabils galvas smadzeņu sīko asinsvadu palielinātas pretestības indikators. Tas ir tiešs fizioloģiskais mērījums mikrovaskulārās disfunkcijas noteikšanai.
Pulsatilitātes indekss būs palielināts gan vaskulāras demences, gan Alcheimera demences gadījumā, taču būtiski augstāks tas būs tieši vaskulāras demences gadījumos. Transkraniālā doplerogrāfija nav tikai vienreiz lietojams rīks. Ir novērota korelācija pacientiem ar vidējas pakāpes kognitīvajiem traucējumiem — pasliktinoties šiem transkraniālās doplerogrāfijas parametriem, īpaši palielinoties pulsatilitātes indeksam un rezistences indeksam, arī kognitīvie traucējumi pasliktinās.
Šķidrumu biomarķieri [3; 4]
Slimību bioloģiskā pamatošana, kas nav balstīta tikai uz sindromu izpausmi, jau sen ir standarta prakse daudzās medicīnas jomās (piemēram, onkoloģijā) un kļūst par vienojošu konceptu, kas kopīga visām neirodeģeneratīvajām slimībām. Slimība vispirms izpaužas in vivo, parādoties slimībai specifiskiem galvenajiem biomarķieriem, bet pacientiem joprojām esot asimptomātiskiem.
Gan amiloīda PET, gan cerebrospinālā šķidruma (likvora) biomarķieru mērījumi ir zelta standarts testēšanā un ar augstu precizitāti spēj identificēt Alcheimera slimību. Gan likvorā, gan PET izmanto divu grupu marķierus — bēta amiloīda deponēšanās galvas smadzenēs un neirodeģeneratīvajām izmaiņām raksturīgus marķierus. Pēdējo gadu nozīmīgākais sasniegums Alcheimera slimības diagnostikā ir asinīs atrodamo biomarķieru izstrāde — ir atrasti daži biomarķieri, kas uzrāda precīzu diagnostisko veiktspēju. Šobrīd šie asinīs atrodamie biomarķieri tiek salīdzināti ar zelta standarta marķieriem — likvorā esošo amiloīdu un PET datiem, bet nākotnes skatījumā tie atvieglos diagnostiku demenču gadījumos.
Slimības agrīnajās stadijās konstatējamie Core 1 biomarķieri ir amiloīds PET, fosforilētais Tau 217 likvorā un serumā. Tie ir saistīti vai nu ar bēta amiloīda, vai Tau proteinopātijas ceļu. Tiek uzskatīts, ka izmainīts Core 1 biomarķiera rezultāts ir pietiekams, lai noteiktu Alcheimera slimības diagnozi.
Biomarķierus iesaka iedalīt trīs plašās kategorijās:
- Alcheimera slimības neiropatoloģisko izmaiņu (ADNPC) galvenie biomarķieri,
- nespecifiski biomarķieri, kam ir nozīme Alcheimera slimības (AD) patoģenēzē, bet kas ir iesaistīti arī citās smadzeņu slimībās,
- biomarķieri izplatītām pavadošajām komorbiditātēm, kas nav saistītas ar Alcheimera slimību.
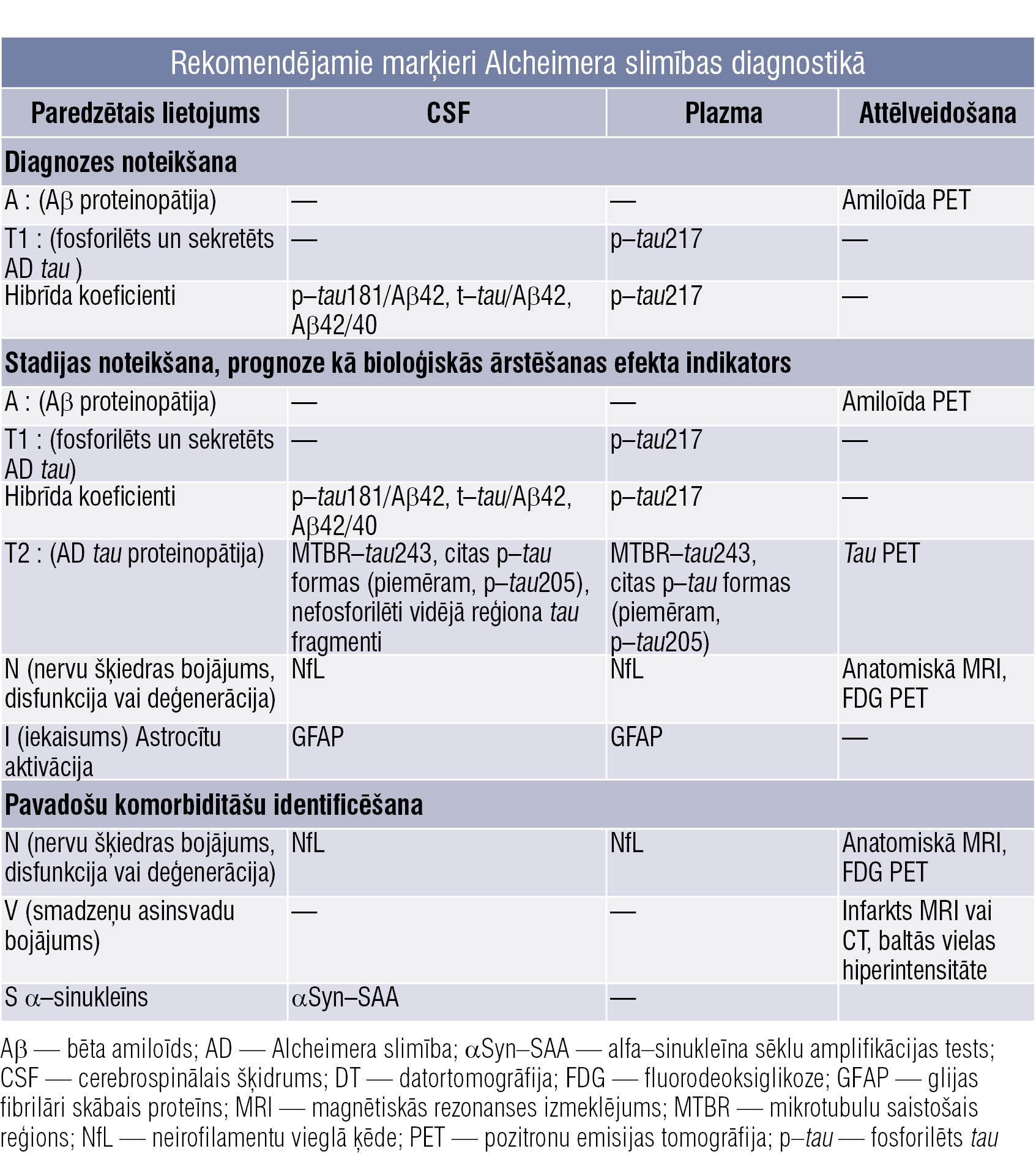

Tabula
Rekomendējamie marķieri Alcheimera slimības diagnostikā
2018. gadā tika atzīta nepieciešamība modificēt biomarķieru klasifikācijas shēmu, lai esošajā AT(N) kategorijā iekļautu jaunizstrādātus biomarķierus. Attiecīgi pašreiz iekļautas trīs jaunas biomarķieru kategorijas:
- iekaisuma/imūnsistēmas mehānismi (I),
- asinsvadu smadzeņu bojājums (V),
- alfa–sinukleinopātija (S).
Šie V un S biomarķieri ir nozīmīgi gados vecākiem pacientiem, kam ir citas pavadošās blakusslimības (tabula).
Augstāk minēto marķieru klīniskā izmantošana pašlaik pasaulē ir paredzēta simptomātisku indivīdu diagnostikai, nevis indivīdu bez kognitīva deficīta novērtēšanai. Latvijā ir pieejams Alcheimera demences riska DNS tests, zināms kā ApoE genotipa noteikšana, kur ApoE epsilona 4 alēlei ir pierādīta augsta Alcheimera slimības paredzamības vērtība. Šis tests gan ir tikai informatīvs, tas nav diagnostisks, jo tas negarantē, ka nēsātājs noteikti saslims ar Alcheimera slimību. Tomēr, ja ir aizdomas, ka pacientam ar kognitīvajiem traucējumiem varētu būt Alcheimera slimība, un tiek plānota specifiskas terapijas (kā lekanemabs) nozīmēšana, tad šī genotipa noteikšana ir obligāta.
Riska faktori [1]
Lai gan vecums ir spēcīgākais riska faktors, demence nav neizbēgamas novecošanās sekas. Demence var būt dažādu slimību un traumu gala rezultāts, kas primāri vai sekundāri ietekmē smadzenes.
Pēdējo gadu publikācijās esošie dati liecina, ka līdz pat 40 % no visām demencēm ir saistāmas ar potenciāli modificējamiem riska faktoriem, piemēram, hipertensiju, augstu holesterīna līmeni, cukura diabētu, neveselīgu uzturu un smēķēšanu.
Laicīgi novēršot šos modificējamos riskus, iespējams, varētu arī novērst demences sākšanos.
Vairāki ilgstoši pētījumi, kuros dalībnieki tika novēroti vairākus gadu desmitus, ir pierādījuši, ka daudziem indivīdiem, kuriem demence attīstījās vēlīnā dzīves posmā, agrāk bija paaugstināts asinsspiediens, tomēr nav arī pārliecinošu pierādījumu, ka, lietojot antihipertensīvo terapiju, būtiski samazinās demences attīstītība un nav vērojama kognitīvo spēju pasliktināšanās. Arī no pieredzētā praksē bieži novēroju samazinātu asins plūsmu intrakraniālajos asinsvados pacientiem, kas lieto antihipertensīvo terapiju. Vairākas metaanalīzes ir parādījušas pretrunīgus rezultātus par asinsspiedienu pazeminošu intervenču ietekmi uz demences un kognitīvo spēju pasliktināšanos.
Kādā apakšpētījumā “Sistoliskā asinsspiediena intervence: atmiņas un izziņas funkcijas pazeminātas hipertensijas gadījumā” tika novērtēts, vai intensīva asinsspiediena terapija (kuras mērķis ir sistoliskais asinsspiediens < 120 mmHg) var samazināt demences gadījumu skaitu, salīdzinot ar standarta asinsspiediena terapiju (kuras mērķis ir sistoliskais asinsspiediens < 140 mmHg). Pētījumā netika ziņots par būtisku demences gadījumu skaita samazināšanos intervences grupā (riska attiecība (HR) 0,83, 95 % ticamības intervāls (TI) no 0,67 līdz 1,04), bet tika konstatēts samazināts vieglu kognitīvo traucējumu risks (HR 0,81, 95 % TI no 0,69 līdz 0,95).
Augsts holesterīna līmenis serumā pusmūžā ir saistīts ar paaugstinātu demences risku. Tiek uzskatīts, ka šī saistība notiek divos veidos: augsts holesterīna līmenis serumā izraisa aterosklerozi, kā rezultātā palielinās sirds un cerebrovaskulāro slimību risks; un augsts holesterīna līmenis ir saistīts ar amiloīda līmeņa paaugstināšanos. Abi šie ceļi potenciāli palielina demences sastopamību. Pašreiz arī pietrūkst pētījumu datu, vai pacientiem, kas lietojuši statīnus, ir mazāks risks saslimt ar demenci.
Uzturs un vielmaiņa
Pareizam uzturam ir potenciāls novērst daudzus stāvokļus, kas palielina demences risku, piemēram, dislipidēmiju un diabētu. Ir ieteikts, ka uzturs ar augstu garās ķēdes omega–3 polinepiesātināto taukskābju saturu aizsargā pret demenci, pateicoties šo skābju asinsvadus ietekmējošajām un pretiekaisuma īpašībām. Turklāt viens pētījums liecināja par Vidusjūras diētas pozitīvo ietekmi uz kognitīvajiem rezultātiem, lai gan kognitīvie traucējumi starp grupām būtiski neatšķīrās un nevienam dalībniekam neattīstījās demence.
Šķiet, ka saistība starp ķermeņa masas indeksu (ĶMI) un demenci ir divu virzienu — augsts ĶMI dzīves vidū un zemāks ĶMI dzīves beigās ir saistīts ar paaugstinātu demences risku. To varētu attiecināt uz apgrieztu cēloņsakarību, jo demence ir saistīta ar svara zudumu pat 10 gadus pirms tās sākuma. Otrkārt, aptaukošanās izraisa rezistenci pret insulīnu un augstu adipokīnu un citokīnu līmeni, kas visi ir saistīti ar paaugstinātu demences risku.
2. tipa CD ir saistīts arī ar kognitīvo spēju pasliktināšanos un demenci, jo var izraisīt traucējumus smadzeņu insulīna un insulīnam līdzīgā augšanas faktora signālmehānismos, potenciāli veicinot molekulārus, bioķīmiskus un histopatoloģiskus bojājumus Alcheimera slimības demences gadījumā, taču šiem pacientiem bieži ir arī citi sirds un asinsvadu slimību riska faktori, kas varētu veicināt demences sastopamību, piemēram, hipertensija, augsts holesterīna līmenis serumā un sirds un asinsvadu slimības.
Fiziskā slodze
Fiziskās aktivitātes veicina demences profilaksi, netieši ietekmējot citus modificējamos riska faktorus, piemēram, aptaukošanos, hipertensiju, augstu holesterīna līmeni serumā un sirds un asinsvadu slimības. Citi iespējamie mehānismi, kas izskaidro saistību starp fiziskajām aktivitātēm un demenci, varētu būt saistīti ar tiešām neiroloģiskām sekām, piemēram, palielinātu neiroģenēzi, smadzeņu asinsriti un smadzeņu atvasinātā neirotrofiskā faktora (BDNF) koncentrāciju.
Nesenā sistemātiskajā pārskatā netika atrasti pierādījumi par fizisko aktivitāšu aizsargājošu ietekmi uz demences attīstību.
Tomēr, tā kā fizisko aktivitāšu aizsargājošā ietekme var darboties lielā mērā netieši, ietekmējot citus riska faktorus, tā var kļūt redzama tikai ilgākā laika periodā.
Psihoemocionālā veselība
Kognitīvie treniņi varētu samazināt demences risku, stimulējot kognitīvo rezervi, smadzeņu spēju kompensēt neiroloģiskus bojājumus, kā arī aizsargājot pret strauju kognitīvo spēju pasliktināšanos.
Ir izteikts pieņēmums, ka kognitīvā stimulācija var veicināt neironu plastiskumu un stimulēt kompensējošo tīklu attīstību smadzenēs, saglabājot kognitīvās funkcijas un potenciāli maskējot (vai novēršot) kognitīvo spēju pasliktināšanās izpausmes. Līdz šim kognitīvo treniņu ietekme uz vecāka gadagājuma cilvēkiem galvenokārt tika pētīta kognitīvās spējas pasliktināšanās profilaksei, un ir maz pierādījumu par ietekmi uz nejaušu demenci.
Depresijai ir labi zināma saistība ar demenci. Ir daudz diskusiju par to, vai depresijas un demences saistība ir cēloņsakarība vai arī depresija ir šīs slimības prodromāls simptoms. Vairāki longitudināli kohortas pētījumi ir parādījuši saistību starp depresijas epizožu skaitu un demences sākšanos, stiprinot cēloņsakarības hipotēzi. Tomēr citā kohortas pētījumā tika atklāts, ka tikai 10 gadus pirms demences diagnozes noteikšanas depresija ir saistīta ar paaugstinātu demences sastopamību, padarot pusmūža depresiju kā demences riska faktoru mazāk ticamu. Bioloģiski ir ticams, ka depresija palielina demences sastopamību, ietekmējot stresa hormonus, neironu augšanas faktorus un hipokampa tilpumu.
Sociālā neaktivitāte ir saistīta ar paaugstinātu kognitīvo spēju pasliktināšanās un demences risku. Tomēr, tāpat kā depresijas gadījumā, ir grūti atšķirt, vai saistība starp sociālo neaktivitātes un kognitīvo spēju pasliktināšanos ir cēloniska vai demences prodromāls simptoms. Sistemātiskā pārskatā ir apstiprināta šīs saistības klātbūtne novērojumu datos, tomēr trijos iekļautajos nejaušināti kontrolētos pētījumos (RCT) netika gūts pārliecinošs apstiprinājums par cēloņsakarību.
Atkarības
Tabakas un pārmērīgas alkohola lietošanas saistība ar daudziem stāvokļiem, tostarp sirds un asinsvadu slimībām un depresiju. Saistība ar kognitīvo spēju pasliktināšanos un demenci (tabaka, alkohols) varētu būt saistīta ar šiem bieži sastopamajiem riska faktoriem vai arī to varētu izraisīt smēķēšanas un alkohola lietošanas tiešā neirodeģeneratīvā ietekme.
Terapija [7]
Holīnesterāzes inhibitori
Tā kā pastāv uzskats, ka slimības patoģenēzē ir holīnerģisko neironu zudums, šīs grupas preparāti lietojami, lai novērstu acetilholīna hidrolīzi ar enzīma acetilholīnesterāzes palīdzību, sekojoši paaugtinot acetilholīna līmeni sinaptiskajā spraugā un uzlabojot neirotransmisiju.
Palielinot acetilholīna līmeni, holīnesterāzes inhibitori palīdz uzlabot kognitīvās funkcijas un mazināt dažus ar Alcheimera slimību saistītos simptomus, īpaši slimības sākumposmā. Rivastigmīns, donepezils un galantamīns tiek nozīmēti vieglas vai vidēji smagas AD ārstēšanai. Šo trīs zāļu farmakokinētiskās un farmakodinamiskās īpašības atšķiras, taču to efektivitātei nav mainīgu atšķirību.
N–metil–D–aspartāta (NMDA) receptoru antagonisti
Sinaptisko plastiskumu, neironu augšanu un diferenciāciju, izziņu, mācīšanos un atmiņu regulē glutamāterģiskie neironi. Pastāv uzskats, ka holīnerģiskie neironi tiek iesaistīti tieši agrīnajās slimības stadijās; vēlāk tiek iesaistītas glutamāterģiskās sistēmas.
Memantīns ir nekonkurējošs NMDA receptoru antagonists, kas ir apstiprināts vidēji smagas vai smagas Alcheimera slimības ārstēšanai. Alcheimera slimības gadījumā NMDA receptoru pāruzbudināmība rada toksisku iedarbību uz neironiem.
Memantīns bloķē glutamāta ierosinošo neirotoksisko iedarbību, tādējādi aizsargājot neironus no eksitotoksicitātes un potenciāli palēninot slimības progresu.
Jaunas slimību modificējošas terapijas
Pētnieki aktīvi strādā ar jauniem zāļu mērķiem un slimību modificējošām terapijām, kuru mērķis ir risināt Alcheimera slimības pamatā esošo patoloģiju. Aβ nogulsnēšanās samazināšana tiek uzskatīta par pirmo soli Alcheimera slimības ārstēšanā.
Aβ plāksnes ir galvenā Alcheimera slimības patoloģiskā pazīme. Šīs plāksnes sastāv no Aβ peptīdiem, kas rodas, patoloģiski sašķeļot APP ar β–sekretāzi un γ–sekretāzi.
Vairāki pētījumi ir parādījuši, ka Aβ uzkrāšanās samazināšana ievērojami samazina neirotoksicitāti un varētu būt potenciāla terapeitiska stratēģija Alcheimera slimības ārstēšanai.
Jaunākie preparāti, kas apstiprināti šīs slimības ārstēšanai, ir vērsti pret amiloīda nogulsnēšanos (Aβ imūnterapija).
Aβ imūnterapija tieši iedarbojas uz Aβ plātnītēm un veicina to izvadīšanu. Vairākas humanizētas monoklonālās antivielas ir izturējušas klīniskos pētījumus, un 2021. gadā FDA apstiprināja adukanumabu AD pacientu ārstēšanai. 2023. gadā arī lekanemabs saņēma paātrinātu FDA apstiprinājumu. Adukanumabs selektīvi iedarbojas uz 3—7 aminoskābēm Aβ agregātu N–terminālā un veicina to izvadīšanu. Tam ir > 10 000 reižu lielāka afinitāte pret Aβ agregātiem nekā pret Aβ monomēriem. Lekanemabs darbojas līdzīgi adukanumabam, un tam ir lielāka saistīšanās afinitāte ar lieliem šķīstošiem Aβ agregātiem. Donanemabs specifiski iedarbojas uz piroglutamāta modificētajiem Aβ peptīdiem amiloīdajās plāksnēs un veicina to izvadīšanu.
Pasaulē šobrīd notiek jaunizstrādātu preparātu klīniskie pētījumi, un iespējams, ka jau tuvākajā nākotnē būs pieejami papildu medikamenti Alcheimera slimības novēršanai vai ārstēšanai.