Funkcionāls hipogonādisms (FH) kā koncepts ir aizstājis vēlīni sākušos hipogonādismu, kas var tikt diagnosticēts vīriešiem novecošanās periodā. FH ir klīnisks un bioķīmisks sindroms, kas raksturojas ar tipiskiem klīniskiem simptomiem un testosterona deficītu vīriešiem pēc 40 gadu vecuma, un var tikt diagnosticēts, izslēdzot organiskus hipogonādisma iemeslus.
Klīniski tas izpaužas ar samazinātu seksuālo vēlmi un aktivitāti, erektilo disfunkciju, zemu enerģijas līmeni, garastāvokļa svārstībām, [17] nogurumu, samazinātu kaulu minerālo blīvumu, osteoporozi, samazinātu muskuļu masu un palielinātu tauku masu, centrālu aptaukošanos (1. tabula). [19; 23] Hipogonadāliem vīriešiem ir arī augstāka prevalence trauksmes traucējumiem un depresijai. [14] pazemināta motivācija, pazeminātas koncentrēšanās spējas, [23] kā arī paaugstināta mirstība. [12] FH var attīstīties sekundāri, zemas enerģijas pieejamības, pārmērīgas fiziskās slodzes un drastiska kaloriju samazinājuma dēļ. [26]
1. tabula. Simptomi un pazīmes, kas var būt saistītas ar testosterona deficītu [23]
|
Specifiskie simptomi
|
Mazāk specifiskie simptomi
|
Mazāk specifiskas pazīmes
|
- Samazināta dzimumtieksme
- Samazināta spontāna erekcija
- Erektilā disfunkcija
|
- Samazināta enerģija
- Samazināts fiziskais spēks/funkcija/aktivitāte
- Samazināta motivācija
- Nomākts garastāvoklis
- Samazinātas koncentrēšanās spējas
- Karstuma viļņi
|
- Ķermeņa/sejas apmatojuma samazinājums
- Sēklinieku izmēra samazinājums
- Ķermeņa tauku pieaugums/muskuļu masas zudums
- Osteoporoze/zems kaulu blīvums
- Centrāla aptaukošanās
|
Kā iemesli FH minami arī blakusslimību sekas: aptaukošanās, cukura diabēts, zema enerģijas pieejamība ar uzturvielu deficītu ar vai bez pārmērīgas uzturvielu izlietošanas, kā arī sekundāras medikamentu iedarbības sekas – opiāti, dzimumhormoni, GnRH analogi, glikokortikosteroīdi (attēls). [26]
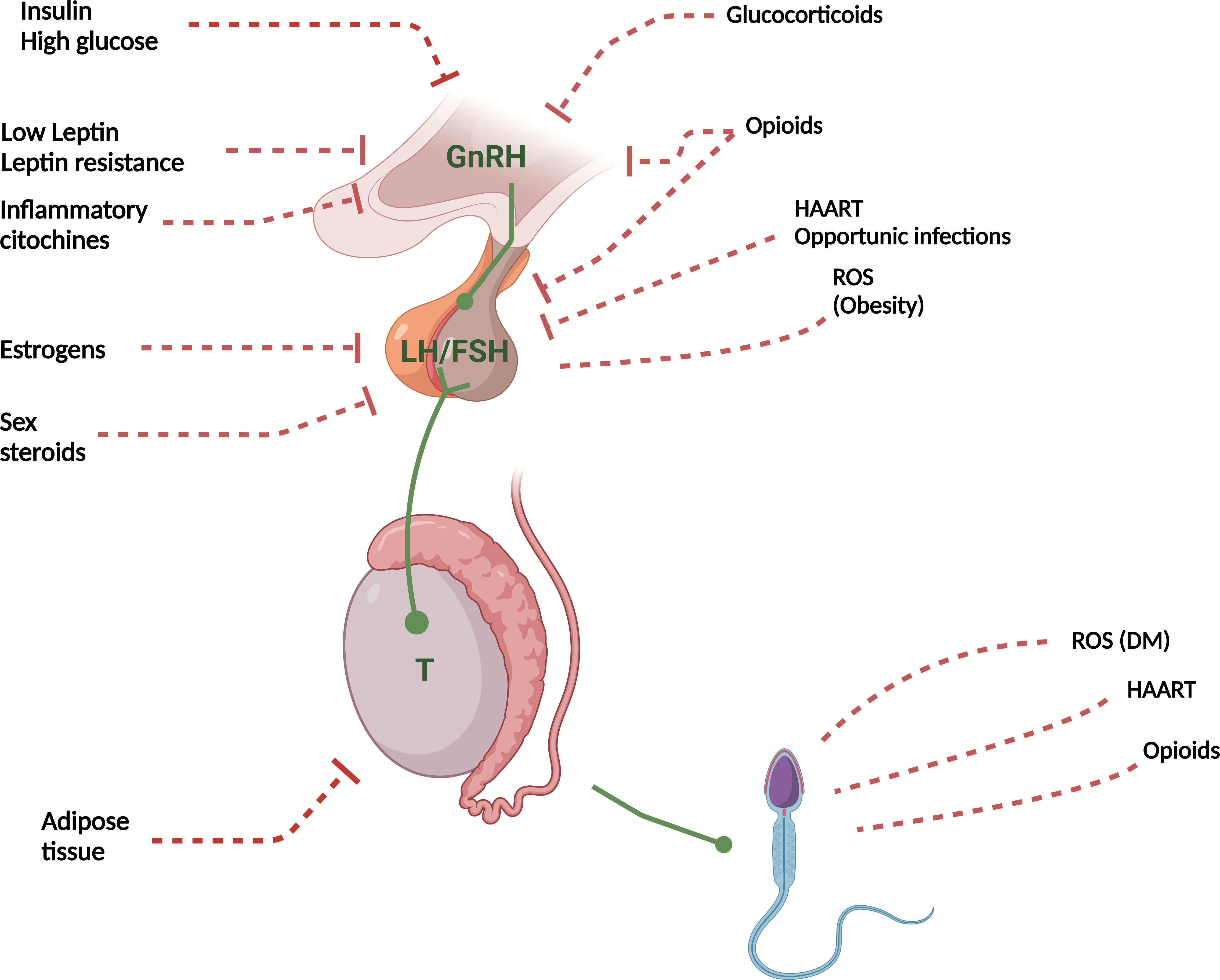

Attēls. Funkcionāla hipogonādisma patofizioloģiskais mehānisms. Spaziani M. et al.
- Insulin — insulīns
- High glucose — augsts glikozes līmenis
- Low leptin — zems leptīna līmenis
- Leptin resistance — leptīna rezistence
- Inflammatory citochines — iekaisuma citokīni
- Estrogens — estrogēni
- Sex steroids — dzimumhormoni
- Adipose tissue — taukaudi
- Glucocorticoids — glikokortikoīdi
- Opioids — opioīdi
- HAART — augsti aktīva antiretrovirāla terapija
- Opportunic infections — oportūniskās infekcijas
- ROS — reaktīvās skābekļa sugas
- Obesity — aptaukošanās
- DM — cukura diabēts
|
Testosterona noteikšana un FH diagnostika
Lielākā asinīs cirkulējošā testosterona daļa ir saistīta ar sekshormonu saistošo globulīnu (SHBG), seruma albumīnu, kortizola saistošo globulīnu un orozomukoīdu (alfa 1 skābo glikoproteīnu). Šiem saistošajiem proteīniem ir svarīga loma testosterona transportēšanas, audu uzņēmīguma, bioaktivitātes un metabolisma regulēšanā. Kopējais testosterons ir summa ar proteīniem saistītajam un nesaistītajam jeb brīvajam testosteronam asinīs. [20]
Pēc Eiropas Andrologu akadēmijas vadlīnijām, funkcionālo hipogonādismu apstiprina, nosakot kopējo testosterona līmeni serumā tukšā dušā, laika periodā no 7.00 līdz 11.00, divās dažādās dienās. Kā arī jaizslēdz hipogonādisma organiskos iemeslus, nosakot luteinizējošā hormona (LH) līmeni asinīs visiem pacientiem ar aizdomām par funkcionālo hipogonādismu. Pie kopējā (seruma) testosterona līmeņa virs 12 nmol/L (>350 ng/dL), hipogonādisms ir mazticams; testosterona līmenis zem 8 nmol/L norāda uz testosterona deficītu. Pacientiem, kuriem kopējā testosterona līmenis ir no 8 līdz 12 nmol/L, var tikt diagnosticēts FH, ja ir attiecīgie simptomi un zems brīvais testosterons. [23]
Brīvo testosteronu iesaka noteikt pacientiem, kuriem pastāv faktori, kas ietekmē SHBG daudzumu (2.tabula) un kuru kopējā T koncentrācija ir robežlīmenī (8-12 nmol/L; 231-350ng/dL), ja klīniski ir aizdomas par hipogonādismu. [23]
Precīzas T koncentrācijas, kas ļautu uzstādīt FH diagnozi, ir dažādas: pēc kohortu pētījuma ASV un Eiropā, kopējais references zemākais T līmenis veselīgiem, neadipoziem vīriešiem no 19 līdz 39 gadiem ir 9,2 nmol/L (264 ng/dL) un 10,5 nmol/L (303 ng/dL) – attiecīgi 2,5. percentīle un 5. percentīle. [24]
Eiropas vīriešu novecošanās pētījumā samazināts libido, vāja rīta erekcija un erektilā disfunkcija tika nozīmīgi saistīta ar kopējā testosterona līmeni < 11 nmol/L un brīvā testosterona līmeni < 220 pmol/L. Tālāka datu analīze parādīja, ka vīriešiem ar normālu kopējo T līmeni, bet zemu brīvā T koncentrāciju, bija augstāki LH līmeņi, viņi atzīmēja vairāk seksuālus un fiziskus simptomus, kā arī zemākas hemoglobīna vērtības un zemāku kaulu minerālo blīvumu, salīdzinot ar vīriešiem, kuriem ir normāls kopējais un brīvais testosterons, vai zems kopējais un normāls brīvais testosterons. Tādējādi, zema brīvā T koncentrācija, pat ja kopējais T ir normāls, ir asociēta ar androgēnu nepietiekamības simptomiem. Pacientiem ar robežlīmeņa kopējā T koncentrāciju, vērtīgi būtu noteikt brīvā testosterona līmeni. [21]
2. tabula. Faktori, kas ietekmē SHBG [2; 23]
|
SHBG samazina
|
SHBG palielina
|
- Aptaukošanās
- Glikokortikosteroīdu, androgēno un progestogēno steroīdu lietošana
- Nefrotiskais sindroms
- Hipotireoze
- Akromegālija
- Polimorfisms SBHG gēnā
|
- Novecošanās
- HIV
- Ciroze un hepatīts
- Hipertireoīdisms
- Antikonvulsanti
- Estrogēni
- Polimorfisms SHBG gēnā
|
Analīzes pirms vai pēc maltītes?
Ir pretrunīgi dati par to, vai testosterona līmenis jānosaka tukšā dūšā. Pētījumā, ko veica Brambilla et al., tika noteikts, ka vīriešiem no 30 līdz 40 gadu vecuma, kopējā T līmeņi bija par 20-25 % zemāki plkst. 16.00 nekā plkst. 8.00, atšķirība samazinājās ar vecumu, kur 70 gadu vecumā bija tikai 10 % atšķirība. Svarīgi, ka 17 no 66 vīriešiem ar vismaz 1 no 3 mērījumiem <10,4 nmol/L pēcpusdienā, bija normāli T līmeņi visos rīta mērījumos. Šī pētījuma autore iesaka testosteronu noteikt no rīta gan jauniem, gan vecākiem vīriešiem. [13]
Bhasin et al., pamatojoties uz T diennakts ritma variācijām un to, ka tas varētu būt samazināts, uzņemot ēdienu vai glikozi, iesaka noteikt kopējā testosterona koncentrāciju divos rītos pēc kārtas, tukšā dūšā. [2] Šī premise tiek balstīta nelielos pētījumos, kā piemēram Lehtihet et al., kas novēroja seruma T samazināšanos par 30 % 60 un 120 minūtes pēc standarta 550 kcal maltītes, salīdzinot ar paraugiem, kas ņemti tukšā dūšā. Autori secina, ka seruma T kritums ne-tukšā dūšā var dot nepareizi zemu seruma T un radīt viltus hipogonādisma diagnozi. [5]
Seruma T un brīvā T samazināšanās pēc dažādu uzturvielu maltītes tika arī novērotas Van de Velde et al. pētījumos, bet, postprandiālais kritums bija mazāk izteikts vīriešiem virs 40 gadu vecuma ar aptaukošanos. [6] Tremellen et al. ziņo, ka 1 h pēc maltītes ar augstu tauku saturu, T serumā nokrītas par 25 %, un tā līmenis paliek samazināts zem tukšas dūšas rādītājiem vēl ≤ 4 h, bez ievērojamiem efektiem uz gonadotropīnu līmeni. Tomēr, intravenozi ievadītiem taukiem (intralipīdiem) nebija efekta uz T līmeni, kas liek domāt par zarnu trakta netieši mediētu atbildes reakciju. [7] Samazinātu cirkulējošo T un brīvo T pēc taukus saturošas maltītes aprakstīja arī Meikle et al. jau 1990. gadā, bet bez izmaiņām pēc jauktas ogļhidrātu un proteīna maltītes. [8] Arī Caronia et al. pētījumā, lietojot 75 g glikozi, testosterons samazinājās, vidējais rādītājs 3,5 nmol/L, bet tā līmeņi reaktīvi atgriezās bāzes mērījumos pēc 120 minūtēm. [9] Līdzīgi, 25 % samazinājums T pēc glikozes maltītes bez izmaiņām LH, SHBG vai kortizola līmeņos. [10]
Interesanti, ka 45 vīriešu pētījumā (vecums 37 +/- 7,2 gadi) par testosterona izmaiņām Ramadāna (intermitējošā gavēņa) laikā, kad četru nedēļu garumā dienas gaišajā laikā, 12-14 h garumā neēd, nedzer, nesmēķē un nenotiek dzimumakts, netika atrasta gavēņa ietekme uz brīvā vai kopējā testosterona līmeni, lai gan pēc gavēņa samazinājās FSH līmenis, samazinājās libido un ķermeņa svars. Netika atrastas statistiski nozīmīgas izmaiņas erektilajā funkcijā, seruma testosteronā, luteinizējošajā hormonā, estradiolā un dehidroepiandrosterona sulfāta līmeņos. [11]
Tomēr, ir arī pretēji viedokļi: pēc 2021. gadā Apvienotajā Karalistē veiktā kohortas pētījuma ar 213 vīriešu dalību, tika noskaidrots, ka nav nozīmīgas atšķirības starp kopējā testosterona līmeni tukšā dūšā un pēc maltītes. [3]
FH ārstēšana
Dzīvesveida maiņa
Vairākos pētījumos tika atklāts, ka ķermeņa svara samazinājums var paaugstināt kopējā testosterona līmeni asinīs. 2013. gadā publicētā šķērsgriezuma pētījumā tika konstatēts testosterona līmeņa proporcionāls pieaugums pie ķermeņa svara samazinājuma. Vislabākie rezultāti tika konstatēti pacientiem, kuri zaudēja >15 % no ķermeņa svara. [28] 2023. gadā publicētā šķērsgriezuma pētījumā, kas veikts ASV ar 2213 vīriešu izlasi, tika noteikta korelācija, ka vieglas līdz vidējas intensitātes fiziskā aktivitāte tiek saistīta ar zemāku tetstosterona deficīta iespējamību, bet augstas intensitātes treniņi tiek saistīti ar augstāku testosterona deficīta risku. [19] Tātad, vispārēji rekomendētām 2,5 h mērenām fiziskām aktivitātēm nedēļas laikā ir pasargājošs efekts.
Liekā svara kontrole: viscerāla adipozitāte tiek negatīvi saistīta ar SHBG līmeni, kā arī hiperinsulinēmija un proiekaisīgie citokīni samazina aknu SHBG ražošanu. [27] SHBG samazinājums izraisa pieaugumu brīvajam testosterona līmenim, kas paaugstina aromatāžu aktivitāti un vairāk testosterona pārvēršas estradiolā. Rodas apburtais loks, jo hipogonādisms pēc būtības saistās ar tauku uzkrāšanu, kas samazina testosterona ražošanu, kas atkal palielina tauku uzkrāšanu. [28]
Pirmo reizi 2023.gadā tika sākts pētījums par vīriešu specifiskas psihoterapijas programmas ietekmi uz depresijas ārstēšanu eigonadāliem un hipogonadāliem vīriešiem, kas saņem testosteronu, salīdzinājumā ar standarta KBT. Pašlaik pētījuma sagaidāmie rezultāti liecina, ka vīriešu specifiska terapija ir efektīvāka, kā arī uzlabo hipogonadālu, depresīvu vīriešu dzīves kvalitāti. [38]
Uztura bagātinātāji
- Ašvaganda (Withania somnifera). Divos pētījumos tika konstatēts seruma T līmeņa paaugstinājums, lietojot ašvagandu astoņas nedēļas. 2019. gada pētījumā izpētīja Ašvagandas ietekmi uz testosterona, estradiola un kortizola līmeni asinīs vīriešiem ar lieko svaru no 40 līdz 70 gadiem. Kontoles analīzes uzrādīja T līmeņa pieaugumu par 14,8 % salīdzinājuma ar kontroles grupu, bez ietekmes uz estrogēna un kortizola līmeņiem. Turklāt, starp pētījumu grupām netika konstatētas atšķirības nogurumā, enerģijas līmenī un dzimumtieksmē. Pētījumā, kurš bija veikts 2022. gadā, pētījuma grupa atzīmēja uzlabojumus arī seksuālajā labklājībā. [30; 31]
- Tribulus (Tribulus terrestris). Ir pretrunīgi dati par šā uztura bagātinātāja ietekmi uz testosterona līmeni serumā. Ir pētījumi, kuros atklāta pozitīva ietekme uz seruma T līmeni, citos pētījumos šis efekts netika konstatēts. 2014. gada sistēmiskā apskatā tika secināts, ka Tribulus nav efektīvs T līmeņa paaugstināšanai. [31; 32]
- Maca (Lepidium meyenii). Maca uzlabo hipogonādisma simptomus eigonadāliem vīriešiem, bez ietekmes uz testosterona līmeni. [35]
- Longjack jeb Eurycoma longifolia. 2022. gada meta-analīzē tika izskatīti deviņi pētījumi par uztura bagātinatāja ietekmi uz testosterona līmeni. Septiņi pētījumi uzrādīja T pieaugumu dažādām pacientu grupām, bet divi pētījumi šādu ietekmi neatklāja. [37]
Testosterona aizvietojoša terapija
Ir divas galvenās indikācijas testosterona aizvietojošai terapijai (TTr):
- Pacienti ar zemu testosterona līmeni, kuriem ir izjaukta hipotalāma-hipofīzes-gonādu ass hipofīzektomijas vai testikulāras atrofijas dēļ.
- Pacienti, kuriem ir testosterona deficīta simptomi ar zemu testosterona koncentrāciju asinīs.
Sākot testosterona aizvietojošo terapiju, jāņem vērā kontrindikācijas un blaknes. Kontrindikācijas testosterona aizvietošanas terapijai ir:
- Prostatas audzējs anamnēzē.
- Krūts vēzis.
- Neizvērtēts prostatas mezgls vai sabiezējums.
- PSA līmenis virs 4 ng/mL (ja nav izslēgt prostatas vēzis).
- Smagi apakšējo urīnvadu simptomi, kas ir asociēti ar prostatas hiperplāziju.
- Hematokrīts virs 50 % (attiecās tikai uz i/m terapiju).
- Nekontrolēta vai slikti kontrolēta sirds mazspēja. [33]
Galvenā blakne pie testosterona aizvietošanas terapijas ir nomākta spermatoģenēze. Testosterons darbojās kā dabīgais kontraceptīvs, tas inhibē ganodotropīnu atbrīvojošo hormonu un gonadotropīnu sekrēciju, kas izraisa hipospermatoģenēzi un var rezultēties azoospermijā. Ir iespēja atgūt spermatoģenēzi pēc TTr ar cilvēka horiogonadotropīnu (cHG). [33] Ir daudz komerciāli pieejamu T savienojumu, ko var izmantot TTr. Tomēr pacientiem ērtāk un efektīvāk izmantot transdermālo gēlu un intramuskulāro injekciju.
Transdermālais T gēls nodrošina stabilu un normālu seruma T līmeni 24 stundu laikā. To jāizmanto katru dienu, noklājot augšdelma ādu. Uzsūkšanas laiks ir no 5 minūtēm, pēc divām stundām var mazgāties un nodarboties ar peldēšanu. Jāuzmanās no transdermālā gēla transferences citiem cilvēkiem, līdz ar to nav ieteicams apskaut citus, nodarboties ar seksu vai cīņas sporta veidiem divu stundu laikā pēc gēla uzlikšanas. [33]
Intramuskulāras T injekcijas iedala īsas un ilgas darbības. Īsas darbības T-enantātu jāievada muskulī reizi 2 līdz 4 nedēļās, atkarībā no mērķa koncentrācijas un individuālajām īpašībām. Garās darbības T-undekanoāta otro devu nepieciešams ievadīt pēc 6 nedēļām, un tad atkārtot ik pa 12 nedēļām. [33]
Alternatīvie varianti TTr
Selektīvie estrogēna receptora modulātori (SERM) inhibē estrogēnu atpakaļsaisti hipotalāmam, kas rezultējas ar LH un FSH paaugstinājumu, kas savukārt stimulē endogēno T produkciju. Klomifēna citrāts ir biežākais SERMs, kuru neoficāli izmanto vīriešiem, lai palielinātu endogēna T produkciju. Enklomifēna citrāts, klomifēna nesteroidāls izomērs, ir otrs izmantojams medikaments, kas ir spēcīgāks par klomifēnu, bet darbības ilgums ir īsāks. [33]
Aromatāzes inhibitori bremzē T konversiju estradiolā. Šīs grupas medikamenti ir anastrazols, testolaktons un letrozols. Trijos pētījumos tika iegūts vidējais pieaugums T līmenim 3-12 mēnešu laikā par 123 ng/dL (4,26 nmol/L) grupā, kurā lietoja preparātu divas reizes nedēļā, un par 229 ng/dL (7,94 nmol/L) grupā, kur lietoja katru dienu. [33]
Tomēr SERM un aromatāzes inhibitori parasti nespēj likvidēt testosterona deficīta simptomus, tādēļ tie netiek rekomendēti FH ārstēšanā.
Cilvēka horiotropais hormons arī paaugstina seruma T līmeni, jo darbojas kā LH analogs. To nozīmē intramuskulārās vai subkutānas injekcijās, atkarībā no devas - katru dienu, divas reizes nedēlā vai reizi divās nedēļās. [33] Tas var tik lietots kombinācijā ar FSH preparātiem pacientiem ar FH, kad nav vēlama spermatoģenēzes inhibīcija – ja pacients plāno grūtniecību ar savu partneri.