Pēdējos gadu desmitos alkohola patēriņš pieaug visā pasaulē. Alkoholisms tiek definēts kā primāra hroniska slimība, kuras attīstību nosaka ģenētiski, psihosociāli un vides faktori. Eiropā alkohola aknu bojājums ir biežākais dekompensētas aknu slimības iemesls. Pārmērīga alkohola lietošana izraisa ne tikai aknu bojājumu, bet arī veicina ļaundabīgu audzēju attīstību, izraisa negadījumus un katastrofas, veicina noziedzīgu rīcību un sociālas problēmas.
Alkohols un aknu veselība

1. attēls
Alkohola lietošanas ietekme uz aknām
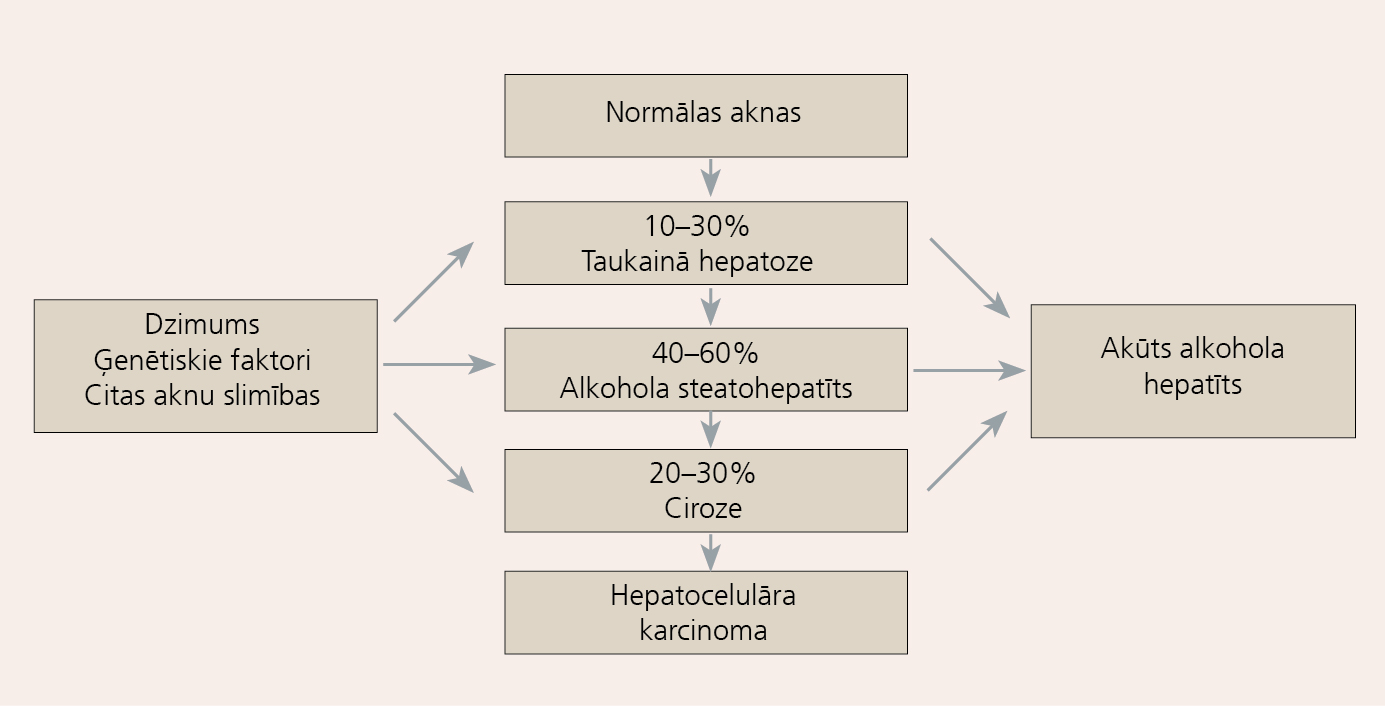
Ir pierādīts, ka aknu slimību risks pieaug, ja alkohola lietošana pārsniedz 20-30 g dienā sievietēm un 40-60 g dienā vīriešiem, taču pēdējā laika ziņojumi rāda, ka mirstība aknu cirozes dēļ palielinās, ja tiek lietots 12-24 g tīrā alkohola dienā (dažādu autoru datos devas atšķiras). Tomēr aknu ciroze ir tikai aptuveni 10% alkohola lietotāju. Alkohola aknu bojājums ir daudzfaktoru slimība, tās attīstību nosaka ne tikai pārmērīgs alkohola patēriņš, bet arī dzimums, ģenētiskā predispozīcija un citas aknu slimības (skat. 1. attēlu).
Ja alkoholu lieto vienādā daudzumā, sievietēm ir lielāka iespēja, ka attīstīsies akūts alkohola hepatīts, salīdzinot ar vīriešiem. Alkohola veidam slimības attīstībā nav nozīmes.Alkohola lietošana izraisa tauku uzkrāšanos hepatocītos - taukaino hepatozi. Ja no alkohola lietošanas atsakās, šis process ir atgriezenisks. Ja alkohola lietošana turpinās, ievērojami pieaug alkohola hepatīta (akūta alkohola hepatīta), aknu fibrozes un cirozes attīstības risks. Pacientiem ar alkohola izraisītu aknu cirozi ir lielāka iespējamība hepatocelulāras karcinomas attīstībai. Ja histoloģiski ir taukainā hepatoze bez iekaisuma un fibrozes pazīmēm, tad cirozes attīstības iespējamība ir mazāka, salīdzinot ar pacientiem, kam ir iekaisuma un fibrozes pazīmes - steatohepatīts. Histoloģiskā atrade alkohola steatohepatīta (ASH) gadījumā ir līdzīga kā pacientiem ar ne-alkohola steatohepatītu (NASH), tad nozīme ir liekajam svaram un cukura diabētam. Tādējādi aknu biopsija un aknu audu morfoloģiskā izmeklēšana ļauj atšķirt taukaino hepatozi no steatohepatīta un prognozēt aknu cirozes attīstības risku, taču, lai noteiktu, vai aknu bojājumu izraisījis alkohols, svarīga ir anamnēze un pacienta atklātība, kā arī vairākas netiešās pazīmes (klīniskās un laboratorās), kas var liecināt, ka pacients ir alkohola lietotājs.
Aknu bojājuma mehānismi
Alkohola aknu bojājuma gadījumā nozīme ir dažādiem faktoriem - etanola metabolītiem, alkohola izraisītā iekaisuma produktiem, ģenētiskai predispozīcijai. Etanola oksidācijas procesā veidojas metabolīti, kas savienojas ar olbaltumvielām un izraisa iekaisuma reakciju, fibrozes un cirozes veidošanos. Alkohols (etanols) organismā tiek oksidēts fermentatīvā vai nefermentatīvā ceļā. Hepatocītos alkohola oksidācija notiek ar alkohola dehidrogenāzes (ADH) palīdzību, veidojot acetaldehīdu. Mitohondrijos acet-aldehīds pārveidojas par acetātu un tālāk par acetil-CoA, kas divoglekļu molekulu iesaista trikarboksilskābes ciklā (skat. 2. attēlu).


2. attēls
Etanola oksidācija fermentatīvā ceļā
Šī oksidācija mazina nikotīnamīda adenīna dinukleotīdus (NAD, NADH), kas normāli inhibē taukskābju oksidāciju, tādējādi palielinot lipoģenēzi. Etanols veicina lipīdu metabolismu arī ar citu fermentu un receptoru palīdzību - inhibējot peroksisomu proliferāciju aktivējošos alfa receptorus (PPAR-alfa receptorus), adenozīnmonofosfāta (AMP) kināzi, stimulējot sterolu regulācijas saistošo proteīnu. Šie mehānismi veicina aknu steatozes rašanos. Lipopolisaharīdi (LPS), kas atbrīvojas zarnu lūmenā, nonāk asinsritē - portālajā vēnā un aknās, veicinot iekaisuma attīstību un citokīnu atbrīvošanos. Kupfera šūnās LPS savienojas ar CD14 un TLR4, tā aktivējot dažādus citokīnu kodējošos gēnus. Citokīni - TNF alfa, IL-8, monocītu hemotakses proteīns-1, trombocītu augšanas faktors (PDGF) - izraisa drudzi, apetītes zudumu, svara zudumu, piesaista neitrofilos leikocītus un makrofāgus, aktivē zvaigžņveida šūnas, veicina to proliferāciju un aknu fibrozes veidošanos. Ir pierādīts, ka alkohols palielina oksidatīvā stresa hormonus, kas veicina brīvo radikāļu atbrīvošanos, mitohondriju bojājumu, apoptozi un tauku sintēzi.Interesanti, ka vairākos pētījumos pierādīta kafijas labvēlīgā ietekme uz aknām alkohola lietotājiem, mazinot saistaudu veidošanos un cirozes attīstību. Turklāt saistība ir tieši atkarīga no lietotā kofeīna daudzuma. Tomēr mehānismi šai saistībai nav pilnībā skaidri.
Klīniskā aina
Alkohola aknu bojājuma gadījumā klīniskā aina var būt ļoti dažāda - no bezsimptomu formas līdz akūtai aknu mazspējai. Taukainā hepatoze un steatohepatīts parasti norit bez simptomiem vai arī tie ir nespecifiski - nogurums, smaguma sajūta labajā paribē. Laboratori raksturīgākās izmaiņas - paaugstināta transamināžu un gamma glutamiltranspeptidāzes aktivitāte serumā. Ultrasonoskopiski - palielinātas aknas, paaugstināta aknu ehogenitāte ar novājinātu ultraskaņas vadību caur aknu audiem. Arī aknu ciroze sākotnēji var noritēt bez simptomiem. Akūts alkohola hepatīts parasti attīstās uz hroniska aknu bojājuma fona - taukainās hepatozes, steatohepatīta vai cirozes fona. Tāpēc klīniskā aina, slimības smaguma pakāpe un prognoze atkarīga no hroniskā aknu bojājuma smaguma.
Akūta alkohola hepatīta klīnika
Akūta alkohola hepatīta klīniskā aina klasiskā gadījumā:
- sūdzības par nespēku, sliktu dūšu, vemšanu, samazinātu apetīti, smaguma sajūtu labajā paribē;
- strauji pieaugoša dzelte pēc alkohola lietošanas;
- aknu mazspējas simptomātika:
- recēšanas traucējumi ar dažādām asiņošanas izpausmēm - hemorāģiski izsitumi, hematomas, asiņošana no mutes, deguna gļotādām, asiņošana no kuņģa-zarnu trakta,
- aknu encefalopātijas pazīmes līdz pat aknu komai;
- febrīla temperatūra;
- portālās hipertensijas pazīmes - ascīts, barības vada vēnu varikoze, hemoroidālā slimība, hidrotorakss;
- parasti aknas ir palielinātas, blīvas konsistences, palpējot nesāpīgas;
- splenomegālija;
- aknu zvaigznītes, Dipitrēna kontraktūras;
- perifēra simetriska neiropātija;
- muskuļu atrofija, pazemināts barojums;
- ginekomastija.
Diagnostika
Laboratorie testi
Vairāki laboratorie testi tieši vai netieši liecina par to, ka pacients ir alkohola lietotājs, vai norāda uz aknu bojājumu.
- Makrocitoze - asinsainā palielināts vidējais eritrocītu tilpums (MCV). 90% alkohola lietotāju MCV ir robežās 100-110 fl. Makrocitoze attīstās, ja regulāri lieto ~ 80 g alkohola dienā (t.i., pudeli vīna). Nelietojot alkoholu, MCV normalizējas 2-4 mēnešos.
- Leikocitoze ar novirzi pa kreisi. Tā kā pacientiem bieži ir arī febrīla temperatūra, tad pirmais iespaids ir par bakteriālu infekciju. Bet parasti CRO ir nedaudz paaugstināts, iekaisuma perēkli nekonstatē, urīna, asins uzsējumi ir sterili.
- Bilirubīns - paaugstināts, galvenokārt uz saistītā bilirubīna rēķina.
- Alanīnaminotransferāzes (AlAT) un aspartātaminotransferāzes (AsAT) attiecība. AsAT:AlAT > 2. Turklāt AsAT aktivitāte parasti nepārsniedz 300 V/l (reti līdz 500 V/l).
- GGT (gamma glutamiltranspeptidāze) aktivitāte - paaugstināta, pat tūkstošos V/l.
- Protrombīna indekss - pazemināts, INR - paaugstināts.
- Seruma transferīns - paaugstināts. Šis tests nav plaši pieejams. Rezultātu ietekmē grūtniecība, dzelzs vielmaiņas traucējumi.
Citi izmeklējumi
Ultrasonoskopisku izmeklēšanu veic, lai konstatētu vai izslēgtu hepatocelulāru karcinomu, žultsvadu nosprostojumu, portālās hipertensijas pazīmes, ascītu, splenomegāliju, portālās vēnas trombozi.Ascīta punkcija un izmeklēšana: par spontānu bakteriālu peritonītu liecina polimorfnukleāro leikocītu skaits ascīta punktātā > 250 šūnas/mm3 un vismaz divi no šiem kritērijiem:
- kopējais olbaltums > 1 g/dl (10 g/l);
- glikoze < 50 mg/dl (2,8 mmol/l);
- laktātdehidrogenāze virs seruma aktivitātes augšējās normas.
Histoloģiskā atrade - hepatocītos lieli tauku pilieni un balonveida uzbriešana ar alkohola hialīna (Melori ķermenīšu) ieslēgumiem, neitrofilo leikocītu infiltrācija, intrasinusoidāla fibroze.
Diferenciāldiagnoze
Alkohola hepatīts jādiferencē no ne-alkohola steatohepatīta, akūta vai hroniska vīrushepatīta, medikamentoza hepatīta, autoimūna hepatīta, Vilsona slimības.
Prognoze
Alkohola hepatīts attīstās tikai nelielai daļai pacientu, kas lieto pārmērīgi daudz alkohola. Taču, lai gan alkohola lietošanu pārtrauc un ārstēšana ir adekvāta, 28 dienu mirstība ir augsta, proti, 30-50%.Ir vairākas punktu sistēmas, pēc kurām nosaka alkohola hepatīta smagumu un prognozi.
- Pēc Maddrey aknu funkcionālās spējas aprēķina, izmantojot protrombīna laiku un seruma bilirubīnu. [4] + seruma bilirubīns, mg/dl. Ja > 32 - smags alkohola hepatīts, indicēta terapija ar GK.
- MELD (model of end-stage liver disease) punktu skaitu aprēķina, izmantojot bilirubīna, INR, kreatinīna līmeni un pacienta vecumu. Formula, pēc kuras aprēķina MELD, atrodama interneta vietnēs:
- http://optn.transplant.hrsa.gov/resources/professionalResources.asp?index=9
- http://www.mayoclinic.org/meld/mayomodel7.htmlJa MELD > 21, tad 90 dienu mirstība sasniedz 20%.
- Lille punktu sistēmu pamato izejas aknu stāvoklis un seruma bilirubīna samazināšanās 7 dienās, lietojot GK. Tas arī nosaka, vai turpināt terapiju ar GK ir mērķtiecīgi.
- Glāzgovas alkohola hepatīta punktu sistēmā (nejaukt ar Glāzgovas komas skalu!) izmanto vecumu, leikocītu skaitu, urīnvielu, bilirubīnu, protrombīna laiku. Arī ar šo sistēmu var izvērtēt GK terapijas nepieciešamību.
- CTP (Child-Turcotte-Pugh) rādītāju aprēķina, izmantojot albumīna, bilirubīna, INR līmeni, ascīta un encefalopātijas esamību. Kā MELD, tā CTP var izmantot, lai prognozētu slimības iznākumu pacientiem ar cirozi. Pēdējā laikā MELD aprēķināšana modificēta, izmantojot arī seruma nātrija līmeni, tas ļauj prognozēt 6 mēnešu mirstības risku pacientiem ar alkohola cirozi.
Ārstēšana
Galvenā ārstēšana - atturēties no alkohola lietošanas. Tas svarīgi arī tiem pacientiem, kam ir alkohola izraisīta aknu ciroze un nepieciešama aknu transplantācija, jo alkohola lietošana ir kontrindikācija aknu transplantācijai. Tikai pēc 6 mēnešu atturēšanās tiek izvērtēta pacienta atbilstība un nepieciešamība transplantācijai. Prognoze pacientiem ar alkohola izraisītu aknu bojājumu atkarīga no alkohola lietošanas. Atturība var veicināt pat fibrozes regresiju un ascīta izzušanu. Alkohola izraisītas taukainās hepatozes gadījumā prognoze ir laba, ja pacients pārtrauc alkohola lietošanu.Smagākos gadījumos pacients jāhospitalizē. Mirstība ir augstāka pacientiem, kam aknu biopsijā ir iekaisuma šūnu klātbūtne (galvenokārt neitrofilo leikocītu) neatkarīgi no citas histoloģiskās atrades. Sliktāka prognoze ir arī tad, ja histoloģiski atrod perivenulāru fibrozi un jaukta tipa mikromakrovezikulāru steatozi.
Alkohola abstinences ārstēšana
Alkohola abstinences ārstēšanai, lai mazinātu krampju un delīrija attīstības risku, izmanto benzodiazepīnu grupas preparātus, piemēram, garas darbības (diazepāmu parenterāli) vai īsas darbības - lorazepāmu, oksazepāmu, kas vairāk piemēroti gados vecākiem pacientiem un cilvēkiem ar aknu funkcijas traucējumiem.
Šķidrums, kalorijas, minerālvielas un vitamīni
Jāizvairās no pārmērīgas šķidruma ievades pacientiem ar aknu cirozes pazīmēm, tas var veicināt ascīta parādīšanos vai pieaugumu, samazināt plazmas nātrija koncentrāciju, stimulēt asiņošanu no varikozi paplašinātām barības vada vēnām. Indicēti B grupas vitamīni (tiamīns, piridoksīns, folskābe), minerālvielas - magnēzijs.K vitamīns - parasti to ordinē pacientiem ar pagarinātu protrombīna laiku, tomēr tā efekts ir apšaubāms, jo koagulopātiju pārsvarā nosaka aknu šūnu mazspēja (pazemināta sintēzes funkcija), nevis K vitamīna deficīts. Svaigi saldētas plazmas pārliešana indicēta tikai tad, ja ir asiņošanas pazīmes, pretējā gadījumā tas var veicināt asiņošanu no varikozi paplašinātām barības vada vēnām.
Barošana
Alkohola lietotājiem bieži vēro pazeminātu barojumu, hipoalbuminēmiju, tūskas, ascītu. Jo izteiktākas malnutrīcijas pazīmes, jo smagāk norit alkohola izraisīts hepatīts. Ir veikti vairāki pētījumi par barošanas ietekmi uz slimības gaitu. Lai gan rezultāti ir pretrunīgi, tomēr lielākajā daļā pētījumu konstatēta aknu funkcijas un histoloģiskās atrades uzlabošanās, ja izvēlas adekvātu enterālu barošanu. Tomēr mirstības mazināšanās un izmaksu efektivitāte nav pierādīta. Proteīnu uzņemšana varētu veicināt aknu encefalopātijas attīstību, tomēr parasti tā ir labi panesama; olbaltumvielu ierobežošana uzturā netiek rekomendēta, ja vien nav jau aknu encefalopātijas pazīmju. Rekomendētais olbaltumvielu daudzums ir 1,5 g/kg dienā. Pacientiem ar aknu encefalopātiju rekomendē aminoskābju produktus.
Medikamentozā terapija
Gremošanas trakta asiņošanas riska mazināšanai ordinē H2 blokatorus, sukralfātu vai protonu sūkņa inhibitorus.
Glikokortikosteroīdi
Pētījumu rezultāti par glikokortikosteroīdu (GK) efektivitāti alkohola hepatīta gadījumā ir pretrunīgi. Pēc Amerikas aknu slimību pētnieku asociācijas (AASLD) rekomendācijām ārstēšana ar GK indicēta pacientiem ar smagas gaitas alkohola hepatītu (Maddrey > 32 ar vai bez encefalopātijas), kuriem nav kontrindikāciju GK lietošanai. Rekomendē 4 nedēļu ārstēšanas kursu ar prednizolonu 40 mg dienā perorāli. Nav pētījumu par prednizolona lietošanu pacientiem, kam līdztekus ir arī pankreatīts, gastrointestināla asiņošana, nieru mazspēju vai akūta infekcija. Šajos gadījumos prednizolons pat varētu būt kontrindicēts. Sākot terapiju ar prednizolonu, efekts jāvērtē pēc 7 dienām: ja bilirubīna līmenis nav pazeminājies, tad terapija ar prednizolonu uzskatāma par neefektīvu un jāpārtrauc.
Pentoksifilīns
Pacientiem ar alkohola hepatītu paaugstinās audzēja nekrozes faktora (TNF) līmenis. TNF inhibitors pentoksifilīns indicēts pacientiem, kam GK terapija nav piemērota. Ir dati, ka tiek mazināts mirstības risks no hepatorenāla sindroma. Pentoksifilīna deva 400 mg 3 ×/dienā perorāli.
Citi medikamenti
Alkohola hepatīta ārstēšanai pētīti arī citi medikamenti (N-acetilcisteīns, etanercepts, infliksimabs, propiltiouracils, insulīns, glikagons, malotilāts), taču pārliecinošu pierādījumu to efektivitātei un drošumam nav.
Ārstēšanās intensīvās terapijas nodaļā
Ārstēšanās intensīvās terapijas nodaļā indicēta, ja ir izteikts uzbudinājums, nestabila hemodinamika, hepatorenāls sindroms, ko neizdodas likvidēt, izteikta aknu encefalopātija vai asiņošana. Encefalopātiskiem un apreibušiem pacientiem jānodrošina elpceļu aizsardzība (aspirācijas risks). Ja nepieciešams, jāveic dažādi diagnostiskie testi - paracentēze un ascīta izmeklēšana, iespējamas infekcijas gadījumā - urīna, asiņu, ascīta uzsējums, retāk - krēpu un cerebrospinālā šķidruma izmeklēšana. Bez uzsējumiem bieži ir grūti diferencēt, vai febrīla temperatūra un iekaisīguma rādītāji analīzēs (leikocitoze ar novirzi pa kreisi) saistāmi ar alkohola hepatītu vai infekcijas perēkli.
Aknu transplantācija
Pašreizējās vadlīnijas pirms aknu transplantācijas indikācijas izvērtēšanas nosaka atturību no alkohola vismaz 6 mēnešus, tāpēc alkohola hepatīts ir kontrindikācija aknu transplantācijai.