Dzelzs nozīme un deficīta izpausmes organismā
Ap 60 % dzelzs mūsu organismā uzglabājas eritrocītos un hemoglobīnā, pārējā daļa muskuļu mioglobīnā, aknās, liesā, kaulu smadzenēs. Plazmā dzelzs savienota ar transferīnu, veidojot tikai 0,2 % no kopējā dzelzs daudzuma organismā. [3; 15] Katra vesela cilvēka organismā uz 1 kg ir 45—60 mg dzelzs. [18] Katru dienu asiņošanas, svīšanas, ādas lobīšanās dēļ, ar fēcēm un urīna izvades rezultātā mēs zaudējam ap 1—2 mg (0,05 %) dzelzs. Hemoglobīna sintēzei de novo dienā nepieciešami 20—30 mg dzelzs, ko organisms ņem no depo — liesā makrofāgi pārstrādā vecus eritrocītus. [18; 23]
Dzelzs deficīta izraisīta anēmija ir viens no biežākajiem anēmijas tipiem. [1; 12] Apmēram 80 % no visām anēmijām saistītas ar dzelzs deficītu, un dzīves laikā dzelzs deficīts ir 20—30 % pasaules iedzīvotāju. [4; 5]
Pie riska grupām pieder sievietes, pacienti ar asiņošanu anamnēzē, īpašu diētu piekritēji (veģetārieši, vegāni, sportisti), asins donori, pusaudži un bērni, pacienti ar samazinātu vai palielinātu svaru vai aptaukošanos. [1; 23] Dzelzs deficīta anēmija konstatēta 40—60 % grūtnieču [4] un saistīta ar palielinātu risku priekšlaicīgām dzemdībām, mirstībai pēcdzemdību periodā, pēcdzemdību depresijai, kognitīvu un intelektuālu traucējumu attīstībai bērnam. [4]
Deficīta izpausmes
Dzelzs deficītu novēro 30—50 % pacientu ar hronisku sirds mazspēju. Sastopamība galvenokārt atkarīga no sirds mazspējas NYHA klases, III un IV klasei deficītu novēro biežāk. [16] Tas ir iemesls biežākai šīs grupas pacientu stacionēšanai un augstākai mirstībai. [16; 23]
Dzelzs deficīts parasti norit bez specifiskiem simptomiem. Ļoti bieži pacients diagnozi uzzina tikai pēc laboratorijas apmeklējuma. [1] Simptomi parasti parādās, kad dzelzs deficīts jau progresē anēmijā, bet arī tas nenotiek visiem pacientiem. Pacientam varētu būt šādi simptomi: nogurums, nespēja pildīt fizisku darbu, vājums, ātra nogurdināmība, galvassāpes, garastāvokļa maiņas, aizdusa, ģībonis un reibonis, bāla āda un gļotādas, matu šķelšanās un izkrišana, nagu deformācija un trauslums. [1; 2]
Par dzelzs deficītu var vēstīt arī pica simptoms — neēdamu priekšmetu ēšana. Pacientiem paradās vēlme ēst mālus, dubļus, akmeņus, cieti, krītu, ziepes, kartonu, papīru vai nevārītus rīsus. [1; 7] Smagas anēmijas gadījumā biežāk būs tahikardija, vājums, ģībonis, nemierīgo kāju sindroms vai galvassāpes. Dzelzs deficīts bez anēmijas var izpausties ar simptomiem, kas ietekmē pacienta kognitīvās un darba spējas. [1]
Dzelzs uzsūkšanās organismā
Tipiska diennakts maltīte var saturēt 10—20 mg dzelzs, no kuriem pilnībā uzsūksies tikai 5 mg. [3; 17] Dzelzs vislabāk uzsūcas no duodenum un jejunum proksimālās daļas. [17] Izšķir divus dzelzs tipus: hēma (galvenokārt Fe2+) un ne–hēma (Fe3+) dzelzs. [15] Hēma dzelzij jābūt savienotai ar olbaltumvielām. [34] Hēma dzelzi iegūstam no dzīvnieku izcelsmes produktiem, bet ne–hēma dzelzi no piena, baltās gaļas un augu izcelsmes produktiem. [9]
Hēma dzelzij ir labāka biopieejamība (uzsūcas vidēji 15—35 % no uzņemtās devas). Tas izskaidro to, kāpēc veģetārieši un vegāni ir riska grupa dzelzs deficīta ziņā. [17] Ne–hēma dzelzs ir diezgan nešķīstošs savienojums. Pirms uzsūkšanās Fe+3 savienojumiem jāpārvēršas par Fe+2, svarīga šajā procesā ir skāba vide. [34]
Tāpēc ne–hēma dzelzs efektu var ietekmēt medikamenti, kas maina vides pH līmeni (piemēram, protonu sūkņu inhibitori, histamīna–2 blokatori, antacīdi), un dažādas slimības. [8; 34] Ne–hēma dzelzs ne tikai neuzsūcas tik labi (vidēji 2—20 % no uzņemtās devas), bet tās uzsūkšanos spēj ietekmēt arī virkne citu faktoru: kalcijs, tanīni, fitāti, polifenoli (sastopami tējā (pat par 90 %), dārzeņos, vīnā, kafijā), sojas proteīni, olas, šķiedrvielas. [1; 2; 14; 20; 31] Kalcijs spēj ietekmēt arī hēma dzelzs uzsūkšanos. [34]
Kāpēc svarīgi dzelzi nepārdozēt?
Hepcidīna lomandzelzs biopieejamībā
Dzelzs ir ne tikai vitāli svarīgs ķīmisks elements, bet arī potenciāli toksisks, tāpēc mūsu organismā ir stingra dzelzs homeostāzes kontrole. [23]
Ievadot ļoti lielu dzelzs devu, var aktivēties hepcidīna izdale aknās. Šī viela ir ļoti svarīga dzelzs uzsūkšanās kontrolē, tā var inhibēt dzelzs uzsūkšanos 24—48 h. Hepcidīns ietekmē feroportīna receptora darbību: šo receptoru galvenā loma ir izdalīt dzelzi sistēmiskā cirkulācijā vai no depo, vai pēc uzsūkšanās no gremošanas trakta. [18] Šis receptors atrodams duodenum enterocītos, liesas makrofāgos un hepatocītos. [23] Tas nozīmē: ja pacients no rīta ieņem pārāk lielu dzelzs daudzumu, tas var ietekmēt nākamās devas uzsūkšanās spējas. [10; 13; 19; 22]
Hepcidīna izdali var veicināt arī iekaisuma procesi organismā, infekcijas, ļaundabīgi audzēji. Bet izdales nomākšana panākta hipoksijas apstākļos, kas tomēr palielinātu organisma prasības pēc dzelzs. [13; 15] Ir ģenētiskas mutācijas, kuru dēļ pacientam ir paaugstināts hepcidīna līmenis organismā. [23] Hepcidīna aktivitāte ietekmē arī dzelzs atbrīvošanos no organisma depo. [18] Tā aktivācija jāņem vērā, lietojot dzelzs preparātus, un dažreiz tas ir izskaidrojums neefektīvai terapijai. [23] Jāatceras: ja ievadīta pārāk liela deva uzreiz, transferīns (transportmolekula) ātri piesātinās ar dzelzi un pārējiem elementiem, ļoti ātri uzsūcas endokrīnās sistēmas šūnās, sirdī un aknās, tāpēc oksidatīvā stresa dēļ varētu būt traucētas šo orgānu funkcijas. [3]
Organisma īpatnības
Dzelzs uzsūkšanās atkarīga arī no organisma prasībām: ja tās pieaug, uzlabojas arī uzsūkšanās. [18] Piemēram, vesels vīrieša vai sievietes organisms attiecīgi uzsūks tikai vidēji 5 % un 5,6 % no uzņemtās dzelzs devas. Savukārt pacientiem ar latentu dzelzs deficītu un dzelzs deficīta anēmiju uzsūkšanās spēja pieaug vidēji līdz 10—13 %. [12] Jo smagāka anēmija vai dzelzs deficīts, jo organisms labāk to uzņems.
Dzelzs preparātu lietošanas īpatnības
Lielākā daļa no per os lietojamajiem dzelzs preparātiem ir ļoti kaprīzi, jo farmakoloģiski ražota dzelzs uzsūcas caur to pašu ceļu kā ne–hēma dzelzs. [23] Dzelzs preparāti jālieto starp ēdienreizēm (1 h pirms vai 2 h pēc). Dzelzs preparāts jālieto 2 stundas pirms vai 4 stundas pēc antacīda uzņemšanas. [14; 23]
Kalcijs būtiski samazina dzelzs uzsūkšanos — par apmēram 60 %, tāpēc ar kalciju bagāts uzturs vai kalciju saturoši uztura bagātinātāji jālieto atsevišķi no dzelzs preparātiem (arī ar 2—4 h intervālu). [14] Savukārt C vitamīna lietošana kopā ar dzelzs preparātiem spēj uzlabot to biopieejamību. [1] Rekomendē lietot 250—500 mg C vitamīnu saturoša preparāta kopā ar dzelzs preparātu. [2; 6; 7; 14; 23] Bet jāņem vērā, ka, lietojot C vitamīnu kopā ar dzelzs preparātiem, var palielināties risks blakusparādību attīstībai. [8]
Dzelzs labāk uzsūcas, ja pacients pārtikā lieto gaļas produktus. [6; 19] Šķidros dzelzs preparātus rekomendē jaukt kopā ar citrusaugļu sulām. [2] Per os lietojamie dzelzs preparāti ietekmē tādu medikamentu biopieejamību kā fluorhinoloni, levodopa, metildopa, tetraciklīni, vairogdziedzera hormonu preparāti.
Dzelzs preparāti, to raksturojums
Dzelzij salīdzinājumā ar citiem elementiem ir diezgan sarežģīti vielmaiņas procesi, kas apgrūtina preparātu biopieejamības un efektivitātes novērtējumu, izmantojot klasiskos farmakokinētikas parametrus, piemēram, koncentrāciju plazmā. Turklāt jauni eritrocīti formējas 3—4 nedēļās, kas arī apgrūtina efektivitātes interpretāciju. Tāpēc svarīgāk dzelzs koncentrāciju laboratoriski noteikt nevis dažas stundas pēc ievades, bet, piemēram, pēc trim mēnešiem. [3] Ir rekomendācijas, ka hemoglobīna noteikšana 2—3 nedēļas pēc dzelzs per os terapijas sākšanas ir labs kritērijs efektivitātes novērtēšanai un lēmuma pieņemšanai par turpmāko. [10] Taču efektivitātes interpretācijai svarīgs ne tikai hemoglobīna daudzums, bet arī dzelzs resursu papildināšana organismā, uz ko norāda feritīns. [23]
Perorāli lietojamie preparāti
Pirmās izvēles preparāti dzelzs anēmijas korekcijā būs perorālie dzelzs preparāti. [1; 7] Šo preparātu biopieejamība 15—50 %. [20] Per os preparāti pēc uzsūkšanās tiek savienoti ar plazmas transferīnu. [23] Preparāti ir salīdzinoši lēti, pieejami, ērti lietošanā, droši un efektīvi. [2]
Pārsvarā lieto Fe (II) saturošus preparātus, kuri pēc uzsūkšanās gremošanas traktā pārveidojas (oksidējas) līdz Fe (III), tikai tādā formā dzelzs var savienoties ar apoferitīnu; šīs reakcijas rezultātā izdalās ar skābekli reaģējoši savienojumi, kas var kairināt un bojāt audus un orgānus, [16] tāpēc ļoti svarīgi atrast līdzsvaru starp efektivitāti un drošumu — pārāk ātra dzelzs uzsūkšanās vai pārāk lielas devas izsauc oksidatīvo stresu, kas var ietekmēt dažādu orgānu pareizu funkcionēšanu un kavēt dzelzs spēju uzsūkties. [3; 10] Per os lietojamās dzelzs blakusparādības izskaidrojamas ar lielo brīvās nesaistītās dzelzs koncentrāciju gremošanas traktā. [23] Ar to izskaidrojams fakts, kāpēc panesība perorāli lietojamiem preparātiem nereti nav laba. Par KZT blaknēm sūdzas 70 % pacientu (īpaši dzelzs sulfāta lietotāji). [2; 19] Ir pacienti, kam dzelzs panesība pēc dažām dienām uzlabojas, citiem ne. [14] KZT blakusparādību risks ir 2 × lielāks nekā placebo lietotāju grupām un 3 × lielāks nekā pacientiem, kam dzelzi ievada i/v. [19]
Pirms nozīmēt per os preparātus, jāzina pacienta anamnēze un KZT stāvoklis, jo dzelzs preparātu lietošana var pasliktināt KZT slimības gaitu. [19] Ir arī dati, ka dzelzs preparātu per os lietošana var negatīvi ietekmēt zarnu mikrofloru, veicinot patogēnu mikrobu augšanu, īpaši iekaisīgu zarnu slimību pacientiem, cilvēkiem ar zemāku ienākumu līmeni, bērniem. [19; 23] Visbiežāk pacienti sūdzas par aizcietējumiem un sliktu dūšu. Blakusparādības pārsvarā korelē ar dzelzs devu un dozēšanu. Tas nozīmē, ka ir daudz iespēju atrast zelta vidusceļu, saglabājot efektivitāti un samazinot dzelzs toksiskos efektus. [1] Pacientiem ar vieglas pakāpes dzelzs deficītu rekomendē lietot mazākas devas, medikamentu sadalot 2—3 lietošanas reizēm dienā vai nozīmējot mazāko iespējamo devu vienā piegājienā. [1; 19]
Pacientiem, kam blakņu dēļ dzelzs preparāti sagādā daudz raižu, var ieteikt dzelzs preparātus lietot ne katru dienu, bet, piemēram, 3 × nedēļā (pāra vai nepāra dienās). [1; 8; 10; 19; 22] Eksperimentā, kurā piedalījās 62 pacienti, puse saņēma 60 mg dzelzs preparāta 2 ×/dienā, otra puse 120 mg/reizē, bet ne katru dienu. Rezultāti rādīja, ka otrajā grupā ir zemāks sliktas dūšas un aizcietējumu sastopamības rādītājs, bet klīniskais efekts (hemoglobīna līmeņa paaugstināšanās) netika sasniegts tik ātri (6 nedēļās, bet grupa, kas medikamentu lietoja katru dienu, 3 nedēļās). Tas nozīmē, ka šī dozēšanas shēma tiešām atkarīga no anēmijas smaguma pakāpes, no tā, cik ātri jāsasniedz rezultāts, un no preparāta panesības. [22]
Divos labi plānotos pētījumos, kuros piedalījās sievietes bez anēmijas, konstatēja, ka arī dzelzs uzsūkšanās uzlabojas, ja dzelzi lieto ne katru dienu; tas, iespējams, saistīts ar hepcidīnu. [23; 24] Dzelzi lietojot tādā dozēšanas shēmā, iespējama labāka dzelzs preparātu uzsūkšanās un veiksmīgāka pacientu līdzestība. [1; 2; 10; 19; 23] Bet, lai pilnībā apstiprinātu hipotēzi, vajag vairāk pētījumu, īpaši par anēmiju dažādās smaguma pakāpēs. [23]
Elementārās dzelzs daudzumu var samazināt, izvēloties preparātu ar mazāku dzelzs saturu, piemēram, dzelzs sulfāta vietā ņemt dzelzs glikonātu. [19] Cita metode, kā samazināt dzelzs preparāta negatīvo ietekmi uz gremošanas traktu, ir tomēr atļaut medikamentu lietot ar ēdienu. Protams, būs zudumi, dzelzs biopieejamība samazināsies par 40 %, bet to var kompensēt ar papildu C vitamīnu. [1; 8; 20] Dzelzs preparātu lietojot ēšanas laikā ar 100 mg C vitamīna, uzsūkšanās uzlabojas par 67 % [20]
Blakusparādību raksturojums
Novērots, ka oksidatīvo stresu un pārējās ar to saistītās sekas vairāk izraisa dzelzs sāļi ar divvērtīgo dzelzi, jo tie ātrāk izdala dzelzi. [3; 23; 25; 31] Blakusparādību risks principā ir vienāds, lietojot dzelzs fumarātu, glikonātu un sulfātu, ko arī pierāda pētījumi. [2] Lai samazinātu blakusparādību iespējamību, šobrīd ir iespēja lietot divvērtīgās dzelzs preparātus ar pagarinātu izdalīšanos, bet daudzi šaubās par šo preparātu uzsūkšanos un biopieejamību, jo tādas tabletes dzelzi sāk atbrīvot tikai pēc nokļūšanas gremošanas trakta apakšdaļā, ārpus labākās dzelzs uzsūkšanās vietas. [9; 11; 15]
Citas blakusparādības, kas novērotas dzelzs lietošanas kursa laikā, ir vēdersāpes, dispepsija, metāliska garša mutē, caureja, meteorisms, tumšas fēces. Pacienti var sūdzēties par ādas nepilnībām, kas, iespējams, saistītas ar fotosensibilizējošu dzelzs iedarbību. [11] Ilgstoša lietošana var veicināt duodenum pigmentāciju, kas ir atgriezenisks process un izzūd dažus mēnešus pēc dzelzs lietošanas kursa pārtraukšanas. [11] Svarīgi pabrīdināt, ka šķidrās formas dzelzs preparāti krāso zobus, bet šo nepatīkamo efektu var samazināt, ja pacients zāles lieto caur salmiņu un pievērš uzmanību zobu higiēnai. [1; 2] Pārdozēšanas risks ir minimāls un ļoti reta parādība klīnikā. [1]
Lietošanas ilgums un devas
Perorālie dzelzs preparāti jālieto vismaz 3—6 mēnešus. [8; 25] Pat pēc hemoglobīna līmeņa normalizēšanās per os dzelzs preparātu lietošana jāturpina vēl trīs mēnešus, lai atjaunotos rezerves. [27] Ja pēc 3—4 nedēļām nav atbildreakcijas uz per os terapiju, tā jāpārtrauc. [25]
No pacienta klīniskās ainas smaguma pakāpes izriet deva: 60—200 mg elementārās dzelzs dienā. [7; 25] Bērniem devu izrēķina pēc ķermeņa masas: 3—6 mg dzelzs/kg svara dienā. [25] Viena no perorālo dzelzs sāļu preparātu galvenajām atšķirībām ir elementārās dzelzs saturs preparātā (1. tabula). [1; 8; 23] Ja uz kastītes norādīta diezgan liela deva, vispirms noteikti jāizrēķina, cik dzelzs reāli satur viena kapsula vai tablete. Dažiem sāļiem elementārās dzelzs saturs var atšķirties — tas atkarīgs no ražotāja un valsts, tāpēc ir tik lieli intervāli procentos. [1]
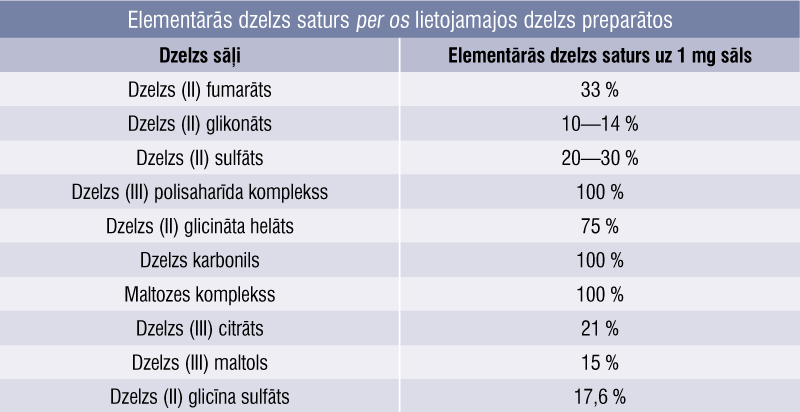

1. tabula
Elementārās dzelzs saturs per os lietojamajos dzelzs preparātos
Efektivitātes ziņā visi preparāti ir vienlīdzīgi, [2; 8; 25] blakņu risks (2. tabula, blakusparādību salīdzinājums 111 pētījumos, 10 695 pacienti [8]) nav atkarīgs no sāļu formas, bet no elementārās dzelzs koncentrācijas preparātā un dzelzs atbrīvošanās ātruma no preparāta. [15]
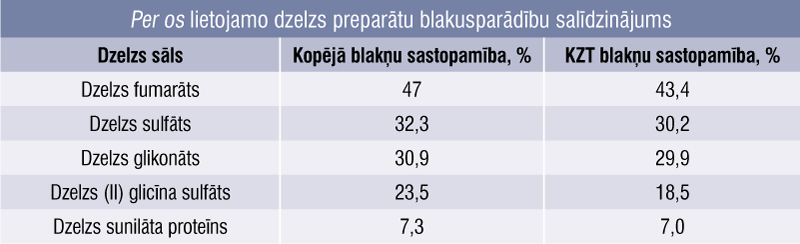

2. tabula
Per os lietojamo dzelzs preparātu blakusparādību salīdzinājums
Dzelzs (III) polimaltozes komplekss
Dzelzs (III) polimaltozes komplekss ir dzelzi saturošs medikaments, kas krasi atšķiras no citiem dzelzs sāļiem: komplekss ir ļoti stabils, tam nav mijiedarbības ar pārtiku vai medikamentiem, nenotiek brīvo skābekļa savienojumu izdale. [3; 16; 25] Dzelzs no kompleksa izdalās ļoti lēni; pēc 6 stundām mērot koncentrāciju asins plazmā, pieaugums ir ļoti minimāls, bet pēc 2—3 nedēļām eritrocītu piesātinājums ar dzelzi ir tikpat liels kā citu dzelzs sāļu lietošanas gadījumā. [3; 5].
Savā ziņā ar šo preparātu pacientu dzīve kļūst komfortablāka — nav uztraukuma par pareizu lietošanu un nevēlamiem efektiem. Un, salīdzinot blakusparādību risku ar dzelzs sulfātu, polimaltozes lietotājiem tas ir daudz mazāks. [16] Bet daudzi klīniskie novērojumi un pētījumi norāda, ka dzelzs (III) savienojumi nav tikpat efektīvi kā dzelzs (II). [19] Polimaltozes savienojumam ir ļoti liela molekulmasa, un mūsu organismam grūtāk asimilēt tādus savienojumus. [32] Kādā 12 nedēļu ilgā pētījumā par pacientiem ar dzelzs deficītu labāku efektu feritīna palielināšanā uzrādīja dzelzs (II) sulfāts nekā polimaltozes komplekss. [27]
Dzelzs (III) maltols
Dzelzs (III) maltols uzrāda i/v ievadītai dzelzs karboksimaltozei līdzīgu terapeitisko efektu, kas nozīmē, ka šis preparāts ir laba alternatīva tiem, kuriem terapija per os nedod efektu, bet arī negribas dzelzi lietot parenterāli. [10]
Helāta un liposomālie dzelzs preparāti
Daudzsološi ir helāta un liposomālie dzelzs preparāti — dažos pētījumos tiem novērota labāka uzsūkšanās un minimāls blakusparādību risks, bet, lai to apgalvotu precīzāk, nepieciešami kvalitatīvāki pētījumi ar lielāku pacientu skaitu un ilgāku novērošanu. [21]
Īpaši lielas cerības raisa aminoskābēs bāzētie helāti, kas, iespējams, uzsūcas labāk (jo izmanto citus absorbcijas ceļus vai mazās molekulmasas dēļ), tiem nav mijiedarbības ar pārtiku vai medikamentiem, kas var ietekmēt klasiskā dzelzs preparāta uzsūkšanos, nepārslogo organismu ar dzelzi. [31; 32]
Viens no tādiem helātiem ir dzelzs (II) bis–alanīns, kas divas nedēļas ilgā pētījumā efektivitātes ziņā tika salīdzināts ar dzelzs (II) sulfātu un dzelzs (II) bis–glicināta helātu. Alanīna savienojumam bija nedaudz labāki rādītāji dzelzs, hemoglobīna līmenī nekā sulfātam, bet ļoti līdzīgi dzelzs bis–glicināta formai. [31] Pētījumā ar dzīvniekiem, kuriem deva gan sulfāta, gan bis–glicināta dzelzs formu, konstatēja, ka pēdējais uzsūcas 5 × labāk. [32] Tas apliecina, ka šim savienojumam ir cits absorbcijas ceļš nekā klasiskiem dzelzs (II) sāļiem. [32]
Pētījumā par 120 grūtniecēm ar dzelzs deficīta anēmiju dzelzs aminoskābes helāts uzrādīja nedaudz ātrāku hemoglobīna, dzelzs līmeņa un feritīna palielināšanos pēc 4, 8 un 12 terapijas nedēļām salīdzinājumā ar dzelzs (II) fumarātu. Klasiski dzelzs nevēlamie efekti tika novēroti abās grupās, bet ar mazāku sastopamību dzelzs helāta grupā, īpaši liela starpība bija aizcietējumu un koliku biežumā. [26]
Pētījumā par 40 bērniem dzelzs (II) bis–glicināta helāts uzrādīja līdzīgu hemoglobīna palielināšanos, bet salīdzinājumā ar dzelzs (II) sulfātu daudz augstāku feritīna līmeni pēc 28 dienām. [27] Pētījumā par 80 grūtniecēm, kas dzelzs preparātus saņēma 15.—19. gestācijas nedēļā, preparātiem netika pierādīta statistiski ticama atšķirība laboratoriskajos rādītājos. Vienīgi grūtnieces, kas saņēma dzelzs (II) bis–glicināta helātu, retāk sūdzējās par melnām fēcēm. Bet blakusparādību biežums bija līdzīgs. [33]
Ir dzelzs (II) bis–glicināta helāta preparāti, kuros šis dzelzs savienojums konjugēts ar nātrija alginātu. Šis savienojums tika testēts celiakijas pacientiem, kuriem per os dzelzs terapija parasti ir neefektīva sliktās uzsūkšanās dēļ. Mazā pētījumā novēroja, ka dzelzs līmenis plazmā krasi pieaug, lietojot šo savienojumu celiakijas pacientiem. [28] Arī dzelzs (II) bis–glicināta helāts ir pētīts bērniem ar celiakiju. [30]
Hēma dzelzi saturošie preparāti
Daudzsološi ir arī hēma dzelzi saturošie preparāti. Mazā pētījumā par 40 pacientiem ar hronisku nieru mazspēju hēma dzelzs polipeptīds uzrādījis līdzīgu efektivitāti un drošuma profilu i/v dzelzs (III) saharozei. Hemoglobīna līmenis pēc sešu mēnešu kursa abās pacientu grupās bija līdzīgs, bet feritīna daudzums lielāks grupā, kas saņēma parenterālu dzelzi. [35]
Arī 122 grūtniecēm ar apstiprinātu dzelzs deficīta anēmiju, kuras trīs mēnešus lietoja hēma dzelzi saturošu preparātu, bija statistiski ticami hemoglobīna un (īpaši) feritīna uzlabojumi laboratorijas analīzēs. Tikai divām pētījuma dalībniecēm bija sūdzības par gastrointestinālām blaknēm. [36]
Tāpat citos mazos pētījumos par dažādiem pacientiem (pieaugušiem, bērniem, priekšlaicīgi dzimušiem bērniem, dialīzes pacientiem) blakusparādību sastopamība bija daudz mazāka. Piemēram, lietojot dzelzs (II) fumarātu, slikta dūša bija 31 % pret 3 % hēma dzelzs lietotāju, bet pētījumā par dzelzs (II) sulfātu caurejas biežums bija 58 % pret 35 % (hēma dzelzs lietotājiem). [37]
Parenterāli dzelzs preparāti
Vēsturiski dzelzs preparātu injekcijām bija ļoti liela molekulmasa un augsts anafilakses un mirstības risks, kas arī veicināja šo preparātu atsaukšanu no tirgus. [2] Jaunās paaudzes preparāti kļuvuši drošāki, kas dod iespēju tos nozīmēt lielākai pacientu populācijai. [2; 19; 25]. Tāpēc bažas un bailes par dzelzs i/v ievadi ir nepamatotas. [25] Pacientiem dzelzi ievadīt parenterāli var, ja: dzelzs deficīta anēmija nepadodas per os preparātu kontrolei, ir izteikta per os preparātu nepanesība, ir malabsorbcijas sindroms, kas saistīts ar dažādām KZT slimībām un stāvokļiem, nepieciešama ļoti ātra dzelzs deficīta vai anēmijas kontrole (grūtnieces, nieru mazspējas pacienti, pēcoperācijas periods u.c.), pacientiem ar palielinātu hepcidīna koncentrāciju asinīs. Šīs zāļu formas priekšrocības salīdzinājumā ar per os ir ātrāks efekts un efektīvāka slimības kontrole, var ievadīt lielas devas, dažos gadījumos arī kā vienreizēju devu, nav KZT blakņu, preparāti efektīvi pat hepcidīna hiperizdales gadījumā. [1; 2; 6; 16; 17; 19; 23]
Blakusparādību risks
Meta–analīzēs, apkopojot 103 pētījumus par 10 000 pacientiem, kas dzelzi saņēma i/v, un 7000 pacientiem, kas dzelzs preparātus lietoja per os, i/v injekciju saņēmējiem netika konstatētas nopietnas blakusparādības. [23] Bet ir arī savi mīnusi — medikamentu ievada mediķis, pacients jāuzrauga medikamenta ievades laikā un īsu brīdi (30 min.) pēc injekcijas, ir anafilakses risks, injekcijas ir sāpīgas. [2; 8]
Jaunās paaudzes preparātiem anafilakses risks ir 0,2 %. [3; 17] Dzīvībai bīstamas anafilakses risks atkarīgs no izvēlētā preparāta, piemēram, dzelzs (III) saharozei 0,002 %, dzelzs glikonātam 0,04 %, tāpēc salīdzinājumā ar lielmolekulāro dekstrānu (risks 0,6—2,3 %) jaunās paaudzes preparāti tiešām ir droši. [25] Pacientiem ar astmu, apstiprinātām medikamentu alerģijām (ar augstu risku alerģiskas reakcijas attīstībai) premedikācijā jāievada glikokortikoīdi, piemēram, metilprednizolons. [2; 6; 25] Arī pacientiem ar iekaisīgu artrītu rekomendē premedikāciju vai īsu glikokortikoīdu kursu, jo dzelzs ievade var provocēt artrīta uzliesmojumu. [2; 11; 25]
Pašlaik nerekomendē premedikācijai lietot difenhidramīnu (dimedrolu), jo šis preparāts spēj izraisīt hipotensiju, miegainību, karstuma viļņus, reiboni, elpas trūkumu un tahikardiju, visi šie blakusefekti vēl vairāk var pasliktināt anafilakses reakciju. [2; 6; 8; 19; 25] Pacienti ar folskābes deficītu, malnutrīciju vai pacienti, kuri pirms tam saņēmuši lielas dzelzs devas, arī pieder riska grupām blakusparādību ziņā. [11] Dzelzs ievade intravenozi spēj izraisīt arī ne–alerģiska tipa blakusparādības, kas attīstās < 1 % pacientu: sirdsklauves, reiboņi, perifēras tūskas, karstuma sajūta, spazmas un sāpes kaklā un muguras rajonā. [2; 3; 11; 23] Ja dzelzs infūzijas laikā pacientam attīstās blakusparādības, mediķim jāpieņem lēmums par rīcību, iespējams, izlemjot pat ievadi pārtraukt (3. tabula). [19]


3. tabula
Rīcības plāns, i/v dzelzs preparāta ievadīšanas laikā rodoties blaknēm
Efektivitāte
Efektivitātes ziņā visi preparāti ir vienādi. [2; 6; 8] Arī parenterālo dzelzs preparātu atšķirības ir atkarīgas no dzelzs sastāva preparātā (4. tabula), no tā dozēšanas un ievades iespējas, no laika, cik ātri dzelzs atbrīvojas no medikamenta. [2] Pētījumos un novērojumos pierādīts, ka pacientiem, kas saņem preparātus ar lēnu dzelzs atbrīvošanos, praktiski neattīstās blakusparādības; pat ja tās ir, to sastopamība ir daudz mazāka nekā per os preparātiem. [3] Lēnu dzelzs atbrīvošanās spēju raksturo kompleksa stabilitāte un tas, cik stipri preparāts saista dzelzi. [3; 17] Ja komplekss nav stabils, tas var dzelzi izdalīt plazmā pirms makrofāgu sasniegšanas. [23] Zinot, pie kura tipa pieder medikaments, ir skaidrs, vai to var ievadīt lielās devās un kāda būs panesība. [3]
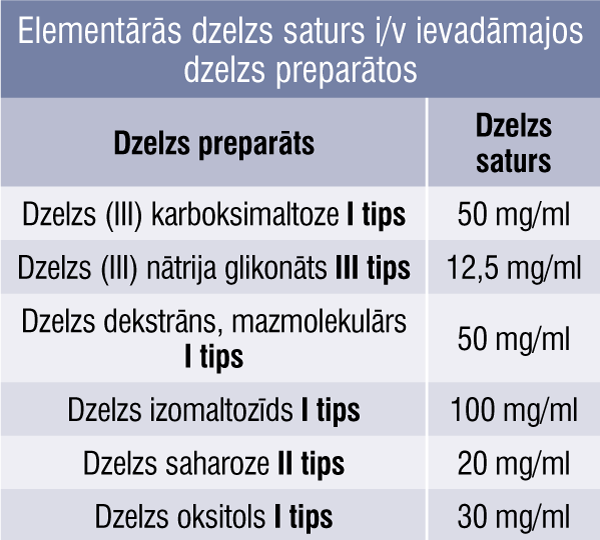

4. tabula
Elementārās dzelzs saturs i/v ievadāmajos dzelzs preparātos
I tipa preparāti ir ļoti stabili kompleksi, ļoti lēni izdala dzelzi ar lielu molekulmasu, labi panesami pat lielās devās, taču iespējamais risks anafilaksei ir augstāks nekā citiem. [3] Bet, piemēram, dzelzs (III) izomaltozīdam (dzelzs III derizomaltozei) novērota ļoti laba panesība un zems risks anafilakses attīstībai. [10]
II tipa preparātiem ir daudz mazāka molekulmasa, kas jau uzskatāma par priekšrocību — mazāk anafilaktisku reakciju, tie nav tik stabili un spēj izdalīt lielāku dzelzs daudzumu. Tāpēc šos preparātus lieto mazākās devās. [3]
Arī III un IV tipa preparāti parasti ir mazmolekulāri, bet ar daudziem komponentiem un nav tik stabili, tāpēc var izraisīt organisma pārsātināšanu ar dzelzi. Tāpēc šie preparāti nav tik droši intravenozai lietošanai, ir risks aknu parenhīmas nekrozei un lipīdu oksidēšanās risks. Īpaši šis fakts attiecas uz dzelzs (III) nātrija glikonātu, kuram blakņu risks ir 2 × lielāks nekā dzelzs saharozei. [3] Dzelzs (III) sorbitols un dzelzs (III) citrāts ļoti ātri izvadās no organisma, pateicoties nierēm (kas arī nav labi terapeitiskās koncentrācijas uzturēšanai), bet tik un tā dzelzs spēj uzkrāties aknās. [3] Tāpēc šie preparāti jālieto mazākās devās. [16]
Preparātus samērīgi ievadāmajai devai parasti ievada 15—60 minūtēs injekcijas veidā un 3—4 stundās infūzijas veidā. [2; 25]. Devu konkrētam pacientam izrēķina, ņemot vērā dzelzs koncentrāciju preparātā, pacienta svaru un laboratoriskos datus. [2]
Pacientam, kurš saņēmis dzelzs oksitolu (ferumoxytol) un kurš trīs mēnešu ietvaros pēc terapijas dodas uz MR izmeklējumu, jābrīdina speciālists par preparāta lietošanu, jo šis medikaments spēj izraisīt spilgtu signālu rašanos skenēšanas laikā. [2; 8; 19; 23]