Mikrobiotas ietekme uz ādas aizsardzību
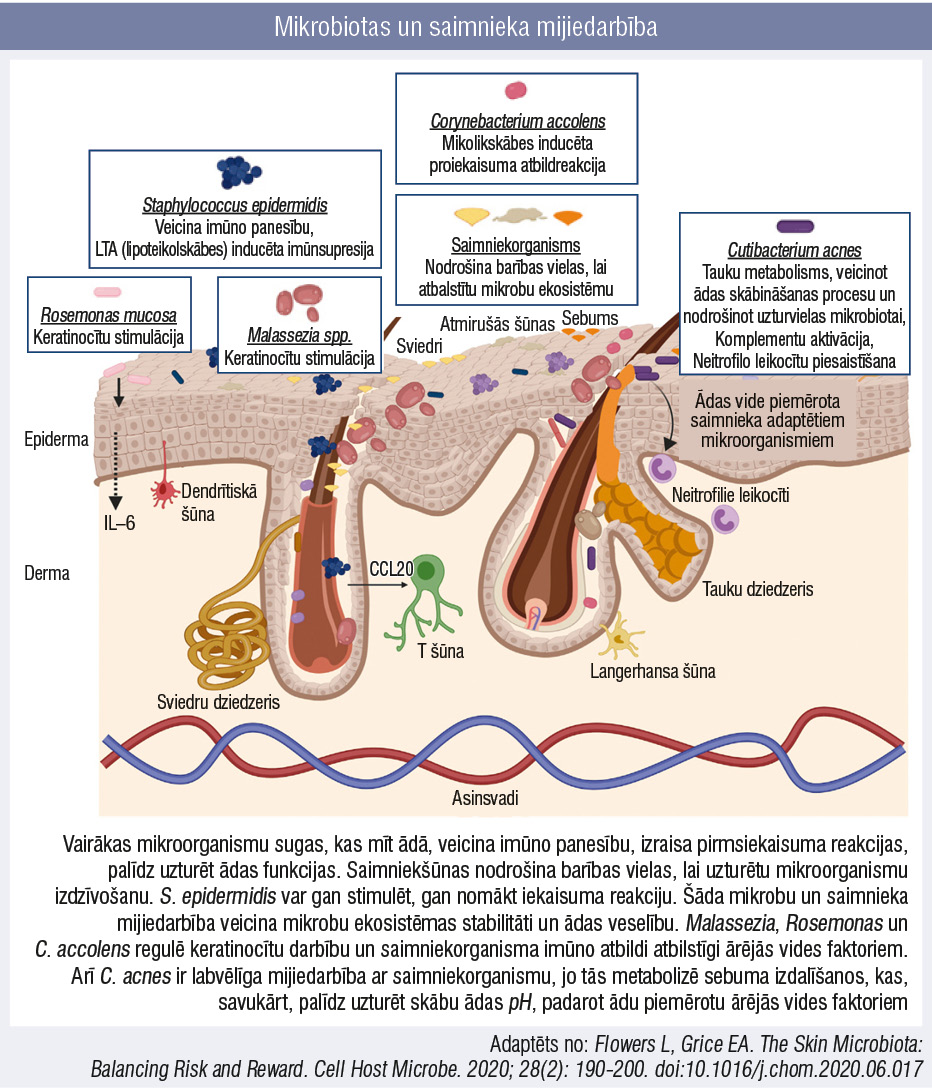
Epitēlijs ir ārējās vides barjera, kurā mīt dažādi mikroorganismi: baktērijas, sēnītes, vīrusi, mikroeikarioti un citi. Ādas mikrobiota ir pielāgota dzīvei unikālos mikrobiotopos, kas nosaka šīs ekosistēmas vides un barības vielu apstākļus. Mijiedarbojoties kopā un izmantojot savstarpēju vai komensālu mijiedarbību ar cilvēka saimniekšūnām, ādas mikrobiota veicina aizsardzības un imūnās atbildreakcijas, kavē oportūnisku vai patogēnu organismu kolonizāciju un infekciju attīstību (attēls). Tāpat mikrobiota veicina audu atjaunošanos un veido ādas barjerfunkciju. [1]

Mikrobiotu ietekmē gan iekšķīgie, gan ārējie faktori. Pie iekšķīgajiem faktoriem pieder ģenētika, dzimums, vecums, imunitāte, hormoni, stress un metabolisms, pie ārējiem — vispārējā higiēna, kopšanas rutīna, ultravioletais starojums, klimata pārmaiņas, fiziskās aktivitātes, ūdens un gaisa piesārņojums, ķīmisko elementu iedarbība.
Agrāk tika uzskatīts, ka auglis dzemdē uzturas pilnīgi sterilā vidē un mikrobiota veidojas pēc piedzimšanas, kolonizējot mikroflorām, kas atrodamas dzemdību ceļos. Tomēr pēdējos gados pierādīts, ka mikrobiotas veidošanās aizsākas dzemdē un ka dzemde, placenta un amnija šķidrums nav pilnīgi sterila vide.
Jaundzimušā mikrobiotu ietekmē arī dzemdību veids — vai bērns dzimis pa dabiskajiem dzemdību ceļiem (mikroflora no ģenitālā trakta) vai ar ķeizargriezienu (mātes ādas mikroflora).
Nākamais attīstības posms ir pubertāte, kad mikrofloru ietekmē hormonālas pārmaiņas, stress un fiziskās aktivitātes. Un vēlāk, jau pieaugušā vecumā, mikrobiota kļūst daudz stabilāka un izmaiņas vairs nav tik izteiktas. [2]
Lai izprastu, kā mikrobiota ietekmē mūsu katra ādas veselību, apskatīsim visbiežāk sastopamos mikroorganismus.
Cutibacterium acnes
Viena no vislielākajām populācijām pieauguša cilvēka mikrobiotā. Tās ir aerotoleranti anaerobi mikroorganismi, kuri kā barības vielu avotu izmanto lipīdiem bagāto sebumu. Pirms pubertātes ādā ir neliels daudzums C. acnes, tās mikrobiotā ieņem savu vietu vienlaikus ar tauku dziedzeru nobriešanu un sebuma sekrēciju. [3]
Kā ādas mikrobiotas komensālā sastāvdaļa C. acnes ražo propionskābi, kas palīdz uzturēt ādas skābo pH līmeni, tādējādi kavējot patogēnāku mikrobu kolonizāciju. Pielāgojoties cilvēka mata maisiņa un tauku dziedzera vienībai (pilosebaceous unit), C. acnes izdala ārpusšūnu lipāzi, kas šķeļ sebuma triglicerīdus, tādējādi atbrīvojot glicerīnu kā augšanas substrātu un brīvās taukskābes, kas ādas virsmu padara vēl skābāku. [4]
Tomēr C. acnes ir galvenais patoģenēzes elements aknes attīstībā. Akne ietekmē mata maisiņa—tauku dziedzera vienību, kas sastāv no daudziem maziem matu folikuliem, kam pievienojas tauku dziedzeris, kas lokalizējas uz sejas, krūtīm un muguras. C. acnes tieši un netieši izraisa iekaisumu un ādas bojājumu. Brīvās tauksābes, ko C. acnes atbrīvo no sebuma triglicerīdiem, arī ir iekaisuma iniciatori, tāpat tās rada dažādus virulences faktorus, tostarp proteāzes, kas aktivē komplementu sistēmas un piesaista neitrofilus.
C. acnes var būt tādu ādas patogēno sugu kā S. aureus sabiedrotais. Pierādīts, ka koproporfirīns III (CIII), kas ir visizplatītākā ārpusšūnu porfirīna molekula, ko ražo C. acnes, izraisa S. aureus agregāciju un bioplēves piesaisti plazmu nesaturošām virsmām. [5] Citos pētījumos atklājies, ka C. acnes pastiprina S. aureus hemolītisko un citolītisko efektivitāti. [6] Mikrobi, kas tiek uzskatīti par komensāliem, var sadarboties ar tradicionālajiem patogēniem, lai uzlabotu to virulenci.
Nesenos pētījumos identificēts C. acnes sekrēta proteīns ar spēcīgu antioksidantu aktivitāti. Šis proteīns, ko sauc par RoxP, veicināja aerobo baktēriju augšanu in vitro un ex vivo. Pētījumā pierādīts, ka RoxP pozitīvi ietekmē oksidatīvajam stresam pakļauto monocītu un keratinocītu dzīvotspēju un ka šis varētu būt spēcīgs antioksidants, kuram paredz izmantošanu biofarmācijā. [7]
Koagulāzes negatīvie stafilokoki
Lai nodrošinātu izdzīvošanu, ādā rezidējošajām baktērijām ir jāsacenšas, lai saglabātu savas nišas kolonizāciju un piekļuvi barības vielām. Mikroorganismi nepārtraukti konkurējoši mijiedarbojas gluži tāpat kā jebkura ekosistēma. Ādas mikrobiota aizsargā ādu no invazīviem patogēniem vai oportūniskiem mikrobiem, pateicoties kolonizācijas rezistences procesam.
Viens veids, kā baktērijas var novērst konkurenci, ir tieša konkurējošo mikrobu nogalināšana. Pilns šo mijiedarbību apjoms nav zināms, taču visvairāk pētītas ir tās, kurās koagulāzes negatīvās Staphylococcus sugas (CoNS) inhibē sev tuvu, bet patogēno radinieku S. aureus. CoNS sugu ādas mikrobiotā ir ļoti daudz. Biežākās CoNS sugas uz cilvēka ādas ir S. epidermidis, S. capitis, S. caprae, S. hominis, S. lugdunensis un S. haemolyticus. [8]
Dažas CoNS sugas nogalina savus S. aureus konkurentus, izdalot pretmikrobu peptīdus, piemēram, S. hominis celmi izdala lantibiotikas, kuras, kā pierādīts, pasargā pret S. aureus kolonizāciju peļu modeļos un cilvēkiem ar iekaisīgu ādas stāvokli, piemēram, atopisko dermatītu. [9] Ir pierādīts, ka S. lugdunensis celmi, kas atrodami nazālajā ejā, ražo lugdunīnu, jaunu tiazolidīnu saturošu ciklisku peptīdu, kam ir spēcīga aktivitāte pret S. aureus. Fenolā šķīstošus modulīnus (PSM) ražo vairākas CoNS sugas, un tie veicina Streptococcus pyogenes, S. aureus un C. acnes bojāeju. [10]
Baktēriju radītie AMP var pastiprināt vai sinerģēt ar saimniekorganisma imūnreakcijām, lai iznīcinātu dažādus patogēnus. S. epidermidis fenolā šķīstošais modulīns darbojas saskaņoti ar saimniekorganisma radītu pretiekaisuma citokīnu IL–37, lai uzlabotu saimniekorganisma (resp., ādas) imūno aizsardzību. [11]
CoNS sugas veido proteāzes, kas arī ir vēl viens mehānisms, kurš traucē S. aureus virulencei. S. epidermidis spēj ražot serīna proteāzi, kas kavē bioplēves veidošanos un izjauc neskartu S. aureus bioplēvi. [12]
Corynebacterium
Arī korinebaktērijas ir plaši izplatīti un bagātīgi ādas mikrobiotas elementi, jo īpaši mitrās ieloku virsmās. Corynebacterium, kas pieder Actinobacteria dzimtai, ir Grama pozitīvi, aerobi mikroorganismi. Agrāk šīs sugas pārstāvji galvenokārt tika vainoti pie sviedru smakas veidošanās padusēs, tomēr pēdējos gados pētījumi liecina, ka arī CoNS sugas ietekmē nepatīkamā aromāta rašanos un sviedru biotransformāciju. [13]
Deguna dobums ir S. aureus galvenais uzglabātājs, un infekcija uz ādas visbiežāk nonāk tieši no tā. C. pseudodiphtheriticum tika identificēta kā spēcīgs S. aureus inhibitors. Nesenos pētījumos pierādīts tiešs C. pseudodiphtheriticum iznīcināšanas mehānisms, kas samazina S. aureus virulenci. [14]
Corynebacterium inhibē arī streptokoku patogēnus. Novērojumā tika pierādīts, ka bērniem ar lielu Corynebacterium relatīvo daudzumu degunā nav Streptococcus pneumoniae izraisītu slimību. C. accolens, ko parasti atrod pieaugušu cilvēku deguna dobumā, ir atkarīga no lipāzes inhibējošās aktivitātes, kas šķeļ triacilglicerīdus, kuri atrodas ādā un sebumā. Hidrolizējot šos triacilglicerīdus, izdalās brīvās taukskābes, kas inhibē S. pneumoniae. [15]
Lai gan korinebaktērijas tiek uzskatītas par komensālām baktērijām, to darbība tiek vērtēta pēc konteksta. Tiek novērota vairāku medikamentu rezistence pret Corynebacterium sugām, piemēram, C. striatum, kas tiek uzskatīta par jaunu patogēnu, kurš izraisa dažādas ādas un mīksto audu slimības cilvēkiem ar novājinātu imunitāti, pacientiem ar hroniskām slimībām un hospitalizētiem pacientiem. Gandrīz visas Corynebacterium sugas satur mikolskābes slāni un garās ķēdes taukskābes, kuru galvenā loma ir noturība pret dezinfekcijas līdzekļiem, antibakteriālām ziepēm, tas ļauj tām kolonizēt pat sarežģītos apstākļos. [16]
Staphylococcus epidermidis
S. epidermidis loma pierādīta iedzimtu imūnreakciju modelēšanā, audu atjaunošanās procesā un brūču dzīšanā. Līdzīgi citām grampozitīvām baktērijām S. epidermidis šūnu membrāna satur lipoteikolskābi (LTA) — adhēzijas molekulu, kas izdalās bakteriolīzes laikā. LTA no stafilokoku sugām kavē audu iekaisumu traumas laikā, izmantojot no Toll receptoriem atkarīgu mehānismu. [17]
Stafilokoka radītās skābes būtiski ietekmē arī C. acnes darbību — tiek mazināts iekaisuma efekts, novērsts iekaisuma progress un stabilizēta sebuma sekrēcija. Tāpat S. epidermidis inhibē S. aureus spēju veidot virulentās formas un novērš bioplēves veidošanos — iznīcina to, izdalot bakteriocīnus. [18]
S. epidermidis mijiedarbība ar to saimniekorganismu norit sarežģītas mikrobu vides fonā, kas ne vienmēr var sadarboties saimnieka interesēs.
Mehānismi, ko S. epidermidis izmanto, lai izdzīvotu mikrobu kopienā, var veidoties arī kā virulences mehānismi. S. epidermidis proteāze var novērst S. aureus bioplēves veidošanos, taču tā noārda arī cilvēka komplementa komponentu C5 un fibrinogēnu, kas ir komplementa un koagulācijas kaskādes kritiskie proteīni, kuri veido iedzimtās imūnās atbildes pamatu. S. epidermidis radītajiem pretiekaisuma peptīdiem ir spēcīga antibakteriālā efektivitāte, taču tie ir arī būtiski, lai strukturētu un veidotu bioplēvi.
S. epidermidis tiek uzskatīta par biežu hospitālo infekciju izraisītāju, jo spēj veidot bioplēves uz medicīniskām ierīcēm, šīs baktērijas viegli pielīp plastmasai un spēj noārdīt saimniekorganisma pretiekaisuma peptīdus. [19] Nesen S. epidermidis proteāze EcpA tika identificēta kā faktors, kas veicina ādas audu iznīcināšanu un iekaisumu monoģenētiskā Netheron sindroma ādas traucējumu gadījumā, uzsverot, ka saimniekorganisma mikrobiota var spēcīgi ietekmēt slimības smagumu. [20]
Malassezia
Malassezia ir visizplatītākās uz cilvēka ādas sastopamās sēnītes. Malassezia attīstās ar lipīdiem bagātā vidē, tāpēc parasti tās atrodas ādas vietās, kas bagātas ar tauku dziedzeriem, piemēram, uz sejas un galvas ādas, ārējā auss ejā. Malassezia sugas, kas saistītas ar mikrobiotu, ir M. dermatis, M. furfur, M. globosa, M. restrikta un M. sympodialis. Šīs ģints loma ādas mikrobiotā ir diezgan niansēta, jo tās bieži dominē dažādās ādas slimībās ar atšķirīgām smaguma pakāpēm. [21]
Lai gan Malassezia sugas ir neatņemama ādas mikrobiotas sastāvdaļa, tām ir pierādīta saistība ar dažādām ādas slimībām, piemēram, blaugznas un seborejiskais dermatīts visbiežāk saistīti ar M. globosa, M. furfur un M. restrikta kolonizāciju. Šajos gadījumos Malassezia spp. metabolizē sebumu par dažādām taukskābēm, kas pēc tam darbojas kā kairinātāji, izraisot ādas lobīšanos un kairinājumu. Malassezia saistītas ar atopisko dermatītu. Jaunākajos pētījumos atklāts, ka pretsēnīšu imunitātes nodrošināšana veicina no IL–17/IL–23 atkarīga iekaisuma veidošanos, kas samazina ādas aizsargbarjeras funkciju. [22]
Nav noliedzams, ka Malassezia spp. var būt slimības izraisītājas, taču ir daudz pierādījumu par to pozitīvo ietekmi uz ādas mikrobiotu un saimniekorganismu. Daudzas Malassezia spp. izdala ārpusšūnu pūslīšus, kas signalizē keratinocītiem, lai tie pirms iekaisuma izdalītu citokīnus. [23] Līdzīgi citām ādas mikrobiotām Malassezia spp. spēj inhibēt un konkurēt ar patogēnu S. aureus. Dominējošā M. globosa izdalītā proteāze (MgSAP1) šķeļ S. aureus proteīnu A (kas ir galvenais virulences faktors), kā arī piedalās bioplēvju atdalīšanā. [24] Šie pētījumi pierāda, ka, lai gan Malassezia izraisa slimības, tās veic arī nozīmīgu darbu, lai uzlabotu kopējo ādas veselību.
Noslēgumā
Ādas mikrobiota ir mājvieta tūkstošiem dažādu mikroorganismu, kas kopā veido bagātīgu ekosistēmu, kurā viena mikroorganisma izdzīvošana ir atkarīga no cita. Vien tad, ja respektējam šīs attiecības, iespējama piemērotas terapijas izvēle un laba ādas veselība.
Literatūra
- Flowers L, Grice EA. The Skin Microbiota: Balancing Risk and Reward. Cell Host Microbe, 2020; 28(2): 190-200; doi:10.1016/j.chom.2020.06.017.
- Skowron Krzysztof, et al. Human Skin Microbiome: Impact of Intrinsic and Extrinsic Factors on Skin Microbiota. Microorganisms, 2021; 9(3): 543; doi:10.3390/microorganisms9030543.
- Fitz-Gibbon S, Tomida S, Chiu BH, et al. Propionibacterium acnes strain populations in the human skin microbiome associated with acne. J Invest Dermatol, 2013; 133: 2152-2160.
- Brown SK, Shalita AR. Acne vulgaris. Lancet, 1998; 351: 1871-1876.
- Wollenberg MS, Claesen J, Escapa IF, et al. Propionibacterium-produced coproporphyrin III induces Staphylococcus aureus aggregation and biofilm formation. mBio, 2014; 5: e01286-14.
- Li H, Goh BN, Teh WK, et al. Skin commensal Malassezia globosa secreted protease attenuates Staphylococcus aureus biofilm formation. J Invest Dermatol, 2018; 138: 1137-1145.
- Andersson T, Ertürk Bergdahl G, Saleh K, et al. Common skin bacteria protect their host from oxidative stress through secreted antioxidant RoxP. Scientific reports, 2019; 9(1): 3596; doi.org/10.1038/s41598-019-40471-3.
- O’Sullivan JN, Rea MC, O’Connor PM, et al. Human skin microbiota is a rich source of bacteriocin-producing staphylococci that kill human pathogens. FEMS Microbiol Ecol, 2019; 95: fiy241.
- Nakatsuji T, Chen TH, Narala S, et al. Antimicrobials from human skin commensal bacteria protect against Staphylococcus aureus and are deficient in atopic dermatitis. Sci Transl Med, 2017; 9: eaah4680.
- O’Neill AM, Nakatsuji T, Hayachi A, et al. Identification of a human skin commensal bacterium that selectively kills Cutibacterium acnes. J Invest Dermatol, 2020.
- Nakatsuji T, Chen TH, Narala S, et al. Antimicrobials from human skin commensal bacteria protect against Staphylococcus aureus and are deficient in atopic dermatitis. Sci Transl Med, 2017; 9: eaah4680.
- Iwase T, Uehara Y, Shinji H, et al. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization. Nature, 2010; 465: 346-349.
- Bawdon D, Cox DS, Ashford D, et al. Identification of axillary Staphylococcus sp. involved in the production of the malodorous thioalcohol 3-methyl-3-sufanylhexan-1-ol. FEMS Microbiol Lett, 2015; 362: fnv111.
- Hardy BL, Dickey SW, Plaut RD, et al. Corynebacterium pseudodiphtheriticum exploits Staphylococcus aureus virulence components in a novel polymicrobial defense strategy. mBio, 2019; 10: e02491-18.
- Bomar L, Brugger SD, Yost BH, et al. Corynebacterium accolens Releases antipneumococcal free fatty acids from human nostril and skin surface triacylglycerols. mBio, 2016; 7: e01725-15.
- Tauch A, Burkovski A. Molecular armory or niche factors: virulence determinants of Corynebacterium species. FEMS Microbiol Lett, 2015; 362: fnv185.
- Lai Y, Di Nardo A, et al. Commensal bacteria regulate toll-like receptor 3-dependent inflammation after skin injury. Nat Med, 2009; 15: 1377-1382.
- Fournière M, Latire T, et al. Staphylococcus epidermidis and Cutibacterium acnes: Two Major Sentinels of Skin Microbiota and the Influence of Cosmetics. Microorganisms, 2020; 8(11): 1752; doi:10.3390/microorganisms8111752.
- Zheng Y, He L, Asiamah TK, Otto M. Colonization of medical devices by staphylococci. Environ Microbiol, 2018; 20: 3141-3153.
- Williams MR, Cau L, Wang Y, et al. Interplay of staphylococcal and host proteases promotes skin barrier disruption in netherton syndrome. Cell Rep, 2020; 30: 2923-2933.e7.
- DeAngelis YM, Gemmer CM, Kaczvinsky JR, et al. Three etiologic facets of dandruff and seborrheic dermatitis: Malassezia fungi, sebaceous lipids, and individual sensitivity. J Investig Dermatol Symp Proc, 2005; 10: 295-297.
- Sparber F, De Gregorio C, Steckholzer S, et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host Microbe, 2019; 25: 389-403.e6.
- Zhang YJ, Han Y, Sun YZ, et al. Extracellular vesicles derived from Malassezia furfur stimulate IL-6 production in keratinocytes as demonstrated in in vitro and in vivo models. J Dermatol Sci, 2019; 93: 168-175.
- Li H, Goh BN, Teh WK, et al. Skin commensal Malassezia globosa secreted protease attenuates Staphylococcus aureus biofilm formation. J Invest Dermatol, 2018; 138: 1137-1145.