Salīdzinājumā ar citu veidu audzējiem HL samērā labi padodas ārstēšanai un piecu gadu dzīvildze pārsniedz 80 %, [14] turklāt HL pacienti parasti ir jauni cilvēki. Pēc pabeigtas veiksmīgas ārstēšanas HL pacienti dzīvo ilgi, tāpēc šī pacientu grupa ir pakļauta lielam riskam attīstīties terapijas komplikācijām un nāvei, kas nav saistīta ar primāro slimību, bet ir terapijas izraisīto komplikāciju sekas. [5] Tieši tāpēc ir ļoti svarīgi, ka HL diagnostika un terapijas efekta izvērtēšana notiktu iespējami precīzāk, lai katrs pacients saņemtu piemērotākos terapijas līdzekļus un tiktu mazināts komplikāciju risks.
Laba un ar pierādījumiem pamatota prakse mūsdienās paredz, ka HL pacientiem slimības stadijas diagnostikai, terapijas efekta noteikšanai un remisijas pierādīšanai izmanto PET/DT izmeklējumu, ko Latvijā par maksu šie pacienti var veikt kopš 2016. gada, bet no 2018. gada septembra to apmaksā valsts.
Ja HL pacientam nav iespējams veikt PET/DT, tad diagnostiku veic ar DT izmeklējumu, kas nav tik specifisks un jutīgs. Pētnieciskajā darbā “PET/DT efektivitātes novērtējums no radioloģiskās diagnostikas un precīzākas terapijas nozīmēšanas viedokļa pirmreizējiem Hodžkina limfomas pacientiem” autore izvirzīja mērķi noskaidrot, kā atšķiras PET/DT un DT rezultāti, izvērtējot HL pacientu atbildreakciju uz sākotnēji izvēlēto terapiju.
PET/DT raksturojums
Pozitronu emisijas tomogrāfija (PET) ir neinvazīva trīsdimensionāla kodolmedicīnas attēldiagnostikas metode. PET sniedz informāciju par audu funkcionālo darbību, bet DT sniedz detalizētu anatomisko informāciju. Galvenā atšķirība — DT izmeklējumā ar kontrastvielu iespējams izmērīt tikai limfomas perēkļu lielumu, bet ar PET/DT izmeklējumu iespējams noteikt gan izmērus, gan šūnu metabolisko aktivitāti (glikozes patēriņu).
Katram pacientam pirms PET/DT izmeklējuma intravenozi tiek ievadīta kontrastviela (tracer), kas satur radionuklīdu ar spēju izstarot (emitēt) pozitronus cilvēka audos sabrukšanas laikā. Izstarotie pozitroni saskrienas ar tuvējiem elektroniem, jo pozitroni un elektroni ir antidaļiņas — abiem ir vienāda masa, bet atšķirīgs lādiņš. Kad abas daļiņas saskrienas, notiek to anihilācija, rezultātā izstarojas divi fotoni, kas kustas pretējā virzienā prom viens no otra. Izstarotie fotoni tālāk tiek atklāti ar PET/DT aparātu. Visa iegūtā informācija tiek rekonstruēta, attēlos redzams trīsdimensionāls kontrastvielas izvietojums ķermenī.
Par kontrastvielu PET izmeklējumos var izmantot ķīmiskos elementus, kam ir pozitronu emitējoši izotopi: fluors, ogleklis, skābeklis, slāpeklis vai jods savienojumā ar kādu citu organisku molekulu (olbaltumvielu, glikozi, hormonu). Onkoloģijā nereti izmanto tieši fluoru, kas savienots ar glikozes molekulu, veidojot kontrastvielu, kas pazīstama kā 18–fluorodezoksiglikoze (18–FDG). Ar PET kontrastvielu vizuāli attēlo kādu konkrētu fizioloģisko procesu, 18–FDG gadījumā — glikozes metabolismu jeb metabolisko aktivitāti.
Ļaundabīgās šūnas metabolisma procesos patērē daudz vairāk glikozes nekā parastas šūnas, tāpēc onkoloģisku procesu diagnostikā izmanto tieši 18–FDG, ja vien izpildās nosacījums, ka audzējs šo kontrastvielu krāj (FDG–avid tumor).
HL ārstēšana un tās komplikācijas
HL terapijas izvēlē svarīgi vairāki faktori: anatomiskā Ann Arbor stadija, HL histoloģiskais tips, dažādi laboratorisko izmeklējumu dati, pacienta vecums diagnozes brīdī un dzimums, pēc kuriem pacientus iedala riska grupās, jo ārstēšana un prognoze katrai grupai atšķiras. Parasti pacienti tiek ārstēti tikai ar ķīmijterapiju vai kombinācijā ar staru terapiju.
Pēdējās desmitgadēs HL pacientu dzīvildze ievērojami pagarinājusies, jo terapija kļuvusi arvien precīzāka un efektīvāka. Piecu gadu dzīvildze visiem HL pacientiem (jebkuras stadijas) mūsdienās ir ap 86 %, agrīnās stadijās sasniedz pat 93 %, [14] tāpēc pacienti dzīvo ilgāk un ir pakļauti terapijas komplikāciju attīstības riskam. HL pacienti bieži cieš no tādām vēlīnām terapijas komplikācijām kā sekundāra malignitāte, kardiovaskulāra toksicitāte, kas var izpausties kā koronārā sirds slimība, kardiomiopātija vai hroniska sirds mazspēja, plaušu fibroze, auglības problēmas, sliktāka vispārējā dzīves kvalitāte. [1]
Retrospektīvā datu analīzē noskaidrots, ka sekundāra malignitāte ir visbiežākais nāves cēlonis 15 gadus pēc sekmīgas HL terapijas; 12 gadus pēc pabeigtas terapijas HL pacientiem bija vidēji 4,6 reizes lielāks risks, ka attīstīsies jauns vēzis, salīdzinot ar vispārējo populāciju. [13] Šiem pacientiem 75 % gadījumu attīstās citi audzēji — krūts, plaušu vai kolorektālais vēzis. [8; 13] Retāk konstatē tādas hematoloģiskas komplikācijas kā mielodisplastiskais sindroms vai akūta mieloīda leikēmija (AML). Svarīgi apzināties, ka ar terapiju saistītā sekundārā malignitāte bieži vien ir agresīvāka un grūtāk padodas terapijai salīdzinājumā ar primāro audzēju. Ar terapiju saistītas AML gadījumā piecu gadu dzīvildze ir < 10 %, primārai AML tā ir ap 23 %. [13]
HL terapijas efekta radioloģiska izvērtēšana ar PET/DT
PET/DT izmanto sākotnēji izvēlētās terapijas efekta novērtēšanā HL pacientiem, veicot interim izmeklējumus, ar ko saprot atkārtotu PET/DT izmeklējumu ķīmijterapijas kursu vidū (visbiežāk pēc pirmajiem diviem vai trīs ķīmijterapijas kursiem).
Terapijas efektivitāti ar DT var vērtēt tikai anatomiski, izvērtējot iesaistīto limfmezglu izmēru izmaiņas salīdzinājumā ar sākotnējo DT izmeklējumu. Limfomu gadījumā skarto limfmezglu izmēru izmaiņas nav tik uzticams rādītājs, jo masas efekts pat pēc veiksmīgi pabeigtas terapijas var saglabāties 65 % pacientu, kas ne vienmēr nozīmē, ka šajā vietā joprojām ir malignas šūnas un terapija nav bijusi efektīva. [13] Arī fibroze un rētošanās HL skartajos reģionos pēc veiksmīgas terapijas var anatomiski izskatīties kā masas efekts, un tikai ar PET/DT palīdzību, kas uzrāda metabolisko aktivitāti, var atšķirt aktīvi noritošu slimību no fibrozes kādā konkrētā reģionā.
Metaboliskās aktivitātes klasificēšanā limfomām izmanto Deauville piecu punktu skalu (1. tabula), kuras pamatā ir 18–FDG uzņemšanas intensitāte audos. Lai metabolisko aktivitāti izvērtētu objektīvi, to mēra standartizētās vienībās SUV (standartized uptake value). Katrā konkrētā ķermeņa reģionā, kur lokalizējas patoloģiski augsta metaboliska aktivitāte, ir iespējams izmērīt SUV un noteikt maksimālo SUV vērtību (SUVmax). Tālāk iegūtās SUVmax vērtības izvērtē attiecībā pret konkrētā pacienta videnes asinsvadu baseina SUVmax un aknu SUVmax, iegūstot vērtību Deauville skalā no viens (zema aktivitāte) līdz pieci (augsta aktivitāte). Augsta aktivitāte ir pielīdzināma PET pozitīvam rezultātam (Deauville skalā 5 vai 4), bet zema metaboliskā aktivitāte ir PET negatīvs rezultāts, kas Deauville skalā ir 1, 2 vai 3 (piemērs 1. attēlā).
![Deauville piecu punktu skala [7]](https://cdn.doctus.lv/media/2019/11/2/original/9d34f3a1f7da.jpg)
![Deauville piecu punktu skala [7]](https://cdn.doctus.lv/media/2019/11/2/original/9d34f3a1f7da.jpg)
1. tabula
Deauville piecu punktu skala [7]
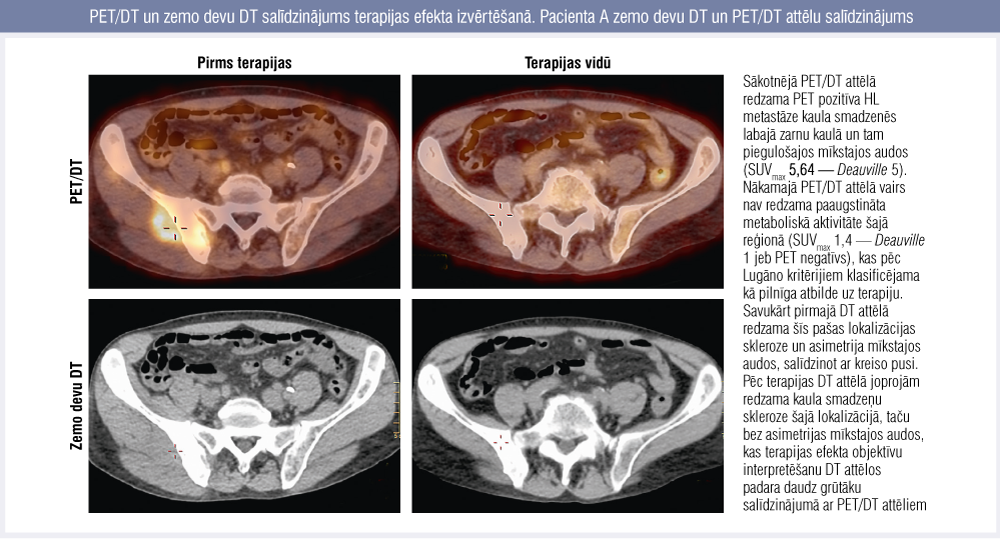

1. attēls
PET/DT un zemo devu DT salīdzinājums terapijas efekta izvērtēšanā. Pacienta A zemo devu DT un PET/DT attēlu salīdzinājums
Tāpēc šajā posmā PET/DT rezultātus var izmantot nolūkā optimizēt terapiju un atšķirt pacientus, kam terapija intensificējama, no pacientiem, kam terapijas intensitāti var samazināt, tādējādi mazinot risku blakusparādību un sekundāru komplikāciju attīstībai.
Pētījums
Tā kā precīza terapijas efekta novērtēšana HL pacientiem ir ļoti svarīga, pētījuma mērķis bija salīdzināt PET/DT un DT sākotnējo izmeklējumu datus un ķīmijterapijas kursu vidū iegūtos datus pirmreizējiem HL pacientiem, lai izvērtētu atbildi uz sākotnēji izvēlēto terapiju.
Mērķa sasniegšanai 2018. gada vasarā retrospektīvā pētījumā tika iesaistīti 16 Rīgas Austrumu klīniskās universitātes slimnīcas Latvijas Onkoloģijas centra (LOC) pirmreizējie HL pacienti. No viņu slimības vēsturēm tika iegūti laboratorisko izmeklējumu dati diagnosticēšanas brīdī un informācija par sākotnējo terapiju. Attēlu analīzē tika izmantoti PET/DT attēli un zemo devu DT attēli, kas iegūti katram pacientam pirms terapijas sākšanas un terapijas vidū (pēc pirmajiem trim ķīmijterapijas kursiem). Piekļuve attēliem tika nodrošināta caur Nukleārās medicīnas centra (NMC) un Latvijas Jūras medicīnas centra (LJMC) datubāzēm un programmatūru.
Katra pacienta attēlos tika izvēlēti vismaz divi ļaundabīgie lokusi, kas netika mainīti pētījuma gaitā, un no izvēlētajiem lokusiem, vadoties pēc Lugāno kritērijiem, tika iegūti šādi dati (sīkāk 2. tabulā):
![Lugāno kritēriji terapijas efekta un remisijas izvērtēšanai [7]](https://cdn.doctus.lv/media/2019/11/2/original/08152f2613c7.jpg)
![Lugāno kritēriji terapijas efekta un remisijas izvērtēšanai [7]](https://cdn.doctus.lv/media/2019/11/2/original/08152f2613c7.jpg)
2. tabula
Lugāno kritēriji terapijas efekta un remisijas izvērtēšanai [7]
- zemo devu DT attēlos tika mērīts un izrēķināts SPD (Sum of Perpendicular Diameters — vairāku izvēlēto ļaundabīgo limfomas perēkļu perpendikulāro diametru reizinājumu summa) terapijas sākumā un ķīmijterapijas kursu vidū,
- PET/DT attēlos tika mērīts SUVmax un izteikts Deauville klasēs.
Tālāk visi pacienti tika iedalīti četrās grupās pēc atbildes uz terapiju un izmantotās diagnostikas metodes: pilnīga atbilde, daļēja atbilde, stabila slimība vai slimības progress (3. tabula). Iegūtie dati rāda, ka pētījumā bija tikai četri pacienti, kam rezultāti saskanēja abās metodēs, bet 12 pacientiem rezultāti atšķīrās. Vienpadsmit no 12 atšķirīgajiem gadījumiem PET/DT uzrādīja labāku atbildi uz terapiju (pilnīga atbilde PET/DT pret daļēju atbildi DT), vienā gadījumā PET/DT uzrādīja sliktāku atbildi nekā DT (stabila slimība PET/DT pret daļēju atbildi DT).
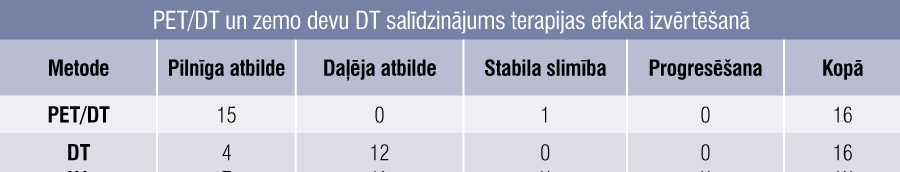

3. tabula
PET/DT un zemo devu DT salīdzinājums terapijas efekta izvērtēšanā
Tātad atšķirīgo rezultātu pacientu grupā (n = 12) lielākajai daļai (11 pacientiem) tiktu izmantota pārāk intensīva ārstēšana ar lielāku komplikāciju risku, bet vienam pacientam pārāk vāja terapija, ja terapijas efektivitātes izvērtēšanā neizmantotu PET/DT.
Kvalitatīvajā attēlu analīzē vislielākās atšķirības starp PET/DT un DT bija ekstranodālo metastāžu analīzē, ko apliecina arī citi pētījumi šajā laukā — PET/DT jutība ārpus limfmezgliem lokalizētu metastāžu diagnostikā sasniedz 88 %, specifiskums 100 %, bet DT jutība ir 50 %, specifiskums 90 %. [9]
Kaulu smadzeņu iesaistes gadījumā PET/DT ir īpaši jutīgs izmeklējums. Ir dati, ka HL gadījumā kaulu smadzeņu iesaisti var izslēgt gandrīz 100 % gadījumu, ja to nevizualizē PET/DT. [7] Kaulu smadzeņu iesaisti konstatēja vienam no 16 pacientiem. Viņa PET/DT attēlus bija daudz vieglāk interpretēt un objektīvi izvērtēt salīdzinājumā ar zemo devu DT attēliem (1. attēls).
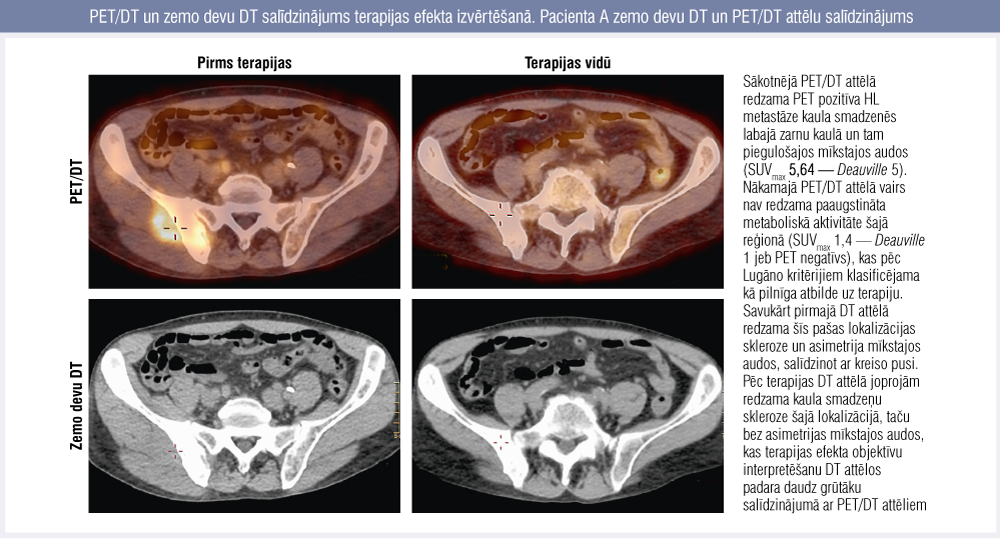

1. attēls
PET/DT un zemo devu DT salīdzinājums terapijas efekta izvērtēšanā. Pacienta A zemo devu DT un PET/DT attēlu salīdzinājums
PET/DT ir efektīvāks izmeklējums arī parenhimatozo orgānu (liesas un aknu) metastāžu vizualizēšanā, kas bieži vien nav redzamas ar citām izmeklēšanas metodēm. Tādējādi netiek diagnosticēti pacienti, kam būtu nepieciešama konsolidācijas radioterapija šiem orgāniem. [4] Perēkļus liesā DT izmeklējumā pirms terapijas vizualizēt izdevās tikai vienam no trim pacientiem, kuriem PET/DT uzrādīja liesas iesaisti (2. attēls).
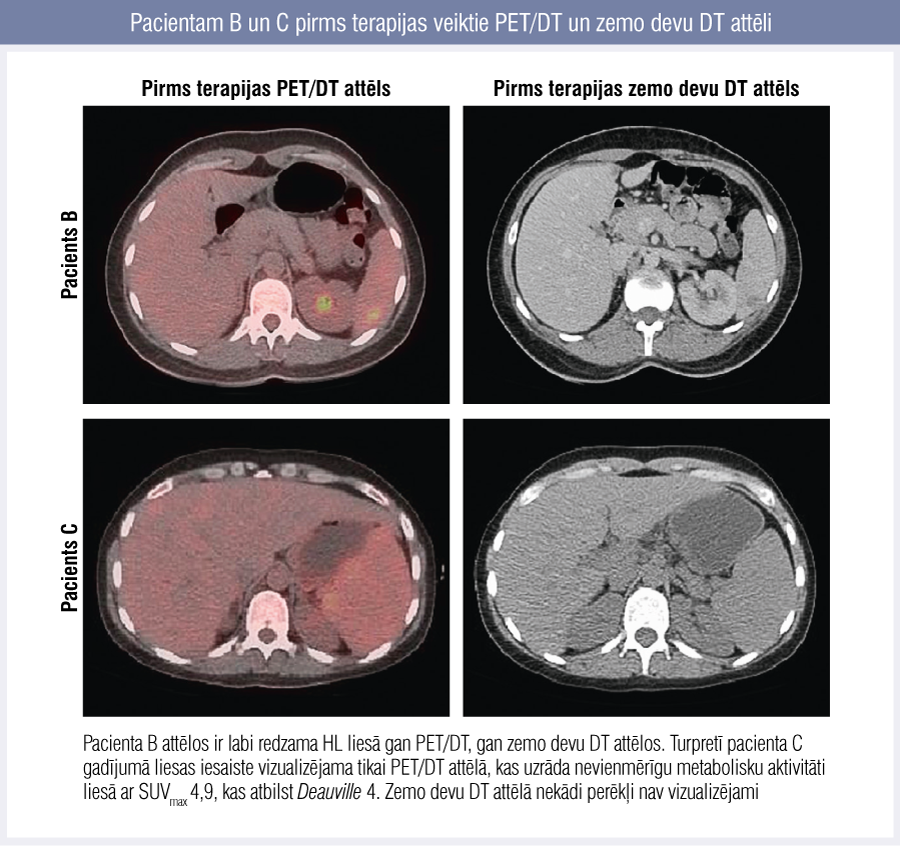

2. attēls
Pacientam B un C pirms terapijas veiktie PET/DT un zemo devu DT attēli
Secinājumi
PET/DT mūsdienās ir neaizvietojama diagnostikas metode HL pacientiem, jo dod iespēju slimības gaitu uzraudzīt gan anatomiski, gan funkcionāli. Šiem pacientiem tas ir īpaši svarīgi, jo HL terapija ir toksiska un pacientiem var attīstīties sekundāras komplikācijas pēc terapijas.
PET/DT izmeklējums palīdz uzraudzīt terapijas efektivitāti un individualizēt terapiju, turklāt tas ir arī jutīgāks un specifiskāks izmeklējums, kad jāizvērtē ekstranodālas limfomas metastāzes, tādējādi palīdzot ārstiem identificēt pacientus, kam jau sākotnēji jāizmanto intensīvāka terapija vai kam būtu nepieciešama konsolidācijas radioterapija.
Īpašs paldies pētījuma darba vadītājai prof. Sandrai Lejniecei, Dr. Marikai Kalniņai un Dr. Andim Lācim par atsaucību un atļauju pētījuma vajadzībām izmantot NMC datubāzes, Dr. Līvai Zemeskalnai par atsaucību un atļauju pētījuma vajadzībām izmantot LJMC datubāzes.