Priekškambaru mirdzēšana (PM) ir visbiežākā aritmija pieaugušajiem. Tās pašreizējā izplatība ir 2—4 % un nākotnē tikai palielināsies. PM pieckārt palielina risku insulta attīstībai.
Salīdzinot ar placebo, K vitamīna antagonisti (VKA), pamatā varfarīns, par 64 % samazina insulta risku un par 26 % — mirstību. VKA uzskatāmi par drošiem preparātiem pacientiem ar reimatisku sirds slimību un pacientiem ar mehāniskiem sirds vārstuļiem. [1] Tomēr šīm zālēm ir šaurs terapeitiskais intervāls un Latvijas apstākļos nodrošināt mērķa INR 2—3 > 70 % analīžu rezultātos nav viegls uzdevums.
Pēc skandināvu kolēģu datiem, kur ir samērā liels INR mērķa sasniegšanas procents, vajadzētu veikt 14—20 INR analīzes gadā, kas Latvijas apstākļiem izklausās pēc zinātniskās fantastikas, un ne jau tāpēc, ka INR analīze ir dārga, — tas ir vairāku apstākļu kopums, tāpēc mums vajadzīgi jauni spēlētāji, un tādi mums ir jau vairāk nekā desmit gadus.
Šī nav tikai Latvijas problēma, tāda pastāv daudzās Eiropas valstīs — ne jau velti saskaņā ar PM Eiropas un Amerikas vadlīnijām insulta profilaksei pacientiem ar PM kā pirmo izvēli ieteicams lietot ne–vitamīna K perorālos antagonistus (NOAK).
[1; 2] Ar “NOAK” apzīmē tiešos perorāli lietojamos Xa faktora inhibitorus apiksabānu, edoksabānu un rivaroksabānu, kā arī tiešo trombīna inhibitoru dabigatrānu.
NOAK ir uzlabota efektivitātes/drošuma attiecība un paredzama antikoagulanta iedarbība bez nepieciešamības regulāri kontrolēt asins analīzes. [3; 4] Tomēr, lai NOAK lietotu pareizi, rūpīgi jāpārdomā daudzi praktiskie aspekti, un šā raksta mērķis ir izskaidrot dažādos faktorus, kas saistīti ar NOAK lietošanu.
Kuriem PM pacientiem neder NOAK?
NOAK ir apstiprināti insulta profilaksei pacientiem ar ne–valvulāru PM. Ko mēs ar to saprotam? Skaidrs, ka NOAK nevar lietot pacients ar mehānisku sirds vārstuli. Dabigatrāna pētījums uzrādīja sliktākus rezultātus par VKA, citi nav pat mēģināti pētīt, tātad šajā grupā paliek tikai VKA.
Otra grupa ir pacienti ar vidēji smagu, smagu mitrālo stenozi, bet INVICTUS programma, kurā tiek pētīta VKA, rivaroksabāna vai aspirīna lietošana pacientiem ar reimatisko sirds slimību, pašlaik turpinās, jāsagaida rezultāti — un iespējams, ka rekomendācijas mainīsies. [5]
PM un antiagreganti
Ja runa ir par PM un antiagregantiem, ar kuriem mēs vairāk saprotam acetilsalicilskābi mazās devās jeb sirds aspirīnu (ASA) un klopidogrelu, tad monoterapijā vai divkāršā terapijā nav indikāciju to lietošanai.
Insulta profilaksei NOAK izrādījušies daudz efektīvāki ar statistiski neatšķirīgu asiņošanas risku, salīdzinot ar antiagregantiem. Vienīgais izņēmums ir pacienti, kuriem kontrindicēta NOAK lietošana un veikta sirds kreisās austiņas okludera implantācija. [1; 2]
Antikoagulantu izvēle un devas pielāgošana
Visi NOAK ir pārbaudīti lielos nejaušinātos perspektīvos pētījumos, kuros pierādīta to efektivitāte un drošums. [6]
NOAK pieejamību noteiktos veselības aprūpes apstākļos var ietekmēt tādi lokālie faktori kā medikamenta kompensācijas sistēma un terapijas izmaksas. Turklāt ir svarīgi novērtēt medikamentu līdztekus lietošanu, daži no kuriem var būt kontrindicēti vai izraisīt zāļu nelabvēlīgu mijiedarbību. Lēmumu par medikamenta izvēli var ietekmēt arī pacienta vecums, nieru, aknu funkcija, citas slimības.
Devas pielāgošana nieru funkcijai
PM un hroniska nieru slimība (HNS) ir biežas blakusslimības, turklāt savstarpēji ļoti saistītas slimības: PM veicina HNS attīstību un progresēšanu — un PM izplatība un sastopamība palielinās līdz ar nieru darbības pavājināšanos. [7]
Pacientiem ar HNS un PM ir ievērojami palielināta saslimstība un mirstība, īpaši palielināta trombembolisku un smagu asiņošanas gadījumu riska dēļ, tādējādi izvērtēšanu un ārstēšanu padarot sarežģītu.
Visi četri NOAK vismaz daļēji tiek izvadīti caur nierēm. Dabigatrānam ir vislielākā eliminācija caur nierēm (80 %), edoksabānam, rivaroksabānam un apiksabānam attiecīgi 50 %, 35 % un 27 %. Svarīgi, ka nieru darbība jānovērtē ar Kokrofta—Golta formulu, jo tā izmantota četros galvenajos III fāzes pētījumos. Izmantojot citas formulas, tādas kā MDRD un CKD–EPI, var pārvērtēt nieru darbību, īpaši gados vecākiem pacientiem un tiem, kuriem ir maza ķermeņa masa. [8]


1. tabula
NOAK devas samērīgi nieru funkcijai
Ja GFĀ < 50 ml/min., rivaroksabāna deva no 20 mg jāmazina uz 15 mg × 1, edoksabāna deva no 60 mg uz 30 mg × 1. Apsverama arī dabigatrāna devas samazināšana no 150 mg uz 110 mg × 2. Apiksabāna lietotājiem deva no 5 mg samazinās uz 2,5 mg × 2, ja pacients atbilst diviem no šiem kritērijiem: kreatinīns ≥ 133 µmol/l, svars ≤ 60 kg un vecums ≥ 80 gadi. Ja GFĀ 15—29 ml/min., reducētās rivaroksabāna, edoksabāna un apiksabāna devas Eiropā ir apstiprinātas, bet terapija ar dabigatrānu nav rekomendējama. NOAK devas samērīgi nieru funkcijai apkopotas 1. tabulā.
Daudzos novērošanas pētījumos pacientiem ar GFĀ < 15 ml/min. ziņoti pretrunīgi rezultāti gan VKA, gan NOAK grupā. [9] Tā kā pārliecinošu pierādījumu trūkst, tad individuāli jāizsver lēmums par antikoagulāciju (NOAK vai VKA lietošanu) pacientiem ar nieru mazspēju beigu stadijā vai dialīzi. [6]
Aknu slimības
Progresējoša aknu slimība saistīta ar palielinātu asiņošanas risku, bet ir arī protrombotisks stāvoklis. NAOK var lietot, ja aknu bojājumi viegli, bet nav vēlams, ja aknu traucējumi smagi. Individuāli būtu izvērtējami pacienti ar vidēju aknu bojājumu, bet šajā gadījumā nav vēlams lietot rivaroksabānu. Novērtēt aknu mazspēju palīdz Child—Turcotte—Pugh riska skala. [6]
Asiņošanas risks
Izvērtēt asiņošanas risku rekomendē ar HAS—BLED skalu, jo literatūras datos norādīts, ka šai skalai ir lielāks jutīgums un specifiskums nekā citām. Asiņošanas risks per se nav iemesls, lai NOAK nelietotu vai samazinātu devu pacienti, kuriem ir palielināts insulta risks.
Toties jābūt identificētiem modificējamajiem riska faktoriem, īpaši pacientiem ar augstu līmeni asiņošanas riskam (piemēram, HAS—BLED ≥ 3), šie riska faktori iespējamā mērā jānovērš, un tādiem pacientiem jābūt biežākā klīniskā novērošanā.
Protonu sūkņu inhibitoru lietošana apsverama, lai samazinātu kuņģa—zarnu trakta (KZT) asiņošanas risku, īpaši tiem, kuriem iepriekš bijusi asiņošana no KZT, kā arī pacientiem, kas paralēli lieto antiagregantus. [6]
Vecums
PM sastopamība pieaug līdz ar vecumu; līdz 2050. gadam 4,4 % pasaules iedzīvotāju būs vecāki par 80 gadiem. [13] Insulta profilakse vecākiem PM pacientiem ir ļoti svarīga, līdz ar vecumu lielā mērā pieaugot insulta riskam. Visos NOAK pētījumos iekļauta nozīmīga vecāka gadagājuma (> 75 gadi) pacientu populācija.
Insultu biežums līdzīgi tika samazināts vecākās vecumgrupās, kas ārstētas ar NOAK, salīdzinot ar VKA.
Svarīgi, ka augstāks absolūtais risks izraisīja lielāku absolūtā riska samazināšanos, lietojot NOAK, nevis VKA, tāpēc ir mazāks skaits, kurus nepieciešams ārstēt, salīdzinot ar jaunākiem pacientiem. Būtībā lielāks ieguvums no antikoagulantu lietošanas, īpaši no NOAK, ir gados vecākiem pacientiem nekā gados jaunākiem pacientiem.
Intrakraniālo asiņošanu novēro mazākam skaitam pacientu ar NOAK nekā VKA. Un pretēji — nav vecuma mijiedarbības ar ekstrakraniālās asiņošanas biežumu, lietojot apiksabānu, edoksabānu vai rivaroksabānu, salīdzinot ar vispārējiem pētījuma rezultātiem. Turklāt gados vecākiem pacientiem novērota mazāk nopietna asiņošana, īpaši tiem, kas lietoja apiksabānu un edoksabānu, salīdzinot ar VKA. NOAK ir pirmā izvēle gados vecākiem pacientiem saistībā ar vieglāku medikamenta lietošanu un tūlītēju darbību, salīdzinot ar VKA. [17]
Farmakokinētika un medikamentu mijiedarbība
Kaut arī NOAK ir daudz mazāks zāļu mijiedarbības risks, tik un tā ārstam jāizvērtē visi medikamenti, kurus pacients lieto, lai izvairītos no nopietnas mijiedarbības. Svarīgs mijiedarbības mehānisms lielākajai daļai NOAK sastāv no ievērojamas kuņģa—zarnu trakta atkārtotas sekrēcijas, izmantojot P glikoproteīna (P–gp) transportētāju pēc absorbcijas zarnās.
P–gp ir iesaistīts arī aktīvā NOAK sekrēcijā nierēs. Konkurējoša P–gp ceļa inhibīcija paaugstinās NOAK līmeni plazmā, kas jāņem vērā, jo daudzas zāles, ko izraksta PM pacientiem, ir P–gp inhibitori (verapamils, dronedarons, amiodarons, ranolazīns, hinidīns u.c.).
No CYP3A4 tipa citohroma P450 atkarīgā eliminācija būtiski saistīta ar rivaroksabāna un apiksabāna klīrensu aknās. Spēcīga citohroma P (CYP) 3A4 inhibīcija vai indukcija var ietekmēt NOAK koncentrāciju plazmā, un tā ir jānovērtē individuāli.
Kopumā NOAK nav ieteicams lietot kopā ar zālēm, kas ir spēcīgi P–gp un/vai CYP3A4 inhibitori. Un pretēji, spēcīgi P–gp un/vai CYP3A4 induktori (piemēram, rifampicīns, karbamazepīns), jo tas ievērojami pazeminās NOAK līmeni plazmā; jāizvairās no vienlaicīgas lietošanas ar NOAK vai jālieto ļoti piesardzīgi.
Svarīgi atcerēties, ka rivaroksabāns jālieto ēšanas laikā normālā ēdienreizē, jo tukšā dūšā tas uzsūcas 66 %, bet ar ēdienu 100 %, šī starpība dažreiz var būt izšķirīga, un diemžēl šīs nianses dēļ ir novēroti insulti. [6]
Situācijas, kad sajaukta zāļu lietošanas secība
Izlaista deva
Aizmirsto devu var lietot līdz nākamajam puslaikam no devu lietošanas intervāla. Tātad, ja shēma ir NOAK lietot divreiz dienā ik pēc 12 h, tad aizmirsto pilno devu var lietot ne vēlāk kā 6 h pēc paredzētās lietošanas reizes.
Aizmirsto vienreiz dienā lietojamā NOAK devu var lietot ne vēlāk kā 12 h pēc plānotās lietošanas. Ja laiks pagājis, tad deva ir jāizlaiž, jālieto nākamā plānotā deva.
Dubulta deva
NOAK ar dozēšanas shēmu divreiz dienā nākamo plānoto devu (t.i., pēc 12 h) var izlaist un lietošanu atsākt 24 h pēc dubultās devas lietošanas. NOAK ar dozēšanas shēmu vienreiz dienā jāturpina parastais režīms, t.i., neizlaižot nākamo devu.
Pacients neatceras, vai ir lietojis zāles
NOAK ar dozēšanas shēmu divreiz dienā parasti nav ieteicams lietot vēl vienu tableti/kapsulu, bet turpināt parasto shēmu, t.i., nākamo devu ar 12 h intervālu. NOAK ar dozēšanas shēmu vienreiz dienā — ja trombembolijas (TE) risks ir augsts (CHA2DS2–VASc ≥ 3), var ieteikt papildu devu lietot 6—8 h pēc neskaidrās epizodes, tad turpināt pēc ierastās shēmas.
Pacientu apsekošana
Pacienti, kuri lieto NOAK, regulāri apsekojami, lai noskaidrotu TE/asiņošanas epizodes, medikamentu izraisītas blaknes, līdzestību, izmaiņas citu izrakstīto medikamentu lietošanā (novērtēt, vai nav nevēlamas mijiedarbības), dinamikā izvērtētu aknu, nieru rādītājus, atkārtoti izvērtētu gan rādītājus pēc CHA2DS2–VASc un HAS—BLED skalām, gan nepieciešamību novērst modificējamos riska faktorus, atkārtoti izvērtētu NOAK devu un vajadzības gadījumā to pielāgotu.
Ja pēc atkārotas izvērtēšanas ir nopietni sarežģījumi, pacients jānosūta pie specialista/multidisciplināras komandas. Eiropas Kardioloģijas biedrības NOAK rekomendācijās atkārtotas vizītes pie ārsta ieteiktas:
- ik pēc četriem mēnešiem pacientiem, kas vecāki par 75 gadiem (īpaši tiem, kas lieto dabigatrānu) vai fiziski vārgiem pacientiem,
- reizi desmit mēnešos izvērtēt nieru funkciju, ja GFĀ < 60 ml/min.,
- steidzami, ja ir kāds paralēls stāvoklis, kas var ietekmēt nieru vai aknu funkciju, piemēram, infekcija, dehidratācija, NSPL lietošana. [6]
Antikoagulantu maiņa
No VKA uz NOAK
Pārejot no VKA uz NOAK, noteikti jāskatās INR līmenis. NOAK var sākt nekavējoties, tiklīdz INR ≤ 2,0. Ja INR 2,0—2,5, NOAK var sākt nekavējoties vai nākamajā dienā. Ja INR > 2,5, jāņem vērā faktiskā INR vērtība un VKA pussabrukšanas periods, lai aprēķinātu laiku, kad INR vērtība nokritīsies zem šīs sliekšņa vērtības (varfarīnam pussabrukšanas periods 36—48 h). Tajā laikā var ieplānot jaunu INR mērījumu. Tiklīdz sākti NOAK, turpmāka INR kontrole jāpārtrauc.
No NOAK uz VKA
Tā kā VKA darbība sākas lēni, var paiet 5—10 dienas, līdz INR būs terapeitiskajā diapazonā, turklāt individuālās variācijas ir lielas. Tāpēc NOAK un VKA vajadzētu lietot vienlaicīgi, līdz INR ir terapeitiskajā diapazonā. Tā kā NOAK var ietekmēt INR mērījumus, svarīgi, lai INR tiktu mērīts tieši pirms nākamās NOAK uzņemšanas vienlaicīgas lietošanas laikā, un to atkārtoti nosaka 2—3 dienas pēc NOAK lietošanas pārtraukšanas (t.i., atspoguļo tikai VKA iedarbību), lai nodrošinātu adekvātu antikoagulāciju. Pirmajā mēnesī ieteicams rūpīgi uzraudzīt INR, līdz sasniegtas stabilas INR vērtības (t.i., 2,0—3,0 trīs mērījumos pēc kārtas).
No NOAK uz NOAK
Cita NOAK lietošanu var sākt nākamajā paredzētajā NOAK devas lietošanas reizē, izņemot situācijas, kad paredzamā NOAK koncentrācija plazmā ir lielāka par terapeitisko (piemēram, pacientam ar pavājinātu nieru darbību). Šādās situācijās ieteicams ievērot ilgāku intervālu starp NOAK devu lietošanu.
No aspirīna/klopidogrela uz NOAK
NOAK var sākt nekavējoties un antiagreganti jāatceļ, izņemot situācijas, kad nepieciešama šo medikamentu kombinācija.
NOAK atcelšana pacientiem pirms plānveida procedūras
Divu gadu laikā ~ ¼ pacientu, kuri lieto antikoagulantus, nepieciešama īslaicīga medikamentu pārtraukšana plānotas iejaukšanās dēļ. [18] Lai gan invazīvas ķirurģiskas iejaukšanās dēļ īslaicīgi jāpārtrauc NOAK lietošana, daudzām mazāk invazīvām procedūrām ir salīdzinoši zems asiņošanas risks un tās var veikt līdztekus minimālai vai nepārtrauktai terapijai ar NOAK. Tomēr, lai noteiktu, kad pārtraukt un atsākt NOAK lietošanu, jāņem vērā gan pacienta īpašības (vecums, insulta risks, asiņošanas komplikāciju vēsture, vienlaikus lietotās zāles, nieru darbība utt.), gan ķirurģiskie faktori.
Nelielas procedūras
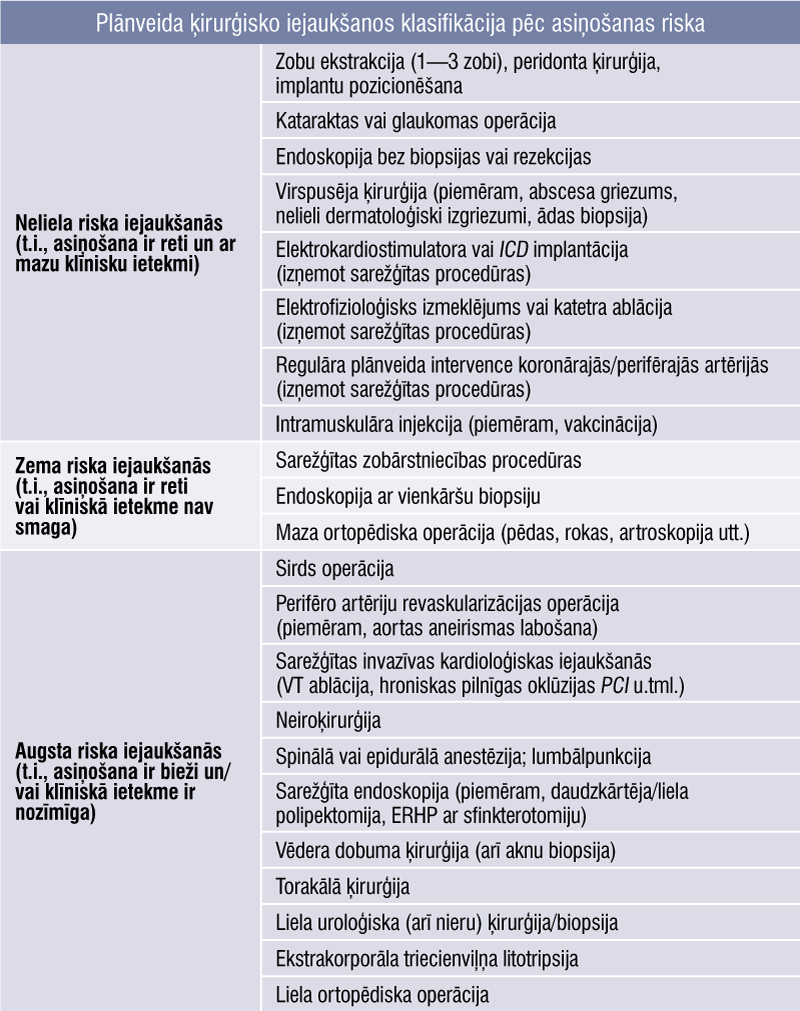

2. tabula
Plānveida ķirurģisko iejaukšanos klasifikācija pēc asiņošanas riska
Mazākas ķirurģiskas procedūras un tās procedūras, kad asiņošana viegli kontrolējama (2. tabula), parasti var pārvaldīt, nepārtraucot perorālo antikoagulāciju. Kopumā šādas procedūras var veikt 12—24 h pēc pēdējās lietotās NOAK devas.
Lietderīgi procedūru ieplānot 18—24 h pēc pēdējā medikamenta lietošanas un tad NOAK lietošanu atjaunot 6 h vēlāk (t.i., apiksabānam un dabigatrānam izlaižot vienu devu, bet edoksabāna un rivaroksabāna devu neizlaižot).
Pacients jāinformē, kā rīkoties, ja sāksies asiņošana.
Zema riska procedūras
Pirms invazīvām procedūrām ar zemu risku (t.i., zems asiņošanas biežuma rādītājs un/vai neliela asiņošanas ietekme) pēdējā NOAK deva jālieto ne mazāk kā 24 h pirms plānveida procedūras pacientiem ar normālu nieru darbību. Pacientiem, kuri lieto dabigatrānu un kuru GFĀ < 80 ml/min., jāapsver pakāpeniska pārtraukšana. Pacientiem, kuri lieto Xa inhibitoru un kuru CrCl 15—29 ml/min., pēdējā NOAK deva jālieto 36 h vai vairāk pirms operācijas.
Augsta riska procedūras
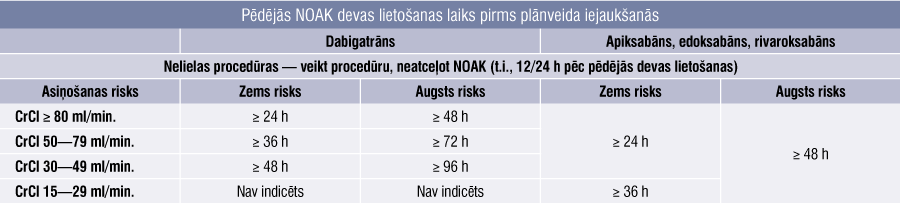

3. tabula
Pēdējās NOAK devas lietošanas laiks pirms plānveida iejaukšanās
Invazīvu procedūru vai operāciju gadījumā, kad lielas asiņošanas risks ir augsts vai ja asiņošanai būs nozīmīga klīniska ietekme, pēdējo NOAK devu ieteicams lietot 48 h vai ilgāk pirms operācijas. Atkal, pieņemot lēmumu pārtraukt terapiju uz ilgāku laiku, jāņem vērā visi attiecīgie ar pacientu un procedūru saistītie faktori. Pacientiem ar pavājinātu nieru darbību ir nepieciešams vēl ilgāks NOAK lietošanas pārtraukums, īpaši dabigatrāna lietotājiem. Apkopojums par NOAK atcelšanu pirms plānotām procedūrām skatāms 3. tabulā.
NOAK pacientiem ar PM un koronāro sirds slimību
Pacientiem, kuriem veikta plānveida perkutāna koronārā intervence (PKI), pamatā pietiktu ar NOAK + klopidogrela lietošanu sešus mēnešus, pēc tam tikai NOAK monoterapijā. Ļoti sarežģītas koronārās anatomijas vai garu koronāro stentu implantācijas gadījumā var apsvērt trīskāršo terapiju 1—7 dienas, terapijā pievienojot ASA.
Akūta koronāra sindroma (AKS) ar PKI gadījumā trīskāršā terapija klopidogrela grupā ir līdz vienam mēnesim, divkāršā terapija 3—12 mēnešus, pēc tam NOAK monoterapijā. AKS ar PKI gadījumā pacientiem, kuriem sākts tikagrelors, trīskāršā terapija lietojama 1—7 dienas, parasti stacionārā, tad divkāršā terapija ar tikagreloru un NAOK 1—6 mēnešus, pēc tam to nomaina uz divkāršo terapiju ar klopidogrelu un NOAK un lieto ~ 12 mēnešus kopš AKS notikuma. Kad pagājis gads no AKS notikuma, pilnībā pietiek ar NOAK monoterapijā. Jāatzīmē, ka šīs robežās nav striktas, jo viss atkarīgs no asiņošanas riska (vai konkrētajam pacientam tas ir augsts vai zems), koronārās anatomijas un PKI gaitas.
Ja ordinē divkāršo vai trīskāršo terapiju, tad antikoagulantu devas nemainās, izņemot rivaroksabānam, kura deva šādā gadījumā ir 15 mg un varbūt 10 mg pacientiem ar izteikti pasliktinātu nieru funkciju, bet par 10 mg vēl notiek diskusijas.
Monoterapijā devas korekcijai ņem vērā glomerulu filtrācijas ātrumu. Pacientiem ar divkāršo vai trīskāršo terapiju būtu vēlams terapijā pievienot protonu sūkņu inhibitorus, lai mazinātu asiņošanu no KZT. Gribētu vēlreiz akcentēt, ka pacientiem ar hronisku vai akūtu koronāru sindromu un PM tikai antiagregantu terapija kaut vai savstarpējā kombinācijā, tas ir, ASA ar P2Y12 inhibitoriem, nav rekomendējama, un šādiem pacientiem vienmēr terapijā ir NOAK vai atsevišķos gadījumos VKA, tad seko divkāršā vai trīskāršā terapija ar antiagregantiem. [6]
Secinājumi
- Priekšroka NOAK dodama paredzamās farmakokinētikas dēļ. NOAK mazāk mijiedarbojas ar medikamentiem, pārtiku un piedāvā stabilāku antikoagulācijas līmeni.
- Visi NOAK vismaz daļēji izvadās caur nierēm, tāpēc regulāri jākontrolē nieru funkcija. Pacientiem, kam nieru disfunkcija ir mērena, NOAK ir droši, bet nepieciešama devas pielāgošana. Pacientiem ar terminālu nieru slimību NOAK ir kontrindicēti.
- Asiņošanas risks pats par sevi nav iemesls, lai nelietotu NOAK pacientiem ar palielinātu insulta risku. Nepieciešams identificēt modificējamos riska faktorus un tos novērst.
- Kaut arī NOAK ir daudz mazāks zāļu mijiedarbības risks, daži medikamenti, kas ir spēcīgi P–gp un CYP3A4 inhibitori un induktori, var nozīmīgi ietekmēt NOAK funkciju, tāpēc jāizvērtē visi medikamenti, kurus lieto pacients, lai nerastos nopietna mijiedarbība.
- Lai gan invazīvas ķirurģiskas iejaukšanās dēļ īslaicīgi jāpārtrauc NOAK lietošana, daudzām mazāk invazīvām procedūrām ir salīdzinoši zems asiņošanas risks un tās var veikt līdztekus minimālai vai nepārtrauktai terapijai ar NOAK.