Pēdējos gadu desmitos zinātniekiem ir izdevies atklāt salīdzinoši daudz par to, kā Alcheimera slimība ietekmē smadzenes. Teorētiski virkne atklājumu varētu sniegt kardināli jaunas ārstēšanas, diagnostiskas un profilakses metodes, tomēr pagaidām tas vēl nav noticis. Šobrīd vairāk nekā 100 klīniskajos pētījumos pasaulē tiek iesaistīti pacienti ar Alcheimera slimību, pacienti ar slimībām, kuras uzskata par saistītām ar Alcheimera slimību, un pacienti ar citas izcelsmes kognitīviem bojājumiem. Patiešām jācer uz izdošanos un ticamiem datiem, jo, kā zināms, ar Alcheimera slimību šodien sirgst 5% pasaules sešdesmitpiecgadnieku un 20% astoņdesmitgadnieku, un ir aprēķināts, ka šo slimnieku skaits pēc 40 gadiem (2050. gadā) sasniegs 100 miljonus. Vai izdosies mainīt šo prognozi?
In vivo diagnostikas progress
Alcheimera slimība (Alzheimer's disease; turpmāk tekstā - AD) ir komplekss stāvoklis, kuru raksturo vesela patoloģisku notikumu kaskāde. Pēdējo 100 gadu laikā galvenais pētījumu objekts ir amiloīda loma AD attīstībā, un šobrīd zinātnieki pauž cerību, ka agrīnā AD diagnostikā, kā arī jaunu medikamentu (t. sk. neiroprotektīvo un preventīvo terapiju) efektivitātes izvērtēšanā būtisku ieguldījumu varētu dot amiloīda attēlveidošana. Molekulārās diagnostikas tehnoloģijas tagad ļauj in vivo izvērtēt ne vien smadzeņu funkcionālo aktivitāti (asinsriti, neirotransmiteru aktivitāti, receptoru blīvumu), bet arī tādus patoloģiskos procesus kā amiloīda pangas un mikroglijas aktivizāciju AD gadījumā. Pavisam nesen ir izstrādāti un izmēģināti vairāki pozitronu emisijas tomogrāfijas (PET) amiloīd-attēlveidošanas modeļi AD pacientiem - ar PET palīdzību patoloģiski augsta amiloīda klātbūtne var tikt noteikta in vivo, jau AD prodromālā stadijā, pirms smadzeņu funkcionālās aktivitātes pazemināšanās, t. i., pirms cerebrālā glikozes metabolisma un holīnerģiskās aktivitātes krituma, kas pavada kognitīvo bojājumu. Turklāt šīs metodes ļauj agrīni diferencēt AD no citu veidu demencēm.

Tematiskais pielikums
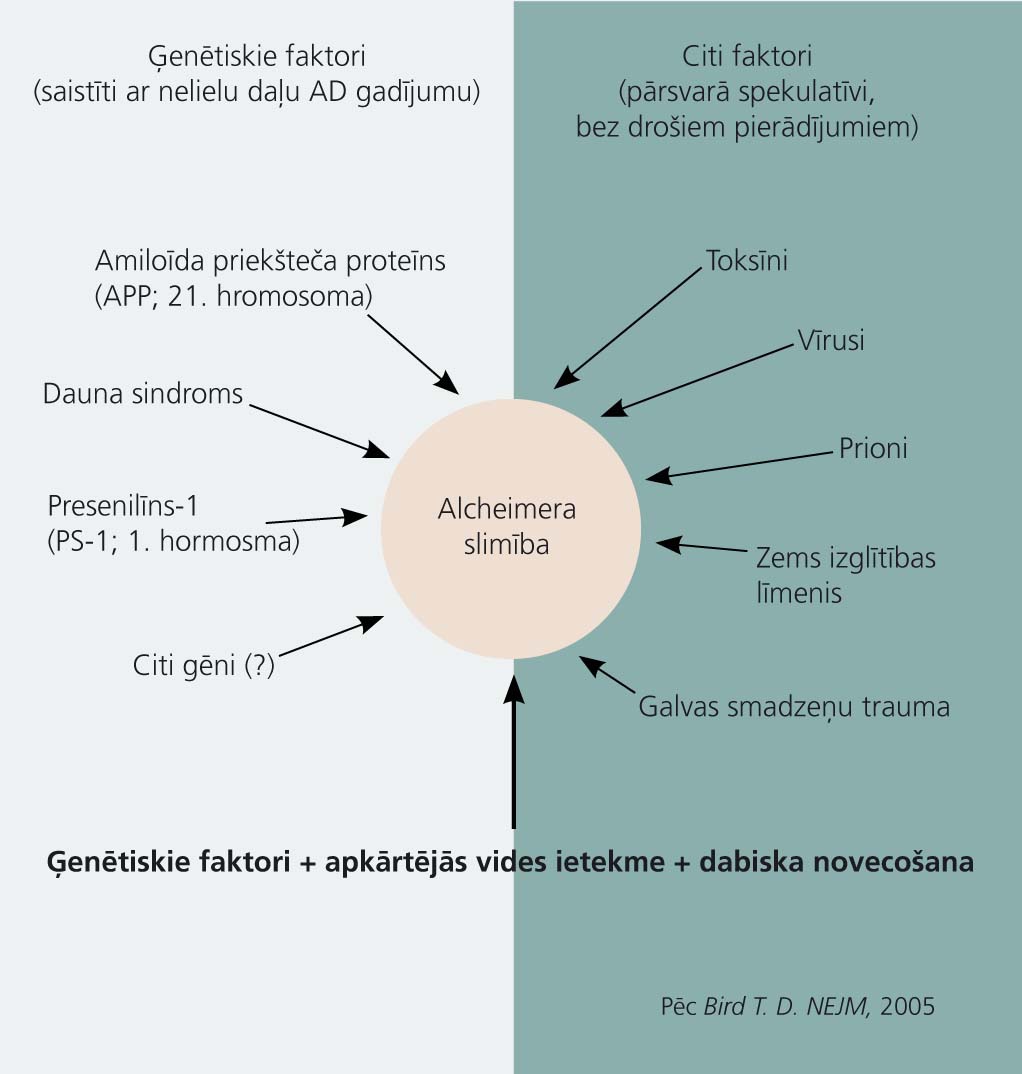
AD patoģenēzes mozaīka
Nordberg A. The Future: New Metods of Imaging Exploration in Alzheimer's Disease. Front Neurol Neurosci 2009; 24: 47-53. 26 Jan 2009 (epub).
Komentē dr. I. Paegle
Eiropas vadlīnijas nosaka attēldiagnostikas metodes pielietojumu pacientam ar aizdomām par demenci. Ar datortomogrāfijas metodi var diagnosticēt ķirurģiski ārstējamu bojājumu, magnētiskās rezonanses izmeklējumu (MRI) izmanto agrīnu, specifisku AD izmaiņu diagnostikai (temporālo daivu struktūru atrofija, mikroglijas izmaiņas) - šīs izmaiņas var vizualizēt daudz agrāk nekā konstatēt klīniskās izpausmes. SPECT un PET palīdz diferencēt bojāto neironu veidu un atšķirt AD no citām demencēm. MRI ļauj kontrolēt procesa gaitu dinamikā.
Primāras išēmijas koncepcija un head-down terapija
Cerebrālās asinsrites lomai AD patoģenēzē pēdējos gados tiek pievērsta aizvien lielāka uzmanība. Viena no jaunākajām AD patoģenēzes teorijām ir balstīta uz primāri išēmisku smadzeņu bojājumu - pretstatā dominējošajai hipotēzei par primāri deģeneratīvu bojājumu. Tomēr, lai gan vairākos pētījumos (piemēram, Roterdamas pētījumā) ir iegūti bagātīgi un ticami dati par cerebrālās asinsrites samazināšanos saistībā ar AD, šī slimība joprojām tiek uzskatīta par neirodeģeneratīvu procesu, kur cerebrālās asinsrites izmaiņas ir sekundāra parādība.
Šā raksta autori kritiski izvērtē agrākos literatūras datus, uzsverot, ka pastāv gana pārliecinoši iemesli pieņemt jauno koncepciju par AD kā primāri išēmiskas dabas patoloģiju. Pirmkārt, tie ir novērojumi par korelāciju starp cerebrālās asinsrites deficīta pakāpi un audu bojājuma pakāpi un/vai klīnisko atradi, kas runā par labu primārai un ir nesavienojami ar sekundāras išēmijas koncepciju.
Interesanti, ka jaunā teorija cerebrālās asinsrites deficītu saista ar cilvēka vertikālu stāju kombinācijā ar individuālu predispozīciju. Kas attiecas uz šo pieņēmumu, tad gan AD terapija, gan prevencija būtu samērā vienkārša un lēta - proti, galvu lejā metode (head-down-therapy), kas tiek monitorēta ar neiropsiholoģiskiem testiem, elektroencefalogrāfiju un doplerogrāfiju. Atzīmēts gan, ka šī metode varētu būt efektīva agrīnās AD stadijās, bet daudz pārāka ir tās profilaktiskā vērtība.
Niedermeyer E. et al. Alzheimer disease: primary ischemia concept and promising therapy. Clin Ter 2008 Nov-Dec; 159(6): 439-442.
Komentē dr. I. Paegle
Jau kopš laika, kad A. Alcheimers definēja specifisku demenci - AD, norit pastāvīgi pētījumi un diskusijas: kas ir primāri? Deģeneratīvas izmaiņas vai asinsvadu patoloģija (ateroskleroze, arteriāla hipertensija) ar asinsvadu sieniņas bojājumu hipoperfūziju. Pētījumi turpinās, bet klīniskā praksē pārliecinoši izpaužas abu patoloģiju kopīgie riska faktori, saslimšanas norises svārstības atbilstīgi hemodinamikai. Veikto biopsiju rezultāti parāda gan bojātās asinsvadu endotēlija šūnas, gan patoloģiskā olbaltuma depozītus.
Cukura diabēts un Alcheimera slimība - vai kopīgi vaibsti?
Korelācijai starp AD un 2. tipa cukura diabētu epidemioloģiskos pētījumos ir augsts ticamības līmenis. Miklossy ar līdzautoriem analizējuši aizkuņģa dziedzera audus autopsijas materiālos no desmit personām ar 2. tipa cukura diabētu un 11 kontrolpersonām - ar mērķi noteikt amiloīda beta proteīna (A-beta) un hiperfosforilēta tau proteīna klātbūtni.
Izmantojot polimerāzes ķēdes reakciju, imunoblota analīzi (Western blotting) un infrasarkanās mikrospektroskopijas metodi, 2. tipa cukura diabēta slimnieku aizkuņģa dziedzera Langerhansa saliņās konstatēja A-beta sakopojumus, hiperfosforilētu tau proteīnu, ubikvitīnu, apolipoproteīnus E un (a), IB1/JIP-1 un JNK1 - faktorus, kas saistīti ar AD risku un patoloģisko procesu. Tāpat novēroja A-beta plātnīšu veidošanos in situ.
Šie novērojumi ļauj secināt, ka A-beta depozītu un hiperfosforilēta tau proteīna klātbūtne asociējas ar 2. tipa cukura diabētu līdzīgi kā AD, un tas norāda uz abu slimību patoģenēzes kopīgiem mehānismiem.
Būtiski, ka šis pētījums pierāda - A-beta depozīcija un hi perfosforilēts tau nav specifiski tikai smadzenēm, bet var veidoties arī citos orgānos.
Miklossy J., Qing H. et al. Beta amyloid and hiperphosphorylated tau deposits in the pancreas in type 2 diabetes. Neurobiol Aging. 2008 Oct 16.
Komentē dr. I. Paegle
Diabēts var izsaukt izmaiņas sīkajos cerebrālajos asinsvados, mikrocirkulācijas traucējumus un paaugstināt insulta risku, kas savukārt pasliktina jau esošo neirodeģeneratīvo procesu. Insulīna receptori lokalizējas gan hippocampus, gan smadzeņu garozā. Insulīnu šķeļošais enzīms ir viens no svarīgākajiem faktoriem, kas degradē beta amiloīdu. Mutācijas šā enzīma gēnā paaugstina beta amiloīda depozīciju smadzenēs.
Antivielas kā individuāls AD gaitu ietekmējošs faktors
Līdz šim ar panākumiem nav vainagojušies pūliņi, kas vērsti uz amiloīda pangu evakuāciju no AD slimnieku smadzeņu audiem. Vēlamais efekts nav sasniegts ne ar "pret-pangu" vakcīnām, ne imunoglobīniem, respektīvi, nedz ar aktīvas, nedz pasīvas imunizācijas palīdzību.
Pretstatā tam pētīts, vai dabīgās autoantivielas neimunizētiem AD pacientiem varētu sekmēt pangu izvadi no smadzenēm. Izgatavoja un analizēja vairāk par 2000 centrālās nervu sistēmas audu paraugu no 48 AD pacientiem un 48 saskanīgām kontrolpersonām. Novēroja, ka liela daļa neirītisko pangu ir klātas ar IgG antivielām, un pacientiem, kam dominē šādas - "IgG-dekorētas" - pangas, kopējais neirītisko pangu daudzums ir būtiski zemāks, bet fagocitāras mikroglijas daudzums - lielāks (turklāt bez mikrohemorāģiju daudzuma pieauguma).
Pirmais secinājums - tiešās autoantivielas pret amiloīda beta proteīnu bieži ir atrodamas AD pacientiem.
Otrais secinājums - šādas antivielas var būt nozīmīgs faktors neirītisko pangu daudzuma kontrolē (lai gan nav zināms, kādi faktori saistīti ar to veidošanos).
Kellner A., Matschke J. et al. Autoantibodies against beta-amyloid are common in Alzheimer's disease and help control plaque burden. Ann Neurol 2009 Jan; 65(1): 24-31.
Komentē dr. I. Paegle
Var piebilst, ka tālākie pētījumi jaunu vakcīnu, imūnglobulīnu izstrādē ir ļoti nozīmīgi iespējamai AD ārstēšanai.
Seruma albumīna līmenis koriģē donezepila efektu
Šobrīd veiksmīgākā AD terapija ir acetilholīnesterāzes (Ach) inhibitori. Taču, ņemot vērā šo medikamentu variablos efektivitātes rādītājus, būtu svarīgi identificēt farmakokinētiskos un farmakodinamiskos mehānismus, kas var kavēt Ach inhibitoru efektu. Šā pētījuma mērķis bija izvērtēt holīnesterāzes inhibitora donezepila ietekmi uz kognitīvo funkciju atkarībā no seruma albumīna līmeņa. Pētījums ilga divus gadus, un tajā tika iesaistīti 98 ambulatori, ar donezepilu ārstēti pacienti ar vieglas līdz vidējas pakāpes AD. Pētījuma sākumā visiem pacientiem veica vispusīgu kognitīvo, funkcionālo un psihosociālo funkciju izvērtējumu, atzīmējot arī visas blakus saslimšanas. Visus pacientus atkarībā no seruma albumīna līmeņa iedalīja trīs grupās: zems, vidējs, augsts.
Rezultāti: pēc trim mēnešiem visiem pacientiem novēroja ADAS-Cog (Alcheimera slimības novērtējuma skalas) rezultātu uzlabošanos salīdzinājumā ar izejas līmeni; kognitīvo stabilizāciju pēc deviņiem mēnešiem; un to, ka stāvoklis nav būtiski pasliktinājies, pēc 15 mēnešiem. Pacientu grupā ar zemu seruma albumīna līmeni novēroja labāku donezepila efektu: ja runā par ADAS-Cog vidējo dinamiku, 15 mēnešu laikā tā uzlabojās tieši šajā grupā, bet abās pārējās - pasliktinājās.
Pētījuma autori vērš uzmanību uz to, ka šie preliminārie dati iezīmē jaunu monitorējamu faktoru Ach inhibotoru klīniski terapeitiskās efektivitātes izvērtēšanai.
Rozzini L. et al. Serum albumin level interferes with the effect of donepezil in Alzheimer's disease. Aging Clin Exp Res 2008 Dec; 20 (6): 509-512.
Komentē dr. I. Paegle
Monitorēt Ach inhibitoru efektivitāti ir nepieciešams gan preparātu devas izvēlei, gan ārstēšanas ilguma noteikšanai.
Visi statīni līdzīgā mērā mazina AD risku: Roterdamas pētījuma rezultāti
12 līdz 15 gadu tika analizēta AD incidence 6992 personu populācijā. Visas pētāmās personas iedalīja atkarībā no holesterīnu pazeminošo līdzekļu lietošanas (statīni vai cita veida holesterīnu pazeminoši līdzekļi jeb "ne-statīni") un sīkāk - atkarībā no statīnu veida (lipofili vai hidrofili). Iegūtos datus analizēja ar Koksa regresijas metodi, izlīdzinot pēc vecuma, dzimuma un potenciālajiem blakus faktoriem.
Vidējā novērošanas perioda laikā (9 gadi) 582 personām attīstījās AD. Salīdzinot ar personām, kas nebija lietojušas nekādus holesterīnu pazeminošus līdzekļus, statīnu lietošana asociējās ar zemāku AD attīstības risku (HR 0,57), bet "ne-statīnu" lietošana - ne (HR 1,05); turklāt HR (riska attiecība) neatšķīrās starp lipofilajiem un hidrofilajiem statīniem.
Šā pētījuma mērķis bija prospektīvi izvērtēt, vai statīnu lietošana ietekmē AD risku un vai šī ietekme atšķiras atkarībā no lietoto statīnu apakšgrupas. Pētnieki ieguva apstiprinošu atbildi uz pirmo un noliedzošu atbildi uz otro jautājumu. Iepriekš citos šķērsgriezuma pētījumos tāpat novērots, ka statīnu lietošana asociējas ar zemāku AD attīstības risku, bet prospektīvu pētījumu dati bija neviennozīmīgi; tāpat nebija ziņu par to, vai šī asociācija atšķiras starp lipofilajiem statīniem - t. i., tiem, kuri vieglāk šķērso asinsvadu barjeru smadzenēs, - un hidrofilajiem statīniem.
Haag M. D., Hofman A. et al. Statins are associated with a reduced risk of Alzheimer disease regardless of lipophilicity. The Rotterdam Study. J Neurol Neurosurg Psychiatry 2009 Jan; 80(1): 13-17.
Komentē dr. I. Paegle
Līdzšinējie pētījumu dati nav pierādījuši statīnu efektivitāti AD riska samazināšanai, bet pārliecinoši pierādījuši to efektivitāti pie kardiovaskulārām saslimšanām. Iespējams, galvenais ir īstais laiks, kad uzsākama statīnu terapija - t. i., agrīni. Pētījumi jāturpina.
Iespējams, AD var ietekmēt ar pretepilepsijas līdzekļiem
AD raksturojas ar paaugstinātu epilēkmju incidenci, ko ir vispārpieņemts interpretēt kā sekundāru procesu, kas rodas prog re sē jošas neirodģenerācijas rezultātā kombinācijā ar citiem ar novecošanos saistītiem procesiem. Tomēr eksperimenti ar dzīvniekiem pakļauj šaubām šo modeli, pieļaujot iespēju, ka patoloģiski izmainīta neironu aktivitāte (kairināmība) ir primārs augšupejošs process, kas var sekmēt kognitīvo deficītu. Autori norāda uz zināmiem faktiem, kas liecina, ka šādai patoloģiskai neironu aktivitātei var būt identiska loma arī cilvēkos:
- pirmkārt, cilvēkiem ar sporādisku AD raksturīga paaugstināta epilēkmju incidence neatkarīgi no slimības stadijas, un tā ir augstāka gadījumos ar agrīnu slimības sākumu;
- galvenā zināmā ģenētiskā AD riska faktora - apoliporoteīna E4 - pārmantošana asociējas ar subklīnisku epileptisku aktivitāti arī personām bez demences;
- atsevišķas amnēzijas un dezorientācijas epizodes pacientiem ar AD ir saistītas ar epileptisku aktivitāti, un to prevencija ir realizējama ar antiepileptisko līdzekļu lietošanu.
Tāpat autori atsaucas uz saviem iegūtajiem eksperimentālajiem datiem, ka augsta amiloīda beta proteīna koncentrācija smadzenēs pelēm ar AD var izraisīt epileptisku aktivitāti un kognitīvu deficītu.
Secināts, ka arī cilvēkam amiloīda beta peptīdi var sekmēt kognitīvu degradāciju AD gadījumā caur patoloģiski izmainītas neironālās aktivitātes indukciju. Protams, šādas hipotēzes apstiprinājumam būtu būtiska ietekme uz pastāvošajiem terapeitiskajiem principiem - šajā gadījumā patoloģiskās neironu aktivizācijas nomākšana varētu pasargāt smadzenes no amiloīda beta degradējošās ietekmes uz kognīciju.
Palop J. J., Mucke L. Epilepsy and Cognitive Impairments in Alzheimer Disease. Arch Neurol 2009 Feb 9 (Epub).
Komentē dr. I. Paegle
Hipotēze par patoloģisko neironu epiaktivitāti pie neirodeģeneratīvā procesa un korekcijas iespējām ir interesanta, bet līdzšinējie pētījumi pagaidām nav pārliecinoši.
Kardiovaskulārā riska faktori un AD dažādos pētījumos
Veikts sistēmisks literatūras pārskats par kardiovaskulāro riska faktoru - hipertensijas, cukura diabēta, alkohola lietošanas, smēķēšanas, lipīdu profila, ApoE4, diētas u. c. - korelāciju ar sporādiskiem AD gadījumiem. Tika izanalizēti visu PubMed datubāzē pieejamo pētījumu dati no 2000. līdz 2007. gadam (ar > 500 pētāmo personu).
Visneatkarīgākais riska faktors bija ApoE4. Tādi individuāli riska faktori kā hipertensija un cukura diabēts nebija pārliecinoši saistīti ar AD risku, bet hipertensijas loma būtiski pieauga pētījumos, kur bija lietoti augstāki sistoliskā asinsspiediena kritēriji, kā arī pusmūža cilvēkiem. AD risks būtiski mainījās dažādu riska faktoru savstarpējā interakcijā, īpaši cukura diabēta un hipertensijas interakcijā (pieauga, abiem faktoriem kombinējoties, un otrādi). AD risku ietekmējošas interakcijas tika atrastas arī tādiem faktoriem kā fiziska aktivitāte, ApoE4, cukura diabēts un holesterīna līmenis.
Var secināt, ka kardiovaskulārā riska faktoru asociācija ar AD pētījumos būtiski mainās atkarībā no mērāmajiem parametriem un to savstarpējām kombinācijām. Faktiski nav pierādījumu neviena atsevišķa riska faktora noturīgai saistībai ar AD risku.
Purnell C., Gao S. et al. Cardiovascular Risk Factors and Incident Alzheimer Disease: A Systematic Review of the Literature. Alzheimer Dis Assoc Disord 2008 Aug 13.
Komentē dr. I. Paegle
Svarīgi ir noskaidrot visus riska faktorus, izvērtējot to nozīmīgumu AD pacienta dažādos dzīves etapos un kontekstā ar blakus saslimšanām. Pētījumos ir pierādīts, ka, riska faktoriem kombinējoties, to kopējais risks pieaug līdz 6%.
AD raksturīgas izmaiņas atrod arī cilvēkiem bez kognitīvā bojājuma
Autopsijās novērots, ka daļai gados vecu cilvēku ir izteiktas AD raksturīgas izmaiņas smadzenēs, lai gan kognitīvā funkcija dzīves laikā bijusi normāla. To faktoru atklāšana, kas saistīti ar šo fenomenu, protams, pavērtu ceļu jaunām neiroprotekcijas iespējām.
Pētījumam izvēlējās 36 personas, kam smadzeņu autopsijas materiālā bija konstatēts vidēji liels vai liels neirītisko pangu daudzums - 12 no šīm personām bija bijusi normāla kognitīvā funkcija, 24 personām - AD diagnoze. Salīdzinot abu grupu demogrāfiskos rādītājus, klīniski patoloģiskos datus un smadzeņu raksturlielumus pirms nāves (MRI dati), pēc datu izlīdzināšanas vienīgā statistiski nozīmīgā atšķirība personām ar normālu kognitīvo funkciju bija lielāki hippocampus izmēri un smadzeņu tilpums MRI pirms nāves.
Ir pilnīgi skaidrs, ka šie faktori saistīti ar kognitīvās funkcijas saglabāšanu par spīti izteiktu AD raksturīgu bojājumu klātbūtnei. Tomēr pētījums nesniedz atbildi par mehānismiem, kuri savukārt nosaka šos faktorus.
Erten-Lyons D. et al. Factors associated with resistance to dementia despite high Alzheimer disease pathology. Neurology 2009 Jan 27; 72(4): 354-360.
Komentē dr. I. Paegle
Kognitīvo funkciju saglabāšanas iespējas par spīti AD procesu klātbūtnei ir izaicinājums gan ārstam, gan slimniekam. More with less problēma ir aktuāla, pētījumi turpinās.