Epidemioloģija un iemesli
Saslimstība pieaug un NATAS biežums palielinās proporcionāli cilvēku saslimstībai ar aptaukošanos un otrā tipa cukura diabētu. [8] Sabiedrības aptaukošanās, palielināta ķermeņa masa tiek skaidrota ar pasīvu dzīvesveidu un kaitīgiem ēšanas paradumiem. [6] Raksturīga samazināta fiziskā slodze, šķiedrvielu lietošana uzturā un hiperkalorijām bagāta ēdiena un fruktozes (saldināto dzērienu) palielināta uzņemšana. [6; 7]
Vecums un iekaisuma plašums ir vērā ņemami raksturlielumi fibrozes attīstībā. [32] Apmēram 5% pacientu, kas slimo ar NATAS, laika gaitā attīstās aknu ciroze. [31]
Slimības biežums pieaug ar vecumu: no 2,6% bērnu vecumā līdz 26% cilvēku 40-50 gadu vecumā. [35]
NATAS bērniem ir progresējoša. Pētījumos pierādīts, ka bērniem ar NATAS raksturīga īsāka ilgtermiņa izdzīvošana nekā bērniem no populācijas tāda paša vecuma un dzimuma grupā. [21] NATAS pasaulē min arī kā vienu no galvenajiem ar aknu patoloģiju saistītas nāves iemesliem. [30]
Pētījumos par pieaugušajiem pierādīts, ka NATAS ir svarīgs riska faktors hepatocelulāras karcinomas attīstībai. NATAS hepatocelulāras karcinomas etioloģijā ierindojas trešajā vietā, divi biežākie ierosinātāji ir C hepatīta vīruss (VHC) un alkohola etioloģijas taukainu aknu slimība. [22; 23]
Aprēķināts, ka nākamajos divdesmit gados ne‑alkohola steatohepatīts (NASH) kļūs par predominantu iemeslu cirozes attīstībā, reizē kļūstot arī par vienu no galvenajiem iemesliem aknu transplantācijas nepieciešamībai. [8]
1980. gadā, kad slimība pirmo reizi aprakstīta, valdīja uzskats, ka tā biežāk ir sievietēm ar palielinātu ĶMI un tādām ar to saistītām slimībām kā cukura diabēts un holedoholitiāze. [1] Mūsdienās zināms, ka NATAS var skart ikvienu. [3]
NATAS nozīmē plašu spektru aknu anomāliju - no vienkāršas, nekomplicētas aknu steatozes līdz steatohepatītam ar iekaisumu dažādās pakāpēs, sekas var būt arī fibroze. [6] Apmēram 80% gadījumu smagāki aknu bojājumi par aknu steatozi nerodas. [10] Vidēji 20% slimības gadījumu attīstās steatohepatīts, kas populācijā atbilst 3-5% cilvēku. [10; 29]
Slimības rašanās iemesls joprojām nav pilnībā noskaidrots. Aprakstīti vairāki riska faktori, kas rosina un ietekmē NATAS attīstību. [8]
Taukainu aknu slimības iemesli tiek iedalīti primāros un sekundāros. [8] Pie primārajiem iemesliem, kas var ierosināt makrovezikulāru steatozi, biežāk nosaukta aptaukošanās, otrā tipa cukura diabēts, insulīna rezistence, dislipidēmija. [8] Pie NATAS izraisītājiem nepieder alkohols un citi sekundārie iemesli. [8]
Gan bērniem, gan pieaugušajiem kā galvenie NATAS riska faktori tiek minēti aptaukošanās, īpaši viscerāla adipozitāte, insulīna rezistence, otrā tipa cukura diabēts un citas metabolajam sindromam raksturīgas iezīmes.
NATAS ir aknu atbildes reakcija uz organismā attīstījušos metabolo sindromu. [6] Metabolais sindroms ir komplekss daudzfaktoru stāvoklis, kam ir cieša saikne ar dažādām orgānu sistēmām. Metabolā sindroma pamatā ir kombinēti dažādi glikozes vielmaiņas traucējumi, kas palielina risku saslimt ar otrā tipa cukura diabētu un sirds-asinsvadu sistēmas slimībām. [6]
Metabolā sindroma kritēriji:
- abdomināla aptaukošanās: vidukļa apkārtmērs vīriešiem virs 102 cm, sievietēm virs 88 cm;
- hipertrigliceridēmija: triglicerīdu līmenis ≥ 1,7 mmol/l;
- pazemināts ABLH līmenis: vīriešiem < 1,03 mmol/l, sievietēm < 1,29 mmol/l;
- paaugstināts asinsspiediens ≥ 130/85 mmHg;
- glikoze tukšā dūšā ≥ 5,6 mmol/L vai ar medikamentiem ārstēts cukura diabēts. [1]
90% pacientu ar NATAS ir vismaz viens no metabolā sindroma raksturlielumiem, 33% pacientu ar NATAS diagnosticē metabolo sindromu. [11] NATAS saistīta arī ar citām metabolam sindromam raksturīgām iezīmēm, piemēram, insulīna rezistenci un hiperlipidēmiju, kas palielina kardiovaskulāro slimību attīstības risku. [12; 13]
Pēdējos pētījumos ir pierādījumi, ka NATAS gadījumā metabolais sindroms varētu būt provocējošs faktors aknu karcinoģenēzei. Determinanta nozīme ir insulīna rezistencei, veicinot šūnu augšanu un dezoksiribonukleīnskābes bojājumu. [24]
Pēdējos gados arvien vairāk aprakstīti t.s. demogrāfiskie riska faktori. Pētījumos pierādīts, ka ar NATAS biežāk slimo pieaugušie, nevis bērni: tas iespējami saistīts ar pubertātei raksturīgām hormonālām izmaiņām, kad paaugstinās insulīna līmenis asinīs un mainās tauku akumulācija aknās. [14; 15]
Dzimumam ir statistiski ticama nozīme NATAS biežumā. Epidemioloģiskos pētījumos apstiprinājies, ka ar NATAS apmēram divas reizes biežāk slimo vīrieši nekā sievietes. [8]
Pētījumos izteiktas aizdomas, ka estrogēni varētu būt aizsargājoši, samazinot lipīdu peroksidāciju lipoproteīnos un tiem kalpojot kā pretiekaisuma līdzekļiem, tādējādi samazinot NATAS attīstību. Šīs hipotēzes apstiprinās pētījumu rezultātos: ir lielāka varbūtība, ka sievietēm ar estrogēna deficītu vai paaugstinātu androgēnu līmeni attīstīsies aknu steatoze, taču sievietēm, kas postmenopauzes periodā lietojušas estrogēnu HAT, risks, ka attīstīsies aknu steatoze, ir mazāks. [16]
Klīniskos pētījumos par dažādām rasēm un etniskajām kopām konstatētas klīnisko gadījumu sērijas, kad slimības attīstība novērota kā pārmantojama - novērojama ģenētiska predispozīcija. Pēdējos pētījumos atrasts, ka viena nukleotīda polimorfisms (patatīnam līdzīgā fosfolipāze 3 un apolipoproteīns C3) tieši korelē ar tauku produkciju aknās. [19; 20] Ģimenes anamnēzes nozīme - līdzīgas izmaiņas aknu audos atrastas 18% pacientu pirmās pakāpes radinieku. [3]
Klīniski visbiežāk izpaužas asimptomātiski. Reti ir sūdzības par nogurumu, nespēku, diskomfortu augšējā labajā kvadrantā. 56-79% pacientu ir palielināts ĶMI (> 25 kg/m2), taču NATAS gadījumā tas var būt arī normāls. [8]
Patoģenēze
NATAS patoģenēzes pamatā ir "divu sitienu" teorija. [10] Pēc "pirmā sitiena" hepatocītos izgulsnējas tauku pilieni. Tauki hepatocītos vairāk uzkrājas tad, ja organismā ir liela taukaudu - īpaši centrālo taukaudu - masa. No centrālajiem taukaudiem, tas ir, apzarņa un taukplēves, asinīs ieplūst vairāk taukskābju. Asinis no apzarņa un taukplēves ieplūst aknās. [10]
Ja seko "otrais sitiens", tauku uzkrāšanās aknās palielinās un rodas aknu iekaisums. Attīstās NASH, palielinās saistaudu daudzums aknās, var attīstīties fibroze, kas tālāk var pārtapt cirozē vai hepatocelulārā vēzī. [10]
Taukaudi nav inerts veidojums, bet savdabīgs iekšējās sekrēcijas dziedzeris, kas izdala hormonus. Šā hormona koncentrācija serumā ir tieši proporcionāla taukaudu masai. Jo vairāk taukaudu, jo hormona koncentrācija stiprāka. Šo hormonu sauc par leptīnu. No asinīm leptīns iekļūst hipotalāma kodolos, kur reaģē ar specifiskiem nervu šūnu receptoriem, proti, leptīna receptoriem, tāpēc samazinās ēstgriba. Leptīna receptori ir endotēlija šūnām, un šo receptoru stimulēšana sekmē jaunu asinsvadu veidošanos. Leptīna receptori ir arī hepatocītiem. Ja leptīns saistās ar hepatocītu receptoriem, šajās šūnās sākas pastiprināta tauku (triglicerīdu) sintēze un uzkrāšanās. Var rasties steatoze. Tomēr ļoti bieži steatoze, lai gan leptīna izdale ir intensīva, nerodas vai arī rodas pacientiem, kam leptīna koncentrācija ir normāla. [10; 33]
Taukšūnas producē vēl vienu hormonu ar unikālām īpašībām - adiponektīnu. Adiponektīns iedarbojas uz adiponektīna receptoriem, tāpēc tiek aktivēta taukskābju bēta oksidēšana un muskuļaudi noārda taukskābes. Taukskābju noārdīšana notiek arī fiziska miera laikā. Adiponektīns samazina insulīna rezistenci un dislipidēmiju. [10; 33]
Steatozes izcelsmē piedalās vairāki faktori: liela tauku masa, leptīns un insulīna rezistence. Viens no tiem ir insulīna rezistences veidošanās, ko NASH slimniekiem novēro ļoti bieži. Insulīna neefektivitāti organisma regulējošās sistēmas cenšas kompensēt - endokrīnais aizkuņģa dziedzeris insulīnu izdala pastiprināti. Bet insulīns sekmē tauku (triglicerīdu) sintēzi hepatocītā un vienlaikus kavē tauku (ļoti zema blīvuma lipoproteīnu) izdalīšanu, tāpēc šūnā krājas tauki. [34]
Insulīna rezistence var skart vairākus iekšējos orgānus. Insulīna rezistence ierosina aptaukošanos, dislipidēmiju, arteriālo hipertensiju un taukainas aknas. Viena orgāna insulīna rezistence var sekmēt šā traucējuma rašanos citā orgānā. Tomēr, ja insulīna rezistence nepārsniedz kritisko slieksni un ja neizplatās ārpus viena orgāna robežām, tad slimība nesākas. [33]
Daudziem NASH slimniekiem insulīna rezistences nav. Iespējams, ir ģenētiski faktori, kas sekmē steatozi. [33]
NATAS iemesli ir grūti izprotami. Ar taukiem pārpildīti hepatocīti funkcionē normāli. Šūnas "aptaukošanās" saistīta ar lielāku bojājuma rašanās iespēju. Ar taukiem pārslogotā hepatocītā taukskābju noārdīšana notiek neparasti. Taukskābes noārda ne vien mitohondriji (kur tiek saražota šūnai nepieciešamā enerģija), bet arī īpaši fermenti, kas īstenībā "paredzēti" šūnā iekļuvušu svešu substanču (piemēram, alkohola) atindēšanai. [9] Tie ir citohroma p450 sistēmas fermenti. Taukskābju noārdīšanu un alkohola atindēšanu īpaši aktīvi veic citohroms, ko sauc par 2E1. NASH slimniekiem šā citohroma ir ļoti daudz. Un tas nav labi, jo enzīma darbības laikā (t.i., brīdī, kad citohroms noārda alkoholu vai taukskābes) izdalās ļoti reaktīvas substances - brīvie skābekļa radikāļi. Ar taukiem pārpildīts hepatocīts līdzinās ar alkoholu "piepildītai" šūnai. Šūnā lielā daudzumā veidojas brīvie radikāļi, bet šūna netiek bojāta, ja brīvos radikāļus neitralizē antioksidanti. Ja radikāļu ir daudz, liela to daļa netiek neitralizēta. Tad šīs reaktīvās substances bojā membrānas un citas šūnas sastāvdaļas, arī taukus, kuru steatozes gadījumā šūnā ir ļoti daudz. Tātad šūnā sakrātie tauki sāk "bojāties" - noris lipīdu peroksidācija un krājas peroksīdi. [9; 10]
Lipīdu peroksīdi hepatocītā "iedarbina" sistēmu, tiek aktivēts nukleārais faktors kappa B (NF‑kB). Tas iekļūst kodolā un inducē citokīnu un citu bioloģiski aktīvu vielu sintēzi. Process no hepatocīta iekšpuses pāriet uz telpu ārpus šūnas, jo hepatocīti apkārtējā vidē izdala brīvos radikāļus, lipīdu peroksīdus un citokīnus. Tiek izdalītas spēcīgas iekaisuma šūnu (limfocītu, granulocītu, neitrofilo leikocītu) "pievilinātājas". [9]
Iekaisuma šūnas infiltrē aknu daivas, sākas aknu iekaisums. Tiek aktivētas zvaigžņveida šūnas, kuru funkcija ir uzkrāt taukus un taukos šķīstošus vitamīnus. Bet, ja šīs šūnas tiek uzbudinātas, tās pārvēršas un sāk sintezēt ekstracelulāro matrici. Attīstās fibroze, kas ar laiku var pārtapt cirozē. [10]
Šo bojājumu attīstību var sekmēt vēl citi faktori. Ar taukiem pārblīvēti hepatocīti ir neizturīgi un viegli pakļaujas baktēriju endotoksīna vai citu agresīvu faktoru (piemēram, citokīna, TNF alfa) bojājošai ietekmei. Tāpēc steatozes slimniekiem aknu bojājumu var izraisīt zarnu baktērijas, ja tās savairojas tievajā zarnā. Iespējams, ka baktēriju proliferācija notiek pēc zarnu anastomožu operācijas, jo tās laikā tiek izveidota akla zarnas cilpa, kurā vairojas baktērijas. [9; 10; 34]
Diagnostika
NATAS ir izslēgšanas diagnoze. [6] Diagnosticējot NATAS, jāizslēdz visi citi iespējamie slimības cēloņi. Jāpievērš uzmanība, vai pacientam ir lieka tauku masa - jāizvērtē aptaukošanās pakāpe. Tomēr der atcerēties, ka arī normāla barojuma cilvēkiem var attīstīties taukainas aknas. [6]
Jānoskaidro, vai pacients lieto alkoholu. Jāizslēdz citi cēloņi, kas var radīt aknu bojājumu (VHB, VHC, medikamenti, autoimūns hepatīts, hemohromatoze, Vilsona slimība). [6; 8; 10]
Jāizmēra arteriālais asinsspiediens, lai konstatētu iespējamu sirds-asinsvadu sistēmas slimību. [8]
Jāveic asins bioķīmiskie izmeklējumi, lai konstatētu, vai ir hepatocītu bojājums. Jānosaka AlAT, AsAT, yGTP koncentrācija serumā. [8]
Tomēr jāatceras, ka normāli asins bioķīmiskie rādītāji vēl neizslēdz taukainu aknu slimības diagnozi. Pētījumu dati liecina, ka 55-79% NATAS pacientu asins bioķīmiskie rādītāji ir normā. Pacientiem ar smagiem aknu struktūras bojājumiem, pat aknu cirozi sākuma stadijā aknu bioķīmiskie rādītāji var nebūt paaugstināti. [8]
Lai konstatētu, vai pacientam ir insulīna rezistence un vai ir lipīdu vielmaiņas traucējumi, jānosaka glikozes koncentrācija serumā, glikozētā hemoglobīna daudzums, holesterīna, ZBLH un ABLH, triglicerīdu koncentrācija. [6; 10]
Pacientiem var būt paaugstināts ferritīna līmenis serumā. Hemohromatozes pacientiem būtu jānosaka ferritīna līmenis. [6]
NATAS diagnosticēšanai izmanto arī vēdera orgānu US. Tomēr jāatceras, ka izmeklējumā ar US var nepamanīt taukainas aknas vai pilnīgi normālas aknas uzskatīt par taukainām. Tā kā US ir viegli veicama, nav dārga un ir pieejama, tad izmeklējums, ko veic pieredzējis speciālists, ir laba taukainu aknu konstatēšanas metode. [10]
Attēlu diagnostikā var izmantot arī vēdera DT un KMR. [6]
Par visinformatīvāko metodi aknu bojājuma pakāpes noteikšanai maldīgi uzskata aknu histoloģisko izmeklēšanu. Lai gan saukta par "zelta standartu", tā ir invazīva un neprecīza diagnostikas metode. [6]
Aknu audu bojājuma pakāpi var noteikt, nosakot hialuronskābes, kolagēna fragmentu koncentrāciju serumā. Ja aknās veidojas fibroze, tad pastiprinās šo vielu koncentrācija. [6; 8; 10]
Var veikt FibroTest komplektu, kas mēra aknu fibrozes veidošanās rādītājus. [6; 10]
Aknu morfoloģiskās pārmaiņas var noteikt, izmantojot ultrasonogrāfu FibroScan, kas reģistrē aknu elastību. Ierīces impulsi iekļūst aknās un izplatās. Reģistrējot viļņu izplatīšanās ātrumu, var spriest par aknu elastību. Tā ir mazinvazīva metode, tomēr mazjutīga aknu fibrozes sākuma stadijā. Latvijā FibroTest un FibroScan neizmanto, tomēr jāatceras par taukainu aknu slimības pieaugošo sastopamību un jāpārdomā šo metožu ieviešanas lietderība. [6; 10]
Tā kā NATAS ir izslēdzoša diagnoze, pacients mērķtiecīgi jānovērtē un jāizmeklē. Svarīgi apzināt pacienta riska faktorus un izmeklēšanas iespējas, lai laikus diagnosticētu slimību. Soli pa solim taukainu aknu slimnieku izmeklēšana jātuvina pasaules standartiem.
Ārstēšanas iespējas
Ārstēšanas mērķis ir mazināt NATAS attīstību un aizkavēt aknu slimību izraisītu nāvi. Ir nemedikamentoza un medikamentoza ārstēšana.
Nemedikamentoza ārstēšana
"Zelta standarts" NATAS ārstēšanā ir nemedikamentoza ārstēšana. [6] Pamatuzdevums NATAS slimības ārstēšanā ir ķermeņa masas mazināšana, tomēr tā būs nesekmīga, ja pacienta dzīves kvalitāte pasliktināsies. Sākotnējais princips ir nevis kilogramu mazināšana, bet veselības stāvokļa un dzīves kvalitātes uzlabošana. Ķermeņa masas mazināšana jākombinē ar lielāku fizisko aktivitāti, kas palielina muskuļu masu. Pat tad, ja svars nav mazinājies, tauku masa fizisko aktivitāšu rezultātā mazināsies. Ļoti bieži ar to pietiek, lai krasi uzlabotos veselība, proti, mazinātos insulīna rezistence, normalizētos ogļhidrātu un lipīdu vielmaiņas rādītāji. [10]
Lai uzlabotu fiziskās spējas, rekomendē aerobus treniņus - soļošanu, lēnu skrējienu, braukšanu ar velosipēdu, peldēšanu, airēšanu. Ieteicamas regulāras pastaigas 3-5 reizes nedēļā 20-30 minūtes. Fiziskā aktivitāte un aerobie treniņi ir arī daļa no ikdienas slodzes - staigāšana, kāpšana pa kāpnēm, darbs mājās un dārzā. [37]
Uzturam, ko ārsts rekomendē ķermeņa masas mazināšanai, jābūt pilnvērtīgam. Dažu sastāvdaļu izslēgšana nenodrošinās ilgstošu un stabilu ķermeņa masas samazināšanos. Uzturā iesaka uzņemt nepilnus 20% tauku, 50-55% ogļhidrātu un 15-30% olbaltumvielu. [6]
Medikamentoza ārstēšana
Ja ne‑medikamentoza ārstēšana izrādās neefektīva, terapiju papildina ar zālēm. No ķermeņa masu mazinošiem medikamentiem Latvijā ir divi: orlistats un sibutramīns. [10]
Šo medikamentu spēja reducēt ķermeņa masu nav liela, tie vidēji ļauj papildus atbrīvoties no 5-8 kg. Turklāt medikamenta svaru mazinošā ietekme ilgt 4-6 mēnešus, tad iestājas svara dinamikas stagnācija. Pārliecinoši pierādīts, ka ķermeņu masu mazinošie medikamenti veselības stāvokli vislabāk uzlabo tad, ja tos lieto ilgstoši, vismaz divus gadus: daudziem slimniekiem ievērojami mazinās gan aknu iekaisums, gan aknu cirozes un aknu vēža attīstības risks. [10]
Aknu bojājumu mazinoša spēja ir medikamentiem, ko lieto 2. tipa cukura diabēta ārstēšanā, piemēram, metformīnam, rosiglitazonam, pioglitazonam. Metformīns īstermiņā nodrošina svara samazināšanos, mazina insulīna rezistenci un samazina viscerālo tauku daudzumu. Ir pierādīts, ka metformīns samazina NATAS sastopamību un smaguma pakāpi. [38]
Rosiglitazons efektīvi samazina aknu iekaisumu, mazinot insulīna rezistenci, normalizē glikozes un insulīna koncentrāciju serumā, tomēr palielina sirds išēmijas risku. Pioglitazona darbības principi ir līdzīgi, bet nozīmīgi, ka, salīdzinot ar rosiglitazonu, tas samazina asinsvadu bojājuma risku. Būtiski, ka rosiglitazons un pioglitazons palielina ķermeņa masu. [10]
Iekaisumu mazinoša ietekme ir arī statīnu grupas medikamentiem un salicilskābes atvasinājumiem, ko var lietot aknu bojājuma mazināšanai NASH slimniekiem. [10]
Ārstēšanā var lietot arī ursodezoksiholskābi, kas uzlabo asins bioķīmiskos rādītājus, bet nenovērš aknu bojājuma progresēšanu. [10]
Ir pētījumi par aspartāta-ornitīna terapijas efektivitāti NATAS ārstēšanā. [37]
Ja vispārēja rakstura pasākumi un medikamenti nav ļāvuši uzlabot pacienta veselības stāvokli, tad slimniekiem, kam ĶMI ir virs 35 kg/m2 un aptaukošanās dēļ radušies veselības traucējumi, jāapsver jautājums par ķermeņa masu mazinošas operācijas veikšanu. [10]
Pētījums
Epidemioloģiskie pētījumi Eiropā liecina, ka slimības sastopamība ir 20-30% ar tendenci pieaugt. [27] Tas ļauj secināt, ka Latvijā ar NATAS slimo 414 074-621 111 iedzīvotāji. Cilvēkiem, kas slimo ar NATAS, 55-79% gadījumu AlAT un AsAT līmenis var nebūt paaugstināts. [8] Tātad mūsu pētījumā apsekoti 21-45% NATAS slimnieku, kam skaita ziņā atbilst 86 955-279 500 slimības gadījumu.
No visiem cilvēkiem, kas slimo ar taukainu aknu slimību, bez nozīmīgas progresēšanas slimo 80%, kas iedzīvotāju skaita ziņā būtu 331 259-496 889 iedzīvotāji. Slimība ar agresīvāku gaitu konstatēta vidēji 20% gadījumu, kas cilvēku skaita ziņā ir 82 814-124 222 iedzīvotāji. Aknu ciroze attīstās vidēji 5% pacientu, kas slimo ar šo slimību. [10; 29]
Pētījuma mērķis bija apzināt NATAS pacientu sastopamību PSKUS Gastroenteroloģijas centrā pacientiem ar paaugstinātu AlAT un AsAT līmeni.
Metodes
Retrospektīvā pētījumā pēc datiem pacientu slimības vēsturēs tika iekļauti visi pacienti ar palielinātiem aknu bioķīmijas marķieriem (AlAT, AsAT), kuri PSKUS 10. Gastroenteroloģijas nodaļā ārstējušies no 2010. gada 1. janvāra līdz 2011. gada 31. decembrim. Tika apkopota informācija par pacientu dzimumu, vecumu, diagnozi, lietotajiem medikamentiem un alkohola lietošanas paradumiem. Izslēgšanas kritēriji: pacienti, kas atteikušies no izmeklējumiem un ārstēšanas.
Tālākai analīzei pacienti tika sadalīti septiņās grupās pēc diagnozēm: ar žults atteci saistīta patoloģija, vīrusu ģenēzes aknu bojājums, aknu ciroze, onkoloģiskas un hematoloģiskas slimības, taukaina aknu slimība, citas sistēmas slimība, cita aknu patoloģija.
Rezultāti
Tika izskatītas 1804 pacientu slimības vēstures: 884 pacientu slimības vēstures 2010. gadā, 920 pacientu slimības vēstures 2011. gadā. No 2010. gada 884 slimības vēsturēm paaugstināts AlAT un AsAT līmenis tika atrasts 233 vēsturēs, no kurām:
- ar žults atteci saistīts aknu bojājums tika novērots 48 gadījumos (20,6%);
- vīrusu ģenēzes rosināts aknu bojājums - 19 gadījumos (8,2%);
- aknu ciroze - 12 gadījumos (5,2%);
- pacienti ar onkoloģiskiem procesiem - 37 gadījumos (15,9%);
- taukainu aknu slimība - 70 gadījumos (30%);
- diagnoze, kas nav saistīta ar aknu patoloģiju, - 36 gadījumos (15,5%);
- cits iemesls/neprecizēts - 11 pacienti (4,7%).
Visbiežākais iemesls pacientiem ar paaugstinātu AsAT un AlAT līmeni 2010. gadā bijusi taukainu aknu slimība. Otrs biežākais - ar žults atteci saistīts aknu bojājums.
2010. gadā no 70 pacientiem, kam bija paaugstināts AlAT un AsAT līmenis un diagnosticēts kāds no taukainu aknu slimības veidiem, bija 22 sievietes un 48 vīrieši. 2011. gadā no 920 slimības vēsturēm paaugstināts AlAT un AsAT līmenis tika atrasts 310 vēsturēs, sadalījumu grupās pēc noteiktās diagnozes skat. attēlā.
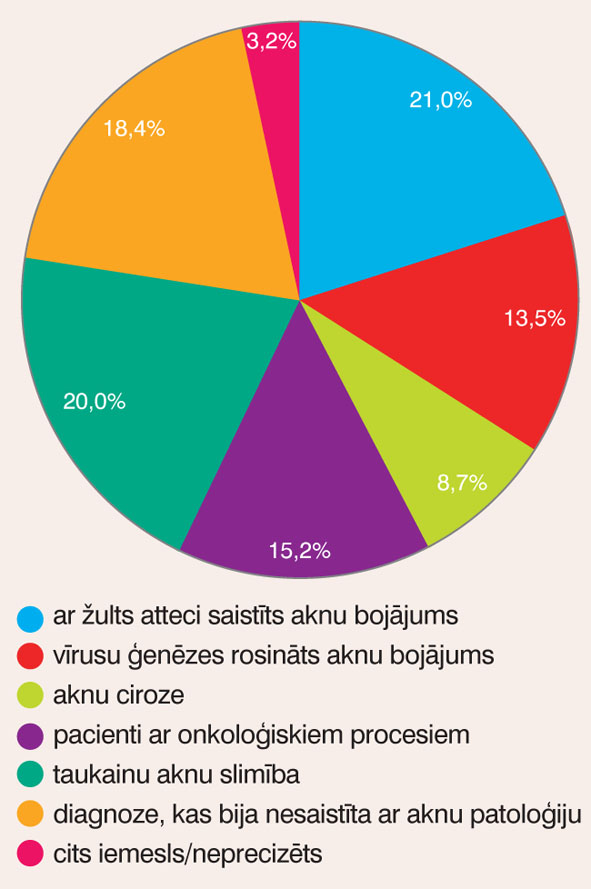

Attēls
Pacientu sadalījums grupās pēc noteiktās diagnozes 2011. gadā
2011. gadā visbiežākais iemesls paaugstinātam AlAT un AsAT līmenim bija ar žults atteci saistīta pataloģija, otrs biežākais - taukainu aknu slimība. 2011. gadā no 62 pacientiem, kam bija paaugstināts AlAT un AsAT līmenis un diagnosticēts kāds no taukainu aknu slimības veidiem, bija 15 sievietes un 47 vīrieši.
Kopā 2010.-2011. gadā ar paaugstinātu AlAT un AsAT līmeni un diagnosticētu taukainu aknu slimību atrastas 37 sievietes (vidējais vecums 57,2 gadi (26-90 gadi)) un 95 vīrieši (vidējais vecums 46,5 gadi (21-80 gadi)). No šīm 37 sievietēm pēc vēstures datu analīzes par alkohola ģenēzes izraisītu taukainu aknu slimību var domāt 5 gadījumos, 17 slimības vēsturēs ir informācija par medikamentu lietošanu, 15 gadījumos nav atrasts neviens aknu bojājuma iespējamais iemesls. No šiem 95 vīriešiem pēc vēstures datu analīzes par alkohola ģenēzes izraisītu taukainu aknu slimību var domāt 47 gadījumos, 20 slimības vēsturēs ir informācija par medikamentu lietošanu, 28 gadījumos nav atrasts neviens aknu bojājuma iespējamais iemesls.
Secinājumi
- Gastroenteroloģijas centrā no 2010. gada 1. janvāra līdz 2011. gada 31. decembrim diagnoze "ne‑alkohola taukainu aknu slimība" nav noteikta nevienam cilvēkam.
- Pēc mūsu iegūtajiem rezultātiem iespējamais slimības sastopamības biežums Gastroenteroloģijas centrā ir 0,006%, bet slimības vidējā sastopamība Eiropā pieaugušu cilvēku populācijā svārstās 20-30% robežās. [27]
- 2010.-2011. gadā ar paaugstinātu AlAT un AsAT līmeni un diagnozē noteiktu taukainu aknu slimību kopā ir 132 pacienti, no kuriem slimības vēstures datos uzrādīts, ka 37 lietojuši medikamentus, 52 lietojuši alkoholu.
- Literatūras avotu dati rāda, ka 55-79% slimības gadījumu AlAT un AsAT līmenis var nebūt paaugstināts. [8] Tātad izanalizētajās slimības vēsturēs apsekoti 11-45% NATAS pacientu, kam skaita ziņā būtu jāatbilst no 86955 līdz 279500 slimības gadījumu.
- Pēc mūsu iegūtajiem datiem NATAS sastopamības biežuma aprēķinos tika iekļauti cilvēki, kas slimo ar taukainu aknu slimību un kam pēc anamnēzes datiem tika izslēgti citi aknu bojājuma cēloņi - medikamenti, alkohols.
- Pēc vēstures datiem nebija iespējams izvērtēt medikamentu iespējamo hepatotoksicitāti, tāpēc visi pacienti, kam pēc anamnēzes datiem tika atrasta medikamentu lietošana, no NATAS sastopamības biežuma aprēķiniem tika izslēgti.
- Pēc vēstures datiem nebija iespējams izvērtēt alkohola patēriņa nozīmīgumu, tāpēc arī šie pacienti no NATAS sastopamības biežuma aprēķiniem tika izslēgti.
- Tāpat pēc vēstures datiem nebija iespējams izvērtēt citu pacientu grupu iespējamo saslimstību ar NATAS kā blakus slimību vai etioloģiju, jo pēc literatūras apskata datiem zināms, ka 5% NATAS slimnieku attīstās aknu ciroze. [10]
- Tas liek domāt, ka uz iepriekš minēto pacientu grupu rēķina slimības sastopamība Gastroenteroloģijas centrā ir lielāka.
- Izvirzītā hipotēze netika pierādīta, un tas, ka Gastroenteroloģijas centrā slimība reģistrēta tik nelielā skaitā, mudina domāt, ka slimības aktualitāte un diagnostikas iespējas ir neskaidras.