Alerģija ir specifiska hipersensitivitātes reakcija, ko ierosina imunoloģiskie mehānismi. Pārtikas alerģija definēta kā sensibilizācija pret pārtikas proteīniem vai pārtikas piedevām. Alerģisku slimību izplatība pieaugusi strauji un turpina augt, Pasaules Alerģijas organizācijas (WAO) dati liecina, ka tā skar 10—40 % pasaules iedzīvotāju.
Slimību kontroles centrs 2013. gadā veiktajā pētījumā atzīmē, ka no 1997. līdz 2011. gadam pārtikas alerģija bērniem palielinājusies par 50 %. Straujo alerģisko slimību pieaugums jāuztver kā sabiedrības veselības problēma. Svarīgi ir pārzināt iespējamos atopiju ietekmējošos faktorus, kas predisponē alerģijas attīstībai pirmajos dzīves gados (alerģija ģimenes anamnēzē, barošanas ar krūti ilgums, dzemdību veids, antibakteriālo (a/b) terapijas līdzekļu lietošana pirmajā dzīves gadā).
Biežākā pārtikas alerģija ir imūnglobulīna E (IgE) mediēta, un tā skar jebkuru orgānu sistēmu, ir galvenais anafilakses cēlonis, tāpēc ārstēšanas stūrakmens ir savlaicīga diagnostika.
Patofizioloģija


IgE un ne–IgE mediēto alerģisko reakciju izpausmes dažādās orgānu sistēmās
Alerģija tiek iedalīta divās lielās grupās: imūnmediēta reakcija, ko iedala — IgE mediēta, ne–IgE mediēta, jaukta tipa reakcija un šūnu mediēta. Otra grupa — ne–imūnmediēta reakcija, ko iedala: metaboliska, farmakoloģiska, toksiska, cita/idiopātiska.
European Academy of Allergy and Clinical Immunology un WAO klasificē četru tipu hipersensitivitātes reakcijas, no tām IgE mediēta alerģija ir 1. tipa hipersensitivitātes reakcija, ko iedala divās fāzēs. Imūno atbildi mediē T helperi, IgE antivielas, tuklās šūnas un bazofilie leikocīti. Pēc pirmā kontakta ar alergēnu organismā veidojas pastiprināts jutīgums — sensibilizācija (sensibilizācijas fāze). Antigēns piesaistās T helperiem un izraisa IgE antivielu veidošanos. Savukārt IgE antivielas saistās ar tuklajām šūnām audos un bazofilajiem leikocītiem asinīs ar Fc receptoru palīdzību.
Tuklās šūnas var aktivēt arī citi stimuli, piemēram, komplementa komponenti C5a un C3a (anafilatoksīni). Efektoriskajā fāzē, atkārtoti saskaroties ar alergēnu tuklo šūnu un bazofilo leikocītu, virsma degranulējas, atbrīvojas histamīns, serotonīns, prostaglandīni, IL–4, IL–13, kas izraisa vazodilatāciju, kapilāru caurlaidību, gludās muskulatūras spazmas, audu infiltrāciju ar eozinofilajiem leikocītiem. Interesanti, ka viens no olbaltumvielu komponentiem galaktozes–alfa–1,3–galaktoze (pazīstams kā alfa–gal) pēc ērču koduma var izraisīt IgE mediēto atbildreakciju, jo alfa–gal atrodas ērču siekalās.
IgE mediēta alerģiska reakcija pret pārtikas proteīniem vai piedevām var skart jebkuru orgānu sistēmu un izraisīt dažādus simptomus. Visizplatītākās ādas reakcijas ir nātrene, angioneirotiskā tūska, eritēma.
Iespējamie simptomi apkopoti 1. tabulā.
Klīniskās izpausmes
Nātrene, angioneirotiskā tūska un orālais alerģiskais sindroms
Nātrene un angioneirotiskā tūska (ANT) raksturīga gan bērniem, gan pieaugušiem, akūti attīstās biežāk bērniem, hroniskā formā pieaugušajiem. Nātrenei raksturīgi piepacelti, eritematozi izsitumi ar bālu centru, kas niez. Tie var būt dažādu izmēru un dažādās vietās. Parasti nātrene parādās pēkšņi un pāriet stundas laikā, lai gan var saglabāties arī diennakti. ANT skar dziļākus dermas slāņus un zemādu, raksturīgs simptoms ir pietūkums un sāpes, nieze nav raksturīga.
Orālais alerģiskais sindroms ir agrīna pārtikas alerģijas izpausme, vērojama daļai pacientu ar ziedputekšņu alerģiju, lietojot uzturā riekstus, svaigus augļus un dārzeņus. Parādās mutes, lūpu nieze, mēles un mutes gļotādas tūska. Patofizioloģijas pamatā ir putekšņu un augļu proteīnu struktūras līdzība, t.s. krusteniskā reakcija. Cilvēkiem ar alerģiju uz ambroziju ziedputekšņiem pēc banānu vai meloņu ēšanas var parādīties orofaringeālie simptomi. Pacientiem ar ziedputekšņu alerģiju simptomi var rasties, ēdot termiski neapstrādātus burkānus, selerijas vai ābolus (2. tabula). Ādas dūriena tests parasti ir negatīvs uz termiski apstrādātiem produktiem, bet pozitīvs uz svaigu vai saldētu pārtiku.


Mutes dobuma alerģiskais sindroms: krusteniski reaģējošie alergēni
Anafilakse
Vissmagākā reakcija ir anafilakse, kas definēta kā smaga, dzīvību apdraudoša sistēmiska alerģiska reakcija ar akūtu sākumu, elpošanas un/vai kardiovaskulāriem simptomiem, ar/bez ādas un gļotādas izpausmēm. Bērniem novēro 0,1 % gadījumu, pieaugušajiem 0,3 % gadījumu.
Anafilakses reakcija parasti sākas ne vēlāk kā pusstundu pēc saskares ar alergēnu. Zemesrieksti, vēžveidīgie un kvieši biežāk izraisa anafilaksi pusaudžu un pieaugušo vecumā, savukārt govs piens un olas — bērnu vecumā. Ātrākai anafilakses diagnosticēšanai izstrādāti klīniskie kritēriji (3. tabula).


Klīniskie kritēriji anafilakses diagnostikai
Diagnostika
Diagnostikas testus izvēlas pēc anamnēzes datiem un alergēnu paneļus plaši neizmanto. Pirms testu veikšanas rūpīgi jāievāc anamnēze, nepieciešama fizikāla izmeklēšana. Svarīgi noskaidrot visus pārtikas produktus, par kuriem ir aizdomas, izrunāt ēdienu pagatavošanas veidu (vārīts, neapstrādāts, garšvielas u.c.), izzināt simptomu ilgumu un smagumu, iespējamos predisponējošos faktorus (fiziskā aktivitāte, NSPL lietošana u.c.).
Izslēgšanas diētu/pārtikas dienasgrāmatu izmanto, lai apstiprinātu, ka konkrētais pārtikas alergēns izraisa alerģijas simptomus. Uzturā 4—6 nedēļas nelieto produktu, par kuru ir aizdomas, ka tas rada simptomus. Ja pēc divām nedēļām novēro simptomu mazināšanos, tad tests ir pozitīvs. Izslēgšanas diētu var izmantot gan pārtikas alerģijas diagnosticēšanai, gan ārstēšanas efektivitātes novērošanai. Dienasgrāmatā pacients hronoloģiski fiksē visu apēsto un ar ēdieniem novērotos simptomus (4. tabula).


Pārtikas dienasgrāmatas princips
Kopējais IgE
Rāda kopējo antivielu daudzumu asins serumā. Palielināts daudzums neapstiprina diagnozi, tāpēc izmantot šo metodi kā ikdienas diagnostisko metodi nav ieteikts. Kopējais IgE antivielu daudzums var būt palielināts arī nealerģiskas izcelsmes slimību gadījumā (infekcijas, IgE mieloma, bronhopulmonāla aspergiloze, askaridoze, ehinokoku invāzija).
Specifiskais IgE
Ar to mēra alergēnspecifisko antivielu daudzumu asins serumā. Rekomendē veikt, ja ir alerģijas, ko izraisa IgE mediētas reakcijas.
Ādas testi (ādas dūriena tests/ādas aplikācijas tests)
Ādas dūriena testa jutīgums 95 %, specifiskums 60 %. Metodes pamatā ir alergēna ievadīšana epidermā. Reakciju novēro pēc 15—20 minūtēm. Pozitīvu reakciju norāda papulas un eritēmas diametrs > 3 mm. Pozitīvs tests ar papulu > 3 mm var būt klīniski nenozīmīgs, jo pacientam var būt arī konkrētā alergēna panesība. Testu neveic, ja pacients lieto antihistamīnus vai glikokortikoīdu preparātus, tad tests var būt viltus pozitīvs.
Provokācijas testu veic medicīnas personāla uzraudzībā. Pirms testa veikšanas vienu mēnesi raksta pārtikas dienasgrāmatu. Testa laikā pacientam tiek dots alergēns mazā devā, ko pakāpeniski palielina, līdz sasniedz devu, kad parādās simptomi. Ja ir aizdomas par novēlotu reakciju, var izmantot aplikācijas testu. Uz ādas tiek uzlīmēts plāksteris, uz kura ir dažādi alergēni, pēc 48 stundām nolasa ādas reakciju (apsārtums, tūska, papulas, vezikulas).
Atopiju ietekmējošie faktori bērniem
Daži bērni jau piedzimstot var būt sensibilizēti uz dažiem pārtikas alergēniem, tie nelielā koncentrācijā šķērso placentu un stimulē augļa limfocītus. Paaugstinātu IgE antivielu līmeni atrod arī nabassaites asinīs, 20. gestācijas nedēļā augļa mononukleārās šūnas dalās, kas norāda uz augļa imūnsistēmas atbildreakciju.
Alerģija ģimenes anamnēzē
Vairāki pētījumi norāda, ka viens no galvenajiem riska faktoriem alerģisku slimību attīstībai ir iedzimtība. Viļņā veikts pētījums apstiprina, ka divreiz lielāks risks uz sensibilizāciju ir bērniem, kuru ģimenē novērota atopija. Zinātnieki secinājuši, ka mātes pārtikas alerģija ir potenciāls riska faktors bērna pārtikas alerģijai. [8]
Pētot alerģiju ģimenes anamnēzē, atklāts, ka palielināts risks uz alerģisku sensibilizāciju agrīnā bērnībā ir tādu vecāku bērnam, kuriem ir bronhiālā astma (BA). Ja alerģija ir abiem vecākiem, tas ir riska faktors atopiskam dermatītam (AD) un jebkurai alerģiskai slimībai bērnam 2—5 gadu vecumā.
Bērnam ir septiņas reizes lielāks risks saslimt ar zemesriekstu alerģiju, ja kādam no vecākiem, brālim vai māsai ir alerģija uz zemesriekstiem.
Monozigotisko dvīņu gadījumā vienam ir 64 % varbūtība zemesriekstu alerģijas attīstībai, ja otram monozigotiskajam dvīnim ir zemesriekstu alerģija.
Ir maz pētījumu par sakarību starp pārtikas alerģiju un HLA gēnu. Han ar kolēģiem pētīja HLA 1. un 2. klases alēļu asociāciju (HLA–A un B un HLA–DRB1 un DQB1) ar sensibilizāciju pret riekstiem un secināja, ka divas alēles (HLA–B un DRB1) ir palielinātas pacientiem ar alerģiju pret riekstiem. Gēnu predispozīcija saistīta ar alerģiju uz riekstiem, ko asociē ar STAT6. [4]
Barošana ar krūti
Krūts piens satur imunoloģiski aktīvus komponentus: citokīnus, antivielas, laktoferīnu, oligosaharīdus, taukskābes un mātes imūnās šūnas. Tomēr saistība starp barošanu ar krūti un alerģisku slimību rašanos joprojām tiek pētīta.
Daļa pētījumu liecina, ka zīdīšana mazina BA un alerģisku slimību risku, tomēr citi pētījumi to nav apstiprinājuši, pat izteikta hipotēze, ka zīdīšana palielina risku BA un AD attīstībai. Lai gan IgA antivielas, kas ir krūts pienā, nodrošina imunoloģisko aizsardzību, no mātes iegūtās IgM un IgG antivielas, kas veidojas, mātei saskaroties ar antigēnu, zīdainim var radīt hipersensitivitāti pret attiecīgajiem antigēniem.
Pētījumā Somijā pierādīja, ka bērni, kas līdz viena mēneša vecumam baroti tikai ar krūti, ir pasargāti pret pārtikas alerģijas attīstību 1—3 gadu vecumā, bet barošanai tikai ar krūti līdz sešu mēnešu vecumam un ilgāk nenovēroja aizsargājošu efektu pret pārtikas alerģiju. Analizējot apakšgrupas, pierādīja, ka vislabākā aizsardzība novērota bērniem ar alerģiju ģimenes anamnēzē. [12] Pētījumā Zviedrijā pierādīja, ka barošana tikai ar krūti līdz četru mēnešu vecumam un ilgāk samazina sensibilizāciju pret govs pienu un mencām astoņu gadu vecumā. Han ar līdzautoriem atzīmēja, ka 18 mēnešu vecumā alerģija pret govs pienu retāk attīstījās tiem, kurus tikai ar krūti baroja līdz sešu mēnešu vecumam. Taču aizsargājošo efektu pret govs pienu konstatēja arī bērniem, kuri krūts piena vietā saņēma augsti hidrolizētos maisījumus. [4]
Barošana ar krūti ietekmē arī zarnu mikrobiotas sastāvu, atopiskiem bērniem zarnu traktā prevalē Lactobacilli spp. un Bifidobacterium spp., nelielā daudzumā arī Clostridium difficile.
Joneja ar līdzautoriem atzīmē, ka TGF β1 krūts pienā ir zemākā līmenī ar IgE mediētu govs piena alerģiju nekā ar ne–IgE mediētu govs piena alerģiju. Zems TGFβ1 līmenis var samazināt sIgA, rezultātā mazinās gļotādas aizsardzība jaundzimušā zarnu traktā, izraisot pārtikas alergēnu sensibilizāciju un IgE pieaugumu. [5]
European Academy of Allergy and Clinical Immunology un European Society for Paediatric Gastroenterology, Hepatology and Nutrition alerģijas profilaksei rekomendē barošanu tikai ar krūti 4—6 mēnešus, PVO — līdz sešu mēnešu vecumam. Vairākās valstīs nav īpašu ieteikumu saistībā ar alerģijas novēršanu, izņemot rekomendācijas barošanai tikai ar krūti līdz sešu mēnešu vecumam. Izņēmums ir Polija, kur ekspertu komiteja iesaka izvairīties no alerģiskiem pārtikas produktiem mātes diētā.
Dzemdību veids
Pierādīts, ka zarnu mikrobiotas sastāvs alerģiskiem un nealerģiskiem bērniem atšķiras, un tas predisponē turpmāko alerģisko slimību veidošanos. Bērniem, kas dzimuši ķeizargrieziena veidā, mainās zarnu trakta flora — Bifidobacterium spp. un Lactobacillus spp. baktērijas atrodamas mazākā daudzumā, taču Clostridium difficile skaits zarnu florā pieaudzis.
Bjorksten ar kolēģiem uzskata, ka izmaiņas zarnu florā alerģiskiem un nealerģiskiem bērniem var būt saistītas ar citiem faktoriem, piemēram, atopiskām slimībām, zarnu gļotādas īpatnībām un pārmērīgu a/b lietošanu. [2]
Pētījums par 957 bērniem Nīderlandē rāda, ka Clostridium difficile fēcēs viena mēneša vecumā ir risks AD attīstībai, sēkšanai un alerģiskai sensibilizācijai bērna 2—6 gadu vecumā. Pastāv uzskats, ka veiksmīga zarnu trakta kolonizācija ir priekšnoteikums imunoloģiskās panesības veidošanai pret pārtikas alergēniem.
Vairāki pētījumi liecina, ka ķeizargrieziens aizkavē zarnu kolonizāciju, jo bērnam dzemdību laikā trūkst saskares ar vaginālo un perineālo mikrofloru, kas turpmāk var predisponēt alerģiskai sensibilizācijai un alerģisko slimību attīstībai. Rietumeiropas bērniem, kas dzimuši ķeizargriezienā, zarnu trakta kolonizācija var ieilgt līdz sešu mēnešu vecumam.
Ir virkne pētījumu, kur meklēta cēloņsakarība starp dzemdību veidu un govs piena alerģiju. Autori norāda, ka lielāka IgE mediēta alerģija uz govs pienu ir bērniem, kas dzimuši ar ķeizargriezienu. Mākslīgos piena maisījumus pirmajā dzīves gadā bērni saņēma 93 % gadījumu, bet vaginālās dzemdībās dzimušie adaptētos maisījumus saņēma tikai 50 % gadījumu. Bager ar kolēģiem pētījumā apkopoja datus no 1996. līdz 2007. gadam par bērniem, kas dzimuši ar ķeizargriezienu, un secināja, ka tāds dzemdību veids palielina alerģiska rinīta, BA, AD veidošanās risku. [1]
Antibakteriālā terapija pirmajā dzīves gadā
Daudzējādi pētīta hipotēze, ko ierosināja Strachan 1989. gadā, ka infekcija un zarnu trakta kolonizācija aizsargā no atopijas. Daļa autoru uzskata, ka alerģiju biežums saistīts ar salīdzinoši sterilu apkārtējo vidi, kā arī ar retāku saskari ar infekcijas slimībām (t.s. higiēnas hipotēze). [14]
Tomēr infekciju samazināšanās saistīta ar vairākiem faktoriem (vakcīnas un agrīna a/b lietošana pirmajā dzīves gadā), tāpēc mikrobu iedarbības trūkuma dēļ veidojas nosacīti labvēlīgi apstākļi, lai dominētu Staphylococcus aureus un Escherichia coli, kas agrīnā dzīves laikā ietekmē imūnsistēmas līdzsvaru un veidojas tādas alerģiskas slimības kā rinokonjunktivīts, AD, BA, pārtikas alergēnu sensibilizācija.
Higiēnas hipotēzi apstiprina daudzi epidemioloģiski un eksperimentāli pētījumi, antibiotiku lietošana pirmajā dzīves gadā ietekmē bakteriālo floru un veicina Th2 imūno atbildreakciju. Normālos apstākļos baktēriju endotoksīni aktivē Th1 imūnsistēmas atbildi, nomācot Th2 alerģisku atbildreakciju. Sterila vide (Rietumeiropas dzīvesveids) un agrīna a/b lietošana samazina bakteriālo darbību un nomāc Th1 reakciju. Antibiotikas izjauc bakteriālo floru, izraisot Th2 imūnatbildes reakciju. Turklāt a/b nomāc Treg reakciju, kas pastiprina Th2 reakciju. Šo procesu dēļ pieaug alerģisku slimību attīstība.
Tiek uzskatīts, ka alerģisku slimību attīstību palielina plaša spektra a/b lietošana, salīdzinot ar šaura spektra a/b. Jo vairāk a/b kursu, jo lielāks risks govs piena alerģijas un BA attīstībai; astmas risku palielina vismaz viens a/b kurss no dzimšanas līdz diagnozes brīdim.
Ir dati, kas norāda, ka IgE mediētās alerģijas veidošanās saistīta ar mātes a/b terapiju sakarā ar B grupas streptokoku infekciju grūtniecības laikā un ka lielāks risks ir arī priekšlaicīgi dzimušiem bērniem intensīvās terapijas nodaļā, atrodoties sterilā vidē, — zarnu trakta kolonizācija tādiem bērniem ir novēlota. A/b lietošana saistīta ar samazināto Bifidobacterium spp. daudzumu jaundzimušo zarnu traktā pirmajā dzīves mēnesī.
Kusel ar līdzautoriem perspektīvā pētījumā par 198 bērniem neatrada saistību starp a/b lietošanu pirmajā dzīves gadā un BA, AD attīstību dzīves laikā. [7] Savukārt divi lielie pētījumi, ko veica Marra ar līdzautoriem (193 412 un 251 817 bērni) rāda, ka a/b lietošana ir saistīta ar rinokonjunktivīta, AD, BA attīstību. [9]
Terapijas iespējas
Ārstēšanas stūrakmens ir alerģisku, provocējošu faktoru izslēgšana, ādas kopšana un mitrināšana. Tādējādi tiek mazināta nieze un jaunu sakasījumu veidošanās, āda sadzīst. Nedrīkst lietot dušas želejas un ziepes, kas ādu kairina vairāk.
Ādas kopšanā jālieto tikai dermatoloģiski testēti emolienti, krēmi, kas mīkstina un mitrina sausu ādu. Lietojot mitrinošos krēmus, šūnas piepildās ar ūdeni un taukiem, veidojas barjera alergēnu un kairinātāju iekļūšanai ādā, mazinās nieze un izteiktais ādas sausums. Parasti emolienti jālieto katru dienu, 2—3 reizes dienā, no rīta un vakarā, rekomendēts tos lietot ūdens peldes laikā.
Pēc vannošanas uz sausās ādas uzklāj mīkstinošos un mitrinošos līdzekļus (losjonus), tie uzklājami vieglāk un vienmērīgāk. Sakaršana un svīšana veicina ādas niezi, tāpēc rekomendē nēsāt neapspīlētu kokvilnas apģērbu, izvairīties no vilnas, sintētikas. Ja ādas kopšana ar emolientiem ir mazefektīva, lieto glikokortikoīdus. Tos uzklāj tikai uz bojātās ādas rajoniem. Lieto 1—2 × dienā akūtajā laikā, bet ne ilgāk par 7—14 dienām. Ja ādas bojājumi ir plaši un pievienojusies sekundāra infekcija, sistēmiski lieto a/b terapijas līdzekļus. Daudziem bērniem paasinājumu laikā ir izteikta nieze, īpaši naktīs, tad 1—2 nedēļas lieto antihistamīna preparātus.
Nātrene un angioneirotiskā tūska
Nātrenes un ANT ārstēšanas pamatā ir antihistamīnu preparātu lietošana, tiem piemīt laba pretiekaisuma, spazmolītiska, antiserotonīna iedarbība. Smagos gadījumos var izmantot īsu perorālo kortikosteroīdu kursu (piemēram, 0,3—0,5 mg/kg prednizolona 10—14 dienas). Izvēles preparāti ārstēšanai apkopoti 5. tabulā. Akūtu ANT iespējams ārstēt arī ar attīrīto C1 inhibitora koncentrātu (C1 inhibitors/C1 esterāzes inhibitors), kalikreīna inhibitoru (ekalantīdu), bradikinīna inhibitoru (ikatibantu).
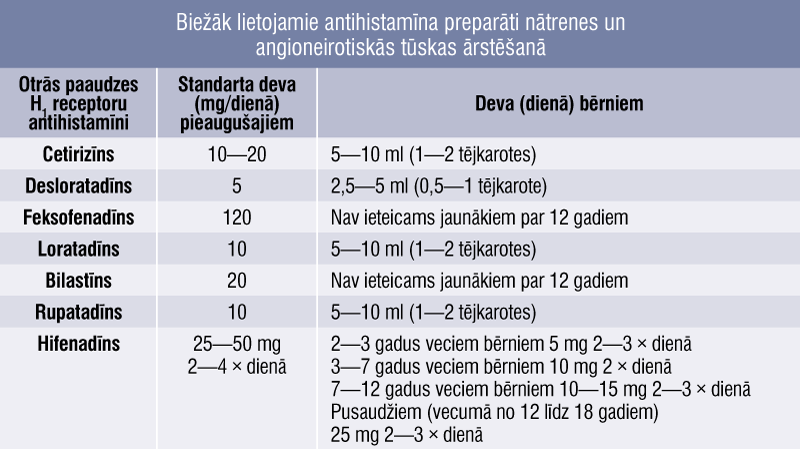

Biežāk lietojamie antihistamīna preparāti nātrenes un angioneirotiskās tūskas ārstēšanā
Perorāla imūnterapija (OIT)
OIT notiek medicīnas personāla klātbūtnē, pamatā ir alergēna ievadīšana ēdienreizēs, devu pakāpeniski ik pēc divām nedēļām palielinot, līdz sasniedz uzturošo devu, ko lieto katru dienu, uzturot desensibilizāciju.
Desensibilizācija notiek, pateicoties IgG sekrēcijas stimulācijai, novēršot alergēna mijiedarbību ar IgE, kas rada alerģisku reakciju. Desensibilizācijas procesā IgE daudzums mazinās. Lai gan vairākos nejaušinātos kontroles pētījumos apstiprināta OIT efektivitāte, šī metode saistīta ar daudzām nevēlamām blakusparādībām. Lielākajai daļai pacientu blakusparādības (orofaringeāla nieze, gremošanas trakta traucējumi u.c.) ir vieglas un izzūd bez ārstēšanas vai perorāli lietojamiem antihistamīna līdzekļiem, tomēr var parādīties nevēlama reakcija, kad nepieciešana epinefrīna deva. Īstermiņā OIT noder dažiem cilvēkiem ar pārtikas alerģijām, taču ilgtermiņa rezultāti ir neskaidri. Dažos klīniskos pētījumos atzīmēts, ka 2,7 % pacientu pēc OIT attīstās eozinofilais ezofagīts.
Anafilakse
Adrenalīns, ko injekcijas veidā (EpiPen) intramuskulāri ievada augšstilba ārējā malā, ir pirmās izvēles preparāts anafilakses gadījumā. Devas: < 6 gadus veciem bērniem ievada 0,15 ml, 6—12 gadus veciem 0,3 ml, > 12 gadus veciem 0,5 ml (maksimālā deva) vai 0,01 ml/kg. Ja attīstās kardiovaskulārās un elpošanas sistēmas simptomi, lieto skābekli 6—8 l/min. Stridora gadījumā ieteicams inhalēt 0,1 % adrenalīnu 4—5 ml.
Bronhu obstrukcijas gadījumā inhalācijās papildus dod β adrenoreceptoru agonistus, piemēram, salbutamolu vai terbutalīnu 2,5 mg. Pacientiem, kurus ārstē ar β adrenoreceptoru antagonistiem un kuri nereaģē uz adrenalīnu vai citu vazoaktīvu vielu injekciju, ieteicams ievadīt glikagonu. Kuņģa—zarnu trakta simptomi (slikta dūša, vemšana, kolikas) jāārstē īpaši. Var apsvērt tādu pretvemšanas līdzekļu kā metoklopramīds, antihistamīna līdzekļi un dimenhidrināts vai serotonīna (5 HTR3) antagonistu (piemēram, ondansetrona) lietošanu. Ja ir tikai angioneirotiskā tūska vai nātrene, lieto antihistamīna preparātus, tomēr, ja ādas simptomi kombinējas ar kuņģa—zarnu trakta simptomiem, nepieciešama adrenalīna deva i/m.
Profilakses iespējas
Pašreizējās vadlīnijās norādīts: ja vismaz vienam bērna pirmās pakāpes radiniekam (vecākiem, brālim, māsai) ir alerģija vai zināma alerģiska slimība anamnēzē (alerģisks rinīts, bronhiāla astma, ekzēma, pārtikas alerģija), bērnam ir lielāks risks pārtikas alerģijas attīstībai. Pētījumi liecina, ka agrīna zemesriekstu, olu vai govs piena ieviešana uzturā var novērst alerģijas veidošanos pret šiem produktiem. Agrīni lietojot zemesriekstus, īpaši bērniem, kuriem ir smaga ekzēma un/vai alerģija uz olas baltumu, panesība līdz piecu gadu vecumam saglabājas 86 % gadījumu.
Nacionālais veselības institūts iesaka zemesriekstus saturošus produktus bērna ēdienkartē ieviest agrīnā posmā (4—11 mēnešos). Vairākos pētījumos apstiprināts, ka bērni, kuriem bija alerģija pret govs pienu un olas baltumu, 69—83 % gadījumu tos panes, lietojot termiski apstrādātā veidā. Pierādīts arī tas, ka ceptas olas un cepts govs piena baltums palielina orālo panesību pret šo produktu nepārstrādātajām formām. Tāpēc šādā veidā pārstrādātu olbaltumu bērna uzturā rekomendē ieviest kā pirmo.
Probiotikas un prebiotikas
Turpmākās alerģijas profilaksei, īpaši AD mazināšanai, WAO iesaka probiotikas lietot tām grūtniecēm un mātēm, kas bērnu baro ar krūti, kuru bērniem ir augsts risks alerģijas attīstībai. Prebiotikas iesaka lietot bērniem, kuri netiek baroti ar krūti un kuriem risks alerģijas attīstībai ir gan augsts, gan zems.
Pierādījumi liecina, ka prebiotiku lietošana mazina BA un atkārtotas sēkšanas risku, šis efekts rodas zarnu mikrobiotas un zarnu gļotādas imūnsistēmas mijiedarbībā. Probiotiku efektivitāte alerģisku slimību profilaksē nav pilnībā pierādīta. Pētījumā par maziem bērniem (6—24 mēnešus veciem) ar atkārtotu sēkšanu un atopiju ģimenes anamnēzē lietoja Lactobacillus spp., netika novērota pozitīva ietekme uz BA vai AD mazināšanos, bet nākamajos sešos mēnešos alerģiska sensibilizācija tika ietekmēta tikai nedaudz.
Cits pētījums ar alerģiskas astmas peles modeli parādīja, ka perorāla L. gasseri lietošana novājina alergēnu izraisītu elpceļu iekaisumu un izraisa IL–17 mediētas imūnās atbildes samazināšanos. Dažos pētījumos, kas veikti ar dzīvnieku modeļiem un paredzēti probiotiku efektivitātes novērtēšanai pārtikas alerģijas novēršanā un ārstēšanā, novēroti pretrunīgi rezultāti. Lactococcus lactis perorāla lietošana septiņas nedēļas sensibilizētām pelēm samazināja alerģisko izpausmi. Pētījums in vitro parādīja, ka, iekšķīgi lietojot probiotiku maisījumu, kas satur astoņus dažādus celmus (Lactobacillus acidophilus, L. delbrueckii subsp. Bulgaricus, L. casei, L. plantarum, Bifidobacterium longum, B. infantis, B. breve, Streptococcus salivarius subsp. thermophilus), labvēlīgi ietekmē peles, kas sensibilizētas uz ovalbumīnu, samazinot simptomu smagumu un Th2 citokīna mRNS ekspresiju, īpaši IL–13, IL–4 un IL–5, tievajā zarnā.
Probiotiku efektivitātes pretrunīgie rezultāti alerģijas profilaksē un ārstēšanā var būt saistīti ar baktērijas celmu neviendabīgumu, terapijas ilgumu un devām.