Zinātniskā revolūcija zāļu atklāšanas un produktu attīstībā biotehnoloģijā, kas notika 20. gadsimta beigās, savu uzvaras gājienu turpina arī 21. gadsimtā. Šobrīd vairāk nekā simt dažādu slimību tiek ārstētas ar biotehnoloģijas palīdzību, turklāt daudzas metodes joprojām ir galvenais atklājums medicīnā. Bioloģisko līdzekļu lietošana strauji paplašinājusies, tos izmanto, piemēram, onkoloģijā, autoimūnu traucējumu, iekaisuma slimību ārstēšanā.
Par bioloģiskajiem jeb biotehnoloģiskiem medikamentiem sauc lielmolekulārus savienojumus, ko bioloģiskos procesos iegūst no dažādu organismu (baktēriju, rauga sēnīšu, kukaiņu, augu vai zīdītāju) šūnām gēnu inženierijas rezultātā ar rekombinētās DNS tehnoloģijas palīdzību. Tā var iegūt, piemēram, citokīnus, plazminogēna aktivētājus, rekombinētos plazmas faktorus, proteīnu maisījumus, enzīmus, hormonus un monoklonālās antivielas. Bioloģiskām zālēm ir dažādi sinonīmi: bioloģiskās zāles, biozāles, biofarmaceitiskās zāles (līdzekļi), tomēr pagaidām par vēlamāko atzītais ir “bioloģiskie medikamenti” kā līdz šim visplašāk lietotais. Bioloģiskās vielas vai no biotehnoloģijām iegūtas zāles (atšķirībā no ķīmiski sintezētām zālēm) ir iegūtas no dzīviem avotiem, piemēram, cilvēkiem, dzīvniekiem vai mikroorganismiem. [1]
Terapeitiskai lietošanai paredzēto biotehnoloģijas produktu klāsts ir ļoti daudzveidīgs: augšanas faktori, citokīni, hormoni, fermenti, asinsreces faktori, monoklonālās antivielas, vakcīnas, DNS vakcīnas, šūnu terapija un audu/orgānu transplantāti. [2]
Bioloģiskās zāles lieto daudzu slimību ārstēšanai, šobrīd šī terapija tiek uzskatīta par vienu no modernākajām terapijas metodēm. Turklāt bioloģiskie medikamenti radikāli mainījuši onkoloģisko slimību ārstēšanu, aizkavējuši vai mainījuši ar imūnsistēmu saistīto slimību gaitu, mainījuši to cilvēku dzīvi, kas slimo ar ar retajām slimībām, un piedāvājuši cerību daudziem pacientiem, kuriem iepriekš nebija efektīvu iespēju viņu stāvokļa ārstēšanai. Bioloģisko zāļu izmantošanas piemēri:
- audzēju ārstēšana,
- reimatoīdais artrīts, ankilozējošais spondilīts,
- Krona slimība un čūlainais kolīts,
- psoriāze,
- cukura diabēts,
- hiperholesterinēmija,
- multiplā skleroze,
- sistēmiskā sarkanā vilkēde,
- ar vecumu saistīta makulas deģenerācija, diabētiska retinopātija,
- pneimonijas profilakse,
- anēmija,
- hroniska migrēna,
- B hepatīts
- hemofīlija,
- respiratorā sincitiālā vīrusa profilakse,
- HPV profilakse,
- vējbaku vīrusa vakcīna,
- augšanas hormona deficīts,
- osteoporoze,
- alerģiska astma,
- neauglība,
- cistiskā fibroze (1. tabula). [3]


Bioloģisko zāļu lietošanas piemēri
Monoklonālās antivielas
Ļoti plaši tiek izmantotas monoklonālās antivielas. Monoklonāla antiviela ir antiviela (olbaltumvielas veids), kas izveidota, lai atpazītu un piesaistītos specifiskai struktūrai (antigēnam) uz noteiktām organisma šūnām.
Kopš 1985. gada aptuveni simt monoklonālo antivielu (mAb) tiek nozīmētas kā medikamenti, turklāt jaunu zāļu reģistrācija turpina pieaugt. Pieejamās mAb ir vērstas pret lielu skaitu antigēnu un tiek izmantotas imunoloģisko slimību un onkoloģisko slimību ārstēšanai. PVO, kas atbild par terapeitisko mAb nomenklatūru, 2017. gadā ziņoja par vairāk nekā 500 mAb nosaukumiem. Monoklonālo antivielu nomenklatūra ir smalki sakārtota un izskaidro to izcelsmi, izmantošanas jomu (2. tabula).
![Monoklonālo antivielu preparātu nosaukuma ģenēze [1]](https://cdn.doctus.lv/media/2021/03/2/original/cb09f6289528.jpg)
![Monoklonālo antivielu preparātu nosaukuma ģenēze [1]](https://cdn.doctus.lv/media/2021/03/2/original/cb09f6289528.jpg)
Monoklonālo antivielu preparātu nosaukuma ģenēze [1]
Piemēram, trastuzumabs kā vēža ārstēšanai izmantojamais un “humanizētais” mabs var tikt identificēts šādi: “tras” ir nosaukuma fragments, kas ir unikāls attiecīgajam mAb proteīnam; “tu” ir atvasināts no tumor = vēzis. [1]
Nomenklatūrā tiek noteikts arī monoklonālo antivielu iegūšanas avots. Pirmās monoklonālās antivielas tika iegūtas no peles vai citiem organismiem (bet ne no cilvēka). Šīs antivielas cilvēka imūnsistēma uztver kā svešas un var radīt alerģiskas reakcijas vai ātri izvadīt no organisma. Lai no tā izvairītos, antivielu daļas var aizstāt ar cilvēka aminoskābju sekvenci vai ar inženierijas palīdzību radīt tīras cilvēka antivielas. [1]
Monoklonālās antivielas mērķis
Katrai monoklonālajai antivielai ir unikāls mērķis, kas tālāk noteiks tās izmantošanu.
Šūnu virsmas antigēns
Mērķis var būt šūnas virsmas antigēns — vēlamais mAb efekts, kas vērsts pret šūnas virsmas antigēnu, un tas var ietvert šūnu virsmas receptora funkcijas bloķēšanu vai mērķa šūnas iznīcināšanu.
- EGFR — epidermālā augšanas faktora receptors. Augšanas faktora receptori, tādi kā EGFR, ir galvenais, ko izmanto audzēja šūnas, lai kļūtu patstāvīgas. Dažos gadījumos mērķa antigēns var būt šūnu virsmas receptors un mAb saistīšanās var bloķēt parasto/fizioloģisko ligandu no receptora saistīšanās, tādējādi traucējot receptora darbību un novēršot šūnu proliferāciju vai izdzīvošanu. Ir monoklonālās antivielas, kas vēršas pret EGFR vai receptoru tirozīna kināzi erbB–2 (sauktu arī par HER2). Spilgtākais piemērs trastuzumabs, kas piesaistās ekstracelulārajam HER2 domēnam, bloķē dabisko ligandu. Lieto HER2 pozitīva metastātiska krūts vēža ārstēšanai. Otrs pārstāvis — cetuksimabs, kas ir himēriska monoklonāla IgG1 antiviela, kas darbojas tieši pret epidermas augšanas faktora receptoriem. To lieto pacientiem ar metastātisku kolorektālo vēzi, galvas un kakla plakanšūnu vēzi.
- CD20 — citos gadījumos mērķis var būt audzēja šūna vai B šūnu klons, kas ražo autoantivielu (piemēram, antitrombocītu antivielu imūnās trombocitopēnijas gadījumā). CD20 ir B šūnu virsmas marķieris, uz kuru mērķtiecīgi iedarbojas mAb, ieskaitot rituksimabu. CD20 atrodas gan uz normālām, gan ļaundabīgām B šūnām, bet nav uz asinsrades cilmšūnām, pro–B šūnām, normāliem plazmocītiem un citos normālos audos. Rituksimaba Fab (fragment antigen–binding) daļa saistās pie B limfocītu CD20 antigēna un Fc daļa var uzņemties imūnā efektora funkciju, lai mediētu B šūnu sabrukšanu. Rituksimabs indicēts ne–Hodžkina limfomas, hroniskas limfoleikozes un reimatoīdā artrīta ārstēšanai.
Plazmas proteīni
Plazmas proteīni, uz kuriem mērķtiecīgi iedarbojas mAb:
- audzēja nekrozes faktors alfa (TNFα). [5] TNFα ir iekaisumu veicinošs citokīns, un tam ir izšķirīga loma hronisku iekaisuma slimību patoģenēzē (reimatoīdais artrīts, spondiloartroze, psoriāze un zarnu iekaisuma slimības). Spilgtākie pārstāvji — adalimumabs un infliksimabs, kas specifiski saistās pie TNF un neitralizē TNF bioloģisko darbību. Infliksimabu izmanto psoriātiskā artrīta, psoriāzes, reimatoīdā artrīta, Krona slimības ārstēšanai. [6] Jāņem vērā, ka klīniskajos pētījumos un pēcreģistrācijas uzraudzībā konstatētas vairākas TNFα inhibīcijas negatīvās sekas: reakcija injekcijas vietā (lokalizēti izsitumi ar dedzināšanu vai niezi), reakcija uz infūziju, neitropēnija, arī infekcijas (tuberkuloze, sēnīšu infekcijas); [7]
![Angioģenēzes process. Izveidojušies jaunie asinsvadi audzēja tuvumā nodrošina to ar augšanai nepieciešamajām uzturvielām [8]](https://cdn.doctus.lv/media/2021/03/2/original/5596232118f3.jpg)
![Angioģenēzes process. Izveidojušies jaunie asinsvadi audzēja tuvumā nodrošina to ar augšanai nepieciešamajām uzturvielām [8]](https://cdn.doctus.lv/media/2021/03/2/original/5596232118f3.jpg)
Angioģenēzes process. Izveidojušies jaunie asinsvadi audzēja tuvumā nodrošina to ar augšanai nepieciešamajām uzturvielām [8]
- vaskulārā endotēlija augšanas faktors (VEGF) — angioģenēzes stimulētājs. Angioģenēze ir procesu kopums, kad no asinsvadiem veidojas jauni kapilāri, un tā prasa saistīšanos ar signalizējošām molekulām, piemēram, ar VEGF. Angioģenēze nepieciešama, lai audzēju nodrošinātu ar skābekli un barības vielām un veicinātu tālāku tā augšanu (1. attēls). [1] Medicīnā izmanto t.s. angioģenēzes inhibitorus, plaši pētītas molekulas, kuru mērķis ir angioģenēzes ceļš. Bevacizumabs, ranibizumabs un ramucirumabs ir monoklonālas humanizētas antivielas, kas paredzētas, lai kavētu VEGF saistīšanos ar receptoriem, inhibētu jaunu audzēja asinsvadu veidošanos, tādējādi kavējot tā metastātisko augšanu. Bevacizumabu plaši izmanto metastātiska kolorektālā vēža ārstēšanai. [8] Bevacizumabs, ranibizumabs anti–VEGF darbības dēļ tiek izmantoti arī acs tīklenes mitrās distrofijas ārstēšanā. Šīs patoloģijas gadījumā ir saauguši jaunveidoti asinsvadi zem tīklenes, tāpēc izteikti pasliktinās redze. Preparātus tad ievada intravitreāli (2. attēls); [1]
![Intravitreālā anti–VEGF injekcija [9]](https://cdn.doctus.lv/media/2021/03/2/original/e11a23e6406f.jpg)
![Intravitreālā anti–VEGF injekcija [9]](https://cdn.doctus.lv/media/2021/03/2/original/e11a23e6406f.jpg)
Intravitreālā anti–VEGF injekcija [9]
- proproteīna konvertāzes subtilizīna/keksīna 9. tips (PCSK9). Zāļu tirgū ir PCSK9 inhibitori — monoklonālās antivielas pret brīvo PCSK9. PCSK9 — ferments, kas atbild par hepatocītu zema blīvuma lipoproteīnu (ZBL) receptoru noārdīšanos. Monoklonālās antivielas, kas inhibē PCSK9, novērš PCSK9 inducēto ZBL receptoru noārdīšanos. Palielinot ZBL receptoru skaitu, tas izraisīs ZBL holesterīna daudzuma samazināšanos serumā. PCSK9 inhibitoru piemēri ir alirokumabs un evolokumabs, kas ir otrās līnijas lipīdu līmeni pazeminošie līdzekļi. Blaknes, ko var izraisīt PCSK9 inhibitori, ir mialģija, tādi neirokognitīvie defekti kā demence un delīrijs. [10]
Šobrīd medicīnā izmanto pretaudzēju medikamentu grupu, t.s. mērķterapijas līdzekļus. Mērķterapija — monoklonālās antivielas un mazmolekulārie inhibitori — pēdējos desmit gados būtiski mainījusi onkoloģisko slimību ārstēšanu. Mērķterapijas līdzekļu piemēri, ko izmanto audzēju ārstēšanā: antivielas pret HER2 receptoriem, antivielas pret VEGF, tirozīnkināžu inhibitori (3. attēls).
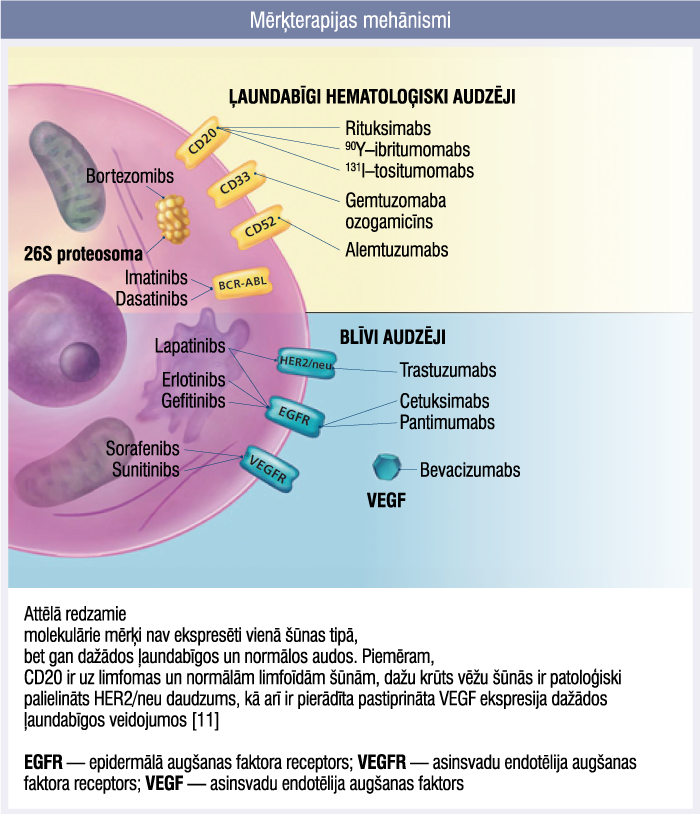

Mērķterapijas mehānismi
Šīs zāles tagad ir terapijas sastāvdaļa daudziem ļaundabīgiem audzējiem (krūts, kolorektālais, plaušu un aizkuņģa dziedzera vēzis, kā arī limfoma, leikēmija un multiplā mieloma). Mērķterapijas darbības mehānismi un toksicitāte atšķiras no tradicionālās citotoksiskās ķīmijterapijas, kas galvenokārt darbojas, inhibējot šūnu dalīšanos, tātad bez vēža šūnām šīs zāles ietekmē arī citas ātri dalošās šūnas (piemēram, matus, kuņģa—zarnu trakta epitēliju, kaulu smadzenes).
Mērķterapija kļuvusi par daudzu onkoloģisko slimību ārstēšanas sastāvdaļu.
Monoklonālās antivielas “uzbrūk” šūnu virsmas receptoriem un antigēniem, bloķējot šūnas membrānas receptoru darbību, kas nepieciešama audzēja attīstībai un augšanai.
Mērķterapija var būt efektīva pacientiem, kuru gadījumiem ir noteikts molekulārais mērķis, taču, ja šāda mērķa nav, tie var būt neefektīvi. Šo atšķirību var ietekmēt pacienta etniskā piederība un dzimums, kā arī audzēja histoloģija. Protams, jāmin šo medikamentu dārdzība, kas var kļūt par svarīgu jautājumu veselības aprūpes ekonomikā. [11]
Mērķis — medikaments
Medikaments, saistoties ar mAb, vairs nespēj nodrošināt savu darbību un būtībā tiek neitralizēts. Piemēram, dabigatrāns tiek neitralizēts, saistoties ar idarucizumabu, humanizētas monoklonālas antivielas fragmentu, kas ir dabigatrānam specifisks pretējas iedarbības medikaments. Idarucizumabs spēj neitralizēt dabigatrāna antikoagulanta iedarbību, ja sākusies spēcīga asiņošana vai notikusi saindēšanās ar dabigatrānu.
Mērķis — infekcijas organisms
Monoklonālās antivielas spēj novērst vai ārstēt specifisku infekciju. Lielākā daļa mAb ir vērstas pret olbaltumvielām uz vīrusa virsmas, tādējādi neitralizējot vīrusu iekļūšanu šūnās.
Piemēram, palivizumabs ir monoklonālā antiviela pret respiratorā sincitiālā vīrusa fūzijas glikoproteīnu; tas kavē vīrusu iekļūšanu saimniekšūnā. [5]
Monoklonālās antivielas var imitēt imūnsistēmas spēju apkarot kaitīgos patogēnus, piemēram, vīrusus. Tāpēc bioloģiskie medikamenti īpaši var noderēt arī dažu jaunu infekcijas slimību ārstēšanā, piemēram, cilvēkiem, kas inficēti ar SARS–CoV–2. Terapijā tiek izmantoti IL–6 inhibitori tocilizumabs, sarilumabs un tiešais IL–6 inhibitors siltuksimabs, kas novērtēti nejaušinātos pētījumos, tomēr rezultāti neapliecina skaidru klīnisko ieguvumu. [12]
Kasirivimabs un imdevimabs ir monoklonālās antivielas, kas īpaši vērstas pret SARS–CoV–2 pīķa proteīnu un paredzētas, lai bloķētu vīrusa piesaisti un iekļūšanu cilvēka šūnās. [13]
Arī daļai vakcīnu šobrīd pamatā ir augsti attīrīts rekombinētais proteīns vai patogēna apakšvienība. Klasisks piemērs rekombinētai proteīnu vakcīnai ir vakcīna pret B hepatītu. Šobrīd zāļu tirgū ienāk dažādas rekombinētās Covid–19 vakcīnas: rekombinētās pīķa proteīna vakcīnas, rekombinētās RBD vakcīnas un vīrusiem līdzīgo daļiņu (VLP) vakcīnas. [14]
Blakusparādības
Monoklonālās antivielas izgatavo, izmantojot rekombinēto biotehnoloģiju. Tie ir bioloģiski medikamenti un var izraisīt vairākas imūnās reakcijas un citus nevēlamus notikumus.
Pacienti, kurus ārstē ar mAb, jāinformē par iespējamām blaknēm un jāsniedz norādījumi, ko darīt situācijās, ja tās rodas.
Lai iegūtu pilnu nevēlamo blakņu aprakstu, katrs medikaments jāanalizē atsevišķi, tāpēc šeit sniegti tikai piemēri:
- reakcija uz infūziju — parasti rodas pirmajās divās stundās pēc infūzijas sākšanas, var ietekmēt jebkuru orgānu sistēmu un izpausties kā viegli kairinoša reakcija injekcijas vietā, nieze, ķermeņa temperatūras paaugstināšanās vai kā potenciāli dzīvībai bīstama anafilakse; [5]
- medikamentu izraisītas hipersensitivitātes reakcijas. Imunogenitāte ir unikālais bioloģisko medikamentu drošuma jautājums. Nevēlama imunogenitāte ir organisma imūnā reakcija pret medikamentu kā antigēnu. Šī reakcija izraisa pretzāļu—antivielu (anti–drug–antibodies) veidošanos, kas var ietekmēt terapeitisko efektivitāti un blakusparādību veidošanos. Visām terapeitiskajām olbaltumvielām ir potenciāls izraisīt antivielu atbildreakciju. Tās intensitāti nosaka pacienta individuālās īpatnības (vecums, imūnsistēmas stāvoklis, pārciestās slimības, blakusslimības, paralēli lietotie medikamenti, ģenētiskie faktori, agrāk saņemtie bioloģiskie preparāti), konkrētā slimība un tās klīniskā gaita, zāļu devas, ievadīšanas ceļš un režīms, kā arī konkrētā bioloģiskā medikamenta ražošanas procesa nianses. Ir vairākas imunogenitātes potenciālās sekas, piemēram, iedarbības zudums vai pastiprināšanās, dabisko olbaltumvielu neitralizācija un vispārēja iedarbība uz imunitāti (alerģija, anafilakse, seruma slimība); [1]
- potenciāls risks infekcijām un autoimunitātei ir pēc jebkuras mAb ievades, kura spēj samazināt imūnās funkcijas, ieskaitot tās mAb, kas vērstas pret B un T limfocītu antigēniem;
- citokīnu atbrīvošanās sindroms — simptomu komplekss, ko izraisa straujā proin-
- flamatoro citokīnu atbrīvošanās no mērķa imūnajām šūnām. Attīstās 1—14 dienās. Simptomi var būt drudzis, galvassāpes, slikta dūša, nogurums, hipotensija, izsitumi, drebuļi, aizdusa un tahikardija. Var novērot aminotransferāžu un bilirubīna līmeņa paaugstināšanos serumā. Dažos gadījumos var rasties diseminēta intravazāla koagulācija. Medikamentu piemēri, kas var izraisīt šo sindromu, — rituksimabs, nivolumabs, blinatumomabs.
- Nevēlamās blakusparādības var būt saistītas arī ar mērķa antigēnu, piemēram:
- cetuksimabs, kas inhibē epidermālo augšanas faktora receptoru (EGFR), var izraisīt dermatoloģisku toksicitāti,
- trastuzumabs, kas nomāc to cilvēka audzēju šūnu proliferāciju, kam ir pārmērīga HER2 ekspresija, var izraisīt kardiotoksicitāti,
- abciksimabs, kas bloķē trombocītu agregāciju, bloķējot trombocītu glikoproteīna IIb/IIIa darbību, var izraisīt asiņošanu. [5]