Iekaisīgu zarnu slimību ārpuszarnu izpausmes. I daļa
Šajā numurā par izpausmēm asinsvados un asinsainā, endokrīnajā sistēmā, plaušās, aknu un žultsizvades sistēmā, aizkuņģa dziedzerī, nākamajā numurā — par izpausmēm balsta un kustību aparātā, ādā, sirdī, acīs, uroģenitālajā sistēmā un CNS. Jāņem vērā, ka šajā tekstā izpausmes nav aprakstītas pēc to sastopamības biežuma.
Ir pilnīgi skaidrs, ka IZS ir viena no sistēmisko slimību grupām, kuras izpausmes primāri skar kuņģa—zarnu traktu, taču plašs ir ārpuszarnu izpausmju spektrs gandrīz visās orgānu sistēmās (tabula). [5] 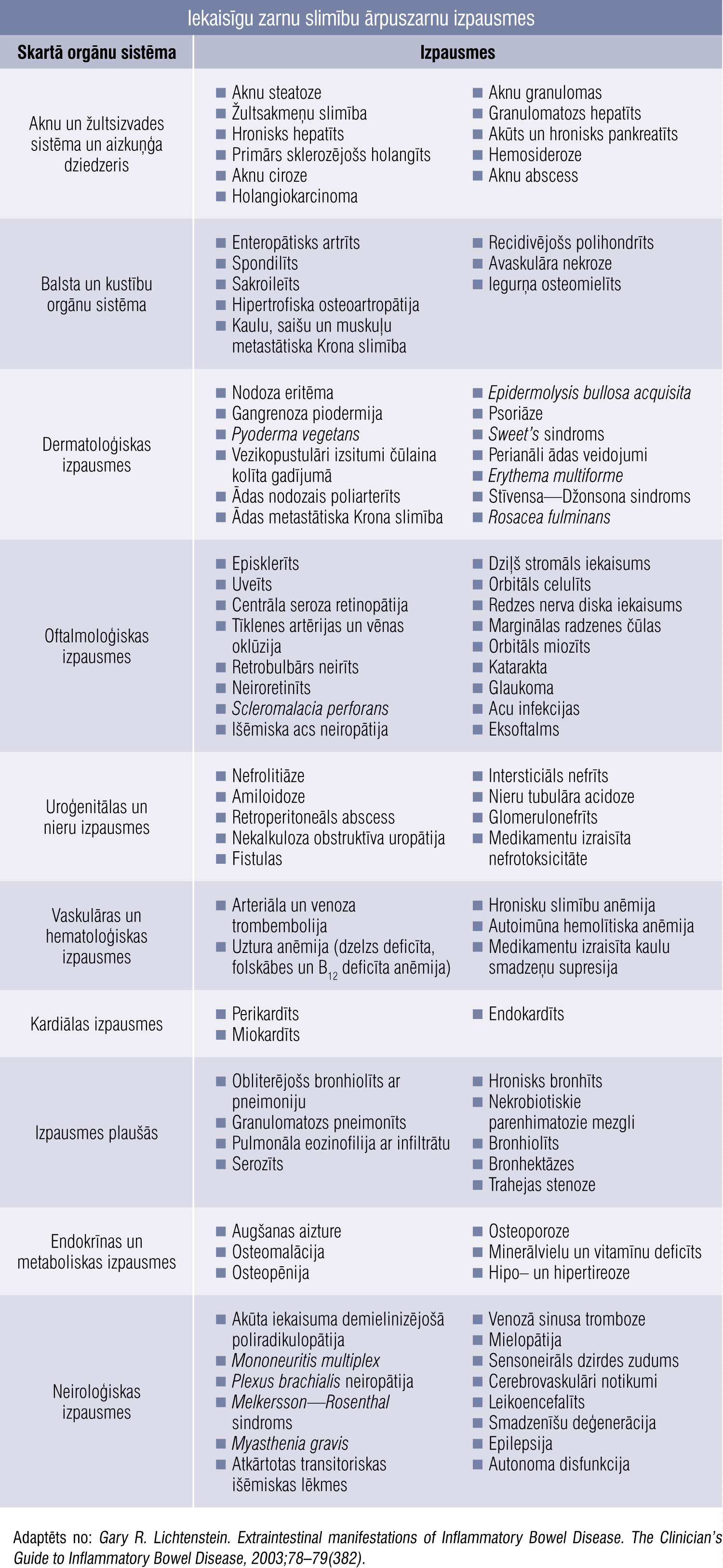

Apmēram pusei pacientu pirms IZS diagnosticēšanas ir kaut viena slimības izpausme ārpus zarnām. Šīs izpausmes negatīvi ietekmē pacienta dzīves kvalitāti, bet dažas, piemēram, primārs sklerozējošs holangīts (PSH) vai venoza trombembolija (VTE), var apdraudēt dzīvību. Ārpuszarnu izpausmju attīstība pieaug līdz ar slimības ilgumu.
Biežāk tās izpaužas Krona slimības (KS) nekā čūlaina kolīta (ČK) pacientiem, īpaši pacientiem ar resnās zarnas KS; dažas no tām, piemēram, irīts/uveīts, biežāk attīstās sievietēm, bet PSH un ankilozējošais spondilīts — vīriešiem. Izpausmes ārpus zarnām lielākoties attīstās paralēli zarnu slimības aktivitātei, izņēmumi ir ankilozējošais spondilīts un uveīts, kā arī (nenoteikti) PSH un pyoderma gangrenosum. [6]
Vaskulāras un hematoloģiskas izpausmes
Anēmija
Bieža izpausme IZS pacientiem. Ir divu tipu anēmijas, kas raksturīgas iekaisīgām zarnu slimībām: dzelzs deficīta anēmija, kas attīstās sekundāri hroniska asins zuduma rezultātā, un hronisku slimību anēmija. [1] Tā kā dzelzs uzsūkšanās notiek divpadsmitpirkstu zarnā, tad Krona slimības pacientiem ar tievo zarnu proksimālās daļas iesaisti patoloģiskajā procesā var būt traucēta enterālās dzelzs uzsūkšanās; tāpēc par-enterāli vai enterāli papildus jāuzņem dzelzs. Vairāki pētījumi rāda, ka ar IZS saistītas anēmijas ārstēšana ievērojami var ietekmēt IZS pacientu dzīves kvalitāti. Visiem pacientiem ar anēmiju pirms terapijas sākšanas svarīgi pārbaudīt dzelzs rezerves, kobalamīnu un folskābes līmeni, asinsainu, feritīnu. [5]
Dzelzs deficīts ir biežākais anēmijas iemesls IZS pacientiem un var rasties sakarā ar hronisku asiņošanu no kuņģa—zarnu trakta un retāk no samazinātas dzelzs uzsūkšanās tievo zarnu proksimālajā daļā vai (mazākā mērā) no nepietiekamas dzelzs enterālas uzņemšanas. [5]
Anēmiju diagnosticē vairāk nekā pusei IZS pacientu. Anēmijas iemesli var mainīties. Bērniem anēmija sastopama biežāk (ap 70 %) nekā pieaugušajiem (30—40 %). Sijājošā diagnostikā jāizvērtē pilna asinsaina, feritīns serumā un CRO. IZS pacientiem remisijā vai ar vieglu slimības gaitu laboratoriskās analīzes jāizvērtē ik pēc 6—12 mēnešiem. Ambulatoriem pacientiem ar aktīvu slimību analīzes jāizvērtē vismaz reizi trijos mēnešos. Pacienti ar B12 vai folskābes deficīta anēmijas risku (piemēram, tievo zarnu slimība vai rezekcija) jānovēro rūpīgāk. B12 un folskābes līmenis serumā jāizvērtē vismaz reizi gadā un/vai tajos gadījumos, kad ir makrocitoze. Anēmijas attīstības risks saistīts ar slimības aktivitāti, jo asins zudumu un hronisku slimību anēmiju aktivē iekaisuma citokīni. Pilna asinsaina, CRO un feritīna līmenis serumā ir minimālais nepieciešamais, lai noteiktu anēmiju, iekaisuma recidīvu vai dzelzs deficītu agrīnā stadijā. [7]
Trombembolija
Būtisks saslimstības un mirstības iemesls pacientiem ar IZS. Lielā pētījumā, kur analizētas IZS pacientu trombemboliskas komplikācijas, 67 % bija dziļo vēnu tromboze ar vai bez plaušu artēriju trombembolijas (PATE), 20 % cerebrāls infarkts un 15 % arteriāla tromboze. Tipiski, ka arteriāla tromboze novērota pacientiem pēcoperācijas periodā. Lielākajai daļai pacientu, kam attīstījās perifēra venozā tromboze, bija aktīva zarnu slimība (64 %). [5]
Hiperkoagulācijas stāvoklis sastopams vairāk nekā ⅓ IZS pacientu; tomēr šis stāvoklis var palikt nepamanīts līdz trombotiskam notikumam. Trombotisku komplikāciju biežums ir ap 39 %; masīva asiņošana — mazāk nekā 1 % pacientu. Cerebrāli infarkti, dziļo vēnu trombozes, PATE un arteriālas trombozes nav retums. Ziņots arī par vārtu vēnas vai aknu vēnas trombozi, tīklenes venozo trombozi, mezenteriālu venozo trombozi. [3]
Hiperkoagulācijas stāvoklis korelē ar IZS aktivitāti. [4] Iemesli līdz galam nav skaidri, bet tas var būt saistīts ar plazminogēna aktivatora inhibitora, V un VIII faktora, kā arī paaugstinātu fibrinogēna līmeni vai ar pazeminātu V Leidena faktora, antitrombīna III, C un S proteīnu līmeni. [9]
Endokrīnas un metaboliskas izpausmes
Bērniem ar IZS, lielākoties bērniem ar Krona slimību, konstatēta augšanas aizture un aizkavēta dzimumnobriešana. Augums ~40 % bērnu ar Krona slimību un 20 % ar čūlaino kolītu ir zem trešās procentiles. Iemesls ir neadekvāta kaloriju uzņemšana un zarnu malabsorbcija. Augšanas hormona (GH) līmenis asins serumā šai pacientu grupai ir normas robežās, lai gan daži pētnieki aprakstījuši zemu insulīnam līdzīgā augšanas faktora (IGF–1) līmeni serumā. [5]
Osteoporoze
Var attīstīties glikokortikoīdu lietošanas, kā arī traucētas D vitamīna un kalcija uzsūkšanās dēļ. [10] Šiem pacientiem jāveic kaulu blīvuma pārbaude, pacienti ar ievērojami zemu kaulu blīvumu jāārstē ar bisfosfonātiem, D vitamīnu un kalcija preparātiem. [8]
Osteoporozes diagnozi pieaugušajiem vislabāk noteikt pēc T skalas ar vērtējumu < ‑2,5, lietojot radiogrāfisku kaulu densitometriju. Osteoporoze ir lūzumu riska faktors un norāda uz to, ka pacientam jālieto terapijas līdzekļi. [6] Mērķtiecīgas terapijas sākšana jāapsver pacientiem ar zemu kaulu blīvumu un/vai tad, ja pacientam ir papildu riska faktori. Lūzumu prognozēšanas ierīces (FRAX, ar kura palīdzību var aprēķināt lūzuma risku, ja nav tieša BMD mērījuma) var būt lietderīgas, lai noteiktu ārstējamos pacientus. Jāierobežo faktori, kas paātrina kaulu blīvuma samazināšanos. Nepieciešams veikt svaru mazinošus vingrinājumus, atmest smēķēšanu un pārtraukt alkohola lietošanu, kā arī uzņemt adekvātu kalcija daudzumu (1 g/dienā) ar uzturu un/vai papildus.
D vitamīna līmenis jāuztur nepieciešamajās robežās. Parasti papildus jāuzņem ap 1000 SV (25 µg) D vitamīna dienas devā vai vairāk, ja zināms D vitamīna deficīts. Papildu kalcija substitūcija nepieciešama tikai tad, ja kalcijs ar uzturu tiek uzņemts < 800 mg/dienā. Terapija ar kalciju 500—1000 mg/dienā un D vitamīnu (800—1000 SV/dienā) palielina kaulu minerālo blīvumu IZS pacientiem. [6]
Vairogdziedzeris
Divos epidemioloģiskos pētījumos atklāts, ka čūlainā kolīta pacientiem vairogdziedzera slimības attīstās biežāk nekā kontroles grupai. Toties Krona slimības gadījumā hipo– vai hipertiroīdisma gadījumu nebija vairāk, salīdzinot ar kontroles grupu, kaut gan bija daži ziņojumi par Hašimoto tireoidītu Krona slimības pacientiem. [5]
Izpausmes aknu un žultsizvades sistēmā un aizkuņģa dziedzerī
Pēc tam, kad tika aprakstīta aknu steatoze pacientiem ar čūlaino kolītu, atklāja, ka daļa aknu un žultsizvades sistēmas patoloģiju saistītas ar iekaisīgām zarnu slimībām. Lai gan vairāk nekā 50 % IZS pacientu ir izmainīti aknu bioķīmiskie rādītāji, mazāk nekā 10 % no tiem ir aknu slimību klīniskās izpausmes. Kopumā korelācija starp aknu un žultsizvades sistēmas izpausmēm un IZS smaguma pakāpi ir maza.
Aknu steatoze ir biežākā IZS izpausme, to atrod apmēram pusei pacientu, kam veikta aknu biopsija. Vairākos pētījumos pamatots, ka apmēram 33 % no visiem pacientiem ar IZS ir aknu steatoze. [5]
Hronisks hepatīts
Tipisku autoimūna hepatīta ainu atrod vairāk nekā 13 % IZS pacientu (biežāk pacientiem ar čūlaino kolītu, salīdzinot ar Krona slimību). Biežāk attīstās pacientiem, kas jaunāki par 40 gadiem, lielākajai daļai šī slimība ir simptomātiska: drudzis, abdominālas sāpes, anoreksija, ādas nieze un artropātijas. Laboratoriskajos izmeklējumos ir nedaudz vai stipri paaugstināts aminotransferāžu līmenis serumā ar minimāli paaugstinātu sārmainās fosfatāzes un bilirubīna līmeni.
Dažiem pacientiem ir paaugstināts cirkulējošo antinukleāro antivielu (ANA), gludās muskulatūras antivielu un globulīnu līmenis serumā. Kopumā endoskopiska retrogrāda holangiopankreatogrāfija
(ERHP) ir indicēta diagnozes precizēšanai, jo vairāk nekā 40 % gadījumu var būt saistība ar primāru sklerozējošu holangītu (PSH). Retos gadījumos slimība var progresēt līdz aknu cirozei.
Terapijā lieto glikokortikoīdus un azatioprīnu. Atbildreakcija uz terapiju ir līdzīga kā pacientiem ar autoimūno hepatītu bez IZS. Aknu slimība var uzlaboties pēc kolektomijas, kā aprakstīts pacientiem, kam nebija atbildreakcijas uz glikokortikoīdiem un azatioprīnu. [5]
Primārs sklerozējošs holangīts
Jauktas etioloģijas autoimūna hroniska holestātiska slimība, ko raksturo difūzs intrahepatisko un ekstrahepatisko žultsceļu iekaisums un fibroze; to apraksta 3—8 % pacientu ar IZS, kaut gan PSH pacientu skaits var būt lielāks, jo aknu bioķīmiskie rādītāji dažiem pacientiem ar PSH var būt normas robežās. [5]
Neviena medikamentoza terapija neuzrādīja efektivitāti, lai attālinātu aknu transplantācijas nepieciešamību, holangiokarcinomas attīstību vai nāvi PSH vai sīko žultsceļu PSH gadījumā. Lai gan ursodezoksiholskābe (15—20 mg/kg/d) uzlabo aknu bioķīmiskos rādītājus, jāizvairās lietot lielākas tās devas. [6] Antibakteriālo līdzekļu lietošana un endoskopiska žultsvadu dilatācija ar īstermiņa stenta implantāciju būtiski ietekmē pacientu saslimstību un mirstību, saistītu ar recidivējošu holangītu un žultsvadu striktūrām. [5]
Smagākā no PSH komplikācijām ir holangiokarcinoma. Holangiokarcinomas saistība ar čūlainu kolītu pirmoreiz aprakstīta 1954. gadā. Vidējais saslimšanas vecums 40 gadi. Biežāk vīriešiem nekā sievietēm (1,6 : 1). Holangiokarcinoma gandrīz vienmēr attīstās pacientiem ar jau iepriekš attīstījušos PSH. Bieži holangiokarcinoma attīstās ČK pacientiem, kuriem ir pankolīts, ar vismaz 15 gadus ilgu anamnēzi.
Holangiokarcinoma var attīstīties arī pēc proktokolektomijas. Parasti pacientiem ar holangiokarcinomu ir drudzis, sāpes, dzelte un svara zudums. Diagnozi parasti pamato ar datortomogrāfijas un ERHP atradi. Aknu transplantācija kontrindicēta pacientiem ar izplatītu holangiokarcinomu, jo ir liels recidīvu risks. [5]
Kriptogēna ciroze
Skar ap 11 % IZS pacientu. Biežāk attīstās pacientiem ar pankolītu. Autoimūns hepatīts vai PSH ir biežākie cirozes iemesli. Ieteicama pacientu standarta uzraudzība hepatocelulāras karcinomas attīstības ierobežošanai. [5]
Aknu granulomas
Ap 8 % gadījumu IZS pacientiem, biežāk Krona slimības gadījumā. Jāpatur prātā arī citi aknu granulomu iemesli — medikamentu izraisīti, sarkoidoze un tuberkuloze. Klīniskā aina variabla: simptomu var nebūt, biežākā atrade ir hepatomegālija, drudzis un dzelte. Analīzēs 50 % gadījumu var būt paaugstināts sārmainās fosfatāzes un bilirubīna līmenis. Pozitīva terapija iespējama, lietojot glikokortikoīdus vai (dažos gadījumos) veicot zarnu rezekciju. [5]
Granulomatozs hepatīts
IZS gadījumā var būt kā viena no ārpuszarnu izpausmēm Krona slimībai, medikamentu (piemēram, sulfasalazīna) inducētam aknu bojājumam. Granulomatozs hepatīts saistīts ar vairākām slimībām: primāru biliāru cirozi, sarkoidozi, Vegenera granulomatozi, infekcijām vai limfomu. [6]
Medikamentu inducēts aknu bojājums (MIAB)
Attīstās daudziem IZS pacientiem, tāpēc reizi 1—3 mēnešos laboratoriski jākontrolē aknu rādītāji. 5–ASA medikamentu lietošanas gadījumā MIAB nav tipisks un parasti vieglā formā, bet aprakstīti gadījumi, kad 5–ASA grupas medikamenti provocējuši hroniska hepatīta attīstību.
Paaugstināts aminotransferāžu līmenis IZS gadījumā novērots apmēram 10 % pacientu, kas terapijā lieto metotreksātu. Papildu riska faktori aknu slimības attīstībai (aptaukošanās, alkohola lietošana u.c.) palielina metotreksāta inducētu aknu bojājumu. [6]
Retākas izpausmes
Ir vairākas retākas izpausmes aknu un žultsizvades sistēmā IZS gadījumā. Nekrotizējošs arterīts saistīts ar ČK un var uzlaboties pēc kolektomijas. Hemosideroze ir retāka IZS izpausme, to novēro pacientiem, kam bijušas atkārtotas asins transfūzijas. Aknu abscesu veidošanās aprakstīta pacientiem ar fistulizējošu Krona slimību. [5]
Izpausmes plaušās
Izmaiņas plaušu funkcionālajos testos perspektīvos pētījumos konstatētas ap 60 % IZS pacientu. Vairāk ietekmēta plaušu funkcija ir IZS pacientiem ar aktīvu zarnu slimību. IZS izpausmes plaušās biežāk attīstās čūlainā kolīta pacientiem. [5]
Atrasta saikne starp IZS un hronisku obstruktīvu plaušu slimību. Intersticiāla pneimonija, asociēta ar IZS, ir biežākais organizējošās pneimonijas veids. Infekcijas vai medikamenti (salicilāti, metotreksāts, tiopurīni, antiTNF–alfa u.c.) var izraisīt parenhimālo plaušu slimību.
Visbiežākā izpausme plaušās IZS gadījumā ir medikamentu inducēta plaušu slimība, biežāk saistīta ar 5–ASA vai metotreksātu. Salicilāti (piemēram, sulfasalazīns) izsauc dažādus intersticiālo plaušu slimību veidus. Biežākie simptomi ir elpas trūkums, drudzis, sāpes krūškurvī un klepus. Perifēru eozinofiliju atrod gandrīz pusē gadījumu. Metotreksāts var izsaukt smagu hipersensitīvu pneimonītu vai plaušu fibrozi. Granulomatozs iekaisums, kas līdzīgs sarkoidozei, aprakstīts pacientiem, kas terapijā lietoja antiTNF–alfa. Paradoksālais iekaisums reducējās pēc antiTNF–alfa lietošanas pārtraukšanas un/vai steroīdu lietošanas.
Visos aizdomu gadījumos jāizslēdz medikamentu inducēta plaušu slimība. Pacientiem, kas terapijā lieto salicilātus vai metotreksātu, ir pamatoti uzskatīt šos medikamentus par iespējamu plaušu slimības cēloni un laikus atcelt. Lielākā daļa elpceļu sistēmas patoloģiju, kas saistītas ar IZS, labi reaģē uz terapiju ar kortikosteroīdiem. Veids, kādā tiek nozīmēts medikaments, atkarīgs no skartā elpceļu sistēmas rajona.
Terapija
Inhalējamie kortikosteroīdi (budezonīds un beklometazons) ir pirmās rindas izvēles medikamenti pacientiem ar lielo elpceļu bojājumu. Sistēmiskos kortiko-steroīdus lieto plaušu parenhimatozā bojājuma un lielo elpceļu iesaistes gadījumā, ja ir rezistence pret inhalējamiem kortikosteroīdiem. Inhalējamie kortikosteroīdi var būt neefektīvi sakarā ar nepietiekamu difūziju ar sekrētu pildītos elpceļos; tad var līdzēt izsmidzināmie kortikosteroīdi.
Pacientiem ar rezistenci pret steroīdiem vai tad, ja plaušu slimība ir refraktāra, atkarīga no lielām steroīdu devām, nepieciešama terapija ar imūnmodulatoriem un/vai bioloģiskiem medikamentiem. Ir pierādīta antiTNF–alfa medikamentu efektivitāte pacientiem ar plaušu bojājumu, kas saistīts ar KS. [6]
Serozīts
Tā pamata izpausme parasti ir pleiroperikardīts, bieži saistīts ar izsvīdumu pleiras dobumā un perikardā. Parasti novēro zarnu slimību paasinājuma reizēs. Terapijas pamatā ir glikokortikoīdi (sistēmiskie vai inhalatoru veidā). Dažos serozīta gadījumos efektīva ir terapija ar NSPL. [5]
Noslēgumā
Lai gan Latvijā IZS izplatības rādītājs ir zems, pacientu skaits pakāpeniski pieaug. P. Stradiņa KUS statistikas dati uzrāda 18—44 gadus vecu Krona slimības pacientu pieaugumu stacionārā, vecumā pēc 60 gadiem — čūlainā kolīta pacientu skaita palielināšanos. Lai nodrošinātu rūpīgu pacientu uzraudzību, nepieciešams profesionāls daudzdisciplīnu komandas darbs.
Kopš 2017. gada jūnija P. Stradiņa KUS Gastroenteroloģijas, hepatoloģijas un uztura terapijas centrā katru nedēļu notiek iekaisīgu zarnu slimību konsiliji (vadītājs asoc. prof. Aldis Puķītis), kur katra pacienta aprūpi izvērtējam individuāli, saskaņojam ārstēšanas plānu un medikamentu terapeitiskās uzraudzības iespējas.
Literatūra
- Garcia-Erce JA, Gomollon F, Munoz M. Blood transfusion for the treatment of acute anaemia in inflammatory bowel disease and other digestive diseases. World J Gastroenterol, 2009 15(37): 4686–4694.
- Salvarani C, Fries W. Clinical features and epidemiology of spondyloarthritides associated with inflammatory bowel disease. World J Gastroenterol, 2009; 15(20): 2449–2455.
- Singh S, Kumar N, Loftus EV Jr., Kane SV. Neurologic complications in patients with inflammatory bowel disease: increasing relevance in the era of biologics. Inflamm Bowel Dis, 2013; 19(4): 864–872.
- Yoshida H, Granger DN. Inflammatory bowel disease: a paradigm for the link between coagulation and inflammation. Inflamm Bowel Dis, 2009; 15(8): 1245–1255.
- Lichtenstein Gary R. Extraintestinal manifestations of Inflammatory Bowel Disease. The Clinician’s Guide to Inflammatory Bowel Disease, SLACK Incorporated, USA; 2003: 77–112.
- Harbord M, Annese V, Vavricka SR, et al, for the European Crohn’s and Colitis Organisation [ECCO]. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. Journal of Crohn’s and Colitis, 2016; 10(3): 239–254.
- Dignass AU, Gasche C, Bettenworth D, Birgegård G, Danese S, Gisbert JP, Gomollon F, Iqbal T, Katsanos K, Koutroubakis I, Magro F, Savoye G, Stein J, Vavricka S, the European Crohn’s and Colitis Organisation [ECCO]. European Consensus on the Diagnosis and Management of Iron Deficiency and Anaemia in Inflammatory Bowel Diseases. Journal of Crohn’s and Colitis, 2015; 9(3): 211–222.
- emedicine.medscape.com/article/1918545-overview
- emedicine.medscape.com/article/1918545-overview
- link.springer.com/article/10.1007%2Fs001980200108
- reference.medscape.com/medline/abstract/19530506
- reference.medscape.com/medline/abstract/19530507