Heterogēnu kohortu, ko veidoja 188 pacienti ar hronisku C hepatītu (HCV) (lielākoties 1b genotipu), Rīgas Austrumu klīniskajā universitātes slimnīcā ārstēja ar ombitasvīra/paritaprevīra/ritonavīra (Viekirax®) un dasabuvīra (Exviera®) kombināciju, un 12 nedēļas pēc ārstēšanas kursa pabeigšanas 100 % pacientu sasniedza noturīgu virusoloģisko atbildes reakciju (SVR12), lai kāda būtu bijusi iepriekšējā pretvīrusu terapija. Augstais SVR12 līmenis apstiprināja lielisko ombitasvīra/paritaprevīra/ritonavīra un dasabuvīra efektivitāti, par ko jau bija ziņots citos reālās dzīves pētījumos.
Aktualitāte
HCV infekcija ir viens no galvenajiem hroniskas aknu slimības cēloņiem pasaulē un ir saistīta ar aknu fibrozes attīstību un cirozes progresēšanu, portālu hipertensiju un hepatocelulāru karcinomu. [1; 2; 3; 4] PVO aprēķinājusi, ka hroniskas HCV infekcijas izplatība ir apmēram 3 % jeb 130—150 miljoni inficēto pasaulē. [5] HCV infekcijas izplatība Latvijā ir 2,4 %. [6]
C hepatīta vīruss ir mazs vienpavediena RNS vīruss, kam ir seši genotipi un vairāk nekā 50 apakštipi. [7] Pasaulē dominē pirmais genotips (GT), veidojot apmēram 46,2 % no visiem gadījumiem, otrais dominējošais ir GT3 (30,1 %). Centrālajā Eiropā HCV izplatība 1., 2., 3. un 4. genotipam ir attiecīgi 89,2 %, 0,1 %, 9,4 % un 1,3 %. [8]
Primārais HCV terapijas mērķis ir izārstēt infekciju. Noturīga virusoloģiskā atbilde (sustained virological response — SVR) definēta kā serumā neatrodams HCV RNS 12 nedēļas (SVR12) vai 24 nedēļas (SVR24) pēc ārstēšanas kursa pabeigšanas. Līdz 2011. gadam pegilētā interferona α (PegIFN) un ribavirīna (RBV) kombinācija bija apstiprināta terapija pacientiem ar hronisku C hepatītu 24 vai 48 nedēļas ilgai terapijai. Ar šo režīmu pacientiem, kas bija inficēti ar HCV GT1, SVR līmenis bija apmēram 40—50 %, augstāks SVR līmenis (līdz 80 %) tika sasniegts pacientiem ar HCV 2., 3., 5. un 6. genotipu. [9] Nesen, kad tika atklāti tiešās iedarbības pretvīrusa (direct–acting antiviral — DAA) līdzekļi, aizsākās jauna C hepatīta ārstēšanas ēra bez interferona.
Biofarmaceitiska pētniecības kompānija AbbVie izstrādājusi perorālu terapiju bez interferona. Viekirax® ir fiksētas devas tablete, kas satur ombitasvīru (NS5A replikācijas inhibitoru), parataprevīru (NS3/4A proteāzes inhibitoru) un ritonavīru (citohroma P450 inhibitoru). Exviera® ir tablete, kas satur dasabuvīru (NS5B polimerāzes inhibitoru). Klīniskos pētījumos, kur novērtēja pacientus bez cirozes un ar cirozi, secināja, ka 12 vai 24 nedēļas ilgs terapijas kurss, lietojot Exviera® un Viekirax®, ir efektīvs, jo pacienti ar HCV GT1 vai GT4 infekciju sasniedz augstu SVR (> 90 %). [10; 11] Viekirax® un Exviera® kombinācija ar vai bez RBV ir apstiprināta Eiropas Savienībā GT1 hroniskas HCV infekcijas ārstēšanai, arī pacientiem ar kompensētu cirozi. Viekirax®apstiprināts hroniskas HCV GT4 infekcijas ārstēšanai. 2016. gadā Latvijā Viekirax® un Exviera® kombinācija rekomendēta kā pirmās izvēles terapija GT1/GT4 ārstētiem pacientiem ar F3/F4 fibrozes stadiju un pacientiem ar cirozi vai pacientiem pēc transplantācijas.
Trūkst informācijas par ombitasvīra/paritaprevīra/ritonavīra un dasabuvīra izmantošanu ikdienas klīniskajā praksē Baltijas valstīs. [12; 13] Autori ziņo reālās dzīves datus par ombitasvīra/paritaprevīra/ritonavīra un dasabuvīra efektivitāti pacientiem ar hronisku HCV, kuri tiek ārstēti vienā slimnīcā Latvijā.
Materiāli un metodes
Retrospektīvi analizēti dati par visiem pacientiem ar hronisku HCV GT1 vai GT4 infekciju, kuri no 2016. gada janvāra līdz 2016. gada decembrim Latvijas Infektoloģijas centrā, Rīgas Austrumu klīniskajā universitātes slimnīcā ārstēti ar ombitasvīra/paritaprevīra/ritonavīra (Viekirax®) un dasabuvīra (Exviera®) kombināciju. Citu specifisku iekļaušanas vai neiekļaušanas kritēriju nebija.
Ārstēšanas shēma, citu medikamentu lietošana, klīniskais novērtējums un citi medicīniskie lēmumi bija ārstējošā ārsta izvēle pēc vietējām HCV pārvaldības vadlīnijām. Ombitasvīra/paritaprevīra/ritonavīra un dasabuvīraizrakstīšana atbilda apstiprinātajam zāļu aprakstam un Nacionālā veselības dienesta noteiktajiem izrakstīšanas nosacījumiem.
Sociāli demogrāfiskā un klīniskā informācija tika iegūta no pacientu slimības vēsturēm, datu analīzē tika iekļauts dzimums, vecums, medicīniskā anamnēze (HCV genotips, METAVIR fibrozes stadija, iepriekšējā terapija), pašreizējās terapijas ilgums un virusoloģiskā atbilde. Virusoloģiskā atbilde tika definēta kā neatrasts HCV RNS serumā, tā tika novērtēta uzreiz pēc terapijas kursa un 12 nedēļas pēc terapijas kursa pabeigšanas. HCV RNS līmenis tika mērīts Rīgas Austrumu klīniskās universitātes slimnīcas laboratorijā, izmantojot kvantitatīvo polimerāzes ķēdes reakciju.
Datu analīzei izmantoja aprakstošo statistiku ar IBM SPSS programmatūras 22. versiju.
Rezultāti un diskusija
Tika analizēti dati par 188 pieaugušajiem. Lielākā daļa pacientu (98,4 %) bija inficēti ar vienu HVC genotipu — 1b genotipu. Trīs (1,6 %) pacienti bija inficēti ar diviem genotipiem (1b un 4). Aknu ciroze (F4 pēc METAVIR) bija pusei pacientu (54,8 %), trijiem no tiem bija dekompensēta ciroze (datu apkopojums 1. tabulā).
Pētāmā populācija bija heterogēna iepriekšējās terapijas ziņā. 28,2 % bija iepriekš neārstēti pacienti, pārējie bija saņēmuši PEG–IFN + RBV. Visiem pacientiem, kas iepriekš bija ārstēti, bija slimības recidīvs vai nebija atbildes uz iepriekšējo ārstēšanu (1. tabulā).
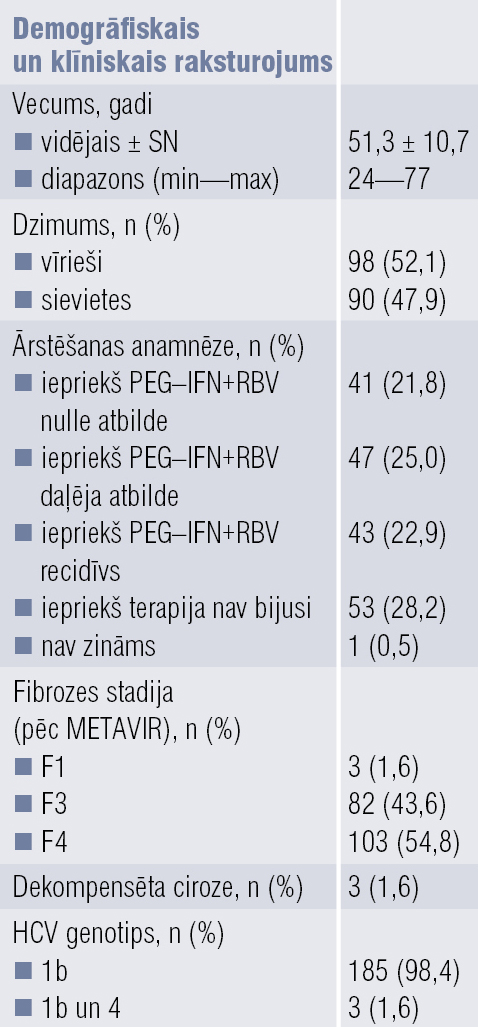

1. tabula
Pētījuma populācijas demogrāfiskais un klīniskais raksturojums
Vidējais terapijas ilgums ar ombitasvīru/paritaprevīru/ritonavīru un dasabuvīru bija 84 dienas (12 nedēļas). Par pieciem pacientiem (2,7 %) trūkst informācijas par virusoloģisko atbildi uzreiz pēc terapijas kursa, par 16 pacientiem (8,5 %) trūkst informācijas par virusoloģisko atbildi 12 nedēļas pēc ārstēšanas pārtraukšanas. Uzreiz pēc terapijas kursa 86,9 % pacientu, kam bija zināma virusoloģiskā atbilde, serumā neatrada HCV RNS. 12 nedēļas pēc terapijas kursa pabeigšanas 100 % pacientu, kam bija zināma virusoloģiskā atbilde, serumā neatrada HCV RNS (2. tabulā). Apakšgrupu analīze uzrādīja, ka SVR12 līmenis ir līdzīgs (100 %) gan pacientiem, kas iepriekš nebija ārstēti, gan tiem, kam iepriekšējā pretvīrusu terapija bija neveiksmīga (attēlā).
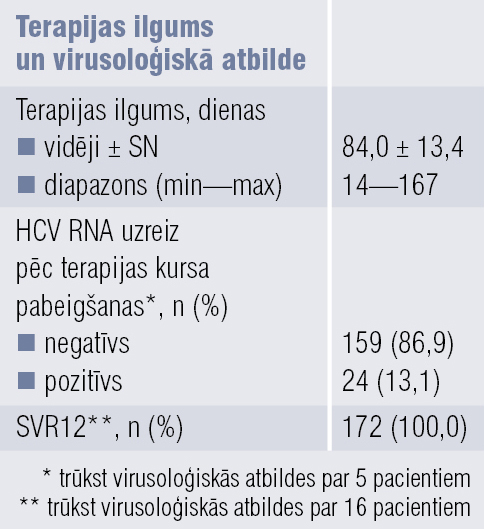

2. tabula
Ombitasvīra/paritaprevīra/ ritonavīra (Viekirax®) un dasabuvīra (Exviera®) lietošanas ilgums un rezultāti
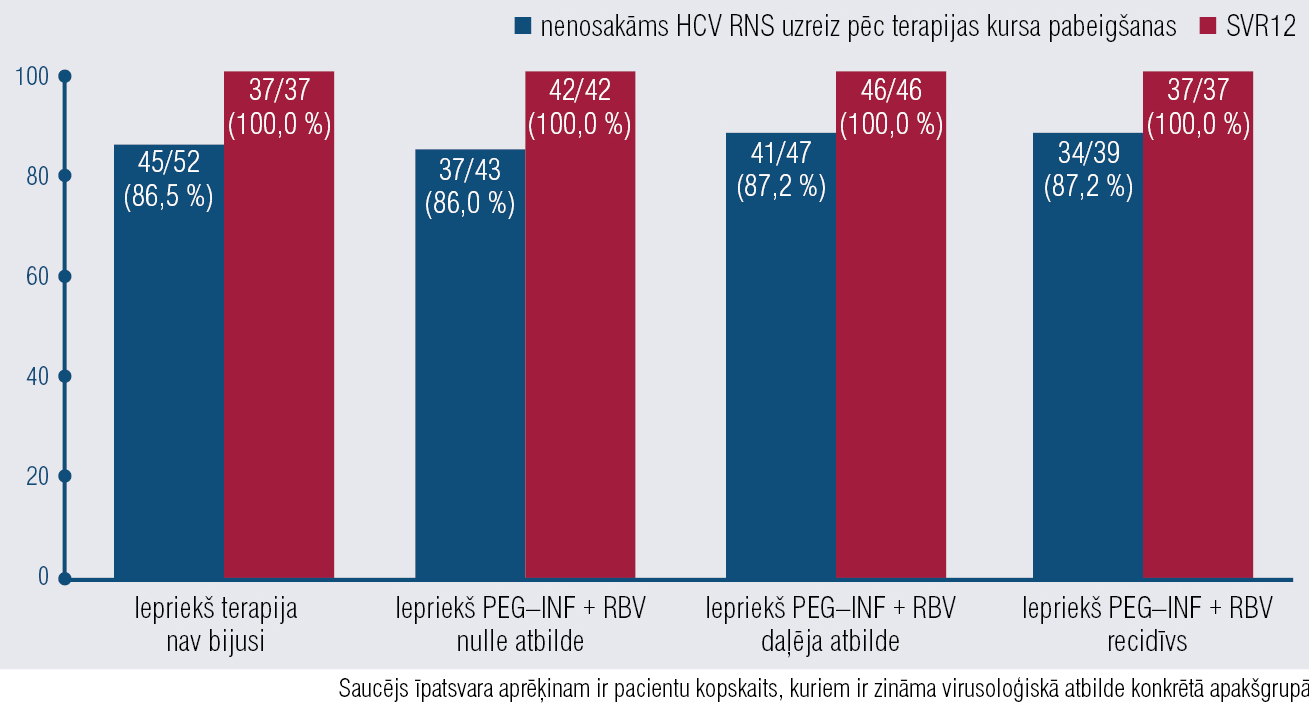

Attēls
Virusoloģiskā atbilde uzreiz pēc terapijas kursa pabeigšanas un 12 nedēļas pēc terapijas kursa pabeigšanas pacientiem ar atšķirīgu iepriekšējās terapijas anamnēzi, n/N (%)
Medikamentu efektivitāte reālajā dzīvē parasti ir mazāka nekā klīniskajos pētījumos, jo pacienti ir dažādi un medikamentus pacienti lieto ne tik disciplinēti kā klīniskajos pētījumos. [14] Tomēr vairākos nesenos reālās dzīves pētījumos dažādās pacientu kohortās un valstīs pierādīta augsta ombitasvīra/paritaprevīra/ritonavīra un dasabuvīra kombinācijas efektivitāte un drošuma profils, kāds novērots klīniskajos pētījumos. 25 publicētu pētījumu meta–analīzē (5158 pacienti) secināts, ka SVR12 līmenis reālajā dzīvē pacientiem ar HCV GT1 un GT4, lietojot ombitasvīru/paritaprevīru/ritonavīru ar vai bez dasabuvīra un ar vai bez RBV, ir stabili augsts (94—98 %) neatkarīgi no cirozes statusa un iepriekšējās HCV terapijas pieredzes. [15] Neseni dati no vienas Latvijas un divām Lietuvas slimnīcām rāda, ka terapija ar ombitasvīru/paritaprevīru/ritonavīru un dasabuvīru ar vai bez RBV ir ļoti efektīva pacientiem, kas inficēti ar HCV GT1 (SVR12 — 98,3 %) un pacientiem pēc aknu transplantācijas ar atkārtotu HCV infekciju (100 %). [12] Šajā pētījumā atklāts, ka kopējais SVR12 līmenis ir 100 %, kas apliecina augsto ombitasvīra/paritaprevīra/ritonavīra un dasabuvīra efektivitāti, kāda aprakstīta arī citos reālās dzīves pētījumos.
Secinājums
Augstais SVR12 līmenis (100 %), kas novērots vienā slimnīcā ārstētajiem pacientiem, apstiprina lielisku ombitasvīra/paritaprevīra/ritonavīra (Viekirax®) un dasabuvīra (Exviera®)kombinācijas efektivitāti pacientiem ar hronisku HCV infekciju reālajā dzīvē.