Klīniskais gadījums
Sākotnēji vesels zēns, dzimis mātei, kurai nav ģenētisku slimību anamnēzē. Jaundzimušais trešajā dzīves dienā tika izrakstīts no slimnīcas labā veselības stāvoklī. Divu mēnešu vecumā bērnam tika ievadīta Bacillus Calmette-Guerin (BCG) vakcīna, pēc kuras netika novērotas komplikācijas vai drudzis.

1. attēls
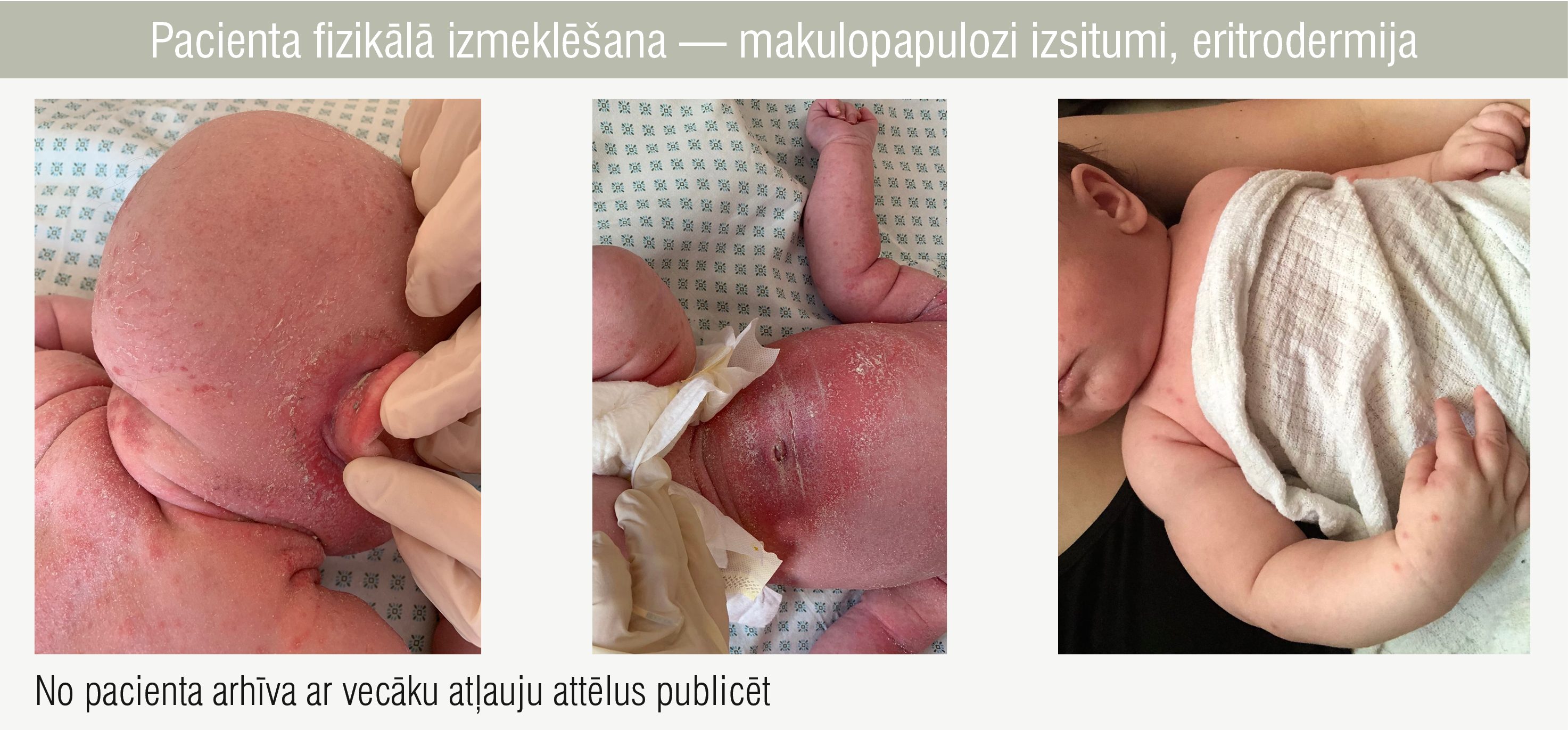
Pacienta fizikālā izmeklēšana — makulopapulozi izsitumi, eritrodermija
2,5 mēnešu vecumā pacients tika stacionēts reģionālajā slimnīcā ar makulopapuloziem izsitumiem, eritrodermiju (1. attēls) un ādas infekcijas pazīmēm padusēs un cirksnī, kā arī pneimoniju. Tika sākta terapija ar klaritromicīnu.

1. tabula
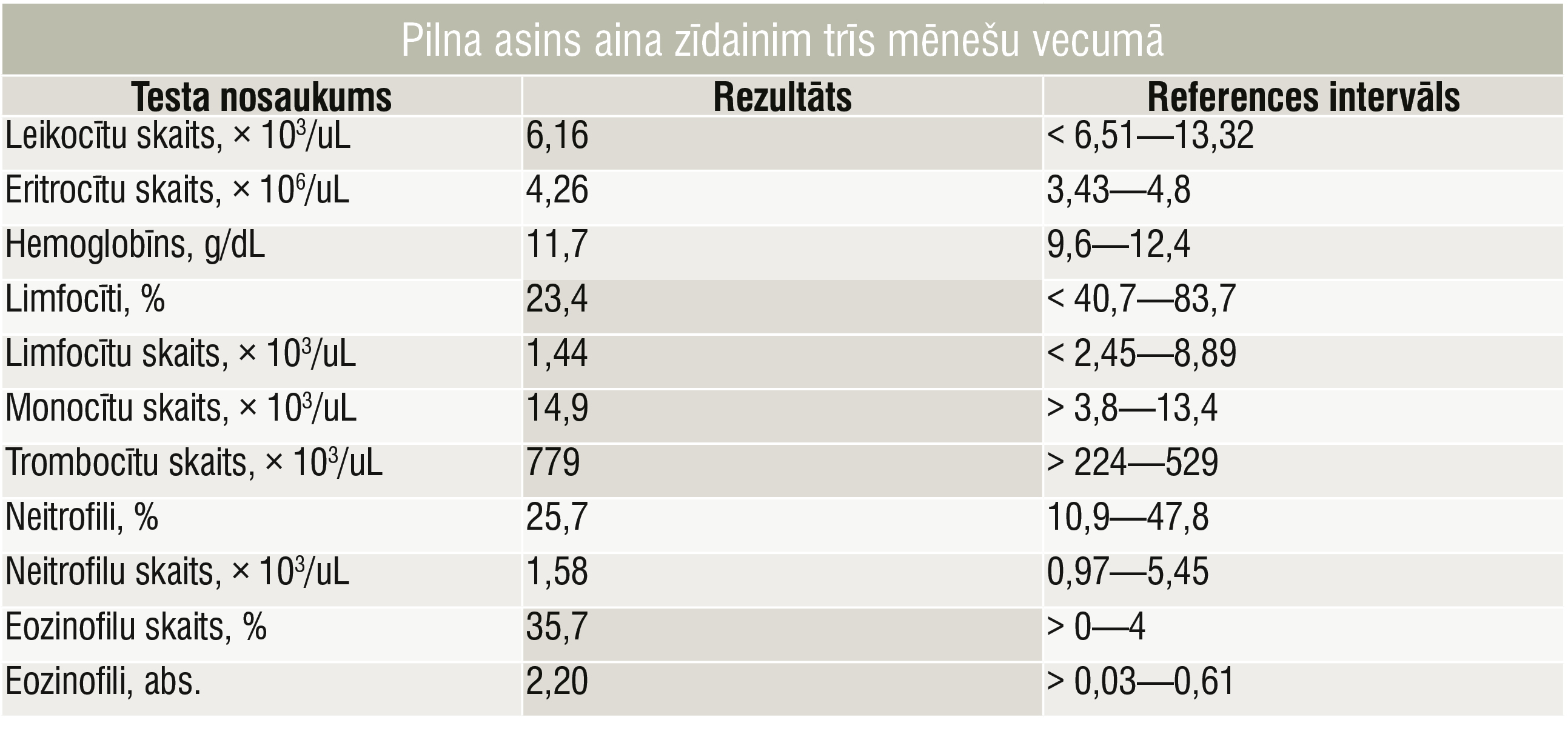
Pilna asins aina zīdainim trīs mēnešu vecumā
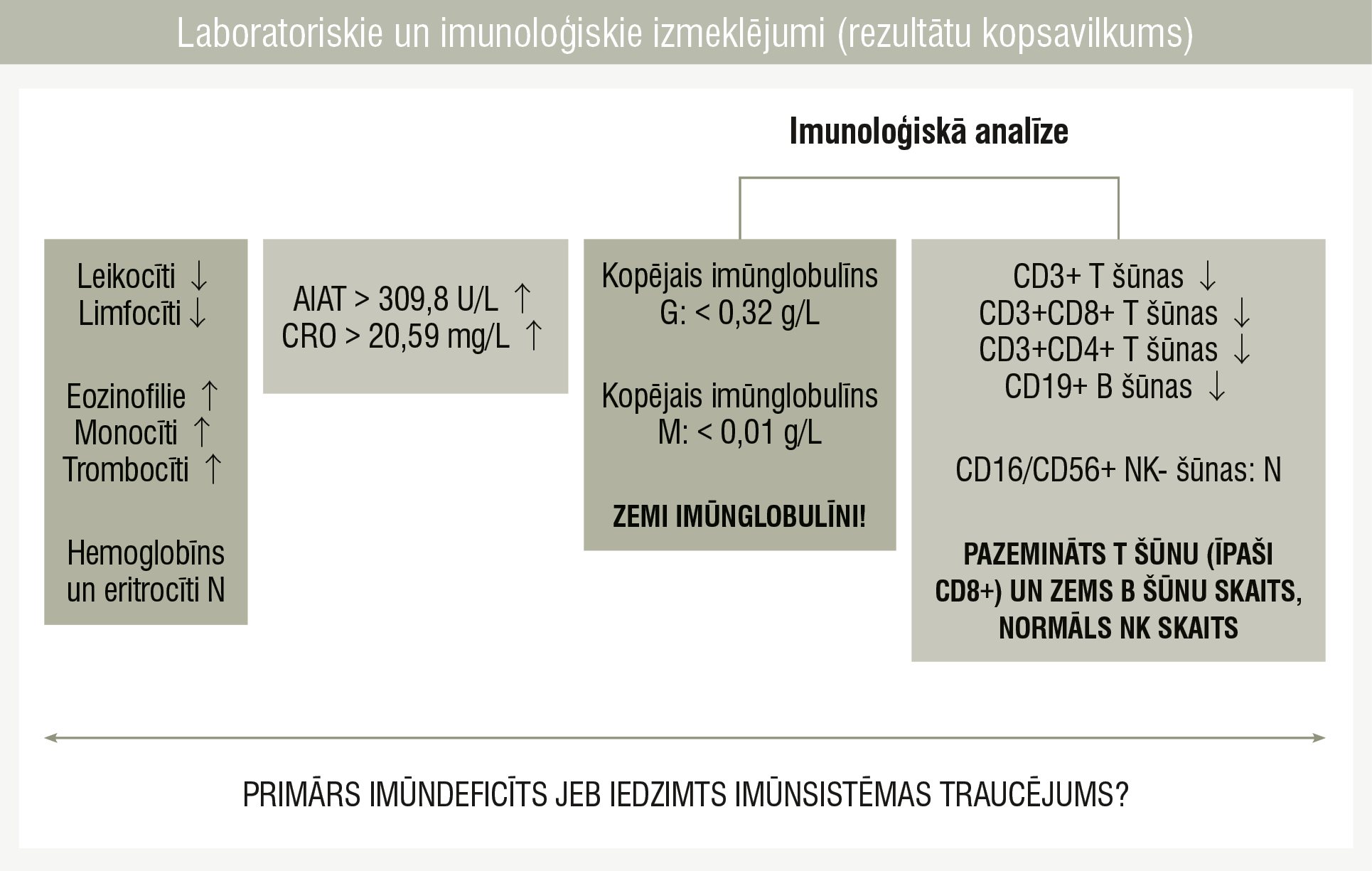
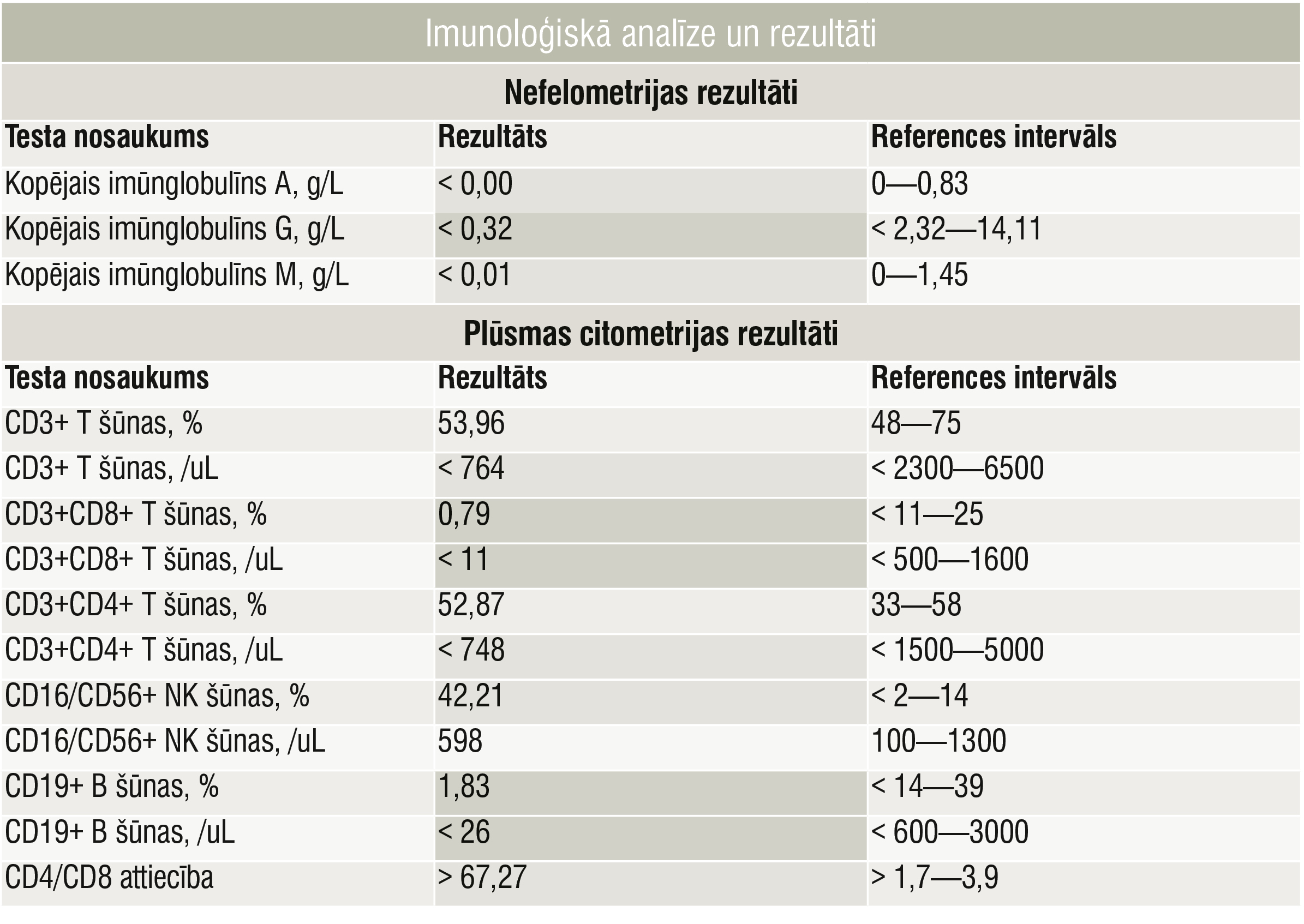
Trīs mēnešu vecumā bērns ar pneimoniju un bakteriālu ādas infekciju (Staphylococcus aureus, Streptococcus viridans) tika pārvests uz Bērnu klīniskās universitātes slimnīcu Rīgā. Terapija: amoksicilīns/klavulānskābe un lokāli antiseptiķi. Vēlāk pacientam parādījās akūta bronhiolīta simptomi (klepus, aizsmakums, sēkšana, elpošana ar palīgmuskulatūras līdzdalību), un tika sāktas inhalācijas ar salbutamolu un budezonīdu. Ņemot vērā atkārtotās respiratorās un ādas infekcijas un šo infekciju smagumu, tika veikta pilna laboratoriskā un imunoloģiskā izmeklēšana (1., 2. tabula un 2. attēls).

2. attēls
Laboratoriskie un imunoloģiskie izmeklējumi (rezultātu kopsavilkums)
Imunoloģiskais profils bija atipisks SKID diagnozei, jo bija konstatējama CD3+ un CD4+ šūnu klātbūtne, taču CD8+ šūnu trūkuma dēļ radās aizdomas par primāru imūndeficītu. Lai precizētu iespējamo iedzimto imūndeficītu, tika nozīmēta ģenētiķa konsultācija ar turpmāku ģenētisku testēšanu. Vienlaicīgi pacientam tika nozīmēta intravenozo imūnglobulīnu ievade infekciju dēļ un profilaktiska antibakteriālā terapija ar trimetoprimu/sulfametoksazolu.

2. tabula
Imunoloģiskā analīze un rezultāti
Tika veikti sekojoši ģenētiskie testi: eksoma sekvenēšana ar PID (primāru imūndeficītu) paneli, hromosomu microarray, QF-PCR un kariotipēšana, kā rezultātā tika konstatēta DCLRE1C gēna 1.—3. eksonu delēcija, kas apstiprināja smaga kombinēta imūndeficīta diagnozi.
Turpmākajos izmeklējumos tika konstatēta iespējama mātes šūnu iedzīvošanās (maternal cell engraftment) (tādēļ jaundzimušajam bija novērojama T šūnu esamība perifērajās asinīs — mātes T šūnas), kas dažkārt novērojama pacientiem ar SKID.
Četru mēnešu vecumā pacientam atkārtojās bakteriālas respiratoras un ādas infekcijas, kā arī pievienojās sēnīšu infekcijas. Saskaņā ar vadlīnijām pacientam nepieciešama alogēna hematopoētisko cilmes šūnu transplantācija.
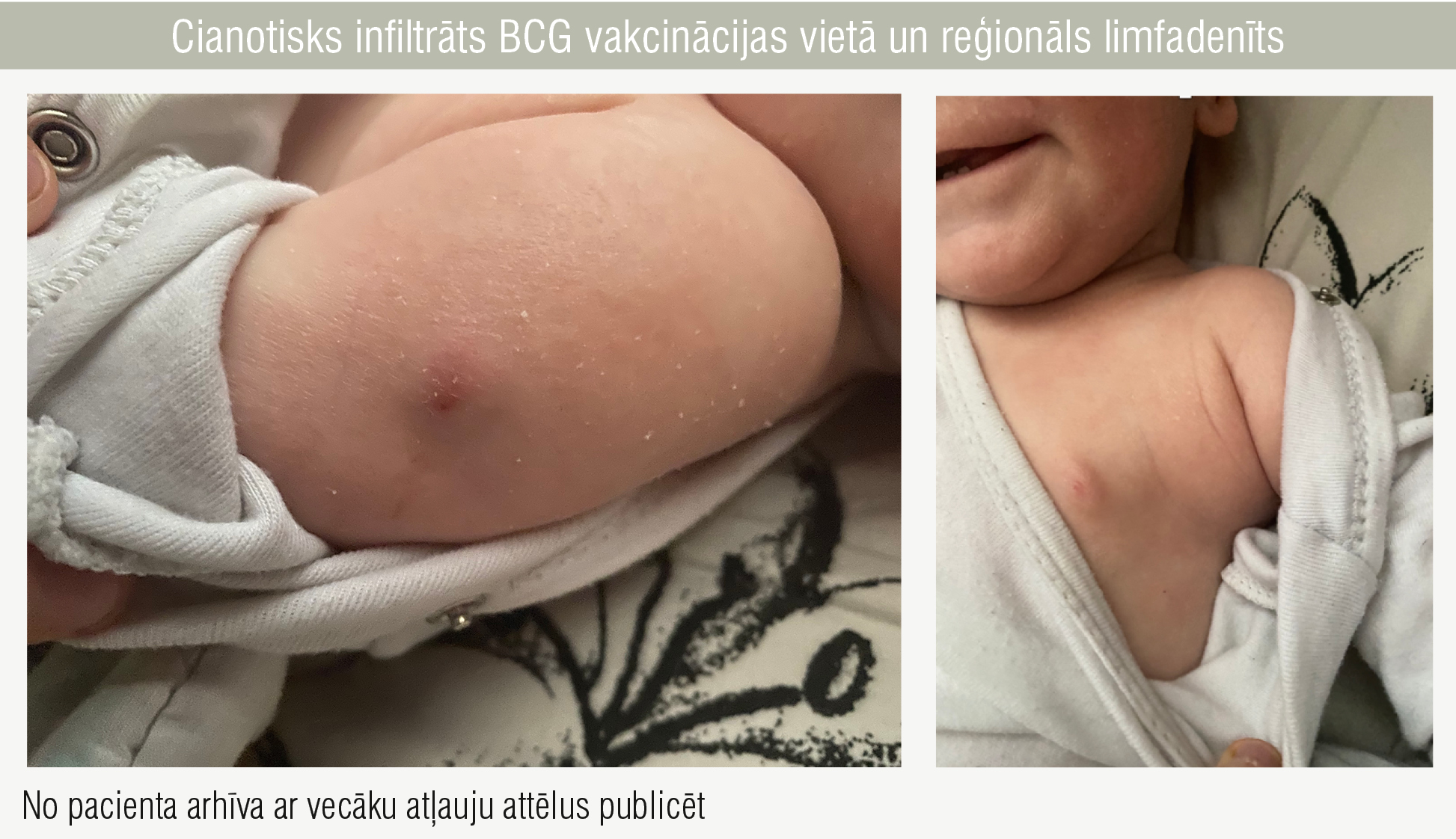

3. attēls
Cianotisks infiltrāts BCG vakcinācijas vietā un reģionāls limfadenīts
7,5 mēnešu vecumā pacientam attīstījās BCG vakcīnas komplikācija — cianotisks infiltrāts augšdelmā vakcinācijas vietā (~ 10 mm) ar reģionālu limfadenītu (3. attēls). MTB DNS analīze fēcēs bija pozitīva, kas apstiprināja ģeneralizētas tuberkulozes infekciju. Terapija: etambutols, levofloksacīns un rifampicīns.
Ņemot vērā, ka Latvijā hematopoētisko cilmes šūnu transplantācijas veikšana SKID pacientiem ir iespējama tikai ar autologām cilmes šūnām un tikai pieaugušiem pacientiem, pacients tika nosūtīts uz Bērnu Onkoloģijas un Hematoloģijas centru Viļņas universitātē Lietuvā, kur pacientam 9,5 mēnešu vecumā tika veikta alogēna hematopoētisko cilmes šūnu transplantācija. Pēc tās sekoja komplicēts atveseļošanās periods.
Pacienta stāvoklis stabilizējās 2,6 gadu vecumā, kam sekoja dinamiskā novērošana pie speciālistiem Bērnu klīniskās universitātes slimnīcā Rīgā un konsultācijas pie speciālistiem Bērnu Onkoloģijas un Hematoloģijas centrā Viļņas universitātē Lietuvā.
Literatūras apskats
Smago kombinēto imūndeficītu incidence dažādās valstīs var atšķirties, taču kopumā to lēš apmēram kā 1 : 50 000. [5] SKID iedala apakštipos: tipiskajā, atipiskajā un Omena sindromā. [6; 12] Tipiskais SKID ir vissmagākā forma ar izteiktu T šūnu defektu, ko izraisa smags patogēnais variants jeb nulles tipa variants gēnā. Tas nozīmē, ka gēnā ir variants, kas pilnībā izslēdz konkrētā gēna funkciju, kā rezultātā nesintezējas funkcionējošs proteīns un T šūnas neattīstās. Atipiskā SKID (literatūrā dēvēta arī par leaky jeb “caurlaidīgo”, daļējo SKID) pamatā ir hipomorfi patogēnie varianti tajos pašos gēnos, kas izraisa tipisko SKID.
Šajā gadījumā varianti gēnos izraisa daļēju, nevis pilnīgu gēna funkcijas zudumu, ļaujot veidoties ierobežotam daudzumam proteīna. Par atipisko SKID sauc arī gadījumus ar atbilstošu klīnisko ainu, bet vēl neatklātiem gēnu patogēnajiem variantiem. [2]
Atipiskā SKID pacientiem var būt arī palielināts vai normāls T šūnu skaits, kas ir viens no iemesliem, kāpēc šo formu klasificē atsevišķi no tipiskā SKID. Tomēr jāņem vērā, ka šo T šūnu funkcionalitāte ir traucēta un tās nenodrošina aizsardzību pret infekcijām.
Turklāt šādas T šūnas var kļūt autoreaktīvas un sāk darboties pret organisma audiem un orgāniem, izraisot dažādas autoimūnas izpausmes, piemēram, limfadenopātiju, hepatosplenomegāliju, matu izkrišanu, ādas izmaiņas u. c. [2; 6]
Omena sindroms ir atipiskā SKID forma, ko raksturo primārs imūndeficīts, eritrodermija, hepatosplenomegālija, limfadenopātija, eozinofīlija, kā arī normāls vai paaugstināts T šūnu skaits un B šūnu trūkums. Vairumā gadījumu Omena sindromu izraisa hipomorfi varianti rekombināciju aktivizējošajos gēnos. Šī sindroma pacientiem organismā ražojas oligoklonālas autoreaktīvas T šūnas, kas nekontrolēti proliferē un izplatās perifērijā, infiltrējot orgānus (aknas, liesu, limfmezglus, ādu, zarnas u. c.) un radot raksturīgo klīnisko ainu. [2; 6; 7; 13]
Ģenētiskais pamatojums
Smagos kombinētos imūndeficītus izraisa izmaiņas gēnos, kas ir būtiski imūnsistēmas attīstībai. Zināmi vairāk nekā 15 gēni (citos avotos — pat ap 20), kas nosaka SKID attīstību.
Aptuveni 80 % gadījumu defekts ir kādā no septiņiem gēniem: IL2RG, RAG1, RAG2, ADA, DCLRE1C, IL7R un JAK3. SKID visbiežāk tiek pārmantots ar X hromosomu saistītā recesīvā (XR) veidā, kā arī autosomāli recesīvā (AR) veidā. Ar X–saistīto SKID pamatā slimo zēni, savukārt meitenes parasti ir varianta nēsātājas. AR pārmantošanas gadījumā slimība skar abus dzimumus ar 25 % varbūtību katram jaundzimušajam. Visbiežāk sastopamais tipiskais SKID ir X–saistītais SKID ar IL2RG gēna variantu. [2; 7; 17]
Varianti RAG1 un RAG2 gēnos biežāk izraisa atipisko SKID vai Omena sindromu. [13]
Klasifikācija


3. tabula
SKID sindromu klasifikācija
Vēsturiski SKID sindromi tiek klasificēti, pamatojoties uz limfocītu apakškopu profiliem (3. tabula).
Šī klasifikācija skaidri demonstrē galveno SKID raksturojošo rādītāju — T šūnu trūkumu. Domājot par SKID un tā izpausmēm, jāņem vērā, ka T šūnas ir nozīmīgas arī B šūnu attīstībā un nobriešanā. Tādēļ pat gadījumos, kad pacientam ar SKID tiek atrastas B šūnas, tās, visticamāk, nebūs funkcionālas un nespēs nodrošināt humorālo imunitāti. Klasificējot SKID, vēlams ņemt vērā arī ģenētisko defektu un atbilstošo molekulāro mehānismu, jo genotips var ietekmēt slimības izpausmes, terapijas izvēli un citus aspektus. [1; 7; 11; 12]
Skrīnings
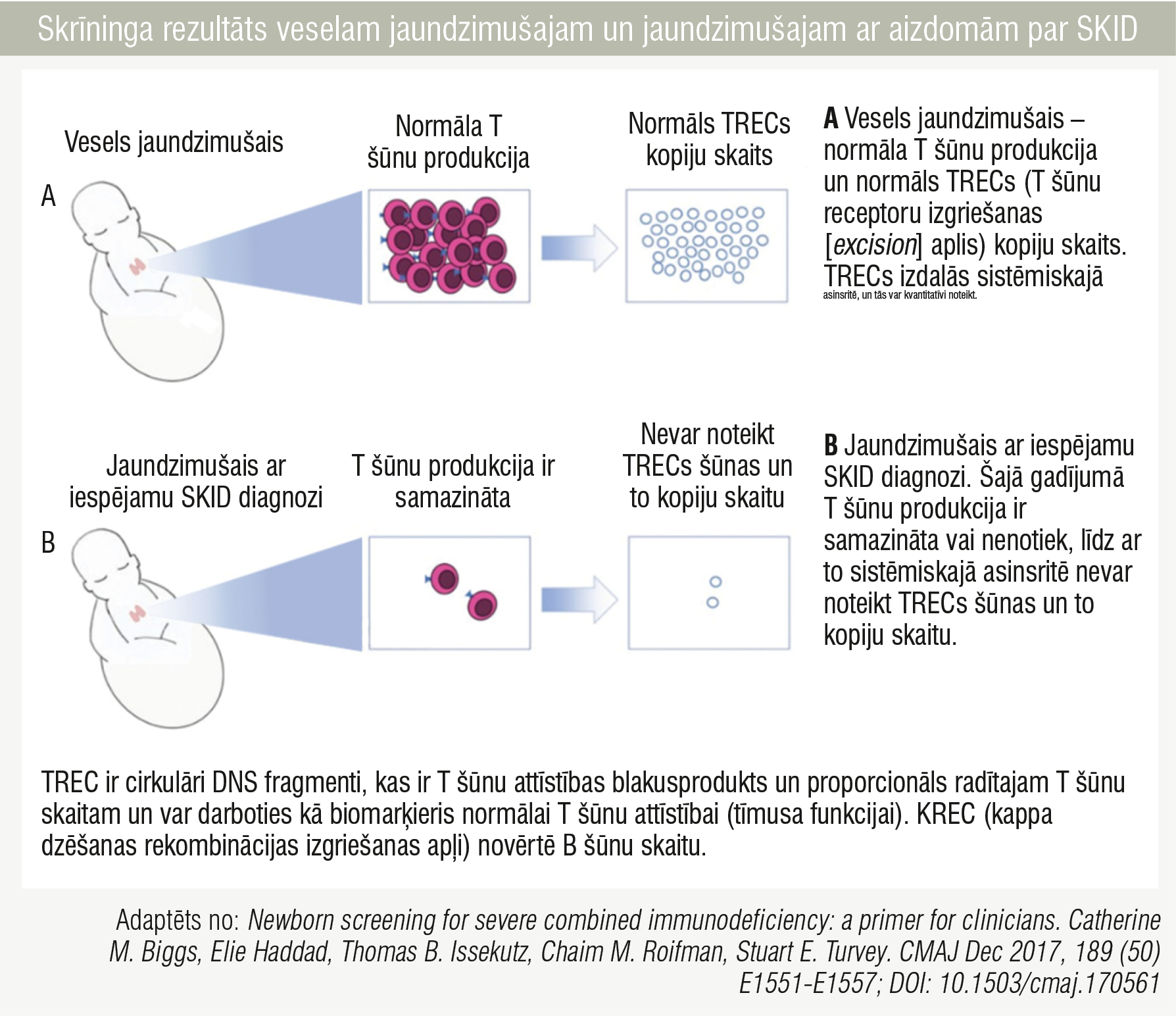

4. attēls
Skrīninga rezultāts veselam jaundzimušajam un jaundzimušajam ar aizdomām par SKID
SKID no 2023. gada 1. aprīļa ir iekļauts Latvijas jaundzimušo skrīningā. Jaundzimušo SKID skrīningu veic, meklējot īpašas DNS daļas (T šūnu ekscīzijas lokusus jeb saīsinājumā TREC), kuras T šūnu veidošanās laikā ražo tīmuss un kuras ir atrodamas vesela jaundzimušā asinīs. Jaundzimušajiem ar SKID asinīs ir samazināts vai nenosakāms TREC daudzums. Līdzīgi TREC noteikšanai notiek arī marķiera KREC noteikšana, kas ļauj secināt par B šūnām. Zems vai neesošs KREC daudzums norāda uz B šūnu attīstības traucējumiem, kas var būt raksturīgi pacientiem ar SKID (4. attēls). [1; 5; 7; 9; 16]
Pozitīva skrīninga gadījumā jaundzimušajiem tiek veikta atkārtota testēšana, pēc tam arī imunoloģiska un ģenētiska izmeklēšana. Laikā no 2023. gada aprīļa līdz 2025. gada jūlijam Latvijā tika testēti aptuveni 45 000 jaundzimušo, no kuriem 11 tika nosūtīti uz konsultāciju pie imunologa, bet pieciem no izmeklētajiem bērniem veikta arī ģenētiskā testēšana. No tiem trīs gadījumos konstatētas ģenētiskas slimības — DiGeorge sindroms un Jacobsen sindroms (ģenētiskie sindromi ar raksturīgu imūndeficītu), tomēr SKID raksturīgie gēnu varianti vēl nav apstiprināti.
Klīniskā aina
Vidējais simptomu parādīšanās vecums tipiskā SKID gadījumā ir aptuveni divi mēneši, bet vidējais diagnozes noteikšanas vecums — 6,5 mēneši. Sākotnēji zīdaiņi ir asimptomātiski, jo pirmajos mēnešos zināmu aizsardzību nodrošina prenatāli no mātes iegūtās IgG antivielas, kā arī zīdaiņiem ir ierobežotāka kontaktēšanās ar infekcijām.
SKID pacienti agrīni saslimst ar atkārtotām un arvien smagākām infekcijām.
Tiek novērotas recidivējošas bakteriālas infekcijas, tostarp pneimonijas, vidusauss iekaisumi un sepse; smagas vīrusu infekcijas, ko izraisa CMV, RSV, enterovīrusi, herpesvīrusi, rotavīrusi u. c.; oportūnistiskas infekcijas, piemēram, sēnīšu infekcijas, tai skaitā Aspergillus un Pneumocystis jirovecii pneimonijas, kā arī persistējoša gļotādas un ādas kandidoze; arī parazitāras infekcijas.
Bērns neaug vai nepieņemas svarā un cieš no recidivējošas hroniskas caurejas. Dažos gadījumos var būt novērojamas arī iedzimtas anomālijas, piemēram, kaulu un skrimšļa bojājumi ADA deficīta gadījumā. [3; 6; 12]
![RTG atradne — tipiska, bet ne absolūta SKID pazīme [12]](https://cdn.doctus.lv/media/2025/11/2/original/b2bb26d62b55.jpg)
![RTG atradne — tipiska, bet ne absolūta SKID pazīme [12]](https://cdn.doctus.lv/media/2025/11/2/original/b2bb26d62b55.jpg)
5. attēls
RTG atradne — tipiska, bet ne absolūta SKID pazīme [12]
Tīmusam ir fetāls izskats, un tas satur entodermālas stromas šūnas, taču tajā nav limfoīdo audu. Par to var pārliecināties ar rentgena izmeklējumu, kurā nav redzama tīmusa ēna (5. attēls). Dažas SKID ģenētiskās formas gan ir saistītas ar radiosensitivitāti, tāpēc rentgena izmeklējumi šiem pacientiem nav ieteicami. [1; 12] Tipiskā SKID gadījumā pacientam var būt hipoplastiskas mandeles un limfmezgli, kā arī vakcinācija ar dzīvām vakcīnām var izraisīt smagas vai pat letālas infekcijas.
Atipiskā SKID un Omena sindroma gadījumā papildus atkārtotām infekcijām un hroniskai caurejai, tāpat kā tipiskā SKID gadījumā, var būt arī hepatomegālija, splenomegālija, limfadenopātija, alopēcija un agrīna difūza eritrodermija, ģeneralizēts dermatīts (pahidermija, deskvamācija). [6; 7; 13] Ādas izmaiņas, piemēram, eritrodermija un ekzēma, nereti tiek novērotas arī tipiskā SKID pacientiem. Šīs ādas izmaiņas rodas bērna imunoloģiskās reakcijas pret mātes audiem dēļ (līdzīgi kā transplantāta pret saimnieku reakcijas gadījumā). Šādu fenomenu dēvē par Omenam līdzīgo (Omenn–like) sindromu, jo tam ir līdzīgs fenotips kā Omena sindromam, taču tas jāatšķir no klasiskā Omena sindroma. Transplantāta pret saimnieku reakciju (GVHR) SKID pacientiem var izraisīt arī neapstarotu asins preparātu pārliešana. [1; 12; 13]
Laboratoriskā aina
Tipiskā SKID gadījumā laboratoriskajā ainā novērojama limfopēnija, kas ir šī sindroma raksturīgais marķieris. T šūnu līmenis ir būtiski samazināts vai tās var būt pilnībā trūkstošas. Dažreiz asinīs nelielā skaitā atrod nenobriedušas T šūnas (CD3-CD2+, CD4-CD8-). Dažos gadījumos asinīs var būt arī mātes limfocīti, kas parasti ir CD8+ un aktivētas T šūnas ar CD25+DR+ marķieriem. Šo fenomenu sauc par transplacentāru mātes T šūnu iedzīvošanos (maternal T cell engraftment), un tas ir viens no tipiskā SKID diagnostiskajiem kritērijiem.
Laboratoriskajā ainā var būt zems B un NK šūnu skaits, bet tas ir atkarīgs no konkrētā ģenētiskā defekta un dažkārt var nebūt tik izteikts. Bieži sastopama hipogammaglobulinēmija ar ļoti zemu IgM un IgA līmeni, kā arī mainīgu, tomēr parasti zemu IgE līmeni. IgG līmenis laboratoriskajā ainā var būt neobjektīvs rādītājs, jo zīdaiņa asinīs saglabājas mātes antivielas.
Atipiskā SKID gadījumā arī vērojama limfopēnija un zems T šūnu skaits, tomēr tas nav tik izteikts kā tipiskā SKID gadījumā. Omena sindroma laboratoriskajā ainā bieži redzams normāls vai paaugstināts limfocītu skaits, kā arī normāls vai paaugstināts leikocītu skaits limfocitozes dēļ. B šūnu daudzums var svārstīties no zema līdz pat pilnīgam to trūkumam, savukārt NK šūnu skaits parasti nav izmainīts. Ir raksturīga eozinofīlija, zems IgM un IgA līmenis, paaugstināts IgE līmenis, kā arī paaugstināti IL4, IL5 un IL13, savukārt IL2 un IFNγ līmenis ir samazināts. Atipiskā SKID un Omena sindroma gadījumā pacientiem sastopamas oligoklonālas T šūnas, kas ir HLA–DR pozitīvas un uzrāda CD45RO fenotipu, kas raksturīgs nobriedušām T šūnām. Normāli zīdaiņu T šūnas nesatur CD45RO, bet gan CD45RA fenotipu (naivās T šūnas), un ir HLA–DR negatīvas. [7; 12; 14]
Diagnostika
Smago kombinēto imūndeficītu (SKID) diagnostika ir uzskatāma par neatliekamu, jo laikus nepamanīta slimība var būt kritiska pacienta izdzīvošanai. Ja rodas aizdomas par SKID, obligāti nepieciešama bērnu imunologa konsultācija. SKID pacientu aprūpē un ārstēšanā svarīga ir multidisciplināra pieeja, kas ietver imunologu, ģenētiķu un neonatologu ciešu sadarbību.
No anamnēzes jānoskaidro informācija par zīdaiņa līdzšinējo augšanu un attīstību, izslimotajām infekcijām, zināmām iedzimtām slimībām un citiem medicīniskajiem stāvokļiem. Tāpat jāprecizē grūtniecības un dzemdību anamnēze, tostarp grūtniecības laikā izslimotās infekcijas, lietotie medikamenti (piemēram, imūnsupresīvi medikamenti), mātes blakusslimības u. c. No ģimenes anamnēzes svarīgi noskaidrot par imūndeficīta gadījumiem vai nāves gadījumiem agrā bērnībā.
Veicot fizikālo izmeklēšanu, īpaša uzmanība jāpievērš ādas stāvoklim, jāpalpē limfmezgli, liesa un aknas, kā arī jāvērtē lielo un mazo anomāliju klātbūtne, kas var liecināt par ģenētiskiem sindromiem. [2; 5]
No laboratoriskajiem izmeklējumiem nepieciešams veikt pilnu asins ainu, limfocītu un eozinofilu absolūtā skaita izvērtēšanu, kā arī Ig līmeņu noteikšanu serumā. Imunoloģiskā izmeklēšana ietver limfocītu fenotipēšanu, subpopulāciju noteikšanu (T, B, NK šūnas un T šūnu subpopulācijas), naivo T šūnu populācijas attiecības izvērtēšanu, T šūnu proliferācijas spējas noteikšanu, T šūnu receptoru analīzi un oligoklonalitātes noteikšanu. Veic arī transplacentāro mātes T šūnu klātbūtnes noteikšanu. Nozīmīga ir arī specifisko antivielu noteikšana asinīs jeb antivielu pārbaude pēc vakcinācijas, jo SKID pacientiem antivielas neveidojas. [9; 11; 12; 14]


4. tabula
SKID diagnostiskie kritēriji
Bioķīmiskos testus izmanto, piemēram, ADA (adenozīna deamināzes) aktivitātes noteikšanai. SKID pacientiem laicīgi jāveic arī HLA tipēšanu, lai sagatavotos hematopoētisko cilmes šūnu transplantācijai. Ļoti nozīmīgi ir ģenētiskie izmeklējumi, kas ļauj identificēt konkrēto patogēno variantu, kas izraisa slimību. Ņemot vērā raksturīgās ādas izpausmes, Omena sindroma diagnostikā liela nozīme ir arī ādas biopsijai. [13]
Ir izstrādāti SKID diagnostiskie kritēriji, kas balstās uz iepriekšminēto izmeklējumu rezultātiem (4. tabula).
Ārstēšana
SKID ārstēšana ir kombinēta un kompleksa. Tā ietver piesardzības pasākumus, piemēram, grūtnieces vakcināciju, lai nodrošinātu zīdaiņa imunitāti pret infekcijām pirmajos dzīves mēnešos, pacienta izolāciju, lai novērstu turpmākās infekcijas, atturēšanos no dzīvo vakcīnu izmantošanas, kā arī krūts barošanas ierobežošanu gadījumos, kad māte ir CMV IgG vai IgM seropozitīva, jo pastāv risks CMV transmisijai uz zīdaini. Asins komponentu pārliešanas gadījumā jāizmanto tikai apstaroti asins komponenti, un asins preparātus drīkst ievadīt tikai no CMV negatīviem donoriem. [6; 12]
Simptomātiskā un profilaktiskā ārstēšana ietver infekciju ierosinātāju identifikāciju un savlaicīgu ārstēšanu, imūnglobulīnu ievadi, Pneumocystis jirovecii pneimonijas profilaksi ar trimetoprimu/sulfametoksazolu, pretsēnīšu profilaksi (flukonazols, vorikonazols, liposomālais amfotericīns B), pretvīrusu profilaksi (aciklovīrs, valganciklovīrs), RSV imūnprofilaksi, enterālu vai parentālu papildu barošanu, lai nodrošinātu pietiekamu kaloriju, uzturvielu un vitamīnu uzņemšanu, kā arī ādas kopšanu. [5; 6; 12]
Omena sindroma gadījumā var tikt izmantoti imūnsupresīvie medikamenti, piemēram, kortikosteroīdi (prednizolons), ciklosporīns A, un atsevišķos gadījumos arī interferons gamma.
Definitīvā jeb galīgā ārstēšana ir hematopoētisko cilmes šūnu transplantācija (kaulu smadzeņu cilmšūnu transplantācija), kas ir ārstēšanas izvēles metode ar pozitīvu iznākumu 70—95 % gadījumu. To nepieciešams veikt pēc iespējas ātrāk, vislabāk — pirms 3,5 mēnešu vecuma, jo agrīna intervence uzlabo prognozi. [4; 6; 10; 12; 16]
Citas definitīvās ārstēšanas metodes ir gēnu terapija un enzīma aizstājterapija. Gēnu terapija galvenokārt piemērota X–saistītā SKID ārstēšanai, bet tiek pētīta un nākotnē varētu tikt lietota arī ADA, RAG2 un JAK3 gēnu variantu gadījumos. Šī terapija balstās uz cilmes šūnu iegūšanu no pacienta kaulu smadzenēm, kurās pēc tam ar vektora palīdzību tiek ievadīts funkcionējošais gēns, un koriģētās šūnas tiek nogādātas atpakaļ organismā. [4; 6; 10; 12]
ADA varianta gadījumā tiek izmantota enzīma aizstājterapija. 2018. gadā apstiprināts medikaments elapegademāze (Revcovi), ko ievada intramuskulāri. [5; 6; 10]
Kad aizdomāties par SKID zīdainim?
Par SKID jāaizdomājas gadījumā, ja:
- atklāta neizskaidrojama limfopēnija,
- bijušas atkārtotas drudža epizodes,
- bērns neaug vai nepieņemas svarā,
- ir hroniska, recidivējoša caureja,
- bijušas atkārtotas kandidozes epizodes, čūlas mutē, vīrusu infekcijas, piemēram, RSV, HSV, gripa u. c.,
- vērojamas infekciozas komplikācijas pēc dzīvo vakcīnu (BCG, rotavīrusa u. c.) ievadīšanas,
- ir bijuši SKID gadījumi vai agrīnas zīdaiņu nāves ģimenes anamnēzē. [12]
Prognoze
Neārstēts SKID ir letāls un visbiežāk noved pie pacienta nāves pirmajā vai pirmajos divos dzīves gados. [4; 8] Ja veikta hematopoētisko cilmes šūnu transplantācija, tā ir veiksmīga līdz pat 95 % gadījumu, un izdzīvošanas rādītāji ir labi, tomēr prognoze atkarīga no transplantācijas veikšanas vecuma, pacienta veselības stāvokļa pirms procedūras un genotipa. Vīrusu infekcijas ir galvenais mirstības cēlonis SKID pacientiem gan pirms hematopoētisko cilmes šūnu transplantācijas, gan pirmajos mēnešos pēc tās. [10; 12; 16]
Pacientiem ar SKID diagnozi ir nepieciešama ilgtermiņa uzraudzība un veselības stāvokļa monitorings visa mūža garumā, kā arī līdz pat 50 % pacientu pēc hematopoētisko cilmes šūnu transplantācijas joprojām nepieciešama imūnglobulīna aizstājterapija. [5]