Var izteikt prognozi, ka straujais neirozinātņu progress un jaunās biotehnoloģijas, kas ienāk 21.gadsimta pētījumos, pietuvinās mūs izpratnei par smadzeņu mistērijām, radīs iespējas, kā apturēt neirodeģeneratīvos procesus, un līdz ar to pilnīgi mainīs psihiskās veselības un dzīves problēmas. Šajā rakstā akcentēsim jaunākās neirodeģenerācijas protekcijas stratēģijas.
Kas ir neirodeģenerācija un neirodeģeneratīvās slimības?
Neirodeģenerācija ir progresīvs neirona struktūras un funkciju zudums, kas noved pie tā bojāejas. Tādējādi par neirodeģeneratīvām slimībām runā tad, ja rodas neiroloģiski traucējumi, kuru iemesls ir neironu patoloģijas. Neirodeģeneratīvās slimības ir hroniskas neirodeģenerācijas formas, un tās izpaužas kā Alcheimera slimība, Parkinsona slimība, Hantingtona slimība, amiotrofā laterāla skleroze.
Viena no pirmajām aprakstītajām neirodeģeneratīvajām slimībām ir Parkinsona slimība (Džeimss Parkinsons, 1817). Mūsdienās tā skar miljoniem cilvēku (Ziemeļamerikā vien vairāk nekā vienu miljonu), pieaug arī tās izraisītā mirstība. Arī Alcheimera slimība, kuru dažās augsti attīstītās valstīs (ASV, Kanāda) ar ilgdzīvojošiem cilvēkiem uzskata par ceturto nogalinātājslimību (killer disease), rada bezgala daudz veselības, sociālu, ekonomisku un ģimenes problēmu. Slimniekiem pakāpeniski zūd koncentrēšanās un ekstrapolācijas spējas, sašaurinās interešu loks, pakāpeniski pavājinās atmiņa, līdz beidzot iestājas izteikts atmiņas zudums, personas degradācija, demence. Dabīgi, ka šāds cilvēks zūd no aktīvās dzīves aprites. Ģimenei jādomā par slimnieka apkopi. ASV un Kanādā ir daudzas veco ļaužu mītnes (nursing houses), kur demences slimnieki tiek labi uzraudzīti un apkopti, taču tas prasa lielus naudas līdzekļus. Demences slimnieku lielais skaits ir biedējošs: tā skar 1-6% populācijas vecumā virs 65 gadiem un 10-20% vecumā virs 80 gadiem. ASV speciālisti uzskata, ka četru līdz piecu gadu laikā šie skaitļi var dubultoties.
Visnepatīkamāk ir apzināties, ka neirodeģeneratīvās slimības ir progresējošas, un līdz šim nav izdevies atrast racionālus paņēmienus, kā šo progresu apturēt. Taču progresē arī neirozinātne. Īpaši strauja šīs nozares attīstība vērojama kopš pagājušā gadsimta deviņdesmitajiem gadiem. Tā, piemēram, ASV bijušais prezidents Ronalds Reigans desmitgadi no 1990. līdz 2000.gadam pasludināja par smadzeņu dekādi, piešķirot lielus finansiālos līdzekļus Alcheimera slimības izpētei. Neapšaubāmi tas ir nesis augļus, jo Alcheimera slimības neirobioloģisko mehānismu izpēte un izpratne ir spērusi milzu soļus.
Neirodeģeneratīvo slimību etiopatoģenētiskie cēloņi
Būtisks riska faktors neirodeģeneratīvo slimību attīstībai ir novecošanās. Akūtu neirodeģenerāciju novēro pēc insulta, galvas traumām, sirds apstāšanās (arrest), subarahnoidālas hemorāģijas, taču neironu nāves iemesli abos gadījumos - akūtā un hroniskā - ir vieni un tie paši. Tie ir kalcija jonu un brīvo radikāļu pārmērīga uzkrāšanās šūnā, oksidatīvais stress, mitohondriālā disfunkcija un metaboliskie traucējumi, kas rada acidozi. Rezultātā šūnas signalizācijas mehānismi, kas ietver sevī tūkstošiem dažādu molekulu savstarpēju saistību, regulējot procesus no membrānas līdz kodolam un atpakaļ, ir totāli traucēti. Šī milzīgā mašinērija vairs nestrādā koordinēti, tiek izjaukta šūnas homeostāze, šūnā uzkrājušies neirotoksiskie produkti izraisa nekrotisku vai apoptotisku šūnas bojāeju. Šūna, kas gājusi bojā, nespēj ne saņemt, ne tālāk pārraidīt, ne saglabāt informāciju, līdz ar to cilvēka kognitīvajās (prāta) funkcijās rodas neirodeficīts.
Proteopātijas
Neraugoties uz to, ka joprojām ir daudz neskaidrību, vai un kā šūnas patoloģijas korelē ar demences izpausmēm, neirodeģeneratīvo slimību terapijā jau ir parādījušies pirmie gaismas stari. Pirmkārt, būtisku pagriezienu šo slimību etiopatoģenēzē devušas zināšanas par šūnas proteīnu izmaiņām jeb patoloģijām, tādējādi radot jaunus terminus - proteopatoloģijas jeb proteopātijas. Tas nozīmē, ka šūnā patoloģiski lielos daudzumos var uzkrāties noteikti proteīni vai to metabolisma produkti, vai arī proteīnu izmainītās konformācijas jeb terciārās struktūras dēļ proteīni nepakļaujas normālai šķelšanai (normāli proteīni ar enzīmu palīdzību tiek sašķelti līdz aminoskābēm, kuras savukārt šūna utilizē citiem mērķiem), vai arī uzkrājas proteīni, kurus sauc par prioniem.
- Zinātnes sasniegumi rāda, ka Parkinsona slimības pamatā ir proteīna - a-sinukleīna - uzkrāšanās smadzeņu nigro-striatālās sistēmas dopamīnu producējošās šūnās. Šī proteīna daudzās molekulas veido it kā ķekarus (clusters), ko sauc par Levi ķermenīšiem (Lewi bodies). Šūnai šādi intracelulārie veidojumi ir kā svešķermenis un šūna uz to reaģē, mobilizējot savas aizsargfunkcijas, t.i., pastiprināti sintezējot dažādas molekulas, kurām uzkrājoties šūnā rodas iekaisums.
- Līdzīga situācija ir Hantingtona slimības gadījumā, taču šoreiz vainīgais ir cits proteīns - hantingtīns.
- Alcheimera slimības gadījumā pārmērīgi šķeļas proteīns - amiloīda peptīda prekursors - kā rezultātā rodas proteīna fragmenta jeb 42 aminoskābes saturoša peptīda (bA4) uzkrāšanās. Tas līdzīgi a‑sinukleīnam klasterizējas un veido plāksnītes, kas traucē šūnas darbību un izraisa šūnās iekaisumu.
- Amiotrofās laterālās sklerozes etiopatoģenētiskais cēlonis ir cita proteīna - enzīma Co/Zn superoksīda dismutāzes - patoloģija. Co/Zn superoksīda dismutāze šūnā darbojas kā antioksidants un aizsargā to no brīvo radikāļu izraisītiem bojājumiem. Ir atrastas šo enzīmu kodējošā gēna mutācijas. Šī slimība skar motoros neironus, izraisot to deģenerāciju. To stimulē arī pārmērīga glutamīnskābes (glutamāta) uzkrāšanās. Glutamāts pieder pie aktivējošām aminoskābēm, un tā pārmērīga izdalīšanās no neirona stresa faktoru (piemēram, hipoksijas/išēmijas, sāpju) ietekmē un saistīšanās ar dažādiem glutamāta receptora tipiem un subtipiem izraisa spēcīgu kalcija un arī nātrija jonu ieplūšanu neironā. Tas rada neirotoksisku iznākumu, jo aktivējas proteīnus, lipīdus un DNS šķeļošie enzīmi, kuru darbības rezultātā šūna vienkārši sabrūk.
Kaut arī neirodeģeneratīvo slimību pirmreizējie etiopatoģenētiskie cēloņi ir atšķirīgi (gēnu mutācijas, akūts smadzeņu bojājums, cerebrāla trauma, epilepsija utt.), šūnas bojāeju izraisošie mehānismi ir kopīgi, un, vadoties no mūsdienu izpratnes par tiem, jaunas farmakoterapijas stratēģijas ir jāvērš tieši uz šiem kopīgajiem šūnas patoloģisko reakciju kaskādes agrīnajiem posmiem, lai pēc iespējas savlaicīgāk apturētu neirodeģenerācijas procesus. Kā jau minēts, šie posmi ietver oksidatīvo stresu, kas savukārt saistīts ar kalcija jonu un brīvo radikāļu pārmērīgu uzkrāšanos, mitohondriālo disfunkciju, iekaisumu izraisošu vielu (piemēram, citokīnu, no kuriem vistoksiskākie ir interleikīns-1 un interleikīns-6, un tumora nekrozes faktora jeb TNF-a) pārmērīgu producēšanos šūnā. Stāstījums par šīm stratēģijām sekos, taču vispirms mazliet par klasiskām pieejām neirodeģenerācijas ārstēšanā.
Mūsdienu neiroprotektējošie preparāti
Neiroprotektantus dēvē arī par nootropām (no grieķu vārda noos - prāts; tropos - virzīt uz) vai antidemences vielām, par atmiņas vai kognīcijas (no latīņu vārda cognoscere - zināt) un smadzeņu funkciju uzlabotājiem. Tā kā par neiroprotektantiem ir daudz grāmatu un literatūras apskatu [1; 2], tad šajā rakstā tiem pieskaršos vien konspektīvi.
Piracetams un tā jaunākie analogi
Tā ir pirmā nootropo zāļu vielu klase, kas savu uzvaras gājienu sāka 1964.gadā. Ķīmiski šīs vielas struktūra tika dizainēta kā cikliska gamma-aminosviestskābes (GASS) molekula. Kaut arī piracetamu un daudzus tā jaunākos analogus - oksiracetamu, aniracetamu, pramiracetamu, nebracetamu un citus, kuri ir aktīvāki un mazāk toksiski - joprojām lieto neiroloģiskajā praksē, tomēr šīs klases preparātu darbības mehānisms vēl arvien nav īsti skaidrs. Tie nesaistās ar specifiskiem receptoriem, taču spēj intensificēt daudzus intracelulāros procesus. Pastāv hipotēze, ka piracetama efekti saistās ar tā spēju uzlabot/pastiprināt šūnas membrānas funkciju - plūstamību/caurlaidību (fluidity), kas būtiski pasliktinās līdz ar novecošanos. Taču, neskatoties uz diezgan labu piracetama grupas preparātu panesamību, tie nav ieguvuši vispārēju atzinību kā efektīvi anti-neirodeģeneratīvi līdzekļi.
Antiholīnesterāzes
Pagājušā gadsimta septiņdesmitajos gados populāra kļuva neirodeģenerācijas holīnerģiskā hipotēze, kas pauda uzskatu, ka galvenais smadzeņu funkciju deficīta cēlonis ir samazināta smadzeņu acetilholīna sintēze vai samazināta acetilholīna receptoru sintēze. Līdz ar to jaunu zāļu vielu dizains tika vērsts uz smadzeņu acetilholīna sistēmas stimulāciju - galvenokārt uz acetilholīnu šķeļošā enzīma acetilholīnesterāzes inhibīciju, lai panāktu acetilholīna akumulāciju un novērstu tā deficītu. Šādi darbojošos zāļu grupu sauc par antiholīnesterāzēm. Vecākie preparāti ir fizostigmīns, galantamīns, jaunākie - amiridīna grupas preparāti - amiridīns (sin. ipidakrīns), takrīns, velnakrīns, donepezils. No šiem preparātiem Latvijā ražo ipidakrīnu (neiromidīnu).
Konstatēts, ka ipidakrīns vienlaicīgi inhibē divas dažādas holīnesterāzes - acetilholīnesterāzi un butirilholīnesterāzi - tādējādi panākot augstu acetilholīna līmeni neironu sinapsēs. Turklāt preparāts darbojas kā kālija jonu kanālu blokators, kas netieši stimulē acetilholīna izdalīšanos, kā arī uzlabo nervu impulsa pārvadi pa visu nerva gaitu.
Klīniskie novērojumi liecina, ka antiholīnesterāzes vielas samazina neirodeģenerācijas simptomus vidēji izteiktas Alcheimera slimības slimniekiem (ārstējot vismaz trīs līdz sešus mēnešus) un palēnina kognitīvo funkciju vājināšanos, taču demences procesus šie preparāti neietekmē. Turklāt jārēķinās ar nevēlamiem efektiem, kas atgādina tipisku holīnerģisko hiperaktivāciju un izraisa arī aknu disfunkciju (ievērojami paaugstinās transamināžu aktivitāte). Jāievēro arī kontrindikācijas: preparātus nedot bērniem, grūtniecēm, ar krūti barojošām mātēm, Parkinsona slimības slimniekiem (kuriem jau ir holīnerģiskā hiperaktivitāte). Strauja preparātu lietošanas pārtraukšana var būtiski pasliktināt kognitīvās funkcijas.
Glutamāta receptoru antagonisti un parciālie agonisti
Pagājušā gadsimta astoņdesmitie gadi nāca ar jauniem sasniegumiem neirozinātnēs, no kuriem viens ir glutamāta receptoru identifikācija. Tika noskaidrota jonotropo (kanālus veidojošo) un metabotropo (ar G proteīnu saistīto receptoru iedarbinātās kaskāžu reakcijas) receptoru struktūra un funkcijas. Jau vairāk nekā 25 gadus notiek plaši zāļu vielu meklējumi, kas fokusēti uz kalcija jonu ieplūdes neironā samazināšanu. Pētījumu galvenais objekts ir tie glutamāta receptori, kurus sauc par NMDA un ne-NMDA receptoriem.
- NMDA receptori ir tie paši glutamāta receptori, bet tiem ir augsta spēja saistīties ar sintētisku asparagīnskābes analogu - N-metil-D-asparagīnskābi. Šis receptors, saistoties ar glutamātu, maina receptora proteīna konformāciju tā, ka veidojas kalciju jonu kanāls.
- Ne-NMDA receptors arī ir glutamāta receptors, bet tas nesaistās ar NMDA. Tā galvenā funkcija ir regulēt nātrija jonu ieplūšanu neironā.
Tā kā NMDA receptori satur daudzus proteīna rajonus jeb saitus (sites), kuri piesaista ne tikai glutamātu, bet arī dažādus citus endogēnos ligandus (magnija jonus, glicīnu, poliamīnus, nitro-tiogrupu saturošas vielas), tad vielu dizains tika vērsts uz glutamāta receptoru antagonistu vai daļējo (parciālo) agonistu sintēzi, lai limitētu kalcija jonu ieplūšanu šūnā.
Jāņem vērā, ka kalcijs ir viena no svarīgākajām šūnas signālmolekulām, kas regulē visus neirona dzīvībai nepieciešamos procesus. Tātad šūnai kalcija joni ir nepieciešami. No otras puses, kā jau iepriekš minēts, kalcija akumulācija izraisa neirona nāvi. Tādēļ atrast īsto līdzsvaru starp receptora aktivāciju un bloķēšanu ir visai grūts uzdevums un līdz šim līdz klīniskai praksei nonākuši tikai daži preparāti.
Visplašākie NMDA receptoru antagonistu pētījumi veikti Merz kompānijā (Vācijā), arī Latvijas Organiskās sintēzes institūtā. Rezultātā ir izveidots preparāts memantīns (magnija saita antagonists), kurš efektīvi darbojas insulta, Parkinsona slimības gadījumā, pielietots arī demences apturēšanā. Uz šo pašu proteīna saitu iedarbojas arī dekstromorfāns. Glicīna saita antagonistu felbamātu pielieto insulta un epilepsijas ārstēšanā, poliamīna saita antagonistu eliprodilu - insulta slimniekiem. Interesi izraisa redox modulārā saita ligandi, kas satur nitro- un sēra (tio) grupas - nitroglicerīns, nātrija nitroprusīds, glutations - kuru efektivitāte epilepsijas, galvas traumas un insulta gadījumā vēl tiek klīniski novērtēta.
Citas lietošanai apstiprinātas vielas ar nozīmi neiroprotekcijā
Gados veciem slimniekiem, kuriem neirodeģeneratīvās slimības ir cieši saistītas ar depresiju, lieto psihostimulantus un antidepresantus. Slimniekiem ar cerebrālās apasiņošanas problēmām lieto cerebrovazodilatatorus. Plaša reklāma ir izvērsta par antioksidantiem, norādot uz to spēju kompensēt enerģijas deficītu, tādējādi uzlabojot šūnas funkciju un izdzīvošanu: koenzīmam Q (uzlabo mitihondriju funkcijas), C un E vitamīniem, kā arī acetil-L-karnitīnam un melatonīnam (uzlabo antioksidatīvo kapacitāti), arī selegelīnam (samazina brīvo radikāļu producēšanos). Mūsu aptieku plauktos ir daudz Ginkgo Biloba preparātu (iegūti no ginka lapām) ar garāku un īsāku (biobalide) struktūru, kas pieder pie multivalentiem regulatoriem, jo ietekmē daudzas neironu funkcijas. Pozitīvi jānovērtē šo preparātu spēja inhibēt trombocītu aktivāciju, uzlabot smadzeņu un redzes nerva cirkulāciju. Atsauces par šo preparātu aktivitāti cilvēkiem ir dažādas, taču no savas eksperimentatora pieredzes varu teikt, ka atmiņas traucējumu modeļos laboratorijas dzīvniekiem tie uzrādīja augstu atmiņu stimulējošo aktivitāti.
Vielas ar teorētisku nozīmi
Pašreiz vēl teorētiska nozīme ir neirotrofīniem jeb augšanas faktoriem, piemēram, bFGF (basic fibroblastic growth factor), BDNF (brain-derived neurotrophic factor), neirotrofīnam-4 un CNTF (ciliary neurotrophic factor). Šie faktori stimulē neironu augšanu, piemēram, dopamīnu producējošām šūnām Parkinsona slimības gadījumā, taču nav izslēgta arī šūnas proliferācijas stimulācija, tumoroģenēze, antivielu veidošanās.
Arī neirosteroīdu - dehidroepiandrosterona un pregnenolona - lietošanai pagaidām vairāk ir teorētisks pamatojums. Uzskata, ka gados veciem slimniekiem šo hormonu līmenis ir samazināts. Turklāt neirosteroīdi pazemina neirotoksiskā interleikīna IL-1 producēšanos. Pētījumi pagājušā gadsimta beigās gan devuši pirmos daudzsološos rezultātus, ļaujot apgalvot, ka neirosteroīdi varētu kalpot kā jaunības strūklaka.
Jaunās neirodeģenerācijas protekcijas stratēģijas
Kā redzams no shēmas neirodeģenerācijas reakciju kaskādes ietver būtiskus posmus, kuru mērķēšana šodien var tikt uzskatīta par stratēģiski racionālāko jaunu un efektīvu anti-neirodeģeneratīvu zāļu dizainā. Var uzskatīt, ka tuvākās nākotnes uzdevums ir tikt galā ar vismaz trim mērķiem, kas ļautu apstādināt neiroiekaisumu, mitohondriālo disfunkciju un proteīnu patoloģijas.
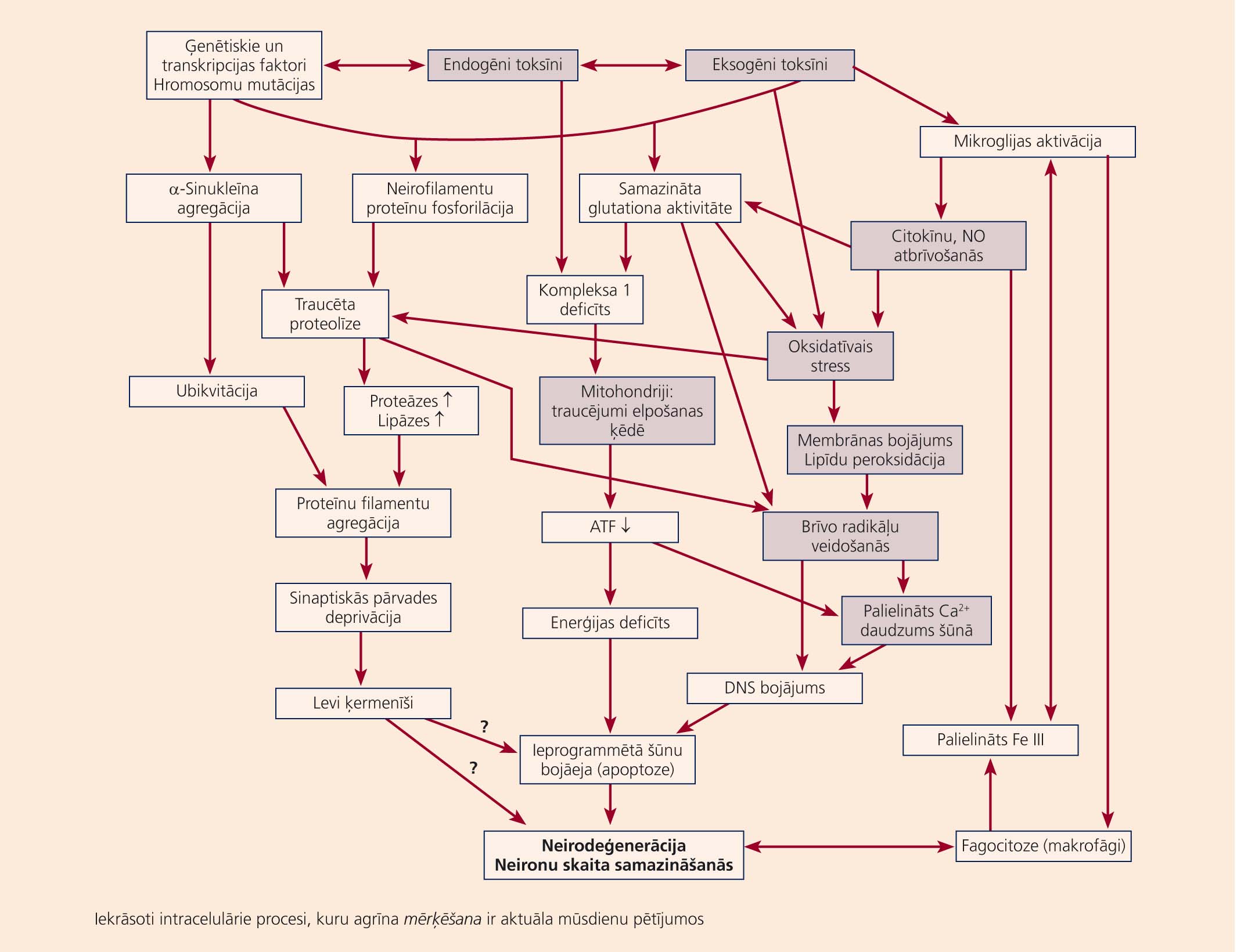

Attēls
Neirodeģenerāciju izraisošo reakciju interaktīvās kaskādes
Neiroiekaisums kā mērķis
Pirmie, kas atklāja neiroiekaisuma lomu Alcheimera slimības skartajos smadzeņu audos un amiotrofās laterālās sklerozes slimnieku muskuļu nervos, deviņdesmito gadu beigās un divdesmit pirmā gadsimta sākumā, bija Kanādas (Vankūvera) zinātnieki Edīte un Patriks MakGīri (McGeer) [3; 4]. Viņi parādīja, ka iekaisums šo slimību gadījumā saistās ar aktivētu mikrogliju un neirotoksisku iekaisuma molekulu - citokīnu, hemokīnu un pentraksīnu (C reaktīvā proteīna un amiloīda peptīda) - producēšanos. Ne mazāk intensīva ir arī citu iekaisuma transmiteru (prostaglandīnu, serotonīna histamīna, bradikinīna) aktivācija. Šie zinātnieki izvirzīja hipotēzi, ka neiroiekaisums ir galvenais neironu nāves iemesls un tāpēc tas jāuzskata par potenciālu terapeitisku mērķi neirodeģeneratīvo slimību ārstēšanā.
Līdz šim veikti klīniskie pētījumi ar pazīstamām nesteroīdu pretiekaisuma vielām COX inhibitoriem (aspirīnu, indometacīnu, diklofenaku un citiem), ar glikokortikoīdiem (piemēram, prednizolonu, kas tieši nomāc citokīnu producēšanos), arī ar pretmalārijas vielām (hlorokīnu un kolhicīnu). Neskatoties uz to, ka nesteroīdu pretiekaisuma vielas pagarināja periodu līdz Alcheimera demences pazīmju manifestācijai, tomēr bija jārēķinās ar šo vielu augsto risku izraisīt asiņošanas un ulcerācijas. Glikokortikoīdu lietošanu limitēja to izraisītā hiperglikēmija un osteoporoze.
Nav šaubu, ka jāmeklē pretiekaisuma vielas, kuru darbības mehānisms ir atšķīrīgs no minēto vielu mehānismiem. Mūsu eksperimentālie dati, kas iegūti kopīgi ar Vankūveras zinātniekiem (McGeer grupu), pētot Latvijas Organiskās sintēzes institūtā sintezēto 1,4-dihidropiridīnu klases analogu cerebrokrastu, liecina, ka šis savienojums uzrāda pretiekaisuma darbību, inhibējot interleikīnu IL-1 un IL-6 producēšanos [5]. Iepriekš jau bijām parādījuši šīs vielas neiroprotektīvo darbību dažādos neirodeficīta modeļos [6], kā arī neirītu augšanu stimulējošu un cerebrovazodilatējošu aktivitāti. Turklāt šim zemas toksicitātes savienojumam nav izdevies atklāt tādus nelabvēlīgus efektus, kas varētu radīt risku ilgstošai tā lietošanai. Šāda jauna tipa zemmolekulāra viela vai tās analogi ar selektīvu pretiekaisuma darbību neapšaubāmi paver jaunus ceļus neiroiekaisuma terapijā.
Proteopātijas kā mērķis
Šī pagaidām ir vissarežģītākā problēma, jo parasti proteīnu patoloģijas skar nevis vienu proteīnu, bet veselu proteīnu plejādi [7]. Tā, piemēram, Alcheimera slimības skarto slimnieku smadzenēs atrod ne tikai patoloģisku amiloīda Ab peptīda uzkrāšanos, bet arī patoloģisku tau-proteīna fosforilāciju, presenilīna-1 un presenilīna-2 mutācijas, apolipoproteīna E4 alēles defektus. Joprojām var tikai teorētiski spriest, kā šos procesus apturēt. Pat it kā visracionālākā pieeja - izstrādāt Ab peptīda vakcīnu un ar to vakcinēt Alcheimera slimības slimniekus - nav vainagojusies ar panākumiem. Vēl, protams, pastāv iespējas inhibēt b un g sekretāzes, tas ir, enzīmus, kas piedalās amiloīda peptīda prekursora šķelšanā, taču arī šajā virzienā pagaidām nav iegūti praktiski rezultāti.
Citos gadījumos, kad kā galvenais patoloģijas cēlonis ir nepareizi salocītie (misfolded) proteīni, jādomā, kā tos atlocīt normālā konformācijā. Acīmredzot šī nepareizā salocīšanās notiek tad, ja organismā nepietiekamā daudzumā izstrādājas vielas šaperoni (chaperons), kas parasti neļauj proteīniem iegūt šo nepareizo konformāciju [8]. Pagaidām pie dabas jeb molekulāriem šaperoniem pieskaita karstuma šoka proteīnu (heat shock protein, HSP), audzējus supresējošo gēnu p53. Taču parādās dati par ķīmiskajiem šaperoniem (chemical chaperons) - DMSO, glicerīnu, verapamīlu, vinblastīnu, ciklosporīnu, kapsaicīnu, kuru īsto spēju reversēt proteīnu konformāciju līdz normālam stāvoklim novērtēs nākotnes pētījumi.
Mitohondriji kā mērķis
Mitohondriji šūnā ir unikāls veidojums, jo tie darbojas paši ar savu mitohondriālo DNS (mtDNS). Unikāla ir mitohondriju spēja saražot ap 65 kg ATF (mūsu enerģijas avota) dienā [9]. Taču mitohondriji ir ļoti jutīgi pret oksidatīvo stresu un paaugstinātu brīvo radikāļu koncentrāciju. Tie ir primārais intracelulārais brīvo radikāļu avots, jo ģenerē lielu skaitu oksidēšanas-reducēšanas reakciju un milzīgos apmēros patērē skābekli. Citiem vārdiem sakot, mitohondriji ir gan oksidatīvā stresa iniciators, gan pirmais šī stresa mērķis. Mitohondriālie bojājumi izraisa šūnas nāvi. Mitohondriji izdala pro-apoptotiskos faktorus, piemēram, citohromu C, apoptozi inducējošo faktoru (AIF). Mitohondriālais deficīts mūsdienās tiek uzskatīts par pudeles šauro kaklu dažādu slimību, piemēram, Parkinsona slimības, Alcheimera slimības, novecošanās, sirds slimību un diabēta etiopatoģenēzē. Arī AIDS terapijā ar nukleozīdu analogiem visvairāk cieš mitohondriji.
Pēdējos 10-20 gados zinātniekus nodarbina jautājumi:
- kā protektēt mitohondriālās membrānas integritāti;
- kā modulēt mitohondriālo caurlaidību regulējošo poru (permeability transition pore - MPTP) atvēršanos, jo tās piedalās kalcija jonu izdalīšanās mehānismos, kā arī mitohondriālajā deenerģizācijā;
- kā kontrolēt apoptotisko proteīnu ekspresiju;
- kā stimulēt mitohondriālo proliferāciju.
Pagaidām vēl notiek intensīvi pētījumi. Viens no mitohondriju bojājuma modeļiem ir neirotoksiska viela MPP+ (1-metil-4-fenilpiridīns), kuru izmanto in vitro pētījumos, lai izraisītu neirotoksicitāti, kas imitētu Parkinsona slimības neironālo šūnu bojājumus. Mūsu pētījumos konstatējām, ka cerebrokrasts pilnībā spēj protektēt MPP+ izraisīto brīvo radikāļu uzkrāšanos, mitohondriju membrānas potenciāla zudumu un šūnas bojāeju [10]. Mūsu sadarbības partneri Koimbras universitātē (Portugālē) savukārt atklāja, ka cerebrokrasts inhibē izolētu mitohondriju iekšējās membrānas anjonu kanālu (IMAC) un daļēji preventē kalcija inducēto MPTP atvēršanos, kas liecina par cerebrokrastu kā mitohondrijus aizsargājošu vielu [11]. Mūsu pētījumi pašlaik tiek fokusēti arī uz Latvijas Organiskās sintēzes institūta radīto preparātu mildronātu, kas parādījis augstu spēju novērst dažādu anti-HIV preparātu izraisītos mitohondriālos bojājumus.
Cilmes šūnas
Domājams, ka cilmes šūnām tiešām pieder vislielākā nākotne. Cilvēka embrionālās cilmes šūnas savā agrīnajā attīstības fāzē spēj pārvērsties par jebkuru pieaugušas šūnas tipu. Tas vieš cerības, ka, transplantējot cilmes šūnas uz neirodeģenerācijas rajoniem, bojātās šūnas un bojātie audi var tikt atjaunoti, piemēram, Parkinsona slimības slimnieku nigrostriatālajos kodolos, kur varētu veidoties jaunas dopamīnu producējošās šūnas [12]. Perspektivitāte saistās arī ar smadzeņu insulta ārstēšanu, kā arī ar miokarda infarkta, diabēta un daudzu citu slimību ārstēšanu, kuru cēlonis ir noteiktu šūnu bojāeja. Jādomā, ka tās problēmas (tumoroģenēze u.c.), kas pašlaik vēl kavē cilmes šūnu izmantošanu terapeitiskiem mērķiem, drīz tiks novērstas.