Audzēja gadījumā sāpes nosacīti var iedalīt divās daļās: hroniskās jeb bāzes sāpēs un izlaušanās sāpēs. Līdz ar to terapijas sastāvdaļa būs hronisko jeb bāzes sāpju kupēšana, visbiežāk izvēloties ilgdarbīgus medikamentus ar 12, (24), 72 stundu iedarbību. Izlaušanās sāpju mazināšanai izmanto ātras un īslaicīgas darbības medikamentus.
Jebkurā gadījumā svarīga ir sāpju diagnostika, mehānismi, sāpju novērtējums (laiks un intensitāte), izlaušanās sāpju profils, individuāla pieeja, medikamentu izraisītu blakņu novēršana, terapijas efektivitātes dinamisks novērtējums. Uz virsraksta jautājumu "Cik daudz mēs zinām pa izlaušanās sāpēm?" var atbildēt šādi: "Zināšanas ir nepārtraukts, dinamisks izziņas process, ko pamato zinātniski pierādījumi un laba klīniskā prakse."
Bāzes sāpju raksturojums
Pacientiem ar audzēju vēlīnās stadijās vismaz divās trešdaļās gadījumu diagnosticē sāpes un vismaz 30% gadījumu to intensitātes diapazons mērāms no vidēji stiprām līdz izteiktām. [1] Par bāzes sāpēm sauc vidēji stipras vai izteiktas hroniskas sāpes, kas ilgst vismaz trīs mēnešus un kopumā vismaz 12 stundas diennaktī. Tātad hroniskas/bāzes sāpes raksturo laiks, ilgums un intensitāte. [2] Intensitāti nosaka verbāli (no maz izteiktām līdz neciešamām) vai ar cipariskās (numeriskās) sāpju intensitātes noteikšanas skalu no 0 līdz 10.
Visbiežākais hronisku sāpju cēlonis ir audzējs. Vismaz 90% gadījumu audzējs izsauc vienu vai divus sāpju veidus, bet 21% gadījumu sāpes rodas specifiskās terapijas dēļ. Hroniskas somatiskas sāpes konstatē 71%, bet neiropātiskas sāpes 39% gadījumu. Ielaistu audzēju gadījumā viscerālas sāpes diagnosticētas 34% gadījumu. [3] Skeleta sāpes un neirālo struktūru nospiedums ir divi biežākie hronisko jeb bāzes sāpju cēloņi.
Izlaušanās sāpju raksturojums
Lai gan audzēja bāzes sāpju terapija diennakts garumā ir efektīva, daudzos gadījumos pacientiem rodas sāpju uzliesmojumi, visbiežāk īslaicīgi un pārejoši, bet var būt arī ļoti intensīvi. Šādas sāpju epizodes pacientam rada izteiktu psiholoģisku distresu, garastāvokļa svārstības, trauksmi un funkcionālus traucējumus. Izlaušanās sāpju definīcijā ietverti vairāki būtiski raksturlielumi: par izlaušanās sāpēm (IS) uzskata pārejošu sāpju uzliesmojumu, kas rodas relatīvi stabilas, pielāgotas bāzes sāpju terapijas fonā, spontāni vai kā atbildes reakcija uz noteiktu provocējošu vai nezināmu izsaucēju. [4] IS bieži novēro ne tikai onkoloģiskiem pacientiem, bet arī neonkoloģisku slimību gadījumā. Definīcijā svarīga ir IS izcelsme attiecībā pret sāpju palaidējmehānismu — tās ir spontānas vai noteikta faktora izraisītas.
Daudzās zemēs ir atšķirīgs IS definējums un līdz ar to nepietiekama sāpju diagnostika, piemēram, angliski runājošajās zemēs IS tiek konstatētas līdz pat 80%, bet Āzijā ap 45% gadījumu. Atšķirības ir arī Rietumeiropas, Ziemeļvalstu (ap 69%) un citu reģionu valstīs IS interpretējumā un noteikšanā. [5] Senākā pētījumā (1999. gadā) neatrada atšķirību IS izvērtējumā, analizējot pacientu vecumu, dzimumu, audzēja veidu, lokalizāciju vai terapiju. [6] Tomēr vēlākos pētījumos (2009. gadā) atklāja, ka intensīvākas IS ir sievietēm nekā vīriešiem. Starpība bija arī baltās ādas krāsas un citu rasēm piederīgo grupās. [7] IS biežums bija atkarīgs arī no audzēja stadijas. Paliatīvās aprūpes nodaļās/hospisos biežāk iestājas pacienti vēlīnās vēža stadijās un IS novēroja pat 90% gadījumu [8], turpretim nespecializētās stacionāru nodaļās IS konstatēja 50—70% gadījumu. [9]
Biežākie faktori, kas ietekmē sekmīgu IS diagnostiku un ārstēšanu, ir sāpju nepietiekams novērtējums, maldīgi uzskati sabiedrībā par audzēja izraisītu sāpju remdēšanu un medikamentiem, īpaši opioīdiem, kā arī pacienta, viņa piederīgo un ārstu nesekmīga komunikācija. Bieži vien sāpju diagnoze ir neskaidra, ja pacienta vispārējais stāvoklis ir smags un izteiktas vēl citu simptomu izpausmes.
Par izlaušanās sāpēm neuzskata
- Ja ir neskaidra slimības/sāpju diagnoze; nediagnosticēts/mainīgs sāpju mehānisms.
- Nav noteiktas bāzes sāpju terapijas.
- Sākot bāzes sāpju medikamentu (opioīdu) titrēšanu.
- Nepietiekama, nestabila bāzes sāpju terapija, piemēram, audzējam progresējot; "pseidopierašanas sindroms" — ja bāzes sāpju medikamenta deva ir nepietiekama.
- "Astes sāpes" — bāzes sāpes, medikamentam beidzot darboties. [4]
Izlaušanās sāpju veidi
Iedala divās pamatgrupās:
- spontānas jeb idiopātiskas, ja nav zināms provocējošais faktors. IS ir neparedzamas un var būt jebkurā ķermeņa vietā. Maksimālais sāpju līmenis tiek sasniegts vidēji 10 minūtēs. Epizodes ilgums — vidēji ne ilgāk par 10 minūtēm;
- momentsāpes — sāpes vidēji maksimumu sasniedz 5 minūtēs. Epizodes ilgums - vidēji ne ilgāk par 45 minūtēm. Momentsāpju iedalījums:
- prognozējamas — specifiski faktori, kas var izsaukt sāpes: ķermeņa poza, tās maiņa (ceļoties, ejot, apsēžoties, pieskaroties utt.),
- neprognozējamas — neierastas, pēkšņas kustības, kritiens, trauksme, meteorisms, urīnpūšļa/žultspūšļa spazmas, klepus u.c.,
- pēc manipulācijām — pārsienot brūci, kustinot bojāto ekstremitāti; pēc procedūras, punkcijas. [11]
Klīniskais iedalījums
- Nociceptīvas jeb nervu sistēmas atbildes reakcija uz nociceptīvu kairinājumu:
- somatiskas IS: 33—46% gadījumu, kad tiek aktivēti ādas vai dziļāko audu — muskuļu, kaulu nociceptori;
- viscerālas 20—30% gadījumu, ja aktivējas viscerālo orgānu nociceptori;
- neiropātiskas 10—27% gadījumu, ja rodas nervu sistēmas disfunkcija vai bojājumi;
- jauktas 10—20% gadījumu.
Audzēja izraisītas izlaušanās sāpes ir apmēram 70—80%, bet 10—20% pacientu tās rodas specifiskas terapijas rezultātā. [5]
Sāpju rašanās galvenie mehānismi
- Pazemināts sāpju slieksnis. Mehānisma pamatā var būt ilgstošas, hroniskas sāpes, bieži vien nepietiekami kupētas.
- Hiperalgēzija jeb pastiprināta sāpju sajūta, kas nerodas normālos fizioloģiskos apstākļos.
- Alodīnija jeb izteikta, neadekvāta sāpju sajūta uz niecīgāko kairinājumu.
- Ektopisku nervu šķiedru aktivitāte, veidojoties sāpju signāliem dažādās nervu sistēmas vietās.
Četru IS mehānismu rašanās pamatā ir perifēra un centrāla sensitizācija, kas visbiežāk rodas hronisku jeb bāzes sāpju rezultātā. Audzējs, tā radīts iekaisums var bojāt nervus perifērijā un/vai centrālajā daļā. Veidojas pārsātināta jutīgo receptoru stimulācija un neadekvāta apkārtējo neironu reakcija. Hiperimpulsācija mugurējās saknītes aferentajos ceļos rada transmiteru deficītu, savukārt citās vietās atbrīvojas pārliecīgs neirotransmiteru daudzums un notiek masīva postsinaptiska depolarizācija, tīkla pārsātinājums. Šādos gadījumos mazinās inhibējošo pārvades ceļu funkcija jeb modulācija. Ektopisko signālu veidošanās izskaidro biežo IS rašanos dažādās ķermeņa vietās, kas nav saistītas ar patoloģiskām izmaiņām. [13]
Psihosociālais slogs
Audzēja izraisītas IS var būt visās slimības stadijās. Tomēr vairāk izteiktas tās ir slimības vēlīnajās fāzēs, ja ir smags vispārējais stāvoklis. Jo sarežģītāka bāzes terapija, jo izteiktākas IS. Tās negatīvi ietekmē dzīves kvalitāti, pacienti jūtas neapmierināti ar analgēziju. IS ierobežo funkcijas, kustības, tām ir negatīva psihosociālā ietekme uz pacientu un viņa piederīgajiem. Veidojas trauksmes stāvokļi, depresija. Biežas IS epizodes ir klīniski slikts prognozes rādītājs, nereti rodas jautājums, cik efektīva ir bāzes (opioīdu) terapija. Veidojas nopietns psihoemocionāls slogs pacientam, ģimenei, kopējiem, medicīnas sistēmai kopumā. Lielākas ir tiešās terapijas izmaksas, vairāk izrakstīto recepšu, pieaug netiešās izmaksas, piemēram, par pacienta transportēšanu. Ja IS ir biežas, vairāk ir neatliekamās palīdzības izsaukumu, vizīšu pie ārsta, biežākas stacionēšanas epizodes, ilgāka uzturēšanās stacionārā. [14; 15]
Diagnostika
Izlaušanās sāpju noteikšanas algoritmu skat. 1. attēlā.
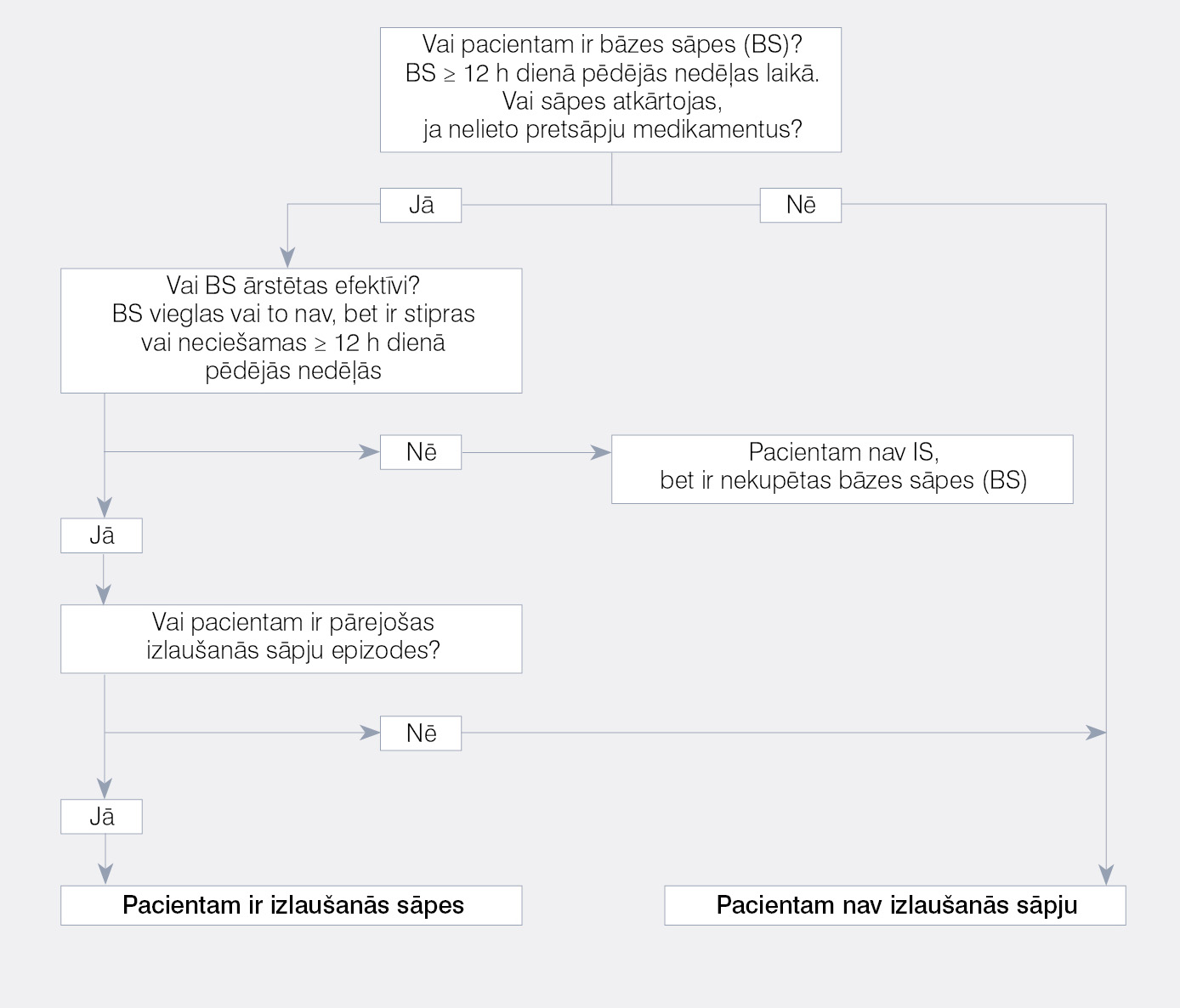

1. attēls
Izlaušanās sāpju noteikšanas algoritms
Raksturojošie lielumi
- Lielākajai daļai pacientu IS tieši saistītas ar bāzes sāpēm.
- Sāpes biežas, pat ja bāzes terapija labi titrēta.
- Vidēji 4 epizodes dienā, bet var būt plašā diapazonā no 1 līdz 60. [8]
- Ātrs sākums, vidēji trijās minūtēs sasniedzot maksimālo intensitāti, bet var būt augstākās intensitātes līmenis 1—30 minūtēs. [16]
- Īslaicīgums — 64% gadījumu epizodes ilgst ne vairāk kā 30 minūtes. 2% gadījumu tās ilgst līdz pat 2 stundām. [8; 15]
- Sāpes ir intensīvas, stipras.
- Biežākais izsaucējfaktors ir kustības, aktivitātes pieaugums: 20—56% gadījumu. [17]
Izlaušanās sāpju kupēšanas metodes
Viens no svarīgākajiem IS mazināšanas noteikumiem ir bāzes sāpju terapijas optimizēšana. Nākamais solis ir piemērot IS kupēšanas medikamentus. Daudzos gadījumos var noderēt invazīvas un/vai nefarmakoloģiskas metodes. [18]. Izlaušanās sāpju mazināšanas algoritmu skat. 2. attēlā.
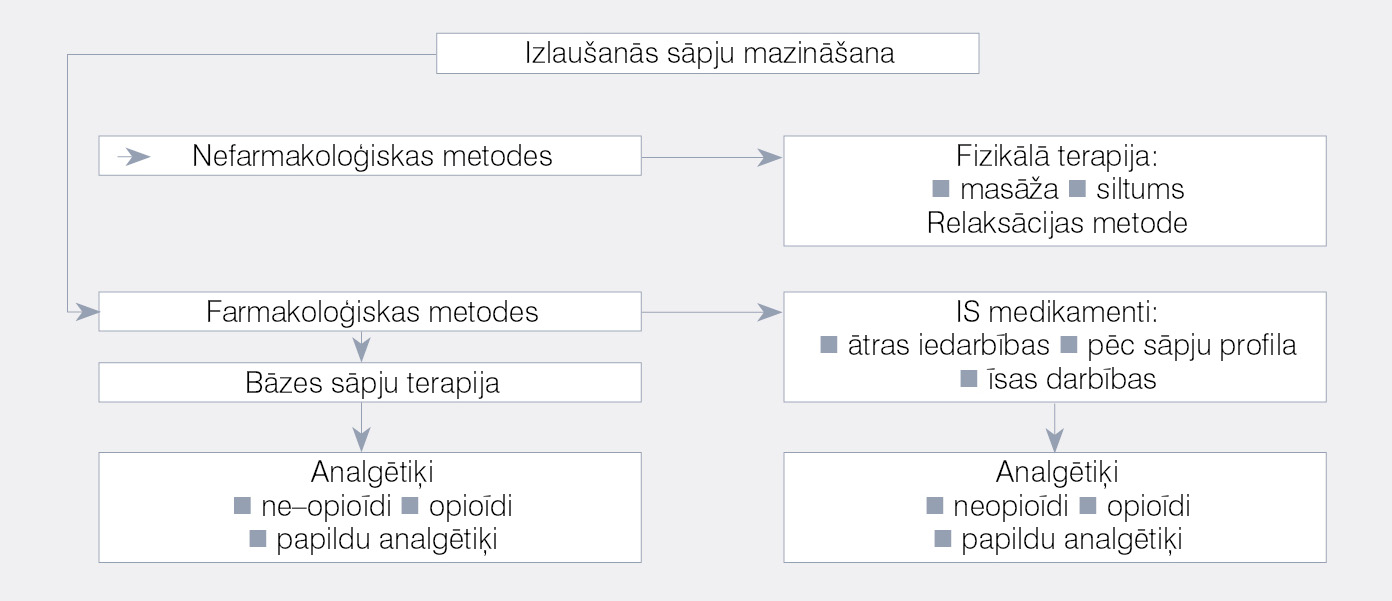

2. attēls
Izlaušanās sāpju mazināšanas algoritms
Teorētiski IS var kupēt ar ātras darbības pretsāpju līdzekļiem, piemēram, nesteroīdajiem pretsāpju līdzekļiem, opioīdiem analgētiķiem, adjuvantiem (papildu) līdzekļiem jeb koanalgētiķiem. Tomēr opioīdi, kas atbilst sāpju profilam, uzskatāmi par efektīvākajiem IS mazināšanā, ja tos lieto stingri individuāli, pēc indikācijām.
1996. gadā PVO vadlīnijās audzēja izraisītas sāpes ieteikts kupēt ar perorāliem līdzekļiem. [19] Tomēr praksē rekomendācija izrādījās efektīva, ārstējot bāzes sāpes, bet mazāk iedarbīga uz IS. Perorāli lietots morfīns iedarbojas ar nokavēšanos, pēc 20—30 minūtēm. [20] Tāpēc tika meklēti alternatīvi zāļu ievades ceļi — orāli transmukozāls opioīdu izmantojums (2001. gadā) [21], intravenozs (2004. gadā) [23], zemādas (2005. gadā) [23] un intrapulmonāls (2000. gadā). [24]
Nosakot vidējo laiku, līdz iestājas pretsāpju efekts, pētījumā 2003. gadā konstatēts, ka atbilstīgi sāpju intensitātei pēc zāļu intravenozas ievades tas bija 5 minūtēs; pēc intranazālas, zemmēles, vaiga gļotādas, zemādas un intramuskulāras ievades — 10 minūtēs, pēc medikamenta perorālas un rektālas ievades — 30 minūtēs. Jo intensīvāka bija IS epizode, jo vairāk pacientu uzrādīja tendenci dot priekšroku zāļu invazīvai ievadīšanai, piemēram, intravenozi. [25]
Lai gan visi ievades ceļi ir efektīvi, tomēr dažām metodēm ģenērisko izmantojumu ierobežo speciāli nepieciešamais aprīkojums, zāļu sagatavošana un izglītots personāls. Invazīva zāļu ievade (intravenozi) ambulatoros apstākļos ir ierobežota. Tāpēc pētniecības un klīniskais darbs Eiropā vairāk vērsts uz transmukozām zāļu formām, respektīvi, vaiga gļotādas, zemmēles un intranazāliem ievades veidiem. Fentanils un tā atvasinājumi, ņemot vērā ļoti niecīgo fentanila molekulmasu (285 g/mol, morfīnam 337 g/mol), kā arī izteiktās lipofilās un arī hidrofilās īpašības, ir piemērotākā substance transmukozālai ievadei.
1990. gados uzskatīja, ka IS kupēšanai nepieciešami tādi paši opioīdi, kādus lieto bāzes sāpju terapijā. Tomēr vēlākos pētījumos secināts, ka opioīdu izmantojums vairāk atkarīgs no farmakokinētiskā, bet ne farmakodinamiskā profila. [26] Tas nozīmē, ka bāzes terapijā var būt jebkurš piemērots opioīds — tramadols, dihidrokodeīns, morfīns fentanils vai oksikodons, toties IS var efektīvi kupēt ar fentanilu vai citu opioīdu parenterālā formā.
Nav arī devas korelācijas IS un BS mazināšanā. [27] IS gadījumā opioīdu devu titrē līdzīgi kā BS gadījumā. [28] IS opioīdu izraisītās blaknes, kā sliktu dūšu, vemšanu, miegainību, galvas reiboni, kupē līdzīgi kā BS opioīdu devas vai ievades veida izraisītas blakusparādības. [26; 27]
Zāļu absorbcija caur mutes gļotādu
Mutes gļotāda klāj mutes dobumu un sastāv no plakanšūnu daudzkārtainā epitēlija, zem kura atrodas bāzes membrāna un lamina propria jeb saistaudu slānis. Kopējā gļotādas virsma mutes dobumā ir ap 200 cm2, kas nav daudz, salīdzinot ar kuņģa–zarnu trakta virsmu 350 000 cm2. [29] Saistaudu slānis ir labi apasiņots un substance no mutes gļotādas caur kapilāriem un venozajiem asinsvadiem, v. jugularis interna nokļūst tieši asinsritē. Asins cirkulācijas ātrums mutes dobuma gļotādā ir pietiekams zāļu ātrai nokļūšanai asinsritē. Zemmēles asinsrites ātrums ir 0,97 ml/min./cm2, bet vaiga gļotādā — 2,4 ml/min./cm2. Turklāt mutes gļotāda klāta ar siekalu slāni, ko izdala trīs pāri lielāko siekalu dziedzeru — pieauss, zemžokļa, zemmēles, kā arī simtiem mazāku siekalu dziedzeru, kas izkaisīti visā mutes dobumā. [26] Atšķirības ir arī epitēlija uzbūvē dažādās mutes dobuma vietās, kas nosaka ūdens caurlaidību. Tā ir lielāka mīkstajās aukslējās, vaiga gļotādā un zemmēles rajonā, kur epitēlijs nav pārragots, toties mēles mugurējo virsmu, cietās aukslējas un smaganas klāj daudzkārtains pārragotais epitēlijs. Atšķirības ir arī gļotādas biezumā. Vaiga gļotāda ir biezāka nekā zemmēles, attiecīgi 500—600 μm un 100—200 μm. [30] Tāpēc zemmēles gļotādas caurlaidība ir lielāka nekā pārējās mutes gļotādas daļās. [31]
Zāļu absorbcija caur mutes gļotādu notiek pasīvas uzsūkšanās veidā — substances (fentanila) molekulām izejot transcelulāri (caur šūnām), paracelulāri (gar šūnām) jeb starpšūnu spraugās, kā arī abu mehānismu kombinācijā. Lipofilie medikamenti pārsvarā absorbējas transcelulāri, respektīvi, izejot caur šūnām, bet hidrofilie — paracelulāri jeb caur starpšūnu telpu. Izteikti lipofilām substancēm, kāds ir fentanils, ir arī hidrofilas īpašības, kas nepieciešamas, šķērsojot šūnu iekšējo, šķidro daļu. [29] Tā kā starpšūnu telpas tilpums ir ierobežots, mazinās substanču uzsūkšanās un caurlaides spējas. [26; 29] Medikamenta daudzuma absorbcija caur mutes gļotādu ir ierobežota un tikai stipri iedarbīgas zāles var izmantot šim mērķim. [29]
Jāņem vērā daži faktori, kas ierobežo zāļu uzsūkšanos caur mutes gļotādu:
- substanču lipofilitāte; jo tā mazāka, jo absorbcija sliktāka; fentanils ir ievērojami lipofilāks par morfīnu;
- jonizēta substances daļa (sāļi, piemēram, morfīna sulfāts vai hidrohlorīds), kas mazina absorbciju;
- substances kontakta ilgums ar mutes gļotādu; [32]
- dažas slimības var ietekmēt absorbciju, piemēram, ja palielinās gļotādas biezums, uzsūkšanās var mazināties. Turpretim gļotādas iekaisums var pat palielināt substances uzsūkšanos. [32] Siekalu dziedzeru disfunkcijas dēļ mutes dobumā var mainīties siekalu un vides pH, kas ietekmēs tabletes šķīšanu, kā arī to zāļu absorbciju, kam sastāvdaļa būs jonu formā. [26] Fentanilam 80% no transmukozās devas ir nejonizētā formā, tāpēc 20% jonizētās daļas būtiski neietekmēt absorbciju. [18]
Perorālo transmukozālo medikamentu lietošanas priekšrocības [18; 33]
- Mutes dobumam ir viegli piekļūt, tam ir liela virsma zāļu absorbcijai.
- Mutes gļotāda ir labi apasiņota, zāles nonāk tieši asinsritē.
- Nokļuvušas asinsritē, substances apiet kuņģa–zarnu traktu un pirmās kārtas metabolismu aknās, tieši saistoties ar μ opioīdu receptoriem, pārsvarā CNS.
- Metode ir neinvazīva, ērta.
- Piemērota ambulatoriem apstākļiem.
- Piemērota pacientiem ar disfāgiju, īpaši galvas un kakla audzēju gadījumā; pacientiem ar izteiktu tūsku, kā arī tad, ja ir slikta dūša.
Absorbcija var samazināties [15; 18; 33]
Absorbcija var mazināties, ja siekalu daudzums mutē reducējas. Paliatīvajā aprūpē kahektiskiem pacientiem bieži novēro sausās mutes sindromu (kserostomiju). Šajā gadījumā gļotādu vispirms mitrina, izskalojot muti ar ūdeni, tikai tad fentanila tableti liek aiz vaiga vai zem mēles. Problemātiski var būt gadījumi ar izteiktu mutes gļotādas iekaisumu, piemēram, staru terapijas izraisītu mukozītu, ķīmijterapijas dēļ radušos gļotādas iekaisumu vai kandidozi, kad izteikta iekaisuma un tūskas dēļ tableti ir grūti palikt zem mēles vai vaiga gļotādas. Absorbcija var mazināties, ja lietoti dzērieni, kas pazemina mutes dobuma pH līmeni pirms zāļu ieņemšanas, piemēram, kafija, augļu sulas, gāzētie dzērieni, kā arī tad, ja tableti uzliek uz mēles vai smaganām — šajās vietās substance (fentanils) absorbējas vājāk. Absorbcija mazinās arī tad, ja tableti sakošļā. Pēc fentanila tabletes norīšanas absorbcija kuņģa–zarnu traktā ir ap 20%, kas ir nenozīmīgi izlaušanās sāpju remdēšanā.
Mutes transmukozālie opioīdi, devas noteikšana [10; 15; 18; 33]
Latvijā kopš 2014. gada kompensācijas sistēmā iekļautas transmukozālās (vaiga, zemmēles) tabletes un šķīstošās membrānas. Devas ir šādas:
- fentanila vaiga gļotādas tabletes: 100, 200, 400, 600 un 800 μg;
- fentanila zemmēles tabletes: 100, 200, 300, 400, 600 un 800 μg;
- fentanila vaiga gļotādas membrānas: 200, 400, 600, 800 un 1200 μg.
IS gadījumā devas titrēšanu jeb noteikšanu sāk ar mazāko, respektīvi, tablešu gadījumā ar 100 μg, bet membrānas gadījumā ar 200 μg. Ja IS nevājinās pēc 15—30 minūtēm, tad otro tableti vai membrānu lieto līdz nākamajam devas lielumam, proti, ja tabletes, tad 100 μg, otrajai membrānai 200 μg. Vienā sāpju epizodē nelieto vairāk kā 2 tabletes vai membrānas. Ja sāpju epizode atkārtojas, tad izmantojamā tabletes deva ir 200 μg, bet membrānas deva 400 μg. Vienas IS epizodes kupēšanai lieto ne vairāk kā 2 tabletes vai 2 šķīstošās membrānas devas, tās titrējot, līdz noteikta optimālā fentanila terapeitiskā reizes deva. Diennaktī vidēji ir 4 IS epizodes, tātad maksimāli izmanto 8 fentanila tabletes vai membrānas, t.i., 24 stundās kupē 4 IS epizodes. Ja epizodes ir biežāk, jāpārskata medikamenti bāzes sāpju terapijai, to deva jāpalielina vai jāveic opioīdu rotācija. Var izmantot arī citas atsāpināšanas metodes: apstarošanu, ķīmijterapiju, ķirurģiskas manipulācijas, blokādes, denervāciju u.c.
Izlaušanās sāpju terapijas vadlīnijas [4; 10; 11; 26]
- IS novērtējums, pacientam ciešot sāpes.
- IS specifisks novērtējums.
- Individuāla IS kupēšana.
- Apsvērt sāpju iemesla ārstēšanas iespējas.
- Ārstēt/novērst sāpes veicinošos faktorus.
- BS analgētisko hēmu modifikācijas iespējas (ATC — diennakts režīmā).
- IS epizožu ārstēšanā opioīdi ir izvēles medikamenti. [] "perorāli opioīdi nav optimālākie IS kupēšanas līdzekļi":
- opioīda devu IS gadījumā nosaka, individuāli titrējot;
- NSPL var noderēt IS ārstēšanā;
- IS terapijā ieteicamas ne–medikamentozas metodes;
- lietderīga invazīvo metožu izmantošana IS gadījumā.
- pacientus ar IS vienmēr atkārtoti specifiski izvērtēt.