

1. attēls
Vadlīnijas pacientu uzraudzības biežumam pēc GFĀ un albuminūrijas pakāpes
Persistējoša proteinūrija vai albuminūrija liecina par nieru bojājumu. [5; 6] Veseliem pieaugušajiem ar urīnu izdalās mazāk nekā 150 mg olbaltumvielu diennaktī un albumīna izdalīšanās ir zem 30 mg diennaktī. [1; 2] Ja diennaktī ar urīnu izdalās 30—300 mg albumīna, to sauc par mēreni palielinātu albuminūriju (iepriekš mikroalbuminūriju). Albumīna izdalīšanās virs 300 mg diennaktī ir izteikti palielināta albuminūrija (agrāk — makroalbuminūrija). [1] Savukārt proteinūrija definēta kā mērena (nefrītiska), ja urīnā 24 stundās izdalās 150—3000 mg olbaltumvielu, un smaga (nefrotiska), ja > 3500 mg. [5]
Albuminūrijas pakāpe un aGFĀ kalpo par pamatprincipu HNS klasifikācijā, slimības prognozē un terapijas efektivitātes izvērtēšanā (1. attēls). [1; 5]
Proteinūrijas diagnostika
Iedzīvotāju skrīningā un ikdienas ambulatorajā praksē plaši tiek izmantotas puskvantitatīvās metodes proteinūrijas noteikšanai. Ir divas šādas metodes: urīna teststrēmeles tests un urīna olbaltumvielu precipitācijas tests ar sulfosalicilskābi. Sulfosalicilskābes tests ļauj noteikt kopējo olbaltumvielu daudzumu urīnā, ieskaitot vieglās ķēdes.
Starptautiskajā praksē un arī Latvijā skrīningam biežāk izmanto teststrēmeles testu, kas olbaltumvielu noteikšanai izmanto kolorimetrisku metodi, kuras specifikas dēļ šādi iespējams diagnosticēt galvenokārt tikai albumīnu. [3; 6]
Svarīgi ir noteikt proteinūriju atkārtoti, lai izvērtētu, vai tā persistē. Ja diagnosticē proteinūriju, nepieciešama tās kvantitatīva noteikšana. [3] To var veikt šādi:
- nosakot olbaltumvielas 24 stundu urīnā (metode tiek uzskatīta par “zelta standartu”); [3]
- aprēķinot olbaltuma/kreatinīna attiecību nejaušā urīna porcijā, nosakot kopējo olbaltumvielu un kreatinīna koncentrāciju urīnā. Ideālā gadījumā analīze tiek veikta no pirmā rīta urīna vidējās strūklas. Šo attiecību var aprēķināt, izmantojot tiešsaistes kalkulatorus. Iegūtais rezultāts tiek izteikts olbaltumvielu mg/kreatinīna g (mg/g) vai mg/mmol. [3] Pieaugušajiem normāla olbaltuma/kreatinīna attiecība ir < 150 mg/g. Olbaltuma/kreatinīna attiecība aptuveni atbilst 24 stundu proteinūrijai, piemēram, olbaltuma/kreatinīna attiecība 1500 mg/g norāda uz 1,5 g olbaltumvielu izdalīšanos diennaktī; [3; 6]


1. tabula
Albuminūrijas un proteinūrijas smaguma pakāpes
- nosakot albumīna/kreatinīna attiecību (izsaka mg/g vai mg/mmol). Epidemioloģiskie dati liecina, ka albumīna daudzums urīnā (arī mikroalbuminūrija) cieši saistīts ar nieru un sirds—asinsvadu sistēmas slimību risku. Albumīna noteikšana ir precīzāka un jutīgāka nekā kopējā olbaltuma mērīšana. Metodes būtība līdzīga olbaltuma/kreatinīna noteikšanai, un to biežāk izvēlas pacientiem ar cukura diabētu (CD), arteriālu hipertensiju, lai diagnosticētu agrīnu nieru bojājumu. [4] Sakarību starp olbaltumvielu vai albumīna un kreatinīna attiecību var redzēt 1. tabulā.
Interpretējot olbaltuma/kreatinīna attiecību, jāņem vērā pacienta muskuļu masa. Cilvēkiem ar lielu muskuļu masu, kuriem diennakts kreatinīna izdalīšanās pārsniedz 1000 mg, olbaltuma/kreatinīna attiecība var novērtēt proteinūriju kā zemāku, nekā tā ir patiesībā. Savukārt kahektiskiem pacientiem vai tiem, kam ir samazināta muskuļu masa un kreatinīna izdalīšanās zem 1000 mg diennaktī, olbaltuma/kreatinīna attiecība var pārvērtēt proteinūrijas līmeni. [3] Iegūtos rezultātus ietekmē arī hematūrija, mēnešreizes, fiziska slodze, infekcija un ļoti koncentrēts urīns, [4] tāpēc šiem faktoriem jāpievērš uzmanība.
Ja, vienlaicīgi nosakot olbaltuma/kreatinīna attiecību un albumīna/kreatinīna attiecību, starpība starp abiem rezultātiem ir ievērojama, jāapsver, ka proteinūrijas iemesls ir paraproteinēmija. [6] Proteinūriju veidojošo olbaltumvielu kvalitatīvai izvērtēšanai jāveic urīna imūnelektroforēze. [5; 6]
Proteinūrijas veidi


2. tabula
Proteinūrijas veidi
Ir četri galvenie proteinūrijas veidi (2. tabula).
- Glomerulāra proteinūrija. Rodas, kad vidējas un liela izmēra olbaltumvielas (piemēram, albumīns) glomerulāro filtru barjeras bojājuma dēļ pastiprināti filtrējas caur glomerulu kapilāru sieniņu. Šeit ietilpst gan proteinūrija, kuras cēlonis ir diabētiska nefropātija, glomerulonefrīts, gan arī labdabīgāki cēloņi, piemēram, ortostatiska vai fiziskas slodzes izraisīta proteinūrija.
- Tubulāra proteinūrija. Mazas molekulmasas olbaltumvielas (bēta2 mikroglobulīns, imūnglobulīnu vieglās ķēdes, albumīna sadalīšanās produkti u.c.) parasti tiek filtrētas caur glomerulāro filtru un gandrīz pilnībā reabsorbētas nieru proksimālajos kanāliņos. Ja nieru proksimālo kanāliņu reabsorbcijas funkcija tubulointersticiālu slimību dēļ ir traucēta, šo olbaltumvielu izdalīšanās urīnā palielinās. Tubulāra proteinūrija bieži netiek diagnosticēta klīniski, jo urīna teststrēmeles tests ir mazjutīgs pret ne–albumīna proteīniem un izdalīto olbaltumvielu daudzums ir neliels. Paaugstināta imūnglobulīnu vieglo ķēžu ekskrēcija tubulārā proteinūrijā ir viegla, poliklonāla (gan kappa, gan lambda) un parasti nekaitīga nierēm — atšķirībā no monoklonālās un potenciāli nefrotoksiskas pārplūdes proteinūrijas, kāda novērojama multiplās mielomas gadījumā.
- Pārplūdes proteinūrija. Šis proteinūrijas veids attīstās, kad rodas kādas mazas molekulmasas olbaltumvielas pārprodukcija, izraisot tās pastiprinātu filtrāciju un izdalīšanos ar urīnu. Visbiežāk to novēro multiplās mielomas gadījumā, kad palielinās imūnglobulīnu vieglo ķēžu daudzums. Līdzīgi procesi var notikt arī rabdomiolīzes (ar mioglobīnu) vai intravaskulāras hemolīzes (ar brīvo hemoglobīnu) gadījumā. Filtrētās olbaltumvielas pārsniedz nieru proksimālo kanāliņu reabsorbcijas spēju. Pacientiem ar multiplo mielomu var attīstīties arī tubulāras proteinūrijas pazīmes, jo vieglās ķēdes var būt toksiskas nieru kanāliņiem, samazinot to reabsorbcijas spēju.
- Postrenāla proteinūrija. Šā veida proteinūrija saistīta ar urīnceļu iekaisumu, piemēram, urīnceļu infekciju gadījumā. Lai gan precīzs mehānisms nav pilnībā skaidrs, iekaisums var palielināt olbaltumvielu izdalīšanos ar urīnu. Šajā gadījumā izdalītās olbaltumvielas biežāk ir imūnglobulīni (IgA, IgG), nevis albumīns, un to kopējais daudzums parasti ir neliels. Bieži tiek novērota arī leikocitūrija. Proteinūrija var rasties arī pacientiem ar nefrolitiāzi vai urīnceļu audzējiem. [3]
Kā rīkoties, ja diagnosticēta proteinūrija?
Pieaugušie pacienti, kam, atkārtoti veicot urīna analīzi, diagnosticēta proteinūrija, jāizmeklē padziļināti, ietverot mērķtiecīgu anamnēzes ievākšanu, objektīvo izmeklēšanu, laboratoriskos testus un attēldiagnostiku, lai identificētu iespējamos proteinūrijas cēloņus un izvērtētu nepieciešamību pēc tālākas izmeklēšanas vai nosūtīšanas pie nefrologa.
1. Mērķtiecīga anamnēzes ievākšana, īpašu uzmanību pievēršot:
- pavadošiem simptomiem:
- putojošs urīns — tā parādīšanās var norādīt uz proteinūrijas sākumu, taču tā ne vienmēr ir. Viens lielu burbuļu slānis urīnā, kas ātri izzūd, tiek uzskatīts par normu,
- makrohematūrija — urīns var būt sarkans, rozā, brūns vai rūsas krāsā,
- dizūrija ar vai bez drudža — var liecināt par urīnceļu infekciju,
- sistēmiski simptomi (drudzis, izsitumi, sāpes locītavās, svara zudums) var liecināt par sistēmisku slimību ar glomerulu bojājumu (sistēmisku sarkano vilkēdi u.c.);
- pārejoši faktori: nesen pārciests drudzis, intensīva fiziska slodze, urīnceļu infekcija;
- blakusslimības:
- arteriāla hipertensija, CD,
- autoimūnas slimības (piemēram, sistēmiska sarkanā vilkēde, sistēmisks vaskulīts),
- onkoloģiskas slimības,
- infekcijas: B vai C hepatīts, HIV infekcija,
- zināmas nieru slimības;
- medikamentu izraisīta proteinūrija:
- nesteroīdie pretiekaisuma līdzekļi var izraisīt akūtu vai hronisku intersticiālu nefrītu,
- onkoloģijā lietotie medikamenti (piemēram, bevacizumabs, pembrolizumabs, ipilimumabs) var izraisīt proteinūriju;
- ģimenes anamnēze — nieru slimības ģimenes locekļiem.
2. Fizikālā izmeklēšana:
- asinsspiediens — jauni radusies vai grūti kontrolējama hipertensija var liecināt par nieru bojājumu,
- tūskas — īpaši pēkšņi sākusies vai dinamikā progresējoša tūska,
- ādas izsitumi vai purpura — var liecināt par vaskulītu vai citu sistēmisku slimību.
3. Laboratoriskā izmeklēšana:
- urīna analīze (teststrēmele) un urīna sedimanta mikroskopija:
- apstiprina pastāvīgu proteinūriju,
- sedimenta mikroskopijā identificē eritrocītus urīnā — dismorfie eritrocīti, eritrocītu un leikocītu cilindri norāda uz glomerulu bojājumu,
- urīna olbaltumvielu kvantitatīva analīze jāveic visiem pacientiem ar pozitīvu olbaltumvielu urīna teststrēmeles testu. Izmanto urīna olbaltuma/kreatinīna vai albumīna/kreatinīna attiecību vai nosaka olbaltumvielas 24 stundu urīnā,
- nieru funkcijas izvērtējums — nosaka kreatinīna līmeni serumā un aGFĀ. [3] Ja GFĀ samazināts, jāvērtē, vai ir akūts nieru bojājums vai HNS. Lai to diferencētu, uzmanība jāpievērš iespējamām HNS komplikācijām: anēmijai, kaulu un minerālu vielmaiņas traucējumiem, papildus nosakot pilnu asins ainu, kālija, kalcija, fosfora, albumīna un parathormona līmeni serumā, [10]
4. Nieru ultrasonogrāfija jāveic pacientiem ar:
- izmainītu urīna analīzi (proteinūrija, eritrocitūrija).
- nieru funkcijas traucējumiem (paaugstināts kreatinīna līmenis, samazināts GFĀ). [10]
Pacientiem virs 40 gadu vecuma ar hiperkalciēmiju, smagu anēmiju, kaulu bojājumiem, proteinūriju vai progresējošu nieru funkcijas pasliktināšanos bez skaidra iemesla jāveic seruma un urīna olbaltumvielu elektroforēze ar imūnfiksāciju un brīvo vieglo ķēžu noteikšanu serumā un urīnā, šādi, iespējams, diagnosticējot multiplo mielomu. [10]
Kad pacients jānosūta pie nefrologa? Ja pacientam ir sistēmiski simptomi ar nieru iesaisti, izmainīta urīna analīze (proteinūrija, eritrocitūrija/dismorfie eritrocīti) un/vai nieru darbības traucējumi (paaugstināts kreatinīna līmenis asinīs vai samazināts GFĀ, īpaši, ja GFĀ samazinās zem 45 ml/min./1,73 m²), nepieciešama nefrologa konsultācija tālākai izmeklēšanai un ārstēšanai: diagnostika var ietvert papildu laboratoriskos testus (seroloģiskos) un bieži arī nieru biopsiju, īpaši, ja proteinūrija pārsniedz 1 g dienā un ir aizdomas par glomerulāru patoloģiju, kad jāsāk specifiska terapija. [1; 3; 5]
Nepieciešamā terapija, diagnosticējot proteinūriju
Proteinūrijas ārstēšanas galvenais mērķis ir identificēt un ārstēt tās pamatcēloni, vienlaikus cenšoties samazināt proteinūrijas un jo īpaši albuminūrijas pakāpi. [5] \
Efektīva ārstēšana nozīmē gan korekcijas dzīvesveidā, gan medikamentozu terapiju.
Dzīvesveida korekcijas
Asinsspiediena kontrole (mērķis: < 130/80 mmHg, īpaši pacientiem ar albuminūriju).
- Diētas un uztura korekcijas:
- olbaltumvielu uzņemšanas ierobežošana samērīgi HNS pakāpei (HNS III—V pakāpe: 0,8 g olbaltumvielu uz kg svara dienā []),
- sāls uzņemšanas ierobežošana: mazāk nekā 5—6 g nātrija hlorīda dienā, lai mazinātu renīna—angiotensīna sistēmas (RAS) inhibitoru efektivitātes zudumu un hipertensiju.
- Ķermeņa masas normalizēšana. Liekais svars ir proteinūrijas riska faktors; mērķtiecīga svara zaudēšana var samazināt albumīna izdalīšanos.
- Glikozes līmeņa kontrole — īpaši nozīmīga pacientiem ar CD. [4]
Medikamentozā terapija
Renīna—angiotensīna sistēmas inhibitori (RASi)
RAS sistēmas blokāde ar angiotensīnu konvertējošā enzīma inhibitoriem (AKEI) vai angiotensīna receptoru blokatoriem (ARB) palēnina HNS progresēšanu, būtiski samazinot proteinūriju, vislabākos rezultātus uzrāda pacienti ar stipri palielinātu albuminūriju ( > 300 mg/g).
Pacientiem ar normoalbuminūriju AKEI vai ARB lietošana galvenokārt indicēta asinsspiediena kontrolei, jo papildu nefroprotektīvs efekts šajā pacientu grupā nav pārliecinoši pierādīts. [8]
Saskaņā ar 2024. gada KDIGO vadlīnijām, AKEI vai ARB lietošana jāsāk maksimālajā panesamajā devā visiem pacientiem ar HNS (G1—G4) un albuminūriju (A2—A3). Jebkura AKEI, ARB un tiešā renīna inhibitoru kombinācija nav rekomendēta paaugstinātā hiperkaliēmijas un akūtas nieru mazspējas riska dēļ. [4; 8] 2—4 nedēļas pēc terapijas sākšanas vai devas korekcijas jānosaka kreatinīna un kālija līmenis serumā. Hiperkaliēmija, kas saistīta ar RASi lietošanu, koriģējama ar diētu vai cilpas diurētiķiem (ja tādi indicēti), nepārtraucot un nesamazinot RASi devu. Samazināt devu vai pārtraukt RASi rekomendēts simptomātiskas hipotensijas, nekoriģējamas hiperkaliēmijas gadījumā vai tad, ja kreatinīna līmenis četrās nedēļās palielinās par > 30 %. [4]
Nātrija—glikozes līdztransportiera–2 inhibitori (SGLT2i)
SGLT2i, vieni no visbiežāk izrakstītajiem perorāli lietojamajiem diabēta līdzekļiem pasaulē, labvēlīgi ietekmē glikēmijas kontroli, svara zudumu, asinsspiediena pazemināšanu un aizsardzību pret smagiem sirds—asinsvadu sistēmas notikumiem un palēnina HNS progresēšanu. [7]
SGLT2i, kas sākotnēji bija domāti glikēmijas kontrolei CD pacientiem, negaidīti izrādījās daudzsološi nefroloģijā, jo uzrādīja nefroprotektīvu efektu, samazinot albuminūriju CD pacientiem. Vēlākos pētījumos tika iekļauti pacienti gan ar CD, gan pacienti bez diabēta, kuri dapagliflozīnu lietoja kopā ar AKEI vai ARB. Abās grupās pētījums tika pārtraukts priekšlaicīgi, jo uzrādīja nepārprotamu pozitīvu šā medikamenta ietekmi uz nieru un sirds—asinsvadu sistēmu. Jaunākais pētījums EMPA—KIDNEY paplašināja pierādījumu bāzi, parādot šā medikamenta efektivitāti dažādas etioloģijas HNS pacientiem neatkarīgi no tā, vai viņiem ir/nav CD. Kopumā šie pētījumi iezīmē nozīmīgu progresu HNS ārstēšanā, pirmo reizi daudzu gadu laikā piedāvājot efektīvu un drošu iespēju, kā palēnināt HNS progresēšanu. [8]
2024. gada KDIGO vadlīnijās rekomendēts SGLT2i terapijā pievienot pacientiem ar HNS un:
- 2. tipa CD, kuriem GFĀ ≥ 20 ml/min./1,73 m²,
- aGFĀ ≥ 20 ml/min./1,73 m² ar urīna albumīna/kreatinīna attiecību ≥ 200 mg/g (≥ 20 mg/mmol) vai aGFĀ 20—45 ml/min./1,73 m² ar urīna albumīna/kreatinīna attiecību < 200 mg/g (< 20 mg/mmol),
- sirds mazspēju neatkarīgi no albuminūrijas līmeņa.
Kad sākta terapija ar STGL2i, to var turpināt arī tad, ja GFĀ samazinās zem 20 ml/min./1,73 m², ja vien tie tiek tolerēti vai nepieciešams sākt nieru aizstājterapiju. SGLT2i īslaicīgi atceļami ilgstošas badošanās, operācijas vai kritiskas slimības laikā (kad var būt lielāks ketozes risks). Sākot šo medikamentu lietošanu, vērojama atgriezeniska aGFĀ samazināšanās terapijas sākumā, un tā parasti nav indikācija terapijas pārtraukšanai. [4]
Saskaņā ar NVD sniegto informāciju, kompensējamo zāļu sarakstā iekļauti divi STGL2i — empagliflozīns un dapagliflozīns (no 2025. gada 15. aprīļa), ko var izrakstīt ar nosacījumu — izraksta nefrologs pieaugušiem pacientiem ar HNS III (N18.3) vai IV (N18.4) pakāpi, ja:
- aGFĀ ≥ 20 ml/min./1,73m²,
- mikroalbuminūrija ≥ 30 mg/g.
Nesteroīdie minerālkortikoīdu receptoru antagonisti (MRA)
Steroīdie MRA, piemēram, spironolaktons un eplerenons, jau daudzus gadus tiek izmantoti primāra aldosteronisma, rezistentas hipertensijas un sirds mazspējas ar samazinātu izsviedes frakciju ārstēšanā. Lai gan šie medikamenti efektīvi samazināja albuminūriju pacientiem ar HNS, to izmantošanu ierobežoja hiperkaliēmija. [4; 8]
Pēdējos gados izstrādāti jauni nesteroīdie MRA, no kuriem viens — finerenons — divos nozīmīgos pētījumos uzrādīja būtiskus uzlabojumus nieru un sirds—asinsvadu sistēmas iznākumos pacientiem ar 2. tipa CD un paaugstinātu albuminūriju. Pētījumā FIDELIO–DKD finerenons par 18 % samazināja nieru mazspējas risku un par 14 % sirds—asinsvadu sistēmas notikumus ar samērā retiem gadījumiem, kad terapija bija jāpārtrauc hiperkaliēmijas dēļ. Arī pētījumā FIGARO–DKD, kur iekļāva zemāka riska pacientus, finerenons būtiski samazināja sirds—asinsvadu sistēmas notikumus un nedaudz uzlaboja nieru iznākumus, piemēram, terminālas nieru mazspējas (N18.5) risku par 36 %. Pētījuma FIDELITY analīze norādīja, ka finerenona efektivitāte ir līdzīga SGLT2i (īpaši pacientiem ar augstāku risku) un kombinēta lietošana ar SGLT2i varētu vienlaikus uzlabot efektivitāti un drošumu, samazinot hiperkaliēmijas risku. [8]
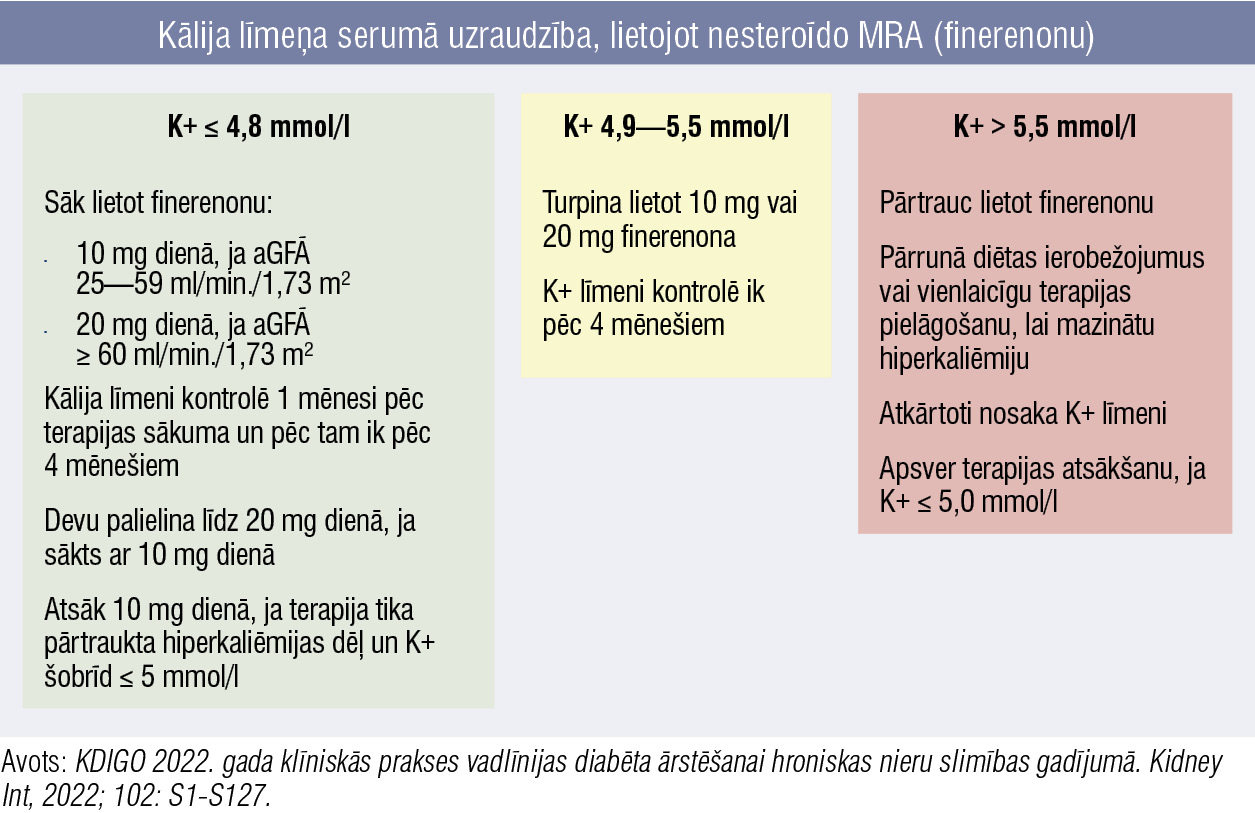

2. attēls
Kālija līmeņa serumā uzraudzība, lietojot nesteroīdo MRA (finerenonu)
Saskaņā ar 2024. gada KDIGO vadlīnijām, pieaugušajiem ar 2. tipa CD, aGFĀ > 25 ml/min./1,73 m², normālu kālija līmeni serumā un albuminūriju (> 30 mg/g), kuriem RASi maksimālajā panesamajā devā nenovērš albuminūriju, rekomendēts lietot nesteroīdos MRA ar pierādītu nieru vai kardiovaskulāru ieguvumu. Tie ir vispiemērotākie pacientiem ar augstu HNS progresēšanas un sirds—asinsvadu sistēmas notikumu risku, un tos var pievienot terapijai ar RASi un SGLT2i. Lai samazinātu hiperkaliēmijas risku, tie rekomendēti pacientiem ar stabilu normālu kālija līmeni serumā, pēc terapijas sākšanas regulāri jākontrolē kālija līmenis (2. attēls). [4]
Glikagonam līdzīgā peptīda–1 receptoru agonisti (GLP1 RA)
Nesen publicēti dati no pētījuma FLOW, kas ir nozīmīgs starptautisks klīniskais pētījums, kurā vērtēja, vai semaglutīds (GLP1 RA) var palēnināt nieru slimības progresēšanu un samazināt sirds—asinsvadu sistēmas risku pacientiem ar 2. tipa CD un HNS. Pārliecinoši pozitīvo rezultātu dēļ pētījumu 2024. gadā pārtrauca priekšlaicīgi. Semaglutīds būtiski pazemināja albuminūrijas līmeni (neatkarīgi no albuminūrijas sākotnējā līmeņa), samazināja nopietnu nieru komplikāciju un kardiovaskulārās nāves risku, kas norāda uz tā potenciālu kļūt par nozīmīgu terapijas līdzekli HNS pacientiem ar CD. [9]
Arī 2024. gada KDIGO vadlīnijas uzsver GLP1 RA nozīmīgumu, rekomendējot ilgstošas darbības GLP1 RA sākt pieaugušajiem ar 2. tipa CD un HNS, kuri nav sasnieguši individualizētos glikēmijas mērķus, lietojot SGLT2i un metformīnu, vai pacientiem, kas šos medikamentus nevar lietot. [4]