Inhalējamie glikokortikoīdi HOPS ārstēšanā
Jau vairākus gadu desmitus turpinās diskusija par inhalējamo glikokortikoīdu (IGK) izmantošanu HOPS ārstēšanā. Izvēles līdzekļi HOPS ārstēšanā ir bronhodilatatori. IGK atsevišķi monoterapijā HOPS ārstēšanā lietot neiesaka. Turpretī ārstēšanas efektivitāte ir pierādīta kombinācijā ar ilgstošas darbības β2 agonistiem pacientu grupā ar biežiem vidēji smagiem vai smagiem uzliesmojumiem (≥ 2 × gadā) un FEV1< 60%. Pētījumā TORCH (Towards a Revolution in COPD Health) ārstēšana ar IGK un ilgstošas darbības β2 agonistu kombināciju vienā inhalatorā vairāk mazināja slimības uzliesmojumu skaitu nekā ārstēšana ar ilgstošas darbības β2 agonistu vai IGK monoterapiju. [2]
Līdzīgi uzliesmojumu skaita samazināšanos un laika perioda palielināšanos līdz pirmajam uzliesmojumam, ārstējot pacientus ar IGK un ilgstošas darbības β2 agonistu kombināciju, novēroja arī citos pētījumos. [3; 4]
Īpaša HOPS pacientu grupa ir pacienti, kam raksturīga tendence uz atgriezeniskumu bronhodilatācijas testā (ΔFEV1 ≥ 12%) un/vai eozinofilais iekaisums elpceļos (eozinofīlija ierosinātās krēpās ≥ 3% un/vai pastiprināta slāpekļa mon-oksīda (NO) koncentrācija izelpas gaisā; FeNO > 27 ppb). Galvenais IGK efektivitātes kritērijs arī šeit ir elpceļu eozinofilais iekaisums, un šajā pacientu apakšgrupā ārstēšana ar tiem ir īpaši noderīga.
Var secināt, ka IGK terapija pacientiem ar HOPS ir efektīva un nepieciešama tiem pacientiem, kam ir bieži slimības uzliesmojumi un t. s. overlap grupā, kam raksturīgas astmai līdzīgas iezīmes. Piemēram, jaunākajās HOPS ārstēšanas vadlīnijās, ko izstrādājušas Čehijas un Spānijas plaušu slimību asociācijas, speciāli tiek izdalīti HOPS fenotipi, kam ir mērķtiecīgi ārstēšanā izrakstīt IGK. [5; 6]
Pneimonija pacientiem ar HOPS
HOPS pacientiem varbūtība saslimt ar pneimoniju pati par sevi ir palielināta. Analizējot pneimonijas risku populācijā, HOPS var uzskatīt par neatkarīgu pnei-monijas riska faktoru (OR 1,99; 95% TI [1]). [7] Turklāt pneimonijas risks pacientiem ar HOPS atkarīgs no slimības smaguma pakāpes pēc GOLD (Global initiative for Obstructive Lung Disease). Pacientiem ar II stadiju pneimonijas novēro daudz retāk nekā pacientiem ar III un IV stadiju. Katrā no šīm stadijām ir tendence, ka pneimonija pacientiem, ko ārstē ar IGK, attīstās biežāk. [2]
Pacientiem ar HOPS pneimonija norit smagāk un biežāk novēro komplikācijas. Piemēram, mirstība pacientiem ar HOPS, kuri ar mākslīgo plaušu ventilāciju saistītu pneimoniju ārstējas intensīvās terapijas nodaļā, sasniedz 60%, salīdzinot ar 43% pacientu grupā, kam nav HOPS (OR 1,96; 95% TI [1]; p = 0,027). [8]
Inhalējamo glikokortikoīdu ietekme uz pneimonijas risku pacientiem ar HOPS
Analizējot TORCH pētījuma rezultātus, uzmanību pievērsa dati, kas liecināja, ka HOPS pacientiem, ko ārstē ar IGK monoterapijā vai kombinācijā ar ilgstošas darbības β2 agonistiem, biežāk novēro pneimoniju. Pacientiem, ko ārstēja ar flutikazona propionātu monoterapijā, pneimonijas bīstamības attiecība HR (hazard ratio) pret placebo pieauga līdz 1,53 (95% TI [1]; p < 0,001), bet kombinētās terapijas grupā līdz 1,64 (95% TI [1]; p < 0,001). Pneimonijas riska palielināšanos novēroja par spīti tam, ka pētījuma laikā bija redzams - ārstēšana pārliecinoši samazina HOPS uzliesmojumu biežumu, no kuriem daļa gadījumu var komplicēties tieši ar pneimoniju. Salīdzinoši pneimonijas risks pacientiem, ko ārstēja ar salmeterolu, būtiski nepalielinājās - HR 1,09 (95% TI []; p = 0,465). Varbūtība saslimt ar pneimoniju šajā 3 gadus ilgajā pētījumā sasniedza 19,6% flutikazona propionāta/salmeterola, 18,3% - flutikazona propionāta, 13,3% - salmeterola un 12,3% - placebo grupā.[9; 10] Arī pētījumā INSPIRE (Investigating New Standards for Prophylaxis in Reduction of Exacerbations) novēroto pneimoniju skaits flutikazona propionāta/salmeterola terapijas grupā bija ievērojami lielāks - 8% pret 4% tiotropija bromīda terapijas grupā (HR 1,94; 95% TI [1]; p = 0,008). [11]
Šie rezultāti izraisīja lielu interesi pētnieku vidū un turpmākajos gados tika veikti un publicēti dažādi pētījumi, to apkopojumi un meta-analīzes, meklējot atbildi uz jautājumu, vai IGK palielina pnei-monijas risku pacientiem ar HOPS.
Līdz šim lielākais pētījums publicēts 2010. gadā. Pētījumā no dažādām datubāzēm tika iekļauti 145 568 HOPS pacienti, kas vecāki par 65 gadiem. 1998.-2002. gadā šajā grupā tika novērotas 13 995 pneimonijas. Pacientu grupā, ko ārstēja ar IGK, varbūtība nonākt slimnīcā ar pneimoniju bija par 1,38 (95% TI [1]) lielāka. [12]
Salīdzinot rentgenoloģiski pierādītas pneimonijas biežumu HOPS pacientiem 18 pētījumu meta-analīzē (16 996 pacienti) par kombinēto terapiju, IGK un ilgstošas darbības β2 agonistu lietošanu salīdzinājumā ar ilgstošas darbības β2 agonistu monoterapiju vai IGK monoterapiju ar placebo, to novēroja attiecīgi 1,68 un 1,81 reizes biežāk. [13; 14]
Citā pētījumā (23 942 pacienti ar HOPS un 95 768 kontroles grupas pacienti) akūtas hospitalizācijas varbūtība pneimonijas dēļ, ja ārstēšanā lietoti IGK, bija par 70% lielāka nekā HOPS pacientu grupā, kas IGK nelietoja (RR 1,70; 95% TI [1]). Pneimonijas risks bija atkarīgs no IGK devas. Jo lielāka IGK deva, jo augstāks pneimonijas riska līmenis. Pat pacientiem, kas IGK bija lietojuši iepriekš, gadu pēc ārstēšanas pārtraukšanas pneimonijas riska līmenis šajā pētījumā bija nedaudz, bet statistiski ticami paaugstināts. Pagarinoties laika sprīdim pēc ārstēšanas pārtraukšanas, risks pakāpeniski mazinājās. [15]
Apkopojot vairāku meta-analīžu rezultātus, pneimonijas riska faktori pacientiem ar HOPS un IGK terapiju ir šādi:
- liela IGK deva [15];
- slikta plaušu ventilācijas funkcija;
- kombinētā terapija ar ilgstošas darbības β2agonistiem [16].
TORCH pētījuma rezultāti skaidri definē pneimonijas riska faktorus pacientiem, kas lieto flutikazona propionātu:
- FEV1 < 50%;
- ĶMI < 25kg/m2;
- vecums > 55g.;
- anamnēzē HOPS uzliesmojumi. [9]
Budezonīda pētījumos pneimoniju biežāk novēroja pacientiem, kas bija vecāki un kam bija zemāks FEV1% pēc bronhodilatatora inhalācijas. [17]
Ārstēšanas ilguma ietekmes rezultāti uz pneimonijas risku dažādos pētījumos ir pretrunīgi. Divos nepublicētos vispārējās prakses ārstu datubāzes (General Practice Research Database) pētījumos novēroja būtisku pneimoniju skaita palielināšanos IGK terapijas grupā pēc 24-48 mēnešiem kopš ārstēšanas sākuma, bet ne pirmajos divos gados. [18; 19] Turpretī Drummond et al. publicētajā meta-analīzē pneimoniju risks būtiski bija palielināts pacientu grupā, kas ar IGK ārstēti nepilnus 2 gadus. [16] Pret pneimonijas riska atkarību no ārstēšanas ilguma ir līdzīga pneimoniju skaita palielināšanās gan TORCH pētījumā, gan budezonīda pētījumos visa pētījumu laika garumā. [3; 4; 10]
Astmas pacientiem atšķirībā no HOPS nenovēro pneimoniju riska palielināšanos IGK terapijas dēļ.
Dažādu IGK ietekme uz pneimonijas risku pacientiem ar HOPS
PATHOS pētījumā, retrospektīvi analizējot informāciju Zviedrijas veselības aprūpes sistēmas datubāzēs 1999.-2009. gadā par 21 361 pacientu ar HOPS, konstatēts, ka 9893 pacientiem ordinēta kombinētā terapija: 7155 ar budezonīda un formoterola 320/9 µg 2 × dienā un 2738 ar flutikazona propionāta un salmeterola 500/50 µg 2 × dienā. Salīdzinot divas vienādotas pacientu grupas ar 2734 pacientiem katrā flutikazona propionāta un salmeterola grupā, risks saslimt ar pneimoniju bija par 73% (RR 1,73; 95% TI 1,57-1,90; p < 0,001) un risks nonākt slimnīcā ar pneimoniju par 74% lielāks (RR 1,74; 95% TI 1,56-1,94; p < 0,001) nekā pacientiem, ko ārstēja ar budezonīdu un formoterolu (skat. 1. attēlu).
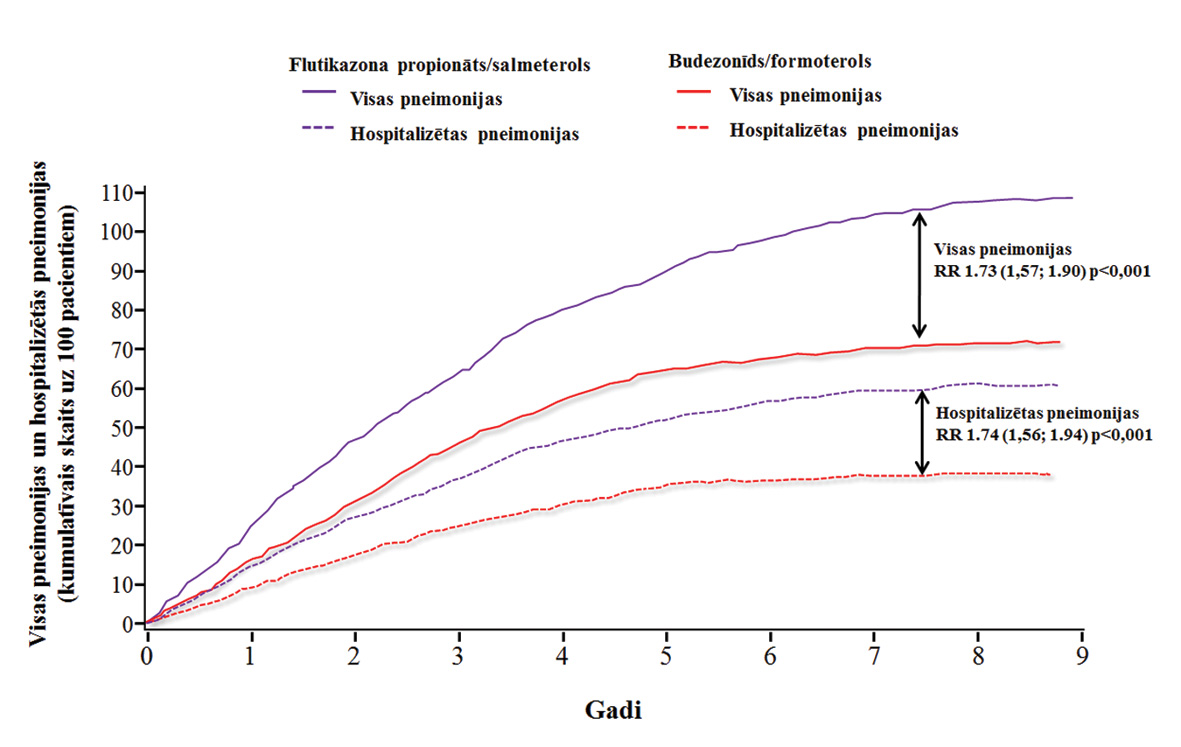

1. attēls
Pneimoniju skaits uz 100 pacientiem gadā PATHOS pētījumā
PATHOS pētījums ir viens no pirmajiem publicētajiem pētījumiem, kur salīdzināta budezonīda/formoterola un flutikazona propionāta/salmeterola ietekme uz uzliesmojumu biežumu. Budezonīda/formoterola grupā pacientiem novēroja par 26% mazāk HOPS uzliesmojumu nekā flutikazona propionāta/salmeterola grupā (RR 0,74; 95% TI []; p < 0,0001).
Arī citi iepriekš publicēti pētījumi liecina, ka dažādu IGK ietekme uz pneimonijas risku varētu atšķirties. Piemēram, salīdzinot pētījumus, kur pacienti ārstēti ar flutikazona propionātu, ar pētījumiem, kur pacienti ārstēti ar budezonīdu, pneimonijas risks pirmajā bija RR 1,67 (95% TI [1]; p<0,00001), otrajā - RR 1,19 (95% TI []; p = 0,19), bet pēdējam riska pieaugums nav statistiski ticams. Šajā meta-analīzē bija iekļauts tikai viens pētījums, kurā pacienti ārstēti ar mometazona furoātu, un šajā gadījumā pneimonijas risks IGK terapijas grupā dubultojās (RR 2,00; 95% TI []; p = 0,12), bet atšķirība nebija statistiski ticama. [14]
Atsevišķi analizējot pētījumus, kur lietots tikai budezonīds, netika novērota būtiska pneimoniju skaita atšķirība pacientiem, kas saņēma IGK, un kontroles grupu, kas saņēma formoterolu vai placebo. Abās terapijas grupās pneimonijas novēroja 3% pacientu. Visu diagnosticēto pnei- moniju risks šajā pētījumā bija HR 1,05 (95% TI []). Hospitalizētās pneimonijas jeb gadījumus, kas tika klasificēti kā smagas nevēlamas blakusparādības, novēroja 1% pacientu budezonīda grupā un 2% kontroles grupā, HR 0,92 (95% TI []). [17]
Divos pētījumos par pacientiem ar vieglu HOPS (FEV1 ~ 80%), kuros ārstēšanas ilgums ar budezonīdu bija divas reizes garāks, novēroja pneimonijas riska palielināšanos. [20; 21] Šie pētījumi varētu liecināt par to, ka relatīvi īsajos budezonīda pētījumos varētu neparādīties pneimoniju riska palielināšanās efekts. Pret šo iespēju liecina līdzīga pneimoniju skaita palielināšanas visā TORCH pētījuma un budezonīda pētījumu garumā. [3; 4; 10]
Netieši salīdzinot pneimonijas risku budezonīdam pret flutikazona propionātu, pirmajam šis risks ir mazāks (skat. tabulu). [22]
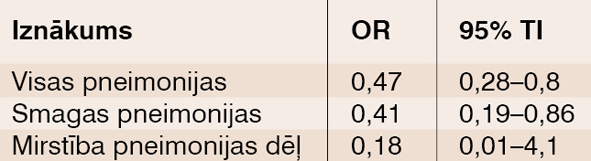

1. tabula
Pneimonijas risks, netieši salīdzinot budezonīdu un flutikazona propionātu (ja OR < 1, tad budezonīds pneimoniju izraisa retāk)
Tā kā pētījumu par budezonīda ietekmi uz pneimonijas risku ir ievērojami mazāk, tie ir īsāki un pacienti šajos pētījumos ir ļoti atšķirīgi, tad šādas meta-analīzes rezultāti jāinterpretē uzmanīgi un nav pilnībā iespējams izslēgt pneimonijas risku palielinošo efektu. Ja šāds risks ir, tas, visticamāk, ir neliels, nepārsniedz statistiskās ticamības robežas un ir mazāks nekā flutikazona propionātam. [14]
IGK un pneimonijas riska pieauguma klīniskā nozīme
Vai ārstiem būtu jāuztraucas par pneimonijas un nāves draudiem pacientiem, kas lieto IGK vai kombinētos inhalatorus?
Klīnisko pētījumu rezultāti liecina, ka IGK palielina pneimonijas risku pacientiem ar HOPS. HOPS par 60% palielina varbūtību, ka pacients nonāks slimnīcā ar akūtu pneimoniju. Varbūtība saslimt ar smagu pneimoniju palielinās vēl vairāk - par 70%. Zināms, ka pacientiem ar HOPS pneimonijas norisinās smagāk un biežāk novēro ar pneimoniju saistītas komplikācijas. Arī nāves riska līmenis HOPS pacientiem ar smagu pneimoniju, kuri ār-stējas intensīvās terapijas nodaļā, ir ļoti augsts un ievērojami pārsniedz 50%, bet, analizējot IGK terapijas ietekmi uz nāves risku, tas nepalielinās.
Analizējot jau pieminētā TORCH pētījuma rezultātus, IGK terapijas grupā, lai gan pneimoniju skaits palielinājās, šajā pētījumā nenovēroja mirušo pacientu, hospitalizāciju un slimnīcā mirušo pacientu skaita pieaugumu. Šo gadījumu skaits gan flutikazona propionāta/salmeterola un flutikazona propionāta grupā bija ~ 60% no visu gadījumu skaita tāpat kā placebo grupā. [9]
To apstiprina fakts, ka, lai gan 2,25 reizes palielinās pneimonijas un hospitalizācijas risks, hospitalizācijas ilgums IGK grupā un pacientu grupā bez kortikosteroīdiem praktiski neatšķiras (11,7 pret 11,8 dienām). [15] Secinājums: pneimonijas, kas rodas terapijas ar IGK dēļ, nav saistītas ar slimības gaitas smaguma palielināšanos.
Jau pieminētajā meta-analīzē par 16 996 pacientu datiem, kur konstatēta pneimoniju skaita palielināšanās IGK saņēmēju grupā, nāves risks būtiski neatšķiras. IGK grupā miruši 525 pacienti no 8635 (6,1%), bet kontroles grupā 549 pacienti no 8361 (6,6%), tādējādi nāves risks RR 0,96 (95% TI []). [14]
Arī citos pētījumos nav novērota nāves riska palielināšanās, pat iedalot pacientus dažādās grupās pēc IGK devas, ārstēšanas ilguma, plaušu funkcijas un blakus terapijas metodēm. [16]
Pētījumos, kur salīdzināti ilgtermiņa rezultāti pacientiem ar HOPS un pneimoniju pēc hospitalizācijas, novēro pat nāves riska samazināšanos. Piemēram, pētījumā Teksasas Universitātes Sanantonio veselības aprūpes centrā IGK saņēmēju grupā (n = 2420) nāves risks bija OR 0,76 (95% TI []; p < 0,001) 30 dienās un OR 0,80 (95% TI []; p < 0,001) 90 dienās pēc izrakstīšanās no slimnīcas, salīdzinot ar pacientiem, kas IGK nesaņēma (n = 3933). [23]
Citā retrospektīvā kohortas pētījumā par vēl lielāku pacientu populāciju - 15 768 pacienti vecumā pēc 65 gadiem (8271 pacients ar un 7497 bez IGK terapijā), nāves risks pēc hospitalizācijas mazinājās attiecīgi par 20% 30 dienās un 22% 90 dienās. [24]
Paradoksāli, ka IGK mazina vienas no infekcijas atkarīgas HOPS izpausmes - uzliesmojumu - biežumu, bet veicina citu - pneimonijas. Viens no svarīgākajiem faktoriem, kas jāņem vērā, novērtējot pneimonijas riska palielināšanās klīnisko nozīmi, ir HOPS uzliesmojumu un pneimoniju absolūtā skaita salīdzināšana. Pneimoniju skaits, salīdzinot ar uzliesmojumu skaitu, ir niecīgs. Kopumā var secināt, ka ieguvumu un riska attiecība ir par labu ieguvumiem, tomēr ieteicams pacientus ārstēt ar mazāko iespējamo IGK devu; īpaša uzmanība jāpievērš pacientu grupai, kam pneimonijas risks varētu būt palielināts (FEV1 < 50%, ĶMI < 35 kg/m2, vecums > 55 g., anamnēzē HOPS uzliesmojumi).
Mehānismi, kas nosaka pneimonijas riska palielināšanos un nāves risku
Mehānismi, kāpēc IGK palielina pnei-moniju skaitu pacientiem ar HOPS, nav izpētīti. IGK ietekme uz pneimonijas risku, visticamāk, saistīta ar lokāla imunitātes nomākuma efektu (skat. 2. attēlu). Par to liecina fakti, ka biežāk pneimonijas attīstās pacientiem ar smagāku HOPS un zemāku FEV1% līmeni, kuriem ir sliktāks elpceļu klīrenss un biežāk novēro elpceļu kolonizāciju ar patogēnām baktērijām. Izteiktāku efektu novēro, ārstējot pacientus ar spēcīgākiem IGK, lielu IGK devu un ar IGK, kuri farmakokinētisko vai farmakodinamisko īpašību dēļ ilgāk uzturas uz elpceļu virsmas, kas raksturīgi flutikazona propionātam. Lielākajā daļā HOPS pētījumu pacienti tiek ārstēti ar 1000 µg flutikazona propionāta diennaktī, toties budezonīda deva, ņemot vērā arī pašas glikokortikoīdu molekulas potenci, ir ievērojami mazāka.
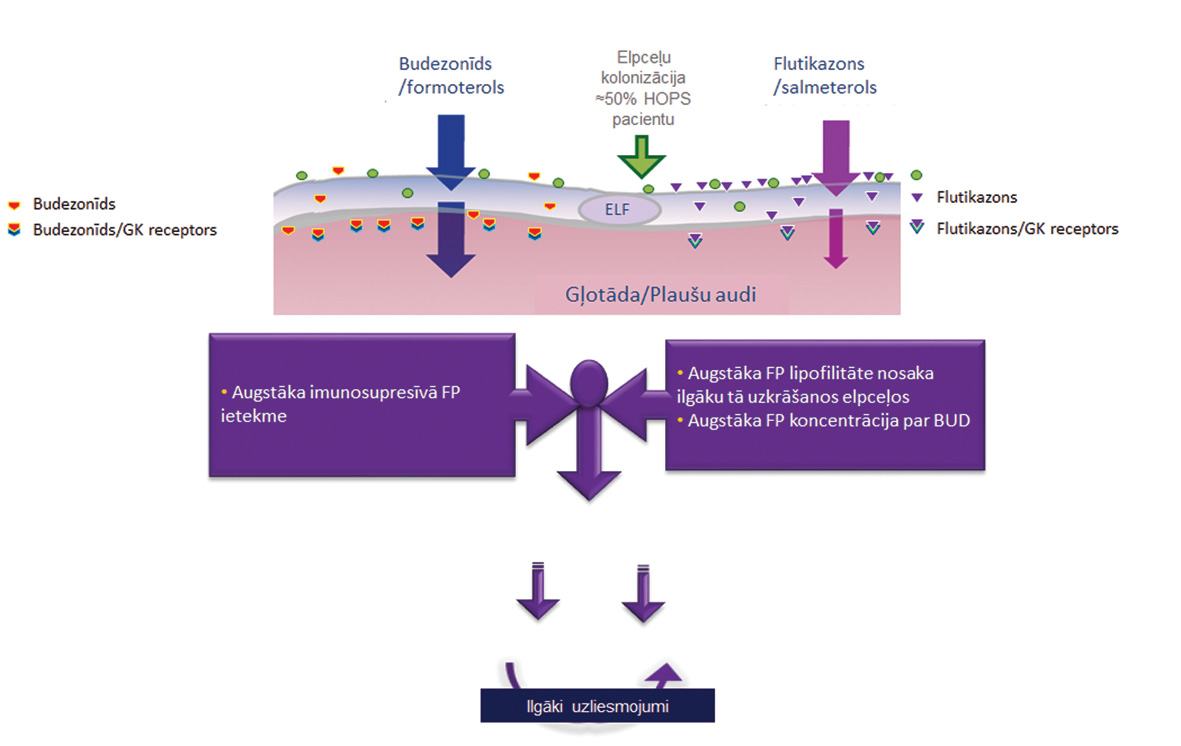

2. attēls
Mehānismi, kā IGK, iespējams, izraisa vietēju imunitātes nomākumu elpceļu gļotādā
Analizējot flutikazona propionāta koncentrāciju pacientu krēpās, redzams, ka flutikazona koncentrācija 4-6 stundās pēc medikamenta inhalācijas ir vismaz 5 × stiprāka nekā budezonīda koncentrācija. [25]
Flutikazona propionāts ir ļoti iedarbīgs glikokortikoīds ar lielu GK receptoru afinitāti. Flutikazona propionāts spēj aptuveni 10 × vairāk mazināt IL-6 un TNF-i sekrēciju no makrofāgiem. [26] Iespējams, ka IGK nomāc neitrofilo leikocītu funkciju, mazinot to adhēziju pie elpceļu epitēlija virsmas vai kapilāru endotēlija. Summējoties šīm īpašībām, pacientiem varētu attīstīties zināms lokāls imunitāti nomācošs efekts gļotādas virsmā, kas bakteriālas kolonizācijas apstākļos varētu palielināt varbūtību, ka attīstīsies pneimonija.
Iespējams, ka atšķirīgo ietekmi uz uzliesmojumiem un pneimonijas risku nosaka infekcijas etioloģija. Vairākumu uzliesmojumu provocē vīrusu infekcijas, turpretī pneimonijas gandrīz vienmēr izsauc baktērijas.
Pneimonijas attīstības brīdī sāk darboties pretēji mehānismi. IGK mazina pārmērīgi izteiktu iekaisuma reakciju un tādā veidā mazina plaušu audu bojājumu, reizē mazinot arī mirstību.
Kopsavilkums
- HOPS pacientu ārstēšana ar inhalējamiem glikokortikoīdiem vai kombinēto terapiju palielina varbūtību, ka attīstīsies pneimonija.
- Pneimonijas riska palielināšanās, iespējams, ir atkarīga no plaušu funkcijas, pacienta vecuma, ķermeņa masas indeksa, slimības uzliesmojumiem anamnēzē, IGK individuālajām īpašībām un devas.
- Pneimonijas riska palielināšanās ir klīniski maznozīmīga, jo uzliesmojumu skaits, ko samazina IGK, ir lielāks nekā pneimoniju skaits, turklāt nenovēro mirstības palielināšanos ne pneimonijas, ne citu iemeslu pēc.
- Mehānismi, kas izraisa pneimoniju riska palielināšanos, nav izzināti, bet tie, visticamāk, saistīti ar vietēja imunitātes nomākuma attīstību īpašiem pacientiem (piemēram, smaga HOPS un elpceļu kolonizācija ar patogēnām baktērijām).